
 2015 年全国统一高考化学试卷(新课标Ⅱ) 一、选择题(共 7 小题,每小题 6 分,满分 42 分) 1.(6 分)食品干燥剂应无毒、无味、无腐蚀性及环境友好.下列说法错误的 是( ) A.硅胶可用作食品干燥剂 B.P2O5 不可用作食品干燥剂 C.六水合氯化钙可用作食品干燥剂 D.加工后具有吸水性的植物纤维可用作食品干燥剂 2.(6 分)某羧酸酯的分子式为 C18H26O5,1mol 该酯完全水解可得到 1mol 羧 酸和 2mol 乙醇,该羧酸的分子式为( ) A.C14H18O5 B.C14H16O4 C.C16H22O5 D.C16H20O5 3.(6 分)原子序数依次增大的元素 a、b、c、d,它们的最外层电子数分别为 1 、6、7、1.a﹣的电子层结构与氦相同,b 和 c 的次外层有 8 个电子,c﹣和 d+ 的电子层结构相同.下列叙述错误的是( ) A.a 和其他 3 种元素均能形成共价化合物 B.元素的非金属性次序为 c>b>a C.d 和其他 3 种元素均能形成离子化合物 D.元素 a、b、c 各自最高和最低化合价的代数和分别为 0、4、6 4.(6 分)NA 代表阿伏加德罗常数的值.下列叙述正确的是( ) A.60g 丙醇中存在的共价键总数为 10NA B.1L 0.1mol•L﹣1 的 NaHCO3 溶液中 HCO3 和 CO32﹣离子数之和为 0.1NA ﹣C.钠在空气中燃烧可生成多种氧化物.23g 钠充分燃烧时转移电子数为 1NA 1D.235g 核素 92235U 发生裂变反应:92235U+01n 90Sr+54136Xe+100 n 净产生 38 1的中子(0 n)数为 10NA 5.(6 分)分子式为 C5H10O2 且可与碳酸氢钠溶液反应放出气体的有机化合物 有( ) A.3 种 B.4 种 C.5 种 D.6 种 6.(6 分)海水开发利用的部分过程如图所示.下列说法错误的是( ) 第 1 页(共 33 页) A.向苦卤中通入 Cl2 是为了提取溴 B.粗盐可采用除杂和重结晶等过程提纯 C.工业生产常选用 NaOH 作为沉淀剂 D.富集溴一般先用空气和水蒸气吹出单质溴,再用 SO2 将其还原吸收 7.(6 分)用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与 实际相符的是( ) 选项 ①中物质 稀盐酸 ②中物质 碳酸钠与氢氧化钠的混合溶液 用砂纸打磨过的铝条 浓氢氧化钠溶液 预测②中的现象 立即产生气泡 ABCD浓硝酸 产生红棕色气体 产生大量白色沉淀 溶液逐渐褪色 氯化铝溶液 草酸溶液 高锰酸钾酸性溶液 A.A B.B C.C D.D 二、解答题 8.(14 分)酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其 周围是有碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电 过程产生 MnOOH,回收处理该废电池可以得到多种化工原料,有关数据下表 所示: 第 2 页(共 33 页) 溶解度/(g/100g 水) 020 40 60 80 100 温度/℃ 化合物 NH4Cl ZnCl2 29.3 343 37.2 395 45.8 452 55.3 488 65.6 541 77.3 614 化合物 Ksp 近似值 Zn(OH)2 Fe(OH)2 10﹣17 Fe(OH)3 10﹣17 10﹣39 回答下列问题: (1)该电池的正极反应式为 ,电池反应的离子方程式为: 。 (2)持续电流强度为 0.5A,电池工作五分钟,理论消耗锌 F=96500C/mol) g.(已经 (3)废电池糊状填充物加水处理后,过滤,滤液中主要有 ZnCl2 和 NH4Cl,两 者可以通过 分离回收,滤渣的主要成分是MnO2、 和 欲从中得到较纯的 MnO2,最简便的方法是 ,其原理是 。 (4)用废电池的锌皮制作 ZnSO4•7H2O 的过程中,需除去铁皮中的少量杂质铁, 其方法是:加入稀 H2SO4 和 H2O2,溶解,铁变为 加碱调节pH 为 时,铁刚好沉淀完全(离子浓度小于 1×10﹣5mol•L﹣1 时,即可认为该离子沉 时,锌开始沉淀(假定 Zn2+浓度为 0.1mol•L﹣1)。若上述过程不加 H2O2 的后果是 , 淀完全)。继续加碱调节 pH 为 ,原因是 。 9.(14 分)甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分 为 CO、CO2 和 H2)在催化剂的作用下合成甲醇,发生的主要反应如下: ①CO(g)+2H2(g)⇌CH3OH(g)△H1 ②CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2 ③CO2(g)+H2(g)⇌CO(g)+H2O(g)△H3 回答下列问题: H﹣H C﹣O H﹣O C﹣H 化学键 C≡O 第 3 页(共 33 页) E/(kJ.mol﹣1) 436 343 1076 465 413 (1)已知反应①中的相关的化学键键能数据如下: 由此计算△H1= .mol﹣1 kJ.mol﹣1,已知△H2=﹣58kJ.mol﹣1,则△H3= kJ (2)反应①的化学平衡常数 K 的表达式为 ;图 1 中能正确反映平衡常 数 K 随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。(3)合成气的组成 n(H2)/n(CO+CO2)=2.60 时体系中的 CO 平衡转化率(a) 与温度和压强的关系如图 2 所示。a(CO)值随温度升高而 ”或“减小”),其原因是 。图2 中的压强由大到小为 理由是 (填“增大 ,其判断 10.(15 分)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒 剂,回答下列问題: (1 )工业上可用 KClO3 与 Na2SO3 在 H2SO4 存在下制得 ClO2,该反应氧化剂与 还原剂物质的量之比为 . (2)实验室用 NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备 ClO2: 第 4 页(共 33 页) ①电解时发生反应的化学方程式为 . . ②溶液 X 中大量存在的阴离子有 ③除去 ClO2 中的 NH3 可选用的试剂是 硫酸 d.饱和食盐水 (填标号)a.水 b.碱石灰 c.浓 (3)用如图装置可以测定混合气中 ClO2 的含量: Ⅰ.在锥形瓶中加入足量的碘化钾,用 50mL 水溶解后,再加入 3mL 稀硫酸: Ⅱ.在玻璃液封装置中加入水.使液面没过玻璃液封管的管口; Ⅲ.将一定量的混合气体通入锥形瓶中吸收; Ⅳ.将玻璃液封装置中的水倒入锥形瓶中: 2﹣ Ⅴ.用 0.1000mol•L﹣1 硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O3 ═2I﹣+S4O62﹣),指示剂显示终点时共用去 20.00mL 硫代硫酸钠溶液.在此过 程中: ①锥形瓶内 ClO2 与碘化钾反应的离子方程式为 ②玻璃液封装置的作用是 ③V 中加入的指示剂通常为 ,滴定至终点的现象是 ④测得混合气中 ClO2 的质量为 g. (4)用 ClO2 处理过的饮用水会含有一定最的亚氯酸盐.若要除去超标的亚氯酸 盐,下列物质最适宜的是 硫酸亚铁. (填标号)a.明矾 b.碘化钾 c.盐酸 d. 三、化学——选修 2:化学与技术。(满分 15 分) 11.(15 分)苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产 第 5 页(共 33 页) 苯酚和丙酮,其反应和工艺流程示意图如图: 相关化合物的物理常数 密度(g/cm﹣3) 物质 相对分子质量 沸点/℃ 120 58 0.8640 0.7898 1.0722 153 56.5 182 异丙苯 丙酮 94 苯酚 回答下列问题: (1)在反应器 A 中通入的 X 是 (2)反应①和②分别在装置 。 和 中进行(填装置符号)。 (3)在分解釜 C 中加入的 Y 为少置浓硫酸,其作用是 缺点是 。 ,优点是用量少, (4)反应②为 (填“放热”或“吸热”)反应。反应温度控制在 50﹣60℃, 温度过高的安全隐患是 。 (5)中和釜 D 中加入的 Z 最适宜的是 。 (填编号。已知苯酚是一种弱酸) a.NaOHb.CaCO3c.NaHCO3d.CaO 第 6 页(共 33 页) (6)蒸馏塔 F 中的馏出物 T 和 P 分别为 和 。 ,判断的依据是 。 (7)用该方法合成苯酚和丙酮的优点是 四、化学-选修 3:物质结构与性质。(满分 15 分) 12.(15 分)A、B、C、D 为原子序数依次增大的四种元素,A2﹣和 B+具有相 同的电子构型;C、D 为同周期元素,C 核外电子总数是最外层电子数的 3 倍 ;D 元素最外层有一个未成对电子.回答下列问题: (1)四种元素中电负性最大的是 电子排布式为 . (2)单质 A 有两种同素异形体,其中沸点高的是 是 ;A 和 B 的氢化物所属的晶体类型分别为 (3)C 和 D 反应可生成组成比为 1:3 的化合物 E,E 的立体构型为 (填元素符号),其中 C 原子的核外 (填分子式),原因 和 . , 中心原子的杂化轨道类型为 . (4)化合物 D2A 的立体构型为 ,中心原子的价层电子对数为 , 单质 D 与湿润的 Na2CO3 反应可制备 D2A,其化学方程式为 (5)A 和 B 能够形成化合物 F,其晶胞结构如图所示,晶胞边长 a=0.566nm,F 的化学式为 ;晶胞中A 原子的配位数为 ;列式计算晶体F 的 密度(g•cm﹣3 ) . (保留小数点后两位数字). 五、化学一选修 5:有机化学基础(满分 15 分) 13.(15 分)聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在 材枓的生物相容性方面有很好的应用前景. PPG 的一种合成路线如下: 第 7 页(共 33 页) 已知: ①烃 A 的相对分子质量为 70,核磁共振氢谱显示只有一种化学环境的氢 ②化合物 B 为单氯代烃:化合物 C 的分子式为 C5H8 ③E、F 为相对分子质量差 14 的同系物,F 是福尔马林的溶质 ④冋答下列问题: (1)A 的结构简式为 . (2)由 B 生成 C 的化学方程式为 (3)由 E 和 F 生成 G 的反应类型为 . ,G 的化学名称为 . (4)①由 D 和 H 生成 PPG 的化学方程式为: ②若 PPG 平均相对分子质量为 10000,则其平均聚合度约为 a. 48b. 58c. 76 d.122 (填标号). (5)D 的同分异构体中能同时满足下列条件的共有 种(不含立体异构) :①能与饱和 NaHCO3 溶液反应产生气体②既能发生银镜反应,又能发生水解反应 其中核磁共振氢谱显示为 3 组峰,且峰面积比为 6:1:1 的是 (写结构 简式) D 的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该 仪器是 (填标号). a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪. 第 8 页(共 33 页) 2015 年全国统一高考化学试卷(新课标Ⅱ) 参考答案与试题解析 一、选择题(共 7 小题,每小题 6 分,满分 42 分) 1.(6 分)食品干燥剂应无毒、无味、无腐蚀性及环境友好.下列说法错误的 是( ) A.硅胶可用作食品干燥剂 B.P2O5 不可用作食品干燥剂 C.六水合氯化钙可用作食品干燥剂 D.加工后具有吸水性的植物纤维可用作食品干燥剂 【考点】KF:常见的食品添加剂的组成、性质和作用.菁优网版权所有 【分析】A.硅胶具有吸水性,无毒; B.P2O5 吸水转化为酸; C.六水合氯化钙不能吸水; D.具有吸水性的植物纤维无毒. 【解答】解:A.硅胶具有吸水性,无毒,则硅胶可用作食品干燥剂,故 A 正确 ;B.P2O5 吸水转化为酸,导致食品变质,则 P2O5 不可用作食品干燥剂,故 B 正 确; C.六水合氯化钙不能吸水,则不能作食品干燥剂,故 C 错误; D.具有吸水性的植物纤维无毒,则可用作食品干燥剂,故 D 正确; 故选:C。 【点评】本题考查物质的性质及食品干燥剂,为高频考点,把握物质的性质、化 学与生活的关系为解答的关键,侧重分析与应用能力的综合考查,题目难度 中等. 2.(6 分)某羧酸酯的分子式为 C18H26O5,1mol 该酯完全水解可得到 1mol 羧 第 9 页(共 33 页) 酸和 2mol 乙醇,该羧酸的分子式为( ) A.C14H18O5 B.C14H16O4 C.C16H22O5 D.C16H20O5 【考点】1B:真题集萃;H3:有机物实验式和分子式的确定;M8:有关有机物 分子式确定的计算.菁优网版权所有 【分析】1mol 该酯完全水解可得到 1mol 羧酸和 2mol 乙醇,则说明酯中含有 2 个酯基,结合酯的水解特点以及质量守恒定律判断。 【解答】解:某羧酸酯的分子式为 C18H26O5,1mol 该酯完全水解可得到 1mol 羧 酸和 2mol 乙醇,说明酯中含有 2 个酯基,设羧酸为 M, 则反应的方程式为 C18H26O5+2H2O→M+2C2H6O, 由质量守恒可知 M 的分子式为 C14H18O5, 故选:A。 【点评】本题为 2015 年高考题,考查有机物的推断,为高频考点,把握酯化反 应中碳原子个数变化、官能团的变化为推断的关系,侧重酯的性质的考查, 题目难度不大。 3.(6 分)原子序数依次增大的元素 a、b、c、d,它们的最外层电子数分别为 1 、6、7、1.a﹣的电子层结构与氦相同,b 和 c 的次外层有 8 个电子,c﹣和 d+ 的电子层结构相同.下列叙述错误的是( ) A.a 和其他 3 种元素均能形成共价化合物 B.元素的非金属性次序为 c>b>a C.d 和其他 3 种元素均能形成离子化合物 D.元素 a、b、c 各自最高和最低化合价的代数和分别为 0、4、6 【考点】8F:原子结构与元素周期律的关系.菁优网版权所有 【分析】原子序数依次增大的元素 a、b、c、d,它们的最外层电子数分别为 1、 6、7、1,a﹣的电子层结构与氦相同,则 a 为 H 元素;b 和 c 的次外层有 8 个 电子,原子只能有 3 个电子层,则 b 为 S 元素,c 为 Cl,c﹣和 d+的电子层结 第 10 页(共 33 页) 构相同,则 d 为 K 元素. A.H 元素与 K 元素形成的化合物为 KH,属于离子化合物; B.同周期自左而右非金属性增强,氢化物中 H 元素为正价,其非金属性最弱; C.K 元素与其它元素可以形成 KH、K2S、KCl; D.H 元素最高正化合价为+1、最低负化合价为﹣1,S 元素最高正化合价为+6、 最低负化合价为﹣2,Cl 元素最高正化合价为+7、最低负化合价为﹣1. 【解答】解:原子序数依次增大的元素 a、b、c、d,它们的最外层电子数分别 为 1、6、7、1,a﹣的电子层结构与氦相同,则 a 为 H 元素;b 和 c 的次外层 有 8 个电子,原子只能有 3 个电子层,则 b 为 S 元素,c 为 Cl,c﹣和 d+的电 子层结构相同,则 d 为 K 元素。 A.H 元素与 S 元素、Cl 元素放出形成 H2S、HCl,二者属于共价化合物,但与 K 元素形成的化合物为 KH,属于离子化合物,故 A 错误; B.同周期自左而右非金属性增强,氢化物中 H 元素为正价,其非金属性最弱, 故非金属性 Cl>S>H,故 B 正确; C.K 元素与其它元素可以形成 KH、K2S、KCl,均属于离子化合物,故 C 正确 ;D.H 元素最高正化合价为+1、最低负化合价为﹣1,S 元素最高正化合价为+6、 最低负化合价为﹣2,Cl 元素最高正化合价为+7、最低负化合价为﹣1,最高 和最低化合价的代数和分别为 0、4、6,故 D 正确, 故选:A。 【点评】本题考查结构性质位置关系应用,推断元素是解题关键,侧重对元素周 期律的考查,题目涉及金属氢化物是中学知识的盲点,难度不大. 4.(6 分)NA 代表阿伏加德罗常数的值.下列叙述正确的是( ) A.60g 丙醇中存在的共价键总数为 10NA B.1L 0.1mol•L﹣1 的 NaHCO3 溶液中 HCO3 和 CO32﹣离子数之和为 0.1NA ﹣C.钠在空气中燃烧可生成多种氧化物.23g 钠充分燃烧时转移电子数为 1NA 第 11 页(共 33 页) 1D.235g 核素 92235U 发生裂变反应:92235U+01n 90Sr+54136Xe+100 n 净产生 38 1的中子(0 n)数为 10NA 【考点】1B:真题集萃;4F:阿伏加德罗常数.菁优网版权所有 【专题】518:阿伏加德罗常数和阿伏加德罗定律. 【分析】A.丙醇中含 7 个 C﹣H 键、2 个 C﹣C 键、1 个 C﹣O 键和 1 个 O﹣H 键; ﹣B.HCO3 水解生成碳酸,结合原子守恒分析; C.钠发生氧化反应后,Na 元素的化合价由 0 升高为+1 价; 1D.92235U+01n 90Sr+54136Xe+100 n 净产生的中子为 10﹣1=9 个. 38 【解答】解:A.60g 丙醇为 1mol,丙醇中含 7 个 C﹣H 键、2 个 C﹣C 键、1 个 C﹣O 键和 1 个 O﹣H 键,存在的共价键总数为 11NA,故 A 错误; B.1L 0.1mol•L﹣1 的 NaHCO3 溶液中 HCO3 和 CO32﹣离子数之和小于 0.1NA,碳 ﹣酸分子中含 C 原子,故 B 错误; C.23g 钠充分燃烧时转移电子数为 ×(1﹣0)×NA=1NA,故 C 正确; 1D.92235U+01n 90Sr+54136Xe+100 n 净产生的中子为 10﹣1=9 个,则 235g 核素 38 1235U 发生裂变反应净产生的中子(0 n)数为 9NA,故 D 错误; 92 故选:C。 【点评】本题考查阿伏伽德罗常数及计算,为高频考点,把握物质中的化学键、 物料守恒、盐类水解、氧化还原反应中转移电子计算等为解答的关键,侧重 分析与应用能力的综合考查,综合性较强,题目难度中等. 5.(6 分)分子式为 C5H10O2 且可与碳酸氢钠溶液反应放出气体的有机化合物 有( ) A.3 种 B.4 种 C.5 种 D.6 种 第 12 页(共 33 页) 【考点】H6:有机化合物的异构现象.菁优网版权所有 【专题】532:同分异构体的类型及其判定. 【分析】分子式为 C5H10O2 且可与碳酸氢钠溶液反应放出气体,则该有机物中含 有﹣COOH,所以为戊酸,戊酸的种类等于丁基的种类,写出丁基的种类即 可. 【解答】解:分子式为 C5H10O2 且可与碳酸氢钠溶液反应放出气体,则该有机物 中含有﹣COOH,所以为戊酸,戊酸的种类等于丁基的种类,丁基(﹣C4H9) 的异构体有:﹣CH2CH2CH2CH3,﹣CH(CH3)CH2CH3,﹣CH2CH(CH3)CH3 ,﹣C(CH3)3,故戊酸的有机物的异构体数目为 4,故选 B。 【点评】本题主要考查同分异构体书写、官能团的性质与确定等,难度中等,注 意利用丁基异构判断. 6.(6 分)海水开发利用的部分过程如图所示.下列说法错误的是( ) A.向苦卤中通入 Cl2 是为了提取溴 B.粗盐可采用除杂和重结晶等过程提纯 C.工业生产常选用 NaOH 作为沉淀剂 D.富集溴一般先用空气和水蒸气吹出单质溴,再用 SO2 将其还原吸收 【考点】1B:真题集萃;E7:海水资源及其综合利用.菁优网版权所有 【分析】A.向苦卤中通入 Cl2 置换出溴单质,分离得到溴; B.粗盐中含有 Ca2+、Mg2+、SO42﹣等杂质,精制时应加入试剂进行除杂,过滤 后向滤液中加入盐酸至溶液呈中性,再进行重结晶进行提纯; 第 13 页(共 33 页) C.工业常选用生石灰或石灰水作沉淀剂; D.先用空气和水蒸气吹出单质溴,再用 SO2 将其还原吸收转化为 HBr,达到富 集的目的. 【解答】解:A.向苦卤中通入 Cl2 置换出溴单质,分离得到溴,通入 Cl2 是为 了提取溴,故 A 正确; B.粗盐中含有 Ca2+、Mg2+、SO42﹣等杂质,精制时通常在溶液中依次中加入过 量的 BaCl2 溶液、过量的 NaOH 溶液和过量的 Na2CO3 溶液,过滤后向滤液中 加入盐酸至溶液呈中性,再进行重结晶进行提纯,故 B 正确; C.工业常选用生石灰或石灰水作沉淀剂,故 C 错误; D.海水提取溴一般用氯气置换溴离子转化为溴单质,用空气和水蒸气吹出单质 溴,再用 SO2 将其还原吸收转化为 HBr,达到富集的目的,故 D 正确, 故选:C。 【点评】本题考查海水资源的综合利用,注意掌握中学常见的化学工业,侧重对 化学与技术的考查,难度不大. 7.(6 分)用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与 实际相符的是( ) 选项 ①中物质 稀盐酸 ②中物质 碳酸钠与氢氧化钠的混合溶液 用砂纸打磨过的铝条 浓氢氧化钠溶液 预测②中的现象 立即产生气泡 ABCD浓硝酸 产生红棕色气体 产生大量白色沉淀 溶液逐渐褪色 氯化铝溶液 草酸溶液 高锰酸钾酸性溶液 A.A B.B C.C D.D 第 14 页(共 33 页) 【考点】U5:化学实验方案的评价.菁优网版权所有 【分析】A.先发生盐酸与 NaOH 的反应; B.常温下,Al 遇浓硝酸发生钝化; C.NaOH 过量,开始不生成沉淀; D.发生氧化还原反应. 【解答】解:A.先发生盐酸与 NaOH 的反应,然后盐酸与碳酸钠反应生成碳酸 氢钠,最后盐酸与碳酸氢钠反应生成气体,则现象不合理,故 A 错误; B.常温下,Al 遇浓硝酸发生钝化,则不能观察到红棕色气体,现象不合理, 故 B 错误; C.NaOH 过量,开始不生成沉淀,反应生成偏铝酸钠和氯化钠,开始无现象, 故 C 错误; D.草酸与高锰酸钾发生氧化还原反应,溶液褪色,现象合理,故 D 正确; 故选:D。 【点评】本题考查物质的性质及实验装置的综合应用,为高频考点,为 2015 年 高考真题,把握物质的性质、发生的反应、反应与现象的关系为解答的关键, 侧重分析与实验能力的综合考查,综合性较强,题目难度中等. 二、解答题 8.(14 分)酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其 周围是有碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电 过程产生 MnOOH,回收处理该废电池可以得到多种化工原料,有关数据下表 所示: 溶解度/(g/100g 水) 020 40 60 80 100 温度/℃ 化合物 NH4Cl ZnCl2 29.3 343 37.2 395 45.8 452 55.3 488 65.6 541 77.3 614 第 15 页(共 33 页) 化合物 Ksp 近似值 Zn(OH)2 Fe(OH)2 Fe(OH)3 10﹣17 10﹣17 10﹣39 回答下列问题: (1)该电池的正极反应式为 MnO2+H++e﹣=MnOOH ,电池反应的离子方程 式为: 2MnO2+Zn+2H+=2MnOOH+Zn2+ 。 (2)持续电流强度为 0.5A,电池工作五分钟,理论消耗锌 0.05 g.(已经 F=96500C/mol) (3)废电池糊状填充物加水处理后,过滤,滤液中主要有 ZnCl2 和 NH4Cl,两 者可以通过 加热浓缩 冷却结晶 分离回收,滤渣的主要成分是 MnO2、 碳粉 和 MnOOH ,欲从中得到较纯的 MnO2,最简便的方法是 空气中 加热 ,其原理是 碳粉转变为二氧化碳,MnOOH 氧化为二氧化锰 。 (4)用废电池的锌皮制作 ZnSO4•7H2O 的过程中,需除去铁皮中的少量杂质铁, 其方法是:加入稀 H2SO4 和 H2O2,溶解,铁变为 Fe3+ 加碱调节 pH 为 2.7 时,铁刚好沉淀完全(离子浓度小于 1×10﹣5mol•L﹣1 时,即可认为该离 子沉淀完全)。继续加碱调节 pH 为 6 时,锌开始沉淀(假定 Zn2+浓度为 0.1mol•L﹣1)。若上述过程不加 H2O2 的后果是 Zn2+和 Fe2+分离不开 ,原 因是 Zn(OH)2、Fe(OH)2 的 Ksp 相近 。 【考点】1B:真题集萃;BH:原电池和电解池的工作原理;P8:物质分离和提 纯的方法和基本操作综合应用.菁优网版权所有 【分析】(1)该电池的正极发生还原反应,MnO2 被还原生成 MnOOH;负极锌 被氧化生成 Zn2+,以此书写电池总反应式; (2)持续电流强度为 0.5A,电池工作五分钟,则电量为 0.5A×300s=150C,转 移电子的物质的量为 ,以此计算消耗锌的质量、物质的量; (3)填充物含有碳粉、二氧化锰,且生成 MnOOH 等,在空气中加热时,碳粉、 MnOOH 可被氧化; (4)铁加入稀 H2SO4 和 H2O2,可被氧化生成 Fe3+,铁刚好沉淀完全时离子浓度 第 16 页(共 33 页) 小于 1×10﹣5mol•L﹣1,结合 Ksp=10﹣39 计算 pH,并根据 Ksp 计算锌开始沉淀 的 pH。 【解答】解:(1)该电池的正极发生还原反应,MnO2 被还原生成 MnOOH,电 极方程式为 MnO2+H++e﹣=MnOOH,负极锌被氧化生成 Zn2+,电池总反应式 为 2MnO2+Zn+2H+=2MnOOH+Zn2+, 故答案为:MnO2+H++e﹣=MnOOH;2MnO2+Zn+2H+=2MnOOH+Zn2+; (2)持续电流强度为 0.5A,电池工作五分钟,则电量为 0.5A×300s=150C,转 移电子的物质的量为 ,则消耗 Zn 的质量为 × × 65g/mol=0.05g, 故答案为:0.05; (3)滤液中主要有 ZnCl2 和 NH4Cl,可通过加热浓缩、冷却结晶得到晶体,填 充物含有碳粉、二氧化锰,且生成 MnOOH 等,在空气中加热时,碳粉、MnOOH 可被氧化,分别生成二氧化碳和二氧化锰,故答案为:加热浓缩;冷却结晶; 碳粉;MnOOH;空气中加热;碳粉转变为二氧化碳,MnOOH 氧化为二氧化 锰; (4)铁加入稀 H2SO4 和 H2O2,可被氧化生成 Fe3+,铁刚好沉淀完全时离子浓度 小于 1×10﹣5mol•L﹣1,因 Ksp=10﹣39 ,则 c(OH﹣)= mol/L≈0.5×10﹣11mol/L,此时 pH=2.7, 如锌开始沉淀,则 c(OH﹣)= mol/L=10﹣8mol/L,此时 pH=6, 由表中数据可知 Zn(OH) 、Fe(OH) 的 Ksp 相近,如不加 H2O2,则 Zn2+和 22Fe2+分离不开, 故答案为:Fe3+;2.7;6;Zn2+和 Fe2+分离不开;Zn(OH)2、Fe(OH)2 的 Ksp 相近。 【点评】本题为 2015 年新课标卷考题,考查原电池知识以及物质的分离、提纯, 侧重于原电池的工作原理以及实验基本操作和注意问题,题目难度中等,有 利于培养学生良好的科学素养。 第 17 页(共 33 页) 9.(14 分)甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分 为 CO、CO2 和 H2)在催化剂的作用下合成甲醇,发生的主要反应如下: ①CO(g)+2H2(g)⇌CH3OH(g)△H1 ②CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2 ③CO2(g)+H2(g)⇌CO(g)+H2O(g)△H3 回答下列问题: H﹣H C﹣O H﹣O C﹣H 化学键 C≡O E/(kJ.mol﹣1) 436 343 1076 465 413 (1)已知反应①中的相关的化学键键能数据如下: 由此计算△H1= ﹣99 kJ.mol﹣1,已知△H2=﹣58kJ.mol﹣1,则△H3= +41 kJ .mol﹣1 (2)反应①的化学平衡常数 K 的表达式为 ;图 1 中能正确 反映平衡常数 K 随温度变化关系的曲线为 a (填曲线标记字母),其判断 理由是 反应①正反应为放热反应,平衡常数随温度升高而减小 。 (3)合成气的组成 n(H2)/n(CO+CO2)=2.60 时体系中的 CO 平衡转化率(a) 与温度和压强的关系如图 2 所示。a(CO)值随温度升高而 减小 (填“增 大”或“减小”),其原因是 反应①正反应为放热反应,升高温度,平衡向逆 反应方向移动,平衡体系中 CO 的量增大,反应③为吸热反应,升高温度, 平衡向正反应方向移动,又使平衡体系中 CO 的增大,总结果,随温度升高, CO 的转化率减小 。图 2 中的压强由大到小为 P3>P2>P1 ,其判断理由 是 相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动, 反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方 向移动,CO 的转化率增大,故增大压强有利于 CO 的转化率升高 第 18 页(共 33 页) 【考点】BB:反应热和焓变;CB:化学平衡的影响因素.菁优网版权所有 【分析】(1)反应热=反应物总键能﹣生成物总键能;根据盖斯定律:反应②﹣ 反应①=反应③,反应热也进行相应的计算; (2)化学平衡常数指可逆反应得到平衡时,各生成物浓度的化学计量数次幂的 乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值; 化学平衡常数只受温度影响,根据温度对平衡移动的影响,进而判断温度对平衡 常数影响; (3)由图可知,压强一定时,随温度的升高,CO 的转化率降低,根据升高温 度对反应①、③的影响,进行分析 CO 转化率变化原因; 相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应① 正反应为气体分子式减小的反应,增大压强,有利于平衡向正反应方向移动, CO 的转化率增大。 【解答】解:(1)反应热=反应物总键能﹣生成物总键能,故△H1=1076kJ. mol﹣1+2×436kJ.mol﹣1﹣(3×413+343+465)kJ.mol﹣1=﹣99kJ.mol﹣1; 根据盖斯定律:反应②﹣反应①=反应③,故△H3=△H2﹣△H1=﹣58kJ.mol﹣1﹣ (﹣99kJ.mol﹣1)=+41kJ.mol﹣1, 故答案为:﹣99;+41; ( 2 ) 反 应 ① CO ( g ) +2H2 ( g ) ⇌ CH3OH ( g ) 的 平 衡 常 数 表 达 式K= 第 19 页(共 33 页) ;反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小, 曲线 a 正确反映平衡常数 K 随温度变化关系, 故答案为: ;a;反应①正反应为放热反应,平衡常数随温度升 高而减小; (3)由图可知,压强一定时,随温度的升高,CO 的转化率减小,反应①正反 应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中 CO 的量增 大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系 中 CO 的增大,总结果,随温度升高,CO 的转化率减小; 相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应① 正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动, CO 的转化率增大,故增大压强有利于 CO 的转化率升高,故压强:P3>P2>P1 ,故答案为:减小;反应①正反应为放热反应,升高温度,平衡向逆反应方向移动 ,平衡体系中 CO 的量增大,反应③为吸热反应,升高温度,平衡向正反应 方向移动,又使平衡体系中 CO 的增大,总结果,随温度升高,CO 的转化率 减小; P3>P2>P1;相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡 移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正 反应方向移动,CO 的转化率增大,故增大压强有利于 CO 的转化率升高。 【点评】本题考查反应热有关计算、平衡常数及其影响因素、化学平衡的影响因 素、化学平衡图象综合应用等,侧重考查学生分析计算能力,需要学生具备 扎实的基础,难度中等。 10.(15 分)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒 剂,回答下列问題: (1 )工业上可用 KClO3 与 Na2SO3 在 H2SO4 存在下制得 ClO2,该反应氧化剂与 第 20 页(共 33 页) 还原剂物质的量之比为 2:1 . (2)实验室用 NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备 ClO2: ①电解时发生反应的化学方程式为 NH4Cl+2HCl ②溶液 X 中大量存在的阴离子有 Cl﹣、OH﹣ . NCl3+3H2↑ . ③除去 ClO2 中的 NH3 可选用的试剂是 c (填标号)a.水 b.碱石灰 c.浓硫 酸 d.饱和食盐水 (3)用如图装置可以测定混合气中 ClO2 的含量: Ⅰ.在锥形瓶中加入足量的碘化钾,用 50mL 水溶解后,再加入 3mL 稀硫酸: Ⅱ.在玻璃液封装置中加入水.使液面没过玻璃液封管的管口; Ⅲ.将一定量的混合气体通入锥形瓶中吸收; Ⅳ.将玻璃液封装置中的水倒入锥形瓶中: 2﹣ Ⅴ.用 0.1000mol•L﹣1 硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O3 ═2I﹣+S4O62﹣),指示剂显示终点时共用去 20.00mL 硫代硫酸钠溶液.在此过 程中: ① 锥 形 瓶 内ClO2 与 碘 化 钾 反 应 的 离 子 方 程 式 为2ClO2+10I﹣+8H+ ═ 2Cl﹣+5I2+4H2O ②玻璃液封装置的作用是 吸收残留的 ClO2 气体(避免碘的逸出) ③V 中加入的指示剂通常为 淀粉溶液 ,滴定至终点的现象是 溶液由蓝色变 为无色,且半分钟内不变色 ④测得混合气中 ClO2 的质量为 0.02700 g. (4)用 ClO2 处理过的饮用水会含有一定最的亚氯酸盐.若要除去超标的亚氯酸 盐,下列物质最适宜的是 d (填标号)a.明矾 b.碘化钾 c.盐酸 d.硫 第 21 页(共 33 页) 酸亚铁. 【考点】RD:探究物质的组成或测量物质的含量;U3:制备实验方案的设计. 菁优网版权所有 【专题】18:实验分析题. 2﹣ 【分析】(1)KClO3 在 H2SO4 存在下与 Na2SO3 反应,SO32﹣被氧化成 SO4 ,﹣2﹣ 2﹣ 由电子、电荷守恒可知该离子反应为 2ClO3 +SO3 +2H+═2ClO2+SO4 +H2O ;(2)由生产流程可知氯化铵在盐酸溶液中进行电解,阴极生成氢气,阳极生成 NCl3,电解方程式为 NH4Cl+2HCl NCl3+3H2↑,在 NCl3 溶液中加入 NaClO2,可生成 ClO2、NH3 和 X,X 中含 Cl﹣、OH﹣;由信息可知,ClO2 易 溶于水,所以不能利用水溶液吸收,氨气为碱性气体,利用性质差异分离提 纯; (3)①由题目信息可知,ClO2 通入锥形瓶与酸性碘化钾溶液反应,氧化 I﹣为 I2 ,自身被还原为 Cl﹣,同时生成水; ②玻璃液封装置可防止有害气体逸出; ③淀粉遇碘单质变蓝; ④根据关系式 2ClO2~5I2~10Na2S2O3 计算 n(ClO2),再根据 m=nM 计算 m( ClO2); (4)亚氯酸盐具有氧化性,Fe2+将 ClO2 还原成 Cl﹣,Fe2+ 被氧化为铁离子. ﹣第 22 页(共 33 页) 2﹣ 【解答】解:(1)KClO3 在 H2SO4 存在下与 Na2SO3 反应制得 ClO2,可知 SO3 ﹣2﹣ 被氧化成 SO42﹣,由电子、电荷守恒可知该离子反应为 2ClO3 +SO3 +2H+═ 2﹣ 2ClO2+SO4 +H2O,氧化剂为 KClO3,还原剂为 Na2SO3,由离子反应可知该 反应氧化剂与还原剂物质的量之比为 2:1,故答案为:2:1; (2)①由生产流程可知氯化铵在盐酸溶液中电解,阴极生成氢气,阳极生成 NCl3 ,电解方程式为 NH4Cl+2HCl NCl3+3H2↑, NCl3+3H2↑; 故答案为:NH4Cl+2HCl ② 在NCl3 溶 液 中 加 入NaClO2 , 可 生 成ClO2 、 NH3 和 X , 发 生 NCl3+NaClO2+H2O→ClO2+NH3+NaOH+NaCl,溶液 X 中大量存在的阴离子有 Cl﹣、OH﹣, 故答案为:Cl﹣、OH﹣; ③a.ClO2 易溶于水,不能利用饱和食盐水吸收氨气,故错误; b.碱石灰不能吸收氨气,故错误; c.浓硫酸可以吸收氨气,且不影响 ClO2,故正确; d.ClO2 易溶于水,不能利用水吸收氨,故错误; 故答案为:c; (3)①由题目信息可知,ClO2 通入锥形瓶与酸性碘化钾溶液反应,氧化 I﹣为 I2 ,自身被还原为 Cl﹣,同时生成水,反应离子方程式为 2ClO2+10I﹣+8H+═ 2Cl﹣+5I2+4H2O, 故答案为:2ClO2+10I﹣+8H+═2Cl﹣+5I2+4H2O; ②玻璃液封装置的作用是吸收残留的 ClO2 气体(避免碘的逸出),故答案为: 吸收残留的 ClO2 气体(避免碘的逸出); ③V 中加入的指示剂通常为淀粉溶液,滴定至终点的现象是溶液由蓝色变为无色 ,且半分钟内不变色,故答案为:淀粉溶液;溶液由蓝色变为无色,且半分 钟内不变色; ④含有 Na2S2O3 物质的量为 0.02 L×0.1mol/L=0.002 mol,则: 第 23 页(共 33 页) 根据关系式:2ClO2~5I2~10Na2S2O3, 210 n(ClO2) 0.002mol 所以 n(ClO2)=0.0004mol,所以 m(ClO2)=0.0004 mol×67.5g/mol=0.02700g, 故答案为:0.02700; (4)若要除去超标的亚氯酸盐,ac 均不能还原亚氯酸盐,b 中 KI 具有还原性但 氧化产物不适合饮用水使用,只有 d 中 Fe2+将 ClO2 还原成 Cl﹣,Fe2+ 被氧 ﹣化为铁离子,且铁离子水解生成胶体可净化饮用水,则最适宜的是 d,故答案 为:d. 【点评】本题考查物质含量的测定,为高频考点,为 2015 年高考真题,把握物 质的性质、制备流程、发生的反应为解答的关键,侧重分析与实验、计算能 力的综合考查,综合性较强,题目难度中等. 三、化学——选修 2:化学与技术。(满分 15 分) 11.(15 分)苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产 苯酚和丙酮,其反应和工艺流程示意图如图: 相关化合物的物理常数 第 24 页(共 33 页) 密度(g/cm﹣3) 物质 相对分子质量 沸点/℃ 120 58 0.8640 0.7898 1.0722 153 56.5 182 异丙苯 丙酮 94 苯酚 回答下列问题: (1)在反应器 A 中通入的 X 是 氧气或空气 。 (2)反应①和②分别在装置 A 和 C 中进行(填装置符号)。 (3)在分解釜 C 中加入的 Y 为少置浓硫酸,其作用是 催化剂 ,优点是用量 少,缺点是 腐蚀设备 。 (4)反应②为 放热 (填“放热”或“吸热”)反应。反应温度控制在 50﹣60℃, 温度过高的安全隐患是 可能会导致(过氧化物)爆炸 。 (5)中和釜 D 中加入的 Z 最适宜的是 c (填编号。已知苯酚是一种弱酸)。 a.NaOHb.CaCO3c.NaHCO3d.CaO (6)蒸馏塔 F 中的馏出物 T 和 P 分别为 丙酮 和 苯酚 ,判断的依据是 丙酮的沸点低于苯酚 。 (7)用该方法合成苯酚和丙酮的优点是 原子利用率高 。 【考点】U3:制备实验方案的设计.菁优网版权所有 【专题】18:实验分析题;25:实验评价题;43:演绎推理法;547:有机实验 综合. 【分析】用异丙苯氧化法生产苯酚和丙酮,由给予的反应信息,异丙苯与氧气在 反 应 器A 中 发 生 氧 化 反 应 生 成 , 在 蒸 发 器 中 分 离 出 在分解 ,未反应的异丙苯进行循环利用, 釜中在浓硫酸作催化剂条件下分解得到 、,在中和釜中 加入 Z,目的是中和硫酸,且不能与苯酚反应,可以是碳酸氢钠,然后用水 第 25 页(共 33 页) 洗涤,再经过蒸馏,由于丙酮的沸点低于苯酚,则 T 为丙酮、P 为苯酚。 (1)在反应器 A 发生信息中的反应①,应通入氧气或空气; (2)由上述分析可知,反应①在 A 中发生,反应②在 C 中发生; (3)浓硫酸起催化剂作用,浓硫酸腐蚀性强,会腐蚀设备; (4)反应②的△H<0,为放热反应,含有过氧化物,温度过高,容易发生爆炸 ,(5)加入的 Z 中和硫酸,且不能与苯酚反应; (6)沸点越低越先蒸出,处于蒸馏塔的上部; (7)由异丙苯最终得到苯酚和丙酮,原子利用率高。 【解答】解:用异丙苯氧化法生产苯酚和丙酮,由给予的反应信息,异丙苯与氧 气在反应器 A 中发生氧化反应生成 ,在蒸发器中分离出 ,未反应的异丙苯进行循环利用, 在分解 釜中在浓硫酸作催化剂条件下分解得到 、,在中和釜中 加入 Z,目的是中和硫酸,且不能与苯酚反应,可以是碳酸氢钠,然后用水 洗涤,再经过蒸馏,由于丙酮的沸点低于苯酚,则 T 为丙酮、P 为苯酚。 (1)在反应器 A 发生信息中的反应①,故需要氧气或空气,所以 X 为氧气或空 气, 故答案为:氧气或空气; (2)由上述分析可知,反应①在反应器中发生,即 A 装置,反应②在分解釜中 进行,即 C 装置, 故答案为:A;C; (3) 在浓硫酸作条件下分解得到 、,浓 硫酸作作催化剂,浓硫酸腐蚀性强,容易腐蚀设备, 故答案为:催化剂;腐蚀设备; (4)反应②的△H<0,为放热反应,有过氧化物存在,温度过高会导致爆炸, 第 26 页(共 33 页) 反应温度控制在 50﹣60℃, 故答案为:放热;温度过高会导致爆炸; (5)加入 Z 的目的是中和硫酸,且不能与苯酚反应, a.NaOH 能与硫酸、苯酚反应,故不选; b.CaCO3 为固体,且与硫酸反应生成的硫酸钙微溶,会阻止碳酸钙与硫酸的反 应,故 b 不选; c.NaHCO3 能与硫酸反应,不与苯酚反应,故 c 选; d.CaO 能与苯酚反应,且与硫酸反应生成的硫酸钙微溶,会阻止氧化钙与硫酸 的反应,故 d 不选; 故选:c; (6)由于丙酮的沸点低于苯酚,沸点越低越先蒸出,处于蒸馏塔的上部,则 T 为丙酮、P 为苯酚, 故答案为:丙酮;苯酚;丙酮的沸点低于苯酚; (7)由异丙苯最终得到苯酚和丙酮,整个过程原子利用率高, 故答案为:原子利用率高。 【点评】本题考查有机物的制备实验方案,涉及对化学工艺流程、装置及试剂的 分析评价等,关键是根据实验目的与给予的反应信息理解工艺流程原理,是 对学生综合能力的考查,难度中等。 四、化学-选修 3:物质结构与性质。(满分 15 分) 12.(15 分)A、B、C、D 为原子序数依次增大的四种元素,A2﹣和 B+具有相 同的电子构型;C、D 为同周期元素,C 核外电子总数是最外层电子数的 3 倍 ;D 元素最外层有一个未成对电子.回答下列问题: (1)四种元素中电负性最大的是 O (填元素符号),其中 C 原子的核外电 子排布式为 1s22s22p63s23p3 . (2)单质 A 有两种同素异形体,其中沸点高的是 O3 (填分子式),原因是 O3 相对分子质量较大,范德华力较大 ;A 和 B 的氢化物所属的晶体类型分 别为 分子晶体 和 离子晶体 . (3)C 和 D 反应可生成组成比为 1:3 的化合物 E,E 的立体构型为 三角锥形 第 27 页(共 33 页) ,中心原子的杂化轨道类型为 sp3 . (4)化合物 D2A 的立体构型为 V 形 ,中心原子的价层电子对数为 4 , 单 质D 与 湿 润 的Na2CO3 反 应 可 制 备D2A , 其 化 学 方 程 式 为2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl . (5)A 和 B 能够形成化合物 F,其晶胞结构如图所示,晶胞边长 a=0.566nm,F 的化学式为 Na2O ;晶胞中 A 原子的配位数为 8 ;列式计算晶体 F 的 密度(g•cm﹣3 ) 2.27g•cm﹣3 (保留小数点后两位数字). 【考点】9I:晶胞的计算.菁优网版权所有 【专题】51B:原子组成与结构专题;51D:化学键与晶体结构. 【分析】A、B、C、D 为原子序数依次增大的四种元素,C、D 为同周期元素, C 核外电子总数是最外层电子数的 3 倍,则 C 为 P 元素;D 元素最外层有一 个未成对电子,D 为 Cl 元素; A2﹣和 B+具有相同的电子构型,则 A 为 O 元素、B 为 Na 元素; (1)四种元素电负性最大的为 O 元素,C 为 P 元素; (2)A 为 O 元素,有 O2、O3 两种同素异形体,O3 相对分子质量较大,沸点较 高,B 的氢化物为 NaH,为离子晶体; (3)C 和 D 反应可生成化合物为 PCl3,为 sp3 杂化; (4)化合物 D2A 为 Cl2O,立体构型为 V 形,氯气与湿润的 Na2CO3 反应的方程 式为 2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl; (5)A 和 B 能够形成化合物 F 为离子化合物,阴离子位于晶胞的定点和面心, 阳离子位于晶胞的体心,则 Na 的个数为 8,O 的个数为 8× +6× =4, N(Na):N(O)=2:1,则形成的化合物为 Na2O,计算质量和体积,可计算 密度. 第 28 页(共 33 页) 【解答】解:A、B、C、D 为原子序数依次增大的四种元素,C、D 为同周期元 素,C 核外电子总数是最外层电子数的 3 倍,则 C 为 P 元素;D 元素最外层 有一个未成对电子,D 为 Cl 元素; A2﹣和 B+具有相同的电子构型,则 A 为 O 元素、B 为 Na 元素; (1)四种元素分别为 O、Na、O、Cl,电负性最大的为 O 元素,C 为 P 元素, 核外电子排布为 1s22s22p63s23p3, 故答案为:O;1s22s22p63s23p3; (2)A 为 O 元素,有 O2、O3 两种同素异形体,二者对应的晶体都为分子晶体, 因 O3 相对分子质量较大,则范德华力较大,沸点较高,A 的氢化物为水,为 分子晶体,B 的氢化物为 NaH,为离子晶体, 故答案为:O3;O3 相对分子质量较大,范德华力较大;分子晶体;离子晶体; (3)C 和 D 反应可生成组成比为 1:3 的化合物为 PCl3,P 形成 3 个 δ 键,孤电 子对数为 =1,则为 sp3 杂化,立体构型为为三角锥形, 故答案为:三角锥形;sp3; (4)化合物 D2A 为 Cl2O,O 为中心原子,形成 2 个 δ 键,孤电子对数为 =2,则中心原子的价层电子对数为 4,立体构型为 V 形, 氯 气 与 湿 润 的Na2CO3 反 应 可 制 备Cl2O , 反 应 的 方 程 式 为 2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl, 故答案为:V 形;4;2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl; (5)A 和 B 能够形成化合物 F 为离子化合物,阴离子位于晶胞的顶点和面心, 阳离子位于晶胞的体心,则 Na 的个数为 8,O 的个数为 8× +6× =4, N(Na):N(O)=2:1,则形成的化合物为 Na2O, 晶胞中 O 位于顶点,Na 位于体心,每个晶胞中有 1 个 Na 与 O 的距离最近,每 个定点为 8 个晶胞共有,则晶胞中 O 原子的配位数为 8, 晶胞的质量为 g, 晶胞的体积为(0.566×10﹣7)3cm3, 则晶体 F 的密度为 g•cm﹣3=2.27 g•cm﹣3, 第 29 页(共 33 页) 故答案为:Na2O;8;2.27g•cm﹣3. 【点评】本题考查物质结构和性质,为高频考点,侧重考查学生空间想象能力、 知识运用能力,涉及晶胞计算、原子结构等知识点,采用均摊法、价层电子 对互斥理论等理论分析解答,难点是晶胞计算,题目难度中等. 五、化学一选修 5:有机化学基础(满分 15 分) 13.(15 分)聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在 材枓的生物相容性方面有很好的应用前景. PPG 的一种合成路线如下: 已知: ①烃 A 的相对分子质量为 70,核磁共振氢谱显示只有一种化学环境的氢 ②化合物 B 为单氯代烃:化合物 C 的分子式为 C5H8 ③E、F 为相对分子质量差 14 的同系物,F 是福尔马林的溶质 ④冋答下列问题: (1)A 的结构简式为 . 成(2)由B生C的化学方程式为 . (3)由 E 和 F 生成 G 的反应类型为 加成反应 ,G 的化学名称为 3﹣羟基 丙醛 . ( 4 ) ① 由D 和 H 生 成PPG 的 化 学 方 程 式 为 :第 30 页(共 33 页) ②若 PPG 平均相对分子质量为 10000,则其平均聚合度约为 b (填标号). a. 48b. 58c. 76 d.122 (5)D 的同分异构体中能同时满足下列条件的共有 5 种(不含立体异构): ①能与饱和 NaHCO3 溶液反应产生气体②既能发生银镜反应,又能发生水解反应 其中核磁共振氢谱显示为 3 组峰,且峰面积比为 6:1:1 的是 (写结构简式) D 的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该 仪器是 c (填标号). a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪. 【考点】HC:有机物的合成.菁优网版权所有 【分析】烃 A 的相对分子质量为 70,核磁共振氢谱显示只有一种化学环境的氢, =5…10,则 A 为 C5H10,结构为 ;A 发生光照下取代反应生成 B 为,B 发生消去反应生成 C 为 ,化合物C 的分子式为 C5H8;C 发生氧化反应生成 D 为 HOOC(CH2)COOH,E、F 为相对分子质 3量差 14 的同系物,F 是福尔马林的溶质,则 F 为 HCHO,可知 E 为 CH3CHO ,由信息④可知 E 与 F 反应生成 G 为 OHCH2CH2CHO,G 与氢气发生加成反 应 生 成H 为 OHCH2CH2CH2OH , D 与 H 发 生 缩 聚 反 应 生 成PPG ( ),以此来解答. 【解答】解:烃 A 的相对分子质量为 70,核磁共振氢谱显示只有一种化学环境 第 31 页(共 33 页) 的氢, =5…10,则 A 为 C5H10,结构为 ;A 发生光照下取代反应生 成 B 为 ,B 发生消去反应生成 C 为 ,化合物C 的分子式 为 C5H8;C 发生氧化反应生成 D 为 HOOC(CH2)3COOH,E、F 为相对分 子质量差 14 的同系物,F 是福尔马林的溶质,则 F 为 HCHO,可知 E 为 CH3CHO,由信息④可知 E 与 F 反应生成 G 为 OHCH2CH2CHO,G 与氢气发 生加成反应生成 H 为 OHCH2CH2CH2OH,D 与 H 发生缩聚反应生成 PPG( ), (1)A 的结构简式为 ,故答案为: ;(2)由B生成C的化学,方程式为故答案为: ;(3)由 E 和 F 生成 G 的反应类型为加成反应,G 的化学名称为 3﹣羟基丙醛, 故答案为:加成反应;3﹣羟基丙醛; ( 4 ) ① 由 D和H生 成PPG 的 化 学 方 程 式 为 ,故答案为:;第 32 页(共 33 页) ②若 PPG 平均相对分子质量为 10000,则其平均聚合度约为 ≈58,故答案为:b; (5)D 的同分异构体中能同时满足①能与饱和 NaHCO3 溶液反应产生气体,含 ﹣COOH,②既能发生银镜反应,又能发生水解反应﹣COOCH,D 中共 5 个 C,则含 3 个 C﹣C﹣C 上的 2 个 H 被﹣COOH、﹣OOCH 取代,共为 3+2=5 种,含其中核磁共振氢谱显示为 3 组峰,且峰面积比为 6:1:1 的是 ,D 及同分异构体中组成相同,由元素分析仪显示的信号(或 数据)完全相同,故答案为:5; ;c. 【点评】本题考查有机物的推断,为高频考点,为 2015 年高考真题,把握合成 中碳链变化、官能团变化及反应条件推断物质为解答的关键,侧重分析与推 断能力的综合考查,题目难度中等. 第 33 页(共 33 页)
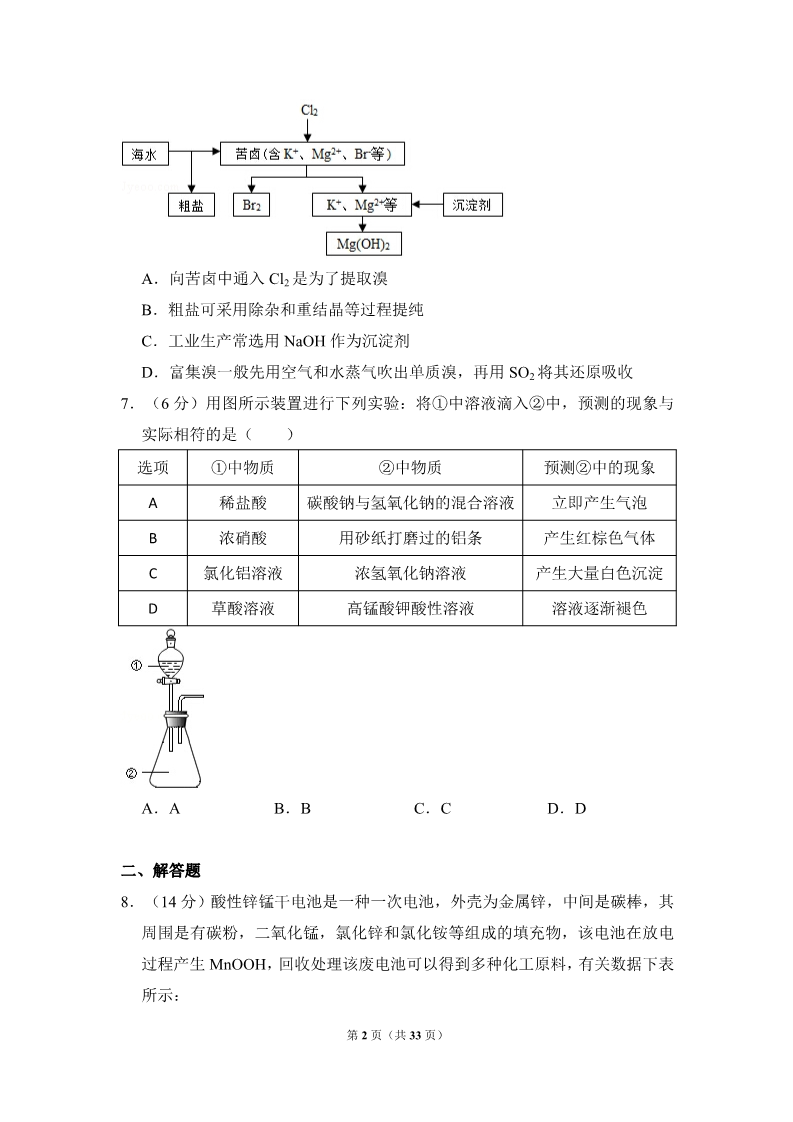
2015 年全国统一高考化学试卷(新课标Ⅱ) 一、选择题(共 7 小题,每小题 6 分,满分 42 分) 1.(6 分)食品干燥剂应无毒、无味、无腐蚀性及环境友好.下列说法错误的 是( ) A.硅胶可用作食品干燥剂 B.P2O5 不可用作食品干燥剂 C.六水合氯化钙可用作食品干燥剂 D.加工后具有吸水性的植物纤维可用作食品干燥剂 2.(6 分)某羧酸酯的分子式为 C18H26O5,1mol 该酯完全水解可得到 1mol 羧 酸和 2mol 乙醇,该羧酸的分子式为( ) A.C14H18O5 B.C14H16O4 C.C16H22O5 D.C16H20O5 3.(6 分)原子序数依次增大的元素 a、b、c、d,它们的最外层电子数分别为 1 、6、7、1.a﹣的电子层结构与氦相同,b 和 c 的次外层有 8 个电子,c﹣和 d+ 的电子层结构相同.下列叙述错误的是( ) A.a 和其他 3 种元素均能形成共价化合物 B.元素的非金属性次序为 c>b>a C.d 和其他 3 种元素均能形成离子化合物 D.元素 a、b、c 各自最高和最低化合价的代数和分别为 0、4、6 4.(6 分)NA 代表阿伏加德罗常数的值.下列叙述正确的是( ) A.60g 丙醇中存在的共价键总数为 10NA B.1L 0.1mol•L﹣1 的 NaHCO3 溶液中 HCO3 和 CO32﹣离子数之和为 0.1NA ﹣C.钠在空气中燃烧可生成多种氧化物.23g 钠充分燃烧时转移电子数为 1NA 1D.235g 核素 92235U 发生裂变反应:92235U+01n 90Sr+54136Xe+100 n 净产生 38 1的中子(0 n)数为 10NA 5.(6 分)分子式为 C5H10O2 且可与碳酸氢钠溶液反应放出气体的有机化合物 有( ) A.3 种 B.4 种 C.5 种 D.6 种 6.(6 分)海水开发利用的部分过程如图所示.下列说法错误的是( ) 第 1 页(共 33 页) A.向苦卤中通入 Cl2 是为了提取溴 B.粗盐可采用除杂和重结晶等过程提纯 C.工业生产常选用 NaOH 作为沉淀剂 D.富集溴一般先用空气和水蒸气吹出单质溴,再用 SO2 将其还原吸收 7.(6 分)用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与 实际相符的是( ) 选项 ①中物质 稀盐酸 ②中物质 碳酸钠与氢氧化钠的混合溶液 用砂纸打磨过的铝条 浓氢氧化钠溶液 预测②中的现象 立即产生气泡 ABCD浓硝酸 产生红棕色气体 产生大量白色沉淀 溶液逐渐褪色 氯化铝溶液 草酸溶液 高锰酸钾酸性溶液 A.A B.B C.C D.D 二、解答题 8.(14 分)酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其 周围是有碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电 过程产生 MnOOH,回收处理该废电池可以得到多种化工原料,有关数据下表 所示: 第 2 页(共 33 页) 溶解度/(g/100g 水) 020 40 60 80 100 温度/℃ 化合物 NH4Cl ZnCl2 29.3 343 37.2 395 45.8 452 55.3 488 65.6 541 77.3 614 化合物 Ksp 近似值 Zn(OH)2 Fe(OH)2 10﹣17 Fe(OH)3 10﹣17 10﹣39 回答下列问题: (1)该电池的正极反应式为 ,电池反应的离子方程式为: 。 (2)持续电流强度为 0.5A,电池工作五分钟,理论消耗锌 F=96500C/mol) g.(已经 (3)废电池糊状填充物加水处理后,过滤,滤液中主要有 ZnCl2 和 NH4Cl,两 者可以通过 分离回收,滤渣的主要成分是MnO2、 和 欲从中得到较纯的 MnO2,最简便的方法是 ,其原理是 。 (4)用废电池的锌皮制作 ZnSO4•7H2O 的过程中,需除去铁皮中的少量杂质铁, 其方法是:加入稀 H2SO4 和 H2O2,溶解,铁变为 加碱调节pH 为 时,铁刚好沉淀完全(离子浓度小于 1×10﹣5mol•L﹣1 时,即可认为该离子沉 时,锌开始沉淀(假定 Zn2+浓度为 0.1mol•L﹣1)。若上述过程不加 H2O2 的后果是 , 淀完全)。继续加碱调节 pH 为 ,原因是 。 9.(14 分)甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分 为 CO、CO2 和 H2)在催化剂的作用下合成甲醇,发生的主要反应如下: ①CO(g)+2H2(g)⇌CH3OH(g)△H1 ②CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2 ③CO2(g)+H2(g)⇌CO(g)+H2O(g)△H3 回答下列问题: H﹣H C﹣O H﹣O C﹣H 化学键 C≡O 第 3 页(共 33 页) E/(kJ.mol﹣1) 436 343 1076 465 413 (1)已知反应①中的相关的化学键键能数据如下: 由此计算△H1= .mol﹣1 kJ.mol﹣1,已知△H2=﹣58kJ.mol﹣1,则△H3= kJ (2)反应①的化学平衡常数 K 的表达式为 ;图 1 中能正确反映平衡常 数 K 随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。(3)合成气的组成 n(H2)/n(CO+CO2)=2.60 时体系中的 CO 平衡转化率(a) 与温度和压强的关系如图 2 所示。a(CO)值随温度升高而 ”或“减小”),其原因是 。图2 中的压强由大到小为 理由是 (填“增大 ,其判断 10.(15 分)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒 剂,回答下列问題: (1 )工业上可用 KClO3 与 Na2SO3 在 H2SO4 存在下制得 ClO2,该反应氧化剂与 还原剂物质的量之比为 . (2)实验室用 NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备 ClO2: 第 4 页(共 33 页) ①电解时发生反应的化学方程式为 . . ②溶液 X 中大量存在的阴离子有 ③除去 ClO2 中的 NH3 可选用的试剂是 硫酸 d.饱和食盐水 (填标号)a.水 b.碱石灰 c.浓 (3)用如图装置可以测定混合气中 ClO2 的含量: Ⅰ.在锥形瓶中加入足量的碘化钾,用 50mL 水溶解后,再加入 3mL 稀硫酸: Ⅱ.在玻璃液封装置中加入水.使液面没过玻璃液封管的管口; Ⅲ.将一定量的混合气体通入锥形瓶中吸收; Ⅳ.将玻璃液封装置中的水倒入锥形瓶中: 2﹣ Ⅴ.用 0.1000mol•L﹣1 硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O3 ═2I﹣+S4O62﹣),指示剂显示终点时共用去 20.00mL 硫代硫酸钠溶液.在此过 程中: ①锥形瓶内 ClO2 与碘化钾反应的离子方程式为 ②玻璃液封装置的作用是 ③V 中加入的指示剂通常为 ,滴定至终点的现象是 ④测得混合气中 ClO2 的质量为 g. (4)用 ClO2 处理过的饮用水会含有一定最的亚氯酸盐.若要除去超标的亚氯酸 盐,下列物质最适宜的是 硫酸亚铁. (填标号)a.明矾 b.碘化钾 c.盐酸 d. 三、化学——选修 2:化学与技术。(满分 15 分) 11.(15 分)苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产 第 5 页(共 33 页) 苯酚和丙酮,其反应和工艺流程示意图如图: 相关化合物的物理常数 密度(g/cm﹣3) 物质 相对分子质量 沸点/℃ 120 58 0.8640 0.7898 1.0722 153 56.5 182 异丙苯 丙酮 94 苯酚 回答下列问题: (1)在反应器 A 中通入的 X 是 (2)反应①和②分别在装置 。 和 中进行(填装置符号)。 (3)在分解釜 C 中加入的 Y 为少置浓硫酸,其作用是 缺点是 。 ,优点是用量少, (4)反应②为 (填“放热”或“吸热”)反应。反应温度控制在 50﹣60℃, 温度过高的安全隐患是 。 (5)中和釜 D 中加入的 Z 最适宜的是 。 (填编号。已知苯酚是一种弱酸) a.NaOHb.CaCO3c.NaHCO3d.CaO 第 6 页(共 33 页) (6)蒸馏塔 F 中的馏出物 T 和 P 分别为 和 。 ,判断的依据是 。 (7)用该方法合成苯酚和丙酮的优点是 四、化学-选修 3:物质结构与性质。(满分 15 分) 12.(15 分)A、B、C、D 为原子序数依次增大的四种元素,A2﹣和 B+具有相 同的电子构型;C、D 为同周期元素,C 核外电子总数是最外层电子数的 3 倍 ;D 元素最外层有一个未成对电子.回答下列问题: (1)四种元素中电负性最大的是 电子排布式为 . (2)单质 A 有两种同素异形体,其中沸点高的是 是 ;A 和 B 的氢化物所属的晶体类型分别为 (3)C 和 D 反应可生成组成比为 1:3 的化合物 E,E 的立体构型为 (填元素符号),其中 C 原子的核外 (填分子式),原因 和 . , 中心原子的杂化轨道类型为 . (4)化合物 D2A 的立体构型为 ,中心原子的价层电子对数为 , 单质 D 与湿润的 Na2CO3 反应可制备 D2A,其化学方程式为 (5)A 和 B 能够形成化合物 F,其晶胞结构如图所示,晶胞边长 a=0.566nm,F 的化学式为 ;晶胞中A 原子的配位数为 ;列式计算晶体F 的 密度(g•cm﹣3 ) . (保留小数点后两位数字). 五、化学一选修 5:有机化学基础(满分 15 分) 13.(15 分)聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在 材枓的生物相容性方面有很好的应用前景. PPG 的一种合成路线如下: 第 7 页(共 33 页) 已知: ①烃 A 的相对分子质量为 70,核磁共振氢谱显示只有一种化学环境的氢 ②化合物 B 为单氯代烃:化合物 C 的分子式为 C5H8 ③E、F 为相对分子质量差 14 的同系物,F 是福尔马林的溶质 ④冋答下列问题: (1)A 的结构简式为 . (2)由 B 生成 C 的化学方程式为 (3)由 E 和 F 生成 G 的反应类型为 . ,G 的化学名称为 . (4)①由 D 和 H 生成 PPG 的化学方程式为: ②若 PPG 平均相对分子质量为 10000,则其平均聚合度约为 a. 48b. 58c. 76 d.122 (填标号). (5)D 的同分异构体中能同时满足下列条件的共有 种(不含立体异构) :①能与饱和 NaHCO3 溶液反应产生气体②既能发生银镜反应,又能发生水解反应 其中核磁共振氢谱显示为 3 组峰,且峰面积比为 6:1:1 的是 (写结构 简式) D 的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该 仪器是 (填标号). a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪. 第 8 页(共 33 页) 2015 年全国统一高考化学试卷(新课标Ⅱ) 参考答案与试题解析 一、选择题(共 7 小题,每小题 6 分,满分 42 分) 1.(6 分)食品干燥剂应无毒、无味、无腐蚀性及环境友好.下列说法错误的 是( ) A.硅胶可用作食品干燥剂 B.P2O5 不可用作食品干燥剂 C.六水合氯化钙可用作食品干燥剂 D.加工后具有吸水性的植物纤维可用作食品干燥剂 【考点】KF:常见的食品添加剂的组成、性质和作用.菁优网版权所有 【分析】A.硅胶具有吸水性,无毒; B.P2O5 吸水转化为酸; C.六水合氯化钙不能吸水; D.具有吸水性的植物纤维无毒. 【解答】解:A.硅胶具有吸水性,无毒,则硅胶可用作食品干燥剂,故 A 正确 ;B.P2O5 吸水转化为酸,导致食品变质,则 P2O5 不可用作食品干燥剂,故 B 正 确; C.六水合氯化钙不能吸水,则不能作食品干燥剂,故 C 错误; D.具有吸水性的植物纤维无毒,则可用作食品干燥剂,故 D 正确; 故选:C。 【点评】本题考查物质的性质及食品干燥剂,为高频考点,把握物质的性质、化 学与生活的关系为解答的关键,侧重分析与应用能力的综合考查,题目难度 中等. 2.(6 分)某羧酸酯的分子式为 C18H26O5,1mol 该酯完全水解可得到 1mol 羧 第 9 页(共 33 页) 酸和 2mol 乙醇,该羧酸的分子式为( ) A.C14H18O5 B.C14H16O4 C.C16H22O5 D.C16H20O5 【考点】1B:真题集萃;H3:有机物实验式和分子式的确定;M8:有关有机物 分子式确定的计算.菁优网版权所有 【分析】1mol 该酯完全水解可得到 1mol 羧酸和 2mol 乙醇,则说明酯中含有 2 个酯基,结合酯的水解特点以及质量守恒定律判断。 【解答】解:某羧酸酯的分子式为 C18H26O5,1mol 该酯完全水解可得到 1mol 羧 酸和 2mol 乙醇,说明酯中含有 2 个酯基,设羧酸为 M, 则反应的方程式为 C18H26O5+2H2O→M+2C2H6O, 由质量守恒可知 M 的分子式为 C14H18O5, 故选:A。 【点评】本题为 2015 年高考题,考查有机物的推断,为高频考点,把握酯化反 应中碳原子个数变化、官能团的变化为推断的关系,侧重酯的性质的考查, 题目难度不大。 3.(6 分)原子序数依次增大的元素 a、b、c、d,它们的最外层电子数分别为 1 、6、7、1.a﹣的电子层结构与氦相同,b 和 c 的次外层有 8 个电子,c﹣和 d+ 的电子层结构相同.下列叙述错误的是( ) A.a 和其他 3 种元素均能形成共价化合物 B.元素的非金属性次序为 c>b>a C.d 和其他 3 种元素均能形成离子化合物 D.元素 a、b、c 各自最高和最低化合价的代数和分别为 0、4、6 【考点】8F:原子结构与元素周期律的关系.菁优网版权所有 【分析】原子序数依次增大的元素 a、b、c、d,它们的最外层电子数分别为 1、 6、7、1,a﹣的电子层结构与氦相同,则 a 为 H 元素;b 和 c 的次外层有 8 个 电子,原子只能有 3 个电子层,则 b 为 S 元素,c 为 Cl,c﹣和 d+的电子层结 第 10 页(共 33 页) 构相同,则 d 为 K 元素. A.H 元素与 K 元素形成的化合物为 KH,属于离子化合物; B.同周期自左而右非金属性增强,氢化物中 H 元素为正价,其非金属性最弱; C.K 元素与其它元素可以形成 KH、K2S、KCl; D.H 元素最高正化合价为+1、最低负化合价为﹣1,S 元素最高正化合价为+6、 最低负化合价为﹣2,Cl 元素最高正化合价为+7、最低负化合价为﹣1. 【解答】解:原子序数依次增大的元素 a、b、c、d,它们的最外层电子数分别 为 1、6、7、1,a﹣的电子层结构与氦相同,则 a 为 H 元素;b 和 c 的次外层 有 8 个电子,原子只能有 3 个电子层,则 b 为 S 元素,c 为 Cl,c﹣和 d+的电 子层结构相同,则 d 为 K 元素。 A.H 元素与 S 元素、Cl 元素放出形成 H2S、HCl,二者属于共价化合物,但与 K 元素形成的化合物为 KH,属于离子化合物,故 A 错误; B.同周期自左而右非金属性增强,氢化物中 H 元素为正价,其非金属性最弱, 故非金属性 Cl>S>H,故 B 正确; C.K 元素与其它元素可以形成 KH、K2S、KCl,均属于离子化合物,故 C 正确 ;D.H 元素最高正化合价为+1、最低负化合价为﹣1,S 元素最高正化合价为+6、 最低负化合价为﹣2,Cl 元素最高正化合价为+7、最低负化合价为﹣1,最高 和最低化合价的代数和分别为 0、4、6,故 D 正确, 故选:A。 【点评】本题考查结构性质位置关系应用,推断元素是解题关键,侧重对元素周 期律的考查,题目涉及金属氢化物是中学知识的盲点,难度不大. 4.(6 分)NA 代表阿伏加德罗常数的值.下列叙述正确的是( ) A.60g 丙醇中存在的共价键总数为 10NA B.1L 0.1mol•L﹣1 的 NaHCO3 溶液中 HCO3 和 CO32﹣离子数之和为 0.1NA ﹣C.钠在空气中燃烧可生成多种氧化物.23g 钠充分燃烧时转移电子数为 1NA 第 11 页(共 33 页) 1D.235g 核素 92235U 发生裂变反应:92235U+01n 90Sr+54136Xe+100 n 净产生 38 1的中子(0 n)数为 10NA 【考点】1B:真题集萃;4F:阿伏加德罗常数.菁优网版权所有 【专题】518:阿伏加德罗常数和阿伏加德罗定律. 【分析】A.丙醇中含 7 个 C﹣H 键、2 个 C﹣C 键、1 个 C﹣O 键和 1 个 O﹣H 键; ﹣B.HCO3 水解生成碳酸,结合原子守恒分析; C.钠发生氧化反应后,Na 元素的化合价由 0 升高为+1 价; 1D.92235U+01n 90Sr+54136Xe+100 n 净产生的中子为 10﹣1=9 个. 38 【解答】解:A.60g 丙醇为 1mol,丙醇中含 7 个 C﹣H 键、2 个 C﹣C 键、1 个 C﹣O 键和 1 个 O﹣H 键,存在的共价键总数为 11NA,故 A 错误; B.1L 0.1mol•L﹣1 的 NaHCO3 溶液中 HCO3 和 CO32﹣离子数之和小于 0.1NA,碳 ﹣酸分子中含 C 原子,故 B 错误; C.23g 钠充分燃烧时转移电子数为 ×(1﹣0)×NA=1NA,故 C 正确; 1D.92235U+01n 90Sr+54136Xe+100 n 净产生的中子为 10﹣1=9 个,则 235g 核素 38 1235U 发生裂变反应净产生的中子(0 n)数为 9NA,故 D 错误; 92 故选:C。 【点评】本题考查阿伏伽德罗常数及计算,为高频考点,把握物质中的化学键、 物料守恒、盐类水解、氧化还原反应中转移电子计算等为解答的关键,侧重 分析与应用能力的综合考查,综合性较强,题目难度中等. 5.(6 分)分子式为 C5H10O2 且可与碳酸氢钠溶液反应放出气体的有机化合物 有( ) A.3 种 B.4 种 C.5 种 D.6 种 第 12 页(共 33 页) 【考点】H6:有机化合物的异构现象.菁优网版权所有 【专题】532:同分异构体的类型及其判定. 【分析】分子式为 C5H10O2 且可与碳酸氢钠溶液反应放出气体,则该有机物中含 有﹣COOH,所以为戊酸,戊酸的种类等于丁基的种类,写出丁基的种类即 可. 【解答】解:分子式为 C5H10O2 且可与碳酸氢钠溶液反应放出气体,则该有机物 中含有﹣COOH,所以为戊酸,戊酸的种类等于丁基的种类,丁基(﹣C4H9) 的异构体有:﹣CH2CH2CH2CH3,﹣CH(CH3)CH2CH3,﹣CH2CH(CH3)CH3 ,﹣C(CH3)3,故戊酸的有机物的异构体数目为 4,故选 B。 【点评】本题主要考查同分异构体书写、官能团的性质与确定等,难度中等,注 意利用丁基异构判断. 6.(6 分)海水开发利用的部分过程如图所示.下列说法错误的是( ) A.向苦卤中通入 Cl2 是为了提取溴 B.粗盐可采用除杂和重结晶等过程提纯 C.工业生产常选用 NaOH 作为沉淀剂 D.富集溴一般先用空气和水蒸气吹出单质溴,再用 SO2 将其还原吸收 【考点】1B:真题集萃;E7:海水资源及其综合利用.菁优网版权所有 【分析】A.向苦卤中通入 Cl2 置换出溴单质,分离得到溴; B.粗盐中含有 Ca2+、Mg2+、SO42﹣等杂质,精制时应加入试剂进行除杂,过滤 后向滤液中加入盐酸至溶液呈中性,再进行重结晶进行提纯; 第 13 页(共 33 页) C.工业常选用生石灰或石灰水作沉淀剂; D.先用空气和水蒸气吹出单质溴,再用 SO2 将其还原吸收转化为 HBr,达到富 集的目的. 【解答】解:A.向苦卤中通入 Cl2 置换出溴单质,分离得到溴,通入 Cl2 是为 了提取溴,故 A 正确; B.粗盐中含有 Ca2+、Mg2+、SO42﹣等杂质,精制时通常在溶液中依次中加入过 量的 BaCl2 溶液、过量的 NaOH 溶液和过量的 Na2CO3 溶液,过滤后向滤液中 加入盐酸至溶液呈中性,再进行重结晶进行提纯,故 B 正确; C.工业常选用生石灰或石灰水作沉淀剂,故 C 错误; D.海水提取溴一般用氯气置换溴离子转化为溴单质,用空气和水蒸气吹出单质 溴,再用 SO2 将其还原吸收转化为 HBr,达到富集的目的,故 D 正确, 故选:C。 【点评】本题考查海水资源的综合利用,注意掌握中学常见的化学工业,侧重对 化学与技术的考查,难度不大. 7.(6 分)用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与 实际相符的是( ) 选项 ①中物质 稀盐酸 ②中物质 碳酸钠与氢氧化钠的混合溶液 用砂纸打磨过的铝条 浓氢氧化钠溶液 预测②中的现象 立即产生气泡 ABCD浓硝酸 产生红棕色气体 产生大量白色沉淀 溶液逐渐褪色 氯化铝溶液 草酸溶液 高锰酸钾酸性溶液 A.A B.B C.C D.D 第 14 页(共 33 页) 【考点】U5:化学实验方案的评价.菁优网版权所有 【分析】A.先发生盐酸与 NaOH 的反应; B.常温下,Al 遇浓硝酸发生钝化; C.NaOH 过量,开始不生成沉淀; D.发生氧化还原反应. 【解答】解:A.先发生盐酸与 NaOH 的反应,然后盐酸与碳酸钠反应生成碳酸 氢钠,最后盐酸与碳酸氢钠反应生成气体,则现象不合理,故 A 错误; B.常温下,Al 遇浓硝酸发生钝化,则不能观察到红棕色气体,现象不合理, 故 B 错误; C.NaOH 过量,开始不生成沉淀,反应生成偏铝酸钠和氯化钠,开始无现象, 故 C 错误; D.草酸与高锰酸钾发生氧化还原反应,溶液褪色,现象合理,故 D 正确; 故选:D。 【点评】本题考查物质的性质及实验装置的综合应用,为高频考点,为 2015 年 高考真题,把握物质的性质、发生的反应、反应与现象的关系为解答的关键, 侧重分析与实验能力的综合考查,综合性较强,题目难度中等. 二、解答题 8.(14 分)酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其 周围是有碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电 过程产生 MnOOH,回收处理该废电池可以得到多种化工原料,有关数据下表 所示: 溶解度/(g/100g 水) 020 40 60 80 100 温度/℃ 化合物 NH4Cl ZnCl2 29.3 343 37.2 395 45.8 452 55.3 488 65.6 541 77.3 614 第 15 页(共 33 页) 化合物 Ksp 近似值 Zn(OH)2 Fe(OH)2 Fe(OH)3 10﹣17 10﹣17 10﹣39 回答下列问题: (1)该电池的正极反应式为 MnO2+H++e﹣=MnOOH ,电池反应的离子方程 式为: 2MnO2+Zn+2H+=2MnOOH+Zn2+ 。 (2)持续电流强度为 0.5A,电池工作五分钟,理论消耗锌 0.05 g.(已经 F=96500C/mol) (3)废电池糊状填充物加水处理后,过滤,滤液中主要有 ZnCl2 和 NH4Cl,两 者可以通过 加热浓缩 冷却结晶 分离回收,滤渣的主要成分是 MnO2、 碳粉 和 MnOOH ,欲从中得到较纯的 MnO2,最简便的方法是 空气中 加热 ,其原理是 碳粉转变为二氧化碳,MnOOH 氧化为二氧化锰 。 (4)用废电池的锌皮制作 ZnSO4•7H2O 的过程中,需除去铁皮中的少量杂质铁, 其方法是:加入稀 H2SO4 和 H2O2,溶解,铁变为 Fe3+ 加碱调节 pH 为 2.7 时,铁刚好沉淀完全(离子浓度小于 1×10﹣5mol•L﹣1 时,即可认为该离 子沉淀完全)。继续加碱调节 pH 为 6 时,锌开始沉淀(假定 Zn2+浓度为 0.1mol•L﹣1)。若上述过程不加 H2O2 的后果是 Zn2+和 Fe2+分离不开 ,原 因是 Zn(OH)2、Fe(OH)2 的 Ksp 相近 。 【考点】1B:真题集萃;BH:原电池和电解池的工作原理;P8:物质分离和提 纯的方法和基本操作综合应用.菁优网版权所有 【分析】(1)该电池的正极发生还原反应,MnO2 被还原生成 MnOOH;负极锌 被氧化生成 Zn2+,以此书写电池总反应式; (2)持续电流强度为 0.5A,电池工作五分钟,则电量为 0.5A×300s=150C,转 移电子的物质的量为 ,以此计算消耗锌的质量、物质的量; (3)填充物含有碳粉、二氧化锰,且生成 MnOOH 等,在空气中加热时,碳粉、 MnOOH 可被氧化; (4)铁加入稀 H2SO4 和 H2O2,可被氧化生成 Fe3+,铁刚好沉淀完全时离子浓度 第 16 页(共 33 页) 小于 1×10﹣5mol•L﹣1,结合 Ksp=10﹣39 计算 pH,并根据 Ksp 计算锌开始沉淀 的 pH。 【解答】解:(1)该电池的正极发生还原反应,MnO2 被还原生成 MnOOH,电 极方程式为 MnO2+H++e﹣=MnOOH,负极锌被氧化生成 Zn2+,电池总反应式 为 2MnO2+Zn+2H+=2MnOOH+Zn2+, 故答案为:MnO2+H++e﹣=MnOOH;2MnO2+Zn+2H+=2MnOOH+Zn2+; (2)持续电流强度为 0.5A,电池工作五分钟,则电量为 0.5A×300s=150C,转 移电子的物质的量为 ,则消耗 Zn 的质量为 × × 65g/mol=0.05g, 故答案为:0.05; (3)滤液中主要有 ZnCl2 和 NH4Cl,可通过加热浓缩、冷却结晶得到晶体,填 充物含有碳粉、二氧化锰,且生成 MnOOH 等,在空气中加热时,碳粉、MnOOH 可被氧化,分别生成二氧化碳和二氧化锰,故答案为:加热浓缩;冷却结晶; 碳粉;MnOOH;空气中加热;碳粉转变为二氧化碳,MnOOH 氧化为二氧化 锰; (4)铁加入稀 H2SO4 和 H2O2,可被氧化生成 Fe3+,铁刚好沉淀完全时离子浓度 小于 1×10﹣5mol•L﹣1,因 Ksp=10﹣39 ,则 c(OH﹣)= mol/L≈0.5×10﹣11mol/L,此时 pH=2.7, 如锌开始沉淀,则 c(OH﹣)= mol/L=10﹣8mol/L,此时 pH=6, 由表中数据可知 Zn(OH) 、Fe(OH) 的 Ksp 相近,如不加 H2O2,则 Zn2+和 22Fe2+分离不开, 故答案为:Fe3+;2.7;6;Zn2+和 Fe2+分离不开;Zn(OH)2、Fe(OH)2 的 Ksp 相近。 【点评】本题为 2015 年新课标卷考题,考查原电池知识以及物质的分离、提纯, 侧重于原电池的工作原理以及实验基本操作和注意问题,题目难度中等,有 利于培养学生良好的科学素养。 第 17 页(共 33 页) 9.(14 分)甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分 为 CO、CO2 和 H2)在催化剂的作用下合成甲醇,发生的主要反应如下: ①CO(g)+2H2(g)⇌CH3OH(g)△H1 ②CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2 ③CO2(g)+H2(g)⇌CO(g)+H2O(g)△H3 回答下列问题: H﹣H C﹣O H﹣O C﹣H 化学键 C≡O E/(kJ.mol﹣1) 436 343 1076 465 413 (1)已知反应①中的相关的化学键键能数据如下: 由此计算△H1= ﹣99 kJ.mol﹣1,已知△H2=﹣58kJ.mol﹣1,则△H3= +41 kJ .mol﹣1 (2)反应①的化学平衡常数 K 的表达式为 ;图 1 中能正确 反映平衡常数 K 随温度变化关系的曲线为 a (填曲线标记字母),其判断 理由是 反应①正反应为放热反应,平衡常数随温度升高而减小 。 (3)合成气的组成 n(H2)/n(CO+CO2)=2.60 时体系中的 CO 平衡转化率(a) 与温度和压强的关系如图 2 所示。a(CO)值随温度升高而 减小 (填“增 大”或“减小”),其原因是 反应①正反应为放热反应,升高温度,平衡向逆 反应方向移动,平衡体系中 CO 的量增大,反应③为吸热反应,升高温度, 平衡向正反应方向移动,又使平衡体系中 CO 的增大,总结果,随温度升高, CO 的转化率减小 。图 2 中的压强由大到小为 P3>P2>P1 ,其判断理由 是 相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动, 反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方 向移动,CO 的转化率增大,故增大压强有利于 CO 的转化率升高 第 18 页(共 33 页) 【考点】BB:反应热和焓变;CB:化学平衡的影响因素.菁优网版权所有 【分析】(1)反应热=反应物总键能﹣生成物总键能;根据盖斯定律:反应②﹣ 反应①=反应③,反应热也进行相应的计算; (2)化学平衡常数指可逆反应得到平衡时,各生成物浓度的化学计量数次幂的 乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值; 化学平衡常数只受温度影响,根据温度对平衡移动的影响,进而判断温度对平衡 常数影响; (3)由图可知,压强一定时,随温度的升高,CO 的转化率降低,根据升高温 度对反应①、③的影响,进行分析 CO 转化率变化原因; 相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应① 正反应为气体分子式减小的反应,增大压强,有利于平衡向正反应方向移动, CO 的转化率增大。 【解答】解:(1)反应热=反应物总键能﹣生成物总键能,故△H1=1076kJ. mol﹣1+2×436kJ.mol﹣1﹣(3×413+343+465)kJ.mol﹣1=﹣99kJ.mol﹣1; 根据盖斯定律:反应②﹣反应①=反应③,故△H3=△H2﹣△H1=﹣58kJ.mol﹣1﹣ (﹣99kJ.mol﹣1)=+41kJ.mol﹣1, 故答案为:﹣99;+41; ( 2 ) 反 应 ① CO ( g ) +2H2 ( g ) ⇌ CH3OH ( g ) 的 平 衡 常 数 表 达 式K= 第 19 页(共 33 页) ;反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小, 曲线 a 正确反映平衡常数 K 随温度变化关系, 故答案为: ;a;反应①正反应为放热反应,平衡常数随温度升 高而减小; (3)由图可知,压强一定时,随温度的升高,CO 的转化率减小,反应①正反 应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中 CO 的量增 大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系 中 CO 的增大,总结果,随温度升高,CO 的转化率减小; 相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应① 正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动, CO 的转化率增大,故增大压强有利于 CO 的转化率升高,故压强:P3>P2>P1 ,故答案为:减小;反应①正反应为放热反应,升高温度,平衡向逆反应方向移动 ,平衡体系中 CO 的量增大,反应③为吸热反应,升高温度,平衡向正反应 方向移动,又使平衡体系中 CO 的增大,总结果,随温度升高,CO 的转化率 减小; P3>P2>P1;相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡 移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正 反应方向移动,CO 的转化率增大,故增大压强有利于 CO 的转化率升高。 【点评】本题考查反应热有关计算、平衡常数及其影响因素、化学平衡的影响因 素、化学平衡图象综合应用等,侧重考查学生分析计算能力,需要学生具备 扎实的基础,难度中等。 10.(15 分)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒 剂,回答下列问題: (1 )工业上可用 KClO3 与 Na2SO3 在 H2SO4 存在下制得 ClO2,该反应氧化剂与 第 20 页(共 33 页) 还原剂物质的量之比为 2:1 . (2)实验室用 NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备 ClO2: ①电解时发生反应的化学方程式为 NH4Cl+2HCl ②溶液 X 中大量存在的阴离子有 Cl﹣、OH﹣ . NCl3+3H2↑ . ③除去 ClO2 中的 NH3 可选用的试剂是 c (填标号)a.水 b.碱石灰 c.浓硫 酸 d.饱和食盐水 (3)用如图装置可以测定混合气中 ClO2 的含量: Ⅰ.在锥形瓶中加入足量的碘化钾,用 50mL 水溶解后,再加入 3mL 稀硫酸: Ⅱ.在玻璃液封装置中加入水.使液面没过玻璃液封管的管口; Ⅲ.将一定量的混合气体通入锥形瓶中吸收; Ⅳ.将玻璃液封装置中的水倒入锥形瓶中: 2﹣ Ⅴ.用 0.1000mol•L﹣1 硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O3 ═2I﹣+S4O62﹣),指示剂显示终点时共用去 20.00mL 硫代硫酸钠溶液.在此过 程中: ① 锥 形 瓶 内ClO2 与 碘 化 钾 反 应 的 离 子 方 程 式 为2ClO2+10I﹣+8H+ ═ 2Cl﹣+5I2+4H2O ②玻璃液封装置的作用是 吸收残留的 ClO2 气体(避免碘的逸出) ③V 中加入的指示剂通常为 淀粉溶液 ,滴定至终点的现象是 溶液由蓝色变 为无色,且半分钟内不变色 ④测得混合气中 ClO2 的质量为 0.02700 g. (4)用 ClO2 处理过的饮用水会含有一定最的亚氯酸盐.若要除去超标的亚氯酸 盐,下列物质最适宜的是 d (填标号)a.明矾 b.碘化钾 c.盐酸 d.硫 第 21 页(共 33 页) 酸亚铁. 【考点】RD:探究物质的组成或测量物质的含量;U3:制备实验方案的设计. 菁优网版权所有 【专题】18:实验分析题. 2﹣ 【分析】(1)KClO3 在 H2SO4 存在下与 Na2SO3 反应,SO32﹣被氧化成 SO4 ,﹣2﹣ 2﹣ 由电子、电荷守恒可知该离子反应为 2ClO3 +SO3 +2H+═2ClO2+SO4 +H2O ;(2)由生产流程可知氯化铵在盐酸溶液中进行电解,阴极生成氢气,阳极生成 NCl3,电解方程式为 NH4Cl+2HCl NCl3+3H2↑,在 NCl3 溶液中加入 NaClO2,可生成 ClO2、NH3 和 X,X 中含 Cl﹣、OH﹣;由信息可知,ClO2 易 溶于水,所以不能利用水溶液吸收,氨气为碱性气体,利用性质差异分离提 纯; (3)①由题目信息可知,ClO2 通入锥形瓶与酸性碘化钾溶液反应,氧化 I﹣为 I2 ,自身被还原为 Cl﹣,同时生成水; ②玻璃液封装置可防止有害气体逸出; ③淀粉遇碘单质变蓝; ④根据关系式 2ClO2~5I2~10Na2S2O3 计算 n(ClO2),再根据 m=nM 计算 m( ClO2); (4)亚氯酸盐具有氧化性,Fe2+将 ClO2 还原成 Cl﹣,Fe2+ 被氧化为铁离子. ﹣第 22 页(共 33 页) 2﹣ 【解答】解:(1)KClO3 在 H2SO4 存在下与 Na2SO3 反应制得 ClO2,可知 SO3 ﹣2﹣ 被氧化成 SO42﹣,由电子、电荷守恒可知该离子反应为 2ClO3 +SO3 +2H+═ 2﹣ 2ClO2+SO4 +H2O,氧化剂为 KClO3,还原剂为 Na2SO3,由离子反应可知该 反应氧化剂与还原剂物质的量之比为 2:1,故答案为:2:1; (2)①由生产流程可知氯化铵在盐酸溶液中电解,阴极生成氢气,阳极生成 NCl3 ,电解方程式为 NH4Cl+2HCl NCl3+3H2↑, NCl3+3H2↑; 故答案为:NH4Cl+2HCl ② 在NCl3 溶 液 中 加 入NaClO2 , 可 生 成ClO2 、 NH3 和 X , 发 生 NCl3+NaClO2+H2O→ClO2+NH3+NaOH+NaCl,溶液 X 中大量存在的阴离子有 Cl﹣、OH﹣, 故答案为:Cl﹣、OH﹣; ③a.ClO2 易溶于水,不能利用饱和食盐水吸收氨气,故错误; b.碱石灰不能吸收氨气,故错误; c.浓硫酸可以吸收氨气,且不影响 ClO2,故正确; d.ClO2 易溶于水,不能利用水吸收氨,故错误; 故答案为:c; (3)①由题目信息可知,ClO2 通入锥形瓶与酸性碘化钾溶液反应,氧化 I﹣为 I2 ,自身被还原为 Cl﹣,同时生成水,反应离子方程式为 2ClO2+10I﹣+8H+═ 2Cl﹣+5I2+4H2O, 故答案为:2ClO2+10I﹣+8H+═2Cl﹣+5I2+4H2O; ②玻璃液封装置的作用是吸收残留的 ClO2 气体(避免碘的逸出),故答案为: 吸收残留的 ClO2 气体(避免碘的逸出); ③V 中加入的指示剂通常为淀粉溶液,滴定至终点的现象是溶液由蓝色变为无色 ,且半分钟内不变色,故答案为:淀粉溶液;溶液由蓝色变为无色,且半分 钟内不变色; ④含有 Na2S2O3 物质的量为 0.02 L×0.1mol/L=0.002 mol,则: 第 23 页(共 33 页) 根据关系式:2ClO2~5I2~10Na2S2O3, 210 n(ClO2) 0.002mol 所以 n(ClO2)=0.0004mol,所以 m(ClO2)=0.0004 mol×67.5g/mol=0.02700g, 故答案为:0.02700; (4)若要除去超标的亚氯酸盐,ac 均不能还原亚氯酸盐,b 中 KI 具有还原性但 氧化产物不适合饮用水使用,只有 d 中 Fe2+将 ClO2 还原成 Cl﹣,Fe2+ 被氧 ﹣化为铁离子,且铁离子水解生成胶体可净化饮用水,则最适宜的是 d,故答案 为:d. 【点评】本题考查物质含量的测定,为高频考点,为 2015 年高考真题,把握物 质的性质、制备流程、发生的反应为解答的关键,侧重分析与实验、计算能 力的综合考查,综合性较强,题目难度中等. 三、化学——选修 2:化学与技术。(满分 15 分) 11.(15 分)苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产 苯酚和丙酮,其反应和工艺流程示意图如图: 相关化合物的物理常数 第 24 页(共 33 页) 密度(g/cm﹣3) 物质 相对分子质量 沸点/℃ 120 58 0.8640 0.7898 1.0722 153 56.5 182 异丙苯 丙酮 94 苯酚 回答下列问题: (1)在反应器 A 中通入的 X 是 氧气或空气 。 (2)反应①和②分别在装置 A 和 C 中进行(填装置符号)。 (3)在分解釜 C 中加入的 Y 为少置浓硫酸,其作用是 催化剂 ,优点是用量 少,缺点是 腐蚀设备 。 (4)反应②为 放热 (填“放热”或“吸热”)反应。反应温度控制在 50﹣60℃, 温度过高的安全隐患是 可能会导致(过氧化物)爆炸 。 (5)中和釜 D 中加入的 Z 最适宜的是 c (填编号。已知苯酚是一种弱酸)。 a.NaOHb.CaCO3c.NaHCO3d.CaO (6)蒸馏塔 F 中的馏出物 T 和 P 分别为 丙酮 和 苯酚 ,判断的依据是 丙酮的沸点低于苯酚 。 (7)用该方法合成苯酚和丙酮的优点是 原子利用率高 。 【考点】U3:制备实验方案的设计.菁优网版权所有 【专题】18:实验分析题;25:实验评价题;43:演绎推理法;547:有机实验 综合. 【分析】用异丙苯氧化法生产苯酚和丙酮,由给予的反应信息,异丙苯与氧气在 反 应 器A 中 发 生 氧 化 反 应 生 成 , 在 蒸 发 器 中 分 离 出 在分解 ,未反应的异丙苯进行循环利用, 釜中在浓硫酸作催化剂条件下分解得到 、,在中和釜中 加入 Z,目的是中和硫酸,且不能与苯酚反应,可以是碳酸氢钠,然后用水 第 25 页(共 33 页) 洗涤,再经过蒸馏,由于丙酮的沸点低于苯酚,则 T 为丙酮、P 为苯酚。 (1)在反应器 A 发生信息中的反应①,应通入氧气或空气; (2)由上述分析可知,反应①在 A 中发生,反应②在 C 中发生; (3)浓硫酸起催化剂作用,浓硫酸腐蚀性强,会腐蚀设备; (4)反应②的△H<0,为放热反应,含有过氧化物,温度过高,容易发生爆炸 ,(5)加入的 Z 中和硫酸,且不能与苯酚反应; (6)沸点越低越先蒸出,处于蒸馏塔的上部; (7)由异丙苯最终得到苯酚和丙酮,原子利用率高。 【解答】解:用异丙苯氧化法生产苯酚和丙酮,由给予的反应信息,异丙苯与氧 气在反应器 A 中发生氧化反应生成 ,在蒸发器中分离出 ,未反应的异丙苯进行循环利用, 在分解 釜中在浓硫酸作催化剂条件下分解得到 、,在中和釜中 加入 Z,目的是中和硫酸,且不能与苯酚反应,可以是碳酸氢钠,然后用水 洗涤,再经过蒸馏,由于丙酮的沸点低于苯酚,则 T 为丙酮、P 为苯酚。 (1)在反应器 A 发生信息中的反应①,故需要氧气或空气,所以 X 为氧气或空 气, 故答案为:氧气或空气; (2)由上述分析可知,反应①在反应器中发生,即 A 装置,反应②在分解釜中 进行,即 C 装置, 故答案为:A;C; (3) 在浓硫酸作条件下分解得到 、,浓 硫酸作作催化剂,浓硫酸腐蚀性强,容易腐蚀设备, 故答案为:催化剂;腐蚀设备; (4)反应②的△H<0,为放热反应,有过氧化物存在,温度过高会导致爆炸, 第 26 页(共 33 页) 反应温度控制在 50﹣60℃, 故答案为:放热;温度过高会导致爆炸; (5)加入 Z 的目的是中和硫酸,且不能与苯酚反应, a.NaOH 能与硫酸、苯酚反应,故不选; b.CaCO3 为固体,且与硫酸反应生成的硫酸钙微溶,会阻止碳酸钙与硫酸的反 应,故 b 不选; c.NaHCO3 能与硫酸反应,不与苯酚反应,故 c 选; d.CaO 能与苯酚反应,且与硫酸反应生成的硫酸钙微溶,会阻止氧化钙与硫酸 的反应,故 d 不选; 故选:c; (6)由于丙酮的沸点低于苯酚,沸点越低越先蒸出,处于蒸馏塔的上部,则 T 为丙酮、P 为苯酚, 故答案为:丙酮;苯酚;丙酮的沸点低于苯酚; (7)由异丙苯最终得到苯酚和丙酮,整个过程原子利用率高, 故答案为:原子利用率高。 【点评】本题考查有机物的制备实验方案,涉及对化学工艺流程、装置及试剂的 分析评价等,关键是根据实验目的与给予的反应信息理解工艺流程原理,是 对学生综合能力的考查,难度中等。 四、化学-选修 3:物质结构与性质。(满分 15 分) 12.(15 分)A、B、C、D 为原子序数依次增大的四种元素,A2﹣和 B+具有相 同的电子构型;C、D 为同周期元素,C 核外电子总数是最外层电子数的 3 倍 ;D 元素最外层有一个未成对电子.回答下列问题: (1)四种元素中电负性最大的是 O (填元素符号),其中 C 原子的核外电 子排布式为 1s22s22p63s23p3 . (2)单质 A 有两种同素异形体,其中沸点高的是 O3 (填分子式),原因是 O3 相对分子质量较大,范德华力较大 ;A 和 B 的氢化物所属的晶体类型分 别为 分子晶体 和 离子晶体 . (3)C 和 D 反应可生成组成比为 1:3 的化合物 E,E 的立体构型为 三角锥形 第 27 页(共 33 页) ,中心原子的杂化轨道类型为 sp3 . (4)化合物 D2A 的立体构型为 V 形 ,中心原子的价层电子对数为 4 , 单 质D 与 湿 润 的Na2CO3 反 应 可 制 备D2A , 其 化 学 方 程 式 为2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl . (5)A 和 B 能够形成化合物 F,其晶胞结构如图所示,晶胞边长 a=0.566nm,F 的化学式为 Na2O ;晶胞中 A 原子的配位数为 8 ;列式计算晶体 F 的 密度(g•cm﹣3 ) 2.27g•cm﹣3 (保留小数点后两位数字). 【考点】9I:晶胞的计算.菁优网版权所有 【专题】51B:原子组成与结构专题;51D:化学键与晶体结构. 【分析】A、B、C、D 为原子序数依次增大的四种元素,C、D 为同周期元素, C 核外电子总数是最外层电子数的 3 倍,则 C 为 P 元素;D 元素最外层有一 个未成对电子,D 为 Cl 元素; A2﹣和 B+具有相同的电子构型,则 A 为 O 元素、B 为 Na 元素; (1)四种元素电负性最大的为 O 元素,C 为 P 元素; (2)A 为 O 元素,有 O2、O3 两种同素异形体,O3 相对分子质量较大,沸点较 高,B 的氢化物为 NaH,为离子晶体; (3)C 和 D 反应可生成化合物为 PCl3,为 sp3 杂化; (4)化合物 D2A 为 Cl2O,立体构型为 V 形,氯气与湿润的 Na2CO3 反应的方程 式为 2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl; (5)A 和 B 能够形成化合物 F 为离子化合物,阴离子位于晶胞的定点和面心, 阳离子位于晶胞的体心,则 Na 的个数为 8,O 的个数为 8× +6× =4, N(Na):N(O)=2:1,则形成的化合物为 Na2O,计算质量和体积,可计算 密度. 第 28 页(共 33 页) 【解答】解:A、B、C、D 为原子序数依次增大的四种元素,C、D 为同周期元 素,C 核外电子总数是最外层电子数的 3 倍,则 C 为 P 元素;D 元素最外层 有一个未成对电子,D 为 Cl 元素; A2﹣和 B+具有相同的电子构型,则 A 为 O 元素、B 为 Na 元素; (1)四种元素分别为 O、Na、O、Cl,电负性最大的为 O 元素,C 为 P 元素, 核外电子排布为 1s22s22p63s23p3, 故答案为:O;1s22s22p63s23p3; (2)A 为 O 元素,有 O2、O3 两种同素异形体,二者对应的晶体都为分子晶体, 因 O3 相对分子质量较大,则范德华力较大,沸点较高,A 的氢化物为水,为 分子晶体,B 的氢化物为 NaH,为离子晶体, 故答案为:O3;O3 相对分子质量较大,范德华力较大;分子晶体;离子晶体; (3)C 和 D 反应可生成组成比为 1:3 的化合物为 PCl3,P 形成 3 个 δ 键,孤电 子对数为 =1,则为 sp3 杂化,立体构型为为三角锥形, 故答案为:三角锥形;sp3; (4)化合物 D2A 为 Cl2O,O 为中心原子,形成 2 个 δ 键,孤电子对数为 =2,则中心原子的价层电子对数为 4,立体构型为 V 形, 氯 气 与 湿 润 的Na2CO3 反 应 可 制 备Cl2O , 反 应 的 方 程 式 为 2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl, 故答案为:V 形;4;2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl; (5)A 和 B 能够形成化合物 F 为离子化合物,阴离子位于晶胞的顶点和面心, 阳离子位于晶胞的体心,则 Na 的个数为 8,O 的个数为 8× +6× =4, N(Na):N(O)=2:1,则形成的化合物为 Na2O, 晶胞中 O 位于顶点,Na 位于体心,每个晶胞中有 1 个 Na 与 O 的距离最近,每 个定点为 8 个晶胞共有,则晶胞中 O 原子的配位数为 8, 晶胞的质量为 g, 晶胞的体积为(0.566×10﹣7)3cm3, 则晶体 F 的密度为 g•cm﹣3=2.27 g•cm﹣3, 第 29 页(共 33 页) 故答案为:Na2O;8;2.27g•cm﹣3. 【点评】本题考查物质结构和性质,为高频考点,侧重考查学生空间想象能力、 知识运用能力,涉及晶胞计算、原子结构等知识点,采用均摊法、价层电子 对互斥理论等理论分析解答,难点是晶胞计算,题目难度中等. 五、化学一选修 5:有机化学基础(满分 15 分) 13.(15 分)聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在 材枓的生物相容性方面有很好的应用前景. PPG 的一种合成路线如下: 已知: ①烃 A 的相对分子质量为 70,核磁共振氢谱显示只有一种化学环境的氢 ②化合物 B 为单氯代烃:化合物 C 的分子式为 C5H8 ③E、F 为相对分子质量差 14 的同系物,F 是福尔马林的溶质 ④冋答下列问题: (1)A 的结构简式为 . 成(2)由B生C的化学方程式为 . (3)由 E 和 F 生成 G 的反应类型为 加成反应 ,G 的化学名称为 3﹣羟基 丙醛 . ( 4 ) ① 由D 和 H 生 成PPG 的 化 学 方 程 式 为 :第 30 页(共 33 页) ②若 PPG 平均相对分子质量为 10000,则其平均聚合度约为 b (填标号). a. 48b. 58c. 76 d.122 (5)D 的同分异构体中能同时满足下列条件的共有 5 种(不含立体异构): ①能与饱和 NaHCO3 溶液反应产生气体②既能发生银镜反应,又能发生水解反应 其中核磁共振氢谱显示为 3 组峰,且峰面积比为 6:1:1 的是 (写结构简式) D 的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该 仪器是 c (填标号). a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪. 【考点】HC:有机物的合成.菁优网版权所有 【分析】烃 A 的相对分子质量为 70,核磁共振氢谱显示只有一种化学环境的氢, =5…10,则 A 为 C5H10,结构为 ;A 发生光照下取代反应生成 B 为,B 发生消去反应生成 C 为 ,化合物C 的分子式为 C5H8;C 发生氧化反应生成 D 为 HOOC(CH2)COOH,E、F 为相对分子质 3量差 14 的同系物,F 是福尔马林的溶质,则 F 为 HCHO,可知 E 为 CH3CHO ,由信息④可知 E 与 F 反应生成 G 为 OHCH2CH2CHO,G 与氢气发生加成反 应 生 成H 为 OHCH2CH2CH2OH , D 与 H 发 生 缩 聚 反 应 生 成PPG ( ),以此来解答. 【解答】解:烃 A 的相对分子质量为 70,核磁共振氢谱显示只有一种化学环境 第 31 页(共 33 页) 的氢, =5…10,则 A 为 C5H10,结构为 ;A 发生光照下取代反应生 成 B 为 ,B 发生消去反应生成 C 为 ,化合物C 的分子式 为 C5H8;C 发生氧化反应生成 D 为 HOOC(CH2)3COOH,E、F 为相对分 子质量差 14 的同系物,F 是福尔马林的溶质,则 F 为 HCHO,可知 E 为 CH3CHO,由信息④可知 E 与 F 反应生成 G 为 OHCH2CH2CHO,G 与氢气发 生加成反应生成 H 为 OHCH2CH2CH2OH,D 与 H 发生缩聚反应生成 PPG( ), (1)A 的结构简式为 ,故答案为: ;(2)由B生成C的化学,方程式为故答案为: ;(3)由 E 和 F 生成 G 的反应类型为加成反应,G 的化学名称为 3﹣羟基丙醛, 故答案为:加成反应;3﹣羟基丙醛; ( 4 ) ① 由 D和H生 成PPG 的 化 学 方 程 式 为 ,故答案为:;第 32 页(共 33 页) ②若 PPG 平均相对分子质量为 10000,则其平均聚合度约为 ≈58,故答案为:b; (5)D 的同分异构体中能同时满足①能与饱和 NaHCO3 溶液反应产生气体,含 ﹣COOH,②既能发生银镜反应,又能发生水解反应﹣COOCH,D 中共 5 个 C,则含 3 个 C﹣C﹣C 上的 2 个 H 被﹣COOH、﹣OOCH 取代,共为 3+2=5 种,含其中核磁共振氢谱显示为 3 组峰,且峰面积比为 6:1:1 的是 ,D 及同分异构体中组成相同,由元素分析仪显示的信号(或 数据)完全相同,故答案为:5; ;c. 【点评】本题考查有机物的推断,为高频考点,为 2015 年高考真题,把握合成 中碳链变化、官能团变化及反应条件推断物质为解答的关键,侧重分析与推 断能力的综合考查,题目难度中等. 第 33 页(共 33 页)
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





