
 2009 年全国统一高考化学试卷(全国卷Ⅰ) 一、选择题(共 8 小题,每小题 5 分,满分 40 分) 1.(5 分)下列各组离子,在溶液中能大量共存、加入 NaOH 溶液后加热既有 气体放出又有沉淀生成的一组是( ) ﹣+﹣+﹣A.Ba2+、NO3 、NH4 、Cl﹣ B.Ca2+、HCO3 、NH4 、AlO2 ﹣+C.K+、Ba2+、Cl﹣、HSO3 D.Mg2+、NH4 、SO42﹣、K+ 2.(5 分)将 15mL 2mol•L﹣1 Na2CO3 溶液逐滴加入到 40mL 0.5mol•L﹣1 MCln 盐 溶液中,恰好将溶液中的 Mn+离子完全沉淀为碳酸盐,则 MCln 中 n 值是( )A.4 B.3 C.2 D.1 3.(5 分)下列表示溶液中发生反应的化学方程式错误的是( ) A.2Al+2NaOH+2H2O=2NaAlO2+3H2↑ B.KMnO4+HCOOH+KOH=2K2MnO4+CO2↑+H2O C.MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O D.K2Cr2O7+6FeSO4+7H2SO4=Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O 4.(5 分)现有乙酸和两种链状单烯烃的混合物,若其中氧的质量分数为 a,则 碳的质量分数是( ) A. B. C. D. 5.(5 分)用 0.10mol•L﹣1 的盐酸滴定 0.10mol•L﹣1 的氨水,滴定过程中不可能 出现的结果是( ) +A.c(NH4 )>c(Cl﹣),c(OH﹣)>c(H+) +B.c(NH4 )=c(Cl﹣),c(OH﹣)=c(H+) +C.c(Cl﹣)>c(NH4 ),c(OH﹣)>c(H+) +D.c(Cl﹣)>c(NH4 ),c(H+)>c(OH﹣) 6.(5 分)为了检验某含有 NaHCO3 杂质的 Na2CO3 样品的纯度,现将 w1 g 样 品加热,其质量变为 w2 g,则该样品的纯度(质量分数)是( ) 第 1 页(共 21 页) A. C. B. D. 7.(5 分)有关下图所示化合物的说法不正确的是 ( ) A.既可以与 Br2 的 CCl4 溶液发生加成反应,又可以在光照下与 Br2 发生取代 反应 B.1mol 该化合物最多可以与 3molNaOH 反应 C.既可以催化加氢,又可以使酸性 KMnO4 溶液褪色 D.既可以与 FeCl3 溶液发生显色反应,又可以与 NaHCO3 溶液反应放出 CO2 气体 8.(5 分)右图表示反应 X(g) 4Y(g)+Z(g),△H<0,在某温度时 X 的浓度随时间变化的曲线: 下列有关该反应的描述正确的是( ) A.第 6min 后,反应就终止了 B.X 的平衡转化率为 85% C.若升高温度,X 的平衡转化率将大于 85% D.若降低温度,v 正和 v 逆将以同样倍数减小 第 2 页(共 21 页) 二、解答题(共 4 小题,满分 60 分) 9.(15 分)浓 H2SO4 和木炭在加热时发生反应的化学方程式是 2H2SO4(浓)+C CO2↑+2H2O+2SO2↑ 请从图中选用所需的仪器(可重复选用)组成一套进行该反应并要检出反应产物 的装置.现提供浓 H2SO4、木炭和酸性 KMnO4 溶液,其他固、液试剂自选. (连接和固定仪器所用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去) 将所选的仪器连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称 及其作用. 选用的仪器 (填字母) 加入的试剂 作用 10.(15 分)右图所示装置中,甲、乙、丙三个烧杯依次分别盛放 100g 5.00% 的 NaOH 溶液、足量的 CuSO4 溶液和 100g 10.00%的 K2SO4 溶液,电极均为 石墨电极. (1)接通电源,经过一段时间后,测得丙中 K2SO4 浓度为 10.47%,乙中 c 电极 质量增加.据此回答问题: ①电源的 N 端为 ②电极 b 上发生的电极反应为 ③列式计算电极 b 上生成的气体在标准状况下的体积: ④电极 c 的质量变化是 g; ⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因: 极; ; 甲溶液 乙溶液 丙溶液 ; ; ; 第 3 页(共 21 页) (2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么? . 11.(15 分)已知周期表中,元素 R、Q、W、Y 与元素 X 相邻.R 与 Y 同族. Y 的最高化合价氧化物的水化物是强酸.回答下列问题: (1)W 与 Q 可以形成一种高温结构陶瓷材料.W 的氯化物分子呈正四面体结 构,W 的氧化物的晶体类型是 ; (2)Q 的具有相同化合价且可以相互转变的氧化物是 ; (3)R 和 Y 形成的二种化合物中,Y 呈现最高化合价的化合物是化学式是 ;(4)这 5 个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到 低排列次序是(填化学式) ,其原因是 ②电子总数相同的氢化物的化学式和立体结构分别是 ; (5)W 和 Q 所形成的结构陶瓷材料的一种合成方法如下:W 的氯化物与 Q 的 氢化物加热反应,生成化合物 W(QH2)4 和 HCl 气体;W(QH2)4 在高温 下分解生成 Q 的氢化物和该陶瓷材料.上述相关反应的化学方程式(各物质 用化学式表示)是 . 12.(15 分)化合物 H 是一种香料,存在于金橘中,可用如下路线合成: 已知:R﹣CH=CH2 R﹣CH2CH2OH(B2 H6 为乙硼烷) 回答下列问题: 第 4 页(共 21 页) (1)11.2L(标准状况)的烃 A 在氧气中充分燃烧可以产生 88g CO2 和 45g H2O. A 的分子式是 (2)B 和 C 均为一氯代烃,它们的名称(系统命名)分别为 ; (3)在催化剂存在下 1mol F 与 2mol H2 反应,生成 3﹣苯基﹣1﹣丙醇.F 的结 构简式是 (4)反应①的反应类型是 (5)反应②的化学方程式为 ; (6)写出所有与 G 具有相同官能团的 G 的芳香类同分异构体的结构简式: . 第 5 页(共 21 页) 2009 年全国统一高考化学试卷(全国卷Ⅰ) 参考答案与试题解析 一、选择题(共 8 小题,每小题 5 分,满分 40 分) 1.(5 分)下列各组离子,在溶液中能大量共存、加入 NaOH 溶液后加热既有 气体放出又有沉淀生成的一组是( ) ﹣+﹣+﹣A.Ba2+、NO3 、NH4 、Cl﹣ B.Ca2+、HCO3 、NH4 、AlO2 ﹣+C.K+、Ba2+、Cl﹣、HSO3 D.Mg2+、NH4 、SO42﹣、K+ 【考点】DP:离子共存问题.菁优网版权所有 【专题】21:热点问题;52:元素及其化合物. 【分析】根据溶液中离子之间不能结合生成水、气体、沉淀、弱电解质,不能发 生氧化还原反应、不能促进电离来分析离子在溶液中能大量共存;然后根据 溶液中的离子与 NaOH 溶液反应既有气体放出又有沉淀生成的即为正确答案 .【解答】解:A、因该组离子之间不反应,则离子能大量共存,当加入 NaOH 会 +与 NH4 反应产生 NH3,但没有沉淀,故 A 错误; ﹣﹣B、因 AlO2 能促进 HCO3 的电离,生成 Al(OH)3 沉淀和碳酸根离子,则该 组离子不能大量共存,故 B 错误; ﹣C、因该组离子之间不反应,则离子能大量共存,当加入 NaOH 会与 HSO3 生成 SO32﹣,SO32﹣与 Ba2+可生成 BaSO3 沉淀,但无气体生成,故 C 错误; +D、因该组离子之间不反应,则离子能大量共存,当加入 NaOH 后,OH﹣与 NH4 产生 NH3,OH﹣与 Mg2+会产生 Mg(OH)2 沉淀,符合题意,故 D 正确; 故选:D。 【点评】本题考查离子的共存问题及复分解反应,明确题意中原离子组能共存, 当加入碱既有气体又有沉淀生成两个条件来分析解答,熟悉离子的性质及常 第 6 页(共 21 页) 见离子之间的反应是解答的关键. 2.(5 分)将 15mL 2mol•L﹣1 Na2CO3 溶液逐滴加入到 40mL 0.5mol•L﹣1 MCln 盐 溶液中,恰好将溶液中的 Mn+离子完全沉淀为碳酸盐,则 MCln 中 n 值是( )A.4 B.3 C.2 D.1 【考点】5B:离子方程式的有关计算.菁优网版权所有 【分析】根据 Na2CO3 溶液与 MCln 盐溶液反应时,恰好将溶液中的 Mn+离子完 全沉淀为碳酸盐,利用化合价得出 Mn+离子与 nCO32﹣离子的关系,然后利用 物质的量来计算解答. 【 解 答 】 解 : Na2CO3 溶 液 中CO32﹣ 离 子 的 物 质 的 量 为15mL × 10﹣3 2mol•L﹣1=0.03mol, ×MCln 盐溶液中 Mn+离子的物质的量为 40mL×10﹣3×0.5mol•L﹣1=0.02mol, 由反应中恰好将溶液中的 Mn+离子完全沉淀为碳酸盐,及 M 的化合价为+n, 则 Na2CO3 与 MCln 反应对应的关系式为: 2﹣ 2Mn+~nCO3 2n0.02mol 0.03mol ,解得 n=3, 故选:B。 【点评】本题考查学生利用溶液中的离子之间的反应来进行简单计算,明确离子 之间的关系是解答的关键,并应熟悉离子的物质的量的计算来解答即可. 3.(5 分)下列表示溶液中发生反应的化学方程式错误的是( ) A.2Al+2NaOH+2H2O=2NaAlO2+3H2↑ B.KMnO4+HCOOH+KOH=2K2MnO4+CO2↑+H2O 第 7 页(共 21 页) C.MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O D.K2Cr2O7+6FeSO4+7H2SO4=Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O 【考点】45:分子式;48:化学方程式的书写;49:离子方程式的书写.菁优网版权所有 【分析】根据所学元素化合物的知识及氧化还原反应的基本规律,并且具有对简 单氧化还原反应运用化合价的升降配平的技能等来解答此题; 【解答】解:A、因铝既能与强酸反应又能与强碱反应,则铝与氢氧化钠反应生 成偏铝酸钠和氢气,遵循质量守恒定律及氧化还原反应中电子守恒,故 A 对; B、由化学方程式要遵循质量守恒定律,B 项没配平;或应知在碱性条件下,不 可能产生 CO2 气体,而应是 CO32﹣,故 B 错; C、实验室制取氯气的反应原理可知,二氧化锰与浓盐酸反应制取氢气,遵循质 量守恒定律及氧化还原反应中电子守恒,故 C 对; D、根据常见氧化剂、还原剂以及转化规律,D 中发生氧化还原反应,遵循质量 守恒定律及氧化还原反应中电子守恒,故 D 对; 故选:B。 【点评】本题考查了化学方程式的问题,实则为元素化合物的知识以及氧化还原 反应等知识点,本考点为高中化学的主干知识,为必考考点,但也是难点; 学习过程中应重视元素化合物知识及氧化还原反应的基本规律。 4.(5 分)现有乙酸和两种链状单烯烃的混合物,若其中氧的质量分数为 a,则 碳的质量分数是( ) A. B. C. D. 【考点】5E:元素质量分数的计算.菁优网版权所有 【专题】536:有机物分子组成通式的应用规律. 【分析】根据乙酸的化学式为 C2H4O2,烯烃的通式为 CnH2n,则在混合物中碳、 氢存在固定的质量比,混合物中一共有三种元素,氧的质量分数为 a,碳、氢 元素的质量分数之和为 1﹣a,然后可计算出碳元素的质量分数. 第 8 页(共 21 页) 【解答】解:由乙酸的化学式为 C2H4O2,而单烯烃的通式为 CnH2n, 则从化学式可以发现两者中,C 与 H 之间的数目比为 1:2,其质量比为 12×1: 1×2=6:1, 又混合物中共三种元素,氧的质量分数为 a,碳、氢元素的质量分数之和为 1﹣a ,则碳元素的质量分数为 ×(1﹣a)= ,故选:C。 【点评】本题考查学生利用有机物的组成来进行计算,明确碳、氢的固定组成是 解答的关键,较好的训练学生分析问题、解决问题的能力. 5.(5 分)用 0.10mol•L﹣1 的盐酸滴定 0.10mol•L﹣1 的氨水,滴定过程中不可能 出现的结果是( ) +A.c(NH4 )>c(Cl﹣),c(OH﹣)>c(H+) +B.c(NH4 )=c(Cl﹣),c(OH﹣)=c(H+) +C.c(Cl﹣)>c(NH4 ),c(OH﹣)>c(H+) +D.c(Cl﹣)>c(NH4 ),c(H+)>c(OH﹣) 【考点】DN:离子浓度大小的比较;DO:酸碱混合时的定性判断及有关 ph 的 计算.菁优网版权所有 【分析】根据酸碱滴定中,无论溶液中的溶质是氯化铵、氯化铵和氯化氢、氯化 铵和一水合氨,该溶液一定不显电性,则利用遵循电荷守恒来分析解答. 【解答】解:A、若滴定后溶液中的溶质为氯化铵和一水合氨,则一般溶液显碱 +性,即 c(OH﹣)>c(H+),溶液中弱电解质的电离>盐的水解,即 c(NH4 )>c(Cl﹣),则符合电荷守恒,故 A 是可能出现的结果; B、若滴定后溶液中的溶质为氯化铵和一水合氨,当溶液中弱电解质的电离程度 与盐的水解程度相同时,溶液为中性,则 第 9 页(共 21 页) +c(OH﹣)=c(H+),由电荷守恒可知 c(NH4 )=c(Cl﹣),故 B 是可能出现 的结果; +C、当 c(Cl﹣)>c(NH4 ),c(OH﹣)>c(H+),则溶液中阴离子带的电荷 总数就大于阳离子带的电荷总数,显然与电荷守恒矛盾,故 C 是不可能出现 的结果; D、若滴定后溶液中的溶质为氯化铵,由铵根离子水解则溶液显酸性,即 c(H+) >c(OH﹣),又水解的程度很弱,则 +c(Cl﹣)>c(NH4 ),且符合电荷守恒,故 D 是可能出现的结果; 故选:C。 【点评】本题考查酸碱滴定后溶液中离子浓度的关系,明确溶液中的弱电解质的 电离及盐的水解来分析,利用电荷守恒则可知溶液中不可能出现阴离子均大 于阳离子的情况即可解答. 6.(5 分)为了检验某含有 NaHCO3 杂质的 Na2CO3 样品的纯度,现将 w1 g 样 品加热,其质量变为 w2 g,则该样品的纯度(质量分数)是( ) A. C. B. D. 【考点】GF:钠的重要化合物;M3:有关混合物反应的计算.菁优网版权所有 【专题】1A:计算题;45:差量法. 【分析】根据碳酸氢钠加热分解,而碳酸钠在加热时不反应,则利用反应前后固 体的质量差来计算碳酸氢钠的质量,再计算碳酸钠样品的纯度. 【解答】解:设样品中含有 NaHCO3 杂质的质量为 x,则 2NaHCO3 Na2CO3+CO2↑+H2O△m(减少) 106 2×84 62 x(w1g﹣w2g) 第 10 页(共 21 页) ,解得 x= ,则 w(Na2CO3)= 故选:A。 =,【点评】本题考查学生利用反应前后的固体的质量查来进行计算,明确发生的化 学反应及固体质量差的应用是解答的关键. 7.(5 分)有关下图所示化合物的说法不正确的是 ( ) A.既可以与 Br2 的 CCl4 溶液发生加成反应,又可以在光照下与 Br2 发生取代 反应 B.1mol 该化合物最多可以与 3molNaOH 反应 C.既可以催化加氢,又可以使酸性 KMnO4 溶液褪色 D.既可以与 FeCl3 溶液发生显色反应,又可以与 NaHCO3 溶液反应放出 CO2 气体 【考点】HD:有机物的结构和性质.菁优网版权所有 【专题】16:压轴题. 【分析】A、含有碳碳双键,可以与 Br2 发生加成反应; B、酯基可以和氢氧化钠溶液发生水解反应; C、苯环可以被氢加成,碳碳双键可以使 KMnO4 褪色; D、羧基能与 NaHCO3 放出 CO2 气体,酚羟基可以与 FeCl3 溶液发生显色反应. 【解答】解:A、有机物含有碳碳双键,故可以与 Br2 发生加成反应,又含有甲 基,故可以与 Br2 光照发生取代反应,故 A 正确; B、酚羟基要消耗一个 NaOH,两个酯基要消耗两个 NaOH,1mol 该化合物最多 可以与 3molNaOH 反应,故 B 正确; 第 11 页(共 21 页) C、苯环可以催化加氢,碳碳双键可以使 KMnO4 褪色,故 C 正确; D、该有机物中不存在羧基,并且酚羟基酸性比碳酸弱,故不能与 NaHCO3 放出 CO2 气体,故 D 错误。 故选:D。 【点评】本题考查学生有关官能团决定性质的知识,要要求学生熟记官能团具有 的性质,并熟练运用. 8.(5 分)右图表示反应 X(g) 4Y(g)+Z(g),△H<0,在某温度时 X 的浓度随时间变化的曲线: 下列有关该反应的描述正确的是( ) A.第 6min 后,反应就终止了 B.X 的平衡转化率为 85% C.若升高温度,X 的平衡转化率将大于 85% D.若降低温度,v 正和 v 逆将以同样倍数减小 【考点】CK:物质的量或浓度随时间的变化曲线.菁优网版权所有 【专题】13:图像图表题;16:压轴题;36:平衡思想;51E:化学平衡专题. 【分析】根据图可知,X 的浓度在随时间逐渐减少,到第 6min 浓度不再变化, 则反应达到化学平衡;利用 X 变化的量来计算转化率,再利用温度对反应的 影响来分析转化率的变化及反应速率的变化. 【解答】解:A、6min 时反应达平衡,但未停止,故 A 错; B、X 的变化量为 1mol/L﹣0.15mol/L=0.85mol/L,则 X 的转化率为 ×第 12 页(共 21 页) 100%=85%,故 B 正确; C、△H<0,反应为放热,故升高温度,平衡将逆向移动,则 X 的转化率减小, 故 C 错; D、降温时,正、逆反应速率同时减小,但是降温平衡正向移动,故 V 正>V 逆 ,即逆反应减小的倍数大,故 D 错误; 故选:B。 【点评】本题考查物质的浓度随时间的变化图象,明确纵横坐标的意义及影响化 学平衡和化学反应速率的因素是解答的关键,尤其注意温度对反应速率及平 衡移动的影响,不可混淆. 二、解答题(共 4 小题,满分 60 分) 9.(15 分)浓 H2SO4 和木炭在加热时发生反应的化学方程式是 2H2SO4(浓)+C CO2↑+2H2O+2SO2↑ 请从图中选用所需的仪器(可重复选用)组成一套进行该反应并要检出反应产物 的装置.现提供浓 H2SO4、木炭和酸性 KMnO4 溶液,其他固、液试剂自选. (连接和固定仪器所用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去) 将所选的仪器连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称 及其作用. 选用的仪器 (填字母) 加入的试剂 作用 C 浓硫酸和木炭 产生反应物 【考点】PF:常见气体的检验;Q4:气体的净化和干燥;S6:浓硫酸的性质实 验.菁优网版权所有 第 13 页(共 21 页) 【专题】523:氧族元素. 【分析】该反应为固液加热,故选用 C 带有支管的试管做反应容器,加入浓硫 酸和木炭;检验产物水可用无水硫酸铜;检验二氧化硫,可用品红溶液;在 洗气瓶中装有酸性高锰酸钾溶液用来吸收余下二氧化硫;在洗气瓶中装有澄 清石灰水溶液用来检验二氧化碳.在检验时要考虑检验的顺序. 【解答】解:成套装置包括反应装置,检验装置和尾气处理装置.C 中加入浓硫 硫和木炭作为反应物的发生器,产物中必须先检验水,因为在检验其他物质 时会在其它试剂中混入水,可选用装置 B,放入无水硫酸铜,若变蓝则说明 有水.接着检验 SO2 气体,用装置 A,放入品红检验,若品红褪色,则说明 有 SO2 气体产生,再用装置 A,放入酸性 KMnO4 溶液以除去 SO2,然后再用 装置 A,放入品红,检验品红是否除尽,因为 CO2 是用澄清石灰水来检验的, 而 SO2 也可以使澄清石灰水变浑,故先要除去 SO2.最后洗气瓶中装有澄清 石灰水溶液用来检验二氧化碳. 故答案为: 所选用仪器的名称(填字母) 加入的试剂名称 浓硫酸和木炭 无水硫酸铜 品红溶液 作用 CBAAAA产生反应物 检验是否有水 检验 SO2 酸性 KMnO4 品红溶液 除去 SO2 检验 SO2 是否除尽 检验 CO2 的存在 澄清石灰水 【点评】本题考查浓硫酸的性质,掌握相关产物的检验是解题的关键.易错点是 检验的顺序的选择. 10.(15 分)右图所示装置中,甲、乙、丙三个烧杯依次分别盛放 100g 5.00% 的 NaOH 溶液、足量的 CuSO4 溶液和 100g 10.00%的 K2SO4 溶液,电极均为 石墨电极. (1)接通电源,经过一段时间后,测得丙中 K2SO4 浓度为 10.47%,乙中 c 电极 质量增加.据此回答问题: 第 14 页(共 21 页) ①电源的 N 端为 正 极; ②电极 b 上发生的电极反应为 4OH﹣﹣4e﹣=2H2O+O2↑ ; ③列式计算电极 b 上生成的气体在标准状况下的体积: 2.8L ④电极 c 的质量变化是 16 g; ⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因: 甲溶液 甲增大,因为相当于电解水 ; 乙溶液 乙减小,OH﹣放电,H+增多 ; 丙溶液 丙不变,相当于电解水 ; (2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么? 可以, 铜全部析出,可以继续电解 H2SO4,有电解液即可电解 . 【考点】DI:电解原理.菁优网版权所有 【分析】(1)①乙中 C 电极质量增加,则 c 处发生的反应为:Cu2++2e﹣=Cu, 即 C 处为阴极,由此可推出 b 为阳极,a 为阴极,M 为负极,N 为正极.丙 中为 K2SO4,相当于电解水,设电解的水的质量为 x.由电解前后溶质质量相 等有,100×10%=(100﹣x)×10.47%,得 x=4.5g,故为 0.25mol.由方程式 2H2+O2═2H2O 可知,生成 2molH2O,转移 4mol 电子,所以整个反应中转化 0.5mol 电子,而整个电路是串联的,故每个烧杯中的电极上转移电子数是相 等的. ② 甲 中 为NaOH , 相 当 于 电 解H2O , 阳 极b 处 为 阴 离 子OH﹣ 放 电 , 即 4OH﹣﹣4e﹣=2H2O+O2↑. ③转移 0.5mol 电子,则生成 O2 为 0.5/4=0.125mol,标况下的体积为 0.125× 22.4=2.8L. 第 15 页(共 21 页) ④Cu2++2e﹣=Cu,转移 0.5mol 电子,则生成的 m(Cu)= ×64=16g. ⑤甲中相当于电解水,故 NaOH 的浓度增大,pH 变大.乙中阴极为 Cu2+放电, 阳极为 OH﹣放电,所以 H+增多,故 pH 减小.丙中为电解水,对于 K2SO4 而 言,其 pH 几乎不变. (2)铜全部析出,可以继续电解 H2SO4,有电解液即可电解. 【解答】解:(1)①乙杯中 c 质量增加,说明 Cu 沉积在 c 电极上,电子是从 b﹣c 移动,M 是负极,N 为正极,故答案为:正极; ② 甲 中 为NaOH , 相 当 于 电 解H2O , 阳 极b 处 为 阴 离 子OH﹣ 放 电 , 即 4OH﹣﹣4e﹣=2H2O+O2↑,故答案为:4OH﹣﹣4e﹣=2H2O+O2↑; ③丙中为 K2SO4,相当于电解水,设电解的水的质量为 x.由电解前后溶质质量 相等有,100×10%=(100﹣x)×10.47%,得 x=4.5g,故为 0.25mol.由方程 式 2H2+O2═2H2O 可知,生成 2molH2O,转移 4mol 电子,所以整个反应中转化 0.5mol 电子,则生成 O2 为 0.5/4=0.125mol,标况下的体积为 0.125×22.4=2.8L,故答案为:答案 2.8L; ④整个电路是串联的,所以每个烧杯中的电极上转移电子数是相等的,根据电极 反应:Cu2++2e﹣=Cu,可知转移 0.5mol 电子生成的 m(Cu)= ×64=16g, 故答案为:16; ⑤甲中相当于电解水,故 NaOH 的浓度增大,pH 变大.乙中阴极为 Cu2+放电, 阳极为 OH﹣放电,电解方程式为:2CuSO4+2H2O 2Cu+O2↑+2H2SO4, 所以 H+增多,故 pH 减小.丙中为电解水,对于 K2SO4 而言,其 pH 几乎不 变. 故答案为:甲增大,因为相当于电解水;乙减小,OH﹣放电,H+增多.丙不变, 相当于电解水; (2)当铜全部析出时,溶液中仍有电解质硫酸,可以继续电解,故答案为:可 以; 铜全部析出,可以继续电解H2SO4,有电解液即可电解. 【点评】本题为电化学知识的综合应用,做题时要注意根据电极反应现象判断出 第 16 页(共 21 页) 电解池的阴阳级,进而判断出电源的正负极,要注意三个电解池为串联电路, 各电极上得失电子的数目相等.做题时要正确写出电极方程式,准确判断两 极上离子的放电顺序. 11.(15 分)已知周期表中,元素 R、Q、W、Y 与元素 X 相邻.R 与 Y 同族. Y 的最高化合价氧化物的水化物是强酸.回答下列问题: (1)W 与 Q 可以形成一种高温结构陶瓷材料.W 的氯化物分子呈正四面体结 构,W 的氧化物的晶体类型是 原子晶体 ; (2)Q 的具有相同化合价且可以相互转变的氧化物是 NO2 和 N2O4 ; (3)R 和 Y 形成的二种化合物中,Y 呈现最高化合价的化合物是化学式是 SO3 ;(4)这 5 个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到 低排列次序是(填化学式) NH3>PH3,H2O>H2S ,其原因是 因为前者 中含有氢键 ②电子总数相同的氢化物的化学式和立体结构分别是 NH3 和 H2O 分别为三角 锥和 V 形;SiH4、PH3 和 H2S 结构分别为正四面体,三角锥和 V 形 ; (5)W 和 Q 所形成的结构陶瓷材料的一种合成方法如下:W 的氯化物与 Q 的 氢化物加热反应,生成化合物 W(QH2)4 和 HCl 气体;W(QH2)4 在高温 下分解生成 Q 的氢化物和该陶瓷材料.上述相关反应的化学方程式(各物质 用化学式表示)是 SiCl4+4NH3=Si(NH2)+4HCl,3Si(NH2)=8NH3+Si3N4 44.【考点】8J:位置结构性质的相互关系应用.菁优网版权所有 【专题】16:压轴题. 【分析】(1)根据 W 与 Q 可以形成一种高温结构陶瓷材料,及 W 的氯化物分 子呈正四面体结构可知 W 为硅,然后分析二氧化硅的晶体类型; (2)根据高温结构陶瓷材料可知 Q 可能为氮元素,则二氧化氮与四氧化二氮可 以相互转变; (3)根据位置及 Y 的最高化合价氧化物的水化物是强酸、R 和 Y 形成的二价化 第 17 页(共 21 页) 合物来推断 R; (4)根据氢键的存在来比较氢化物的沸点,并根据最外层电子数来分析结构; (5)根据 W 的氯化物与 Q 的氢化物加热反应,生成化合物 W(QH2)4 和 HCl 气;W(QH2) 在高温下分解生成 Q 的氢化物和该陶瓷材料,利用反应物与 4生成物来书写化学反应方程式. 【解答】解:(1)W 的氯化物为正四面体型,则应为 SiCl4 或 CCl4,又 W 与 Q 形成高温陶瓷,故可推断 W 为 Si,W 的氧化物为 SiO2,原子之间以共价键 结合成空间网状结构,则为原子晶体, 故答案为:原子晶体; (2)高温陶瓷可联想到 Si3N4,Q 为 N,则有 NO2 与 N2O4 之间的相互转化关系 ,故答案为:NO2 和 N2O4; (3)Y 的最高价氧化的水化物为强酸,且与 Si 相邻,则 R 只能是 O,Y 为 S, 其最外层电子数为 6,则最高化合价为+6,所以 Y 的最高价化合物应为 SO3, 故答案为:SO3; (4)Q、R、W、Y 与元素 X 相邻,W 为 Si,Q 为 N,R 为 O,Y 为 S,则 X 为 P 元素,①氢化物沸点顺序为 NH3>PH3,H2O>H2S,因为前者中含有氢 键.②NH3 和 H2O 的电子数均为 10,结构分别为三角锥和 V 形,SiH4、PH3 和 H2S 的电子数均为 18,结构分别为正四面体,三角锥和 V 形,故答案为: NH3>PH3,H2O>H2S;因为前者中含有氢键;NH3 和 H2O 分别为三角锥和 V 形;SiH4、PH3 和 H2S 结构分别为正四面体,三角锥和 V 形; (5)由信息可知,四氯化硅与氨气反应生成 W(QH2) 和 HCl,Si(NH2) 在 44高温下分解生成氨气和氮化硅,故答案为:SiCl4+4NH3=Si(NH2)+4HCl,3Si 4(NH2)4=8NH3+Si3N4. 【点评】本题考查位置、结构、性质的关系及应用,明确物质的性质及元素的位 置来推断元素是解答的关键,并注意与元素化合物知识、原子结构与性质相 联系来分析解答即可. 12.(15 分)化合物 H 是一种香料,存在于金橘中,可用如下路线合成: 第 18 页(共 21 页) 已知:R﹣CH=CH2 R﹣CH2CH2OH(B2 H6 为乙硼烷) 回答下列问题: (1)11.2L(标准状况)的烃 A 在氧气中充分燃烧可以产生 88g CO2 和 45g H2O .A 的分子式是 C4H10 (2)B 和 C 均为一氯代烃,它们的名称(系统命名)分别为 2﹣甲基﹣1﹣氯 丙烷、2﹣甲基﹣2﹣氯丙烷 ; (3)在催化剂存在下 1mol F 与 2mol H2 反应,生成 3﹣苯基﹣1﹣丙醇.F 的结 构简式是 (4)反应①的反应类型是 消去反应 ; (5)反应②的化学方程式为 (6)写出所有与 G 具有相同官能团的 G 的芳香类同分异构体的结构简式: 、、、 . 第 19 页(共 21 页) 【考点】HB:有机物的推断;HC:有机物的合成.菁优网版权所有 【专题】16:压轴题;534:有机物的化学性质及推断. 【分析】(1)分别计算 A、CO2 和 H2O 的物质的量,则可求得 C、H、O 的原 子个数比,进而求得化学式; (2)C4H10 存在正丁烷和异丁烷两种,A 与 Cl2 光照取代时有两种产物,且在 NaOH 醇溶液作用下的产物只有一种,则只能是异丁烷.取代后的产物为 2﹣ 甲基﹣1﹣氯丙烷和 2﹣甲基﹣2﹣氯丙烷; (3)F 可以与 Cu(OH)2 反应,故应为醛基,与 H2 之间为 1:2 加成,则应含 有碳碳双键.从生成的产物 3﹣苯基﹣1﹣丙醇分析; (4)由反应条件判断应为消去反应; (5)根据推断 G 的结构为 ,可以将官能团作相应的位置 变换而得出其芳香类的同分异构体. 【解答】解:(1)88gCO2 为 2mol,45gH2O 为 2.5mol,标准 11.2L,即为 0.5mol ,所以烃 A 中含碳原子为 4,H 原子数为 10,则化学式为 C4H10.故答案为: C4H10; (2)C4H10 存在正丁烷和异丁烷两种,但从框图上看,A 与 Cl2 光照取代时有两 种产物,且在 NaOH 醇溶液作用下的产物只有一种,则只能是异丁烷.取代 后的产物为 2﹣甲基﹣1﹣氯丙烷和 2﹣甲基﹣2﹣氯丙烷.故答案为:2﹣甲 基﹣1﹣氯丙烷、2﹣甲基﹣2﹣氯丙烷; (3)F 可以与 Cu(OH)2 反应,故应为醛基,与 H2 之间为 1:2 加成,则应含 有碳碳双键.从生成的产物 3﹣苯基﹣1﹣丙醇分析,F 的结构简式为 .故答案为: ;(4)反应①为卤代烃在醇溶液中的消去反应.故答案为:消去反应; (5)F 被新制的 Cu(OH)2 氧化成羧酸,D 至 E 为然后与信息相同的条件,则 类比可不难得出 E 的结构为 .E 与 G 在浓硫酸作用下可以 第 20 页(共 21 页) 发;生酯化反应.故答案为:(5)G 中含有官能团有碳碳双键和羧基,可以将官能团作相应的位置变换而得 出其芳香类的同分异构体.故答案为: 、、、..【点评】本题考查有机物的合成及推断,涉及分子式的判断、反应类型、化学方 程式的书写以及同分异构体的判断等,注意把握推断题的关键点和题中重要 信息,积累基础知识,以及知识的综合利用. 第 21 页(共 21 页)
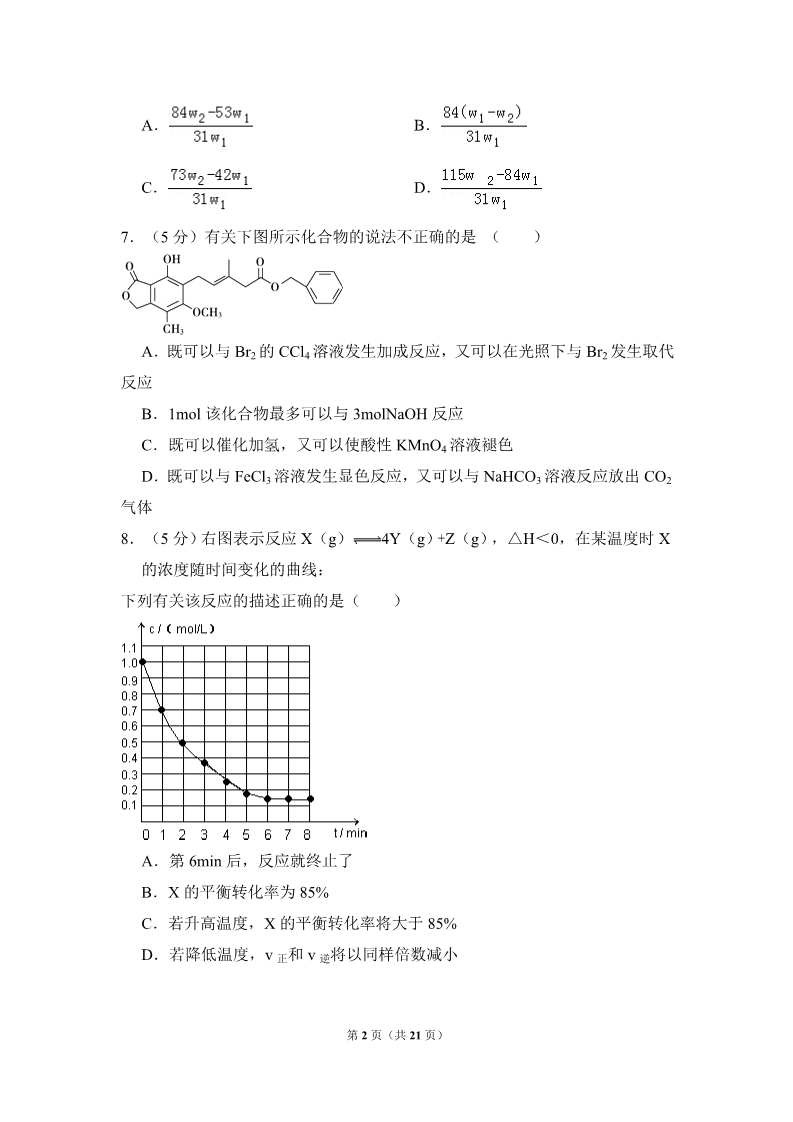
2009 年全国统一高考化学试卷(全国卷Ⅰ) 一、选择题(共 8 小题,每小题 5 分,满分 40 分) 1.(5 分)下列各组离子,在溶液中能大量共存、加入 NaOH 溶液后加热既有 气体放出又有沉淀生成的一组是( ) ﹣+﹣+﹣A.Ba2+、NO3 、NH4 、Cl﹣ B.Ca2+、HCO3 、NH4 、AlO2 ﹣+C.K+、Ba2+、Cl﹣、HSO3 D.Mg2+、NH4 、SO42﹣、K+ 2.(5 分)将 15mL 2mol•L﹣1 Na2CO3 溶液逐滴加入到 40mL 0.5mol•L﹣1 MCln 盐 溶液中,恰好将溶液中的 Mn+离子完全沉淀为碳酸盐,则 MCln 中 n 值是( )A.4 B.3 C.2 D.1 3.(5 分)下列表示溶液中发生反应的化学方程式错误的是( ) A.2Al+2NaOH+2H2O=2NaAlO2+3H2↑ B.KMnO4+HCOOH+KOH=2K2MnO4+CO2↑+H2O C.MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O D.K2Cr2O7+6FeSO4+7H2SO4=Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O 4.(5 分)现有乙酸和两种链状单烯烃的混合物,若其中氧的质量分数为 a,则 碳的质量分数是( ) A. B. C. D. 5.(5 分)用 0.10mol•L﹣1 的盐酸滴定 0.10mol•L﹣1 的氨水,滴定过程中不可能 出现的结果是( ) +A.c(NH4 )>c(Cl﹣),c(OH﹣)>c(H+) +B.c(NH4 )=c(Cl﹣),c(OH﹣)=c(H+) +C.c(Cl﹣)>c(NH4 ),c(OH﹣)>c(H+) +D.c(Cl﹣)>c(NH4 ),c(H+)>c(OH﹣) 6.(5 分)为了检验某含有 NaHCO3 杂质的 Na2CO3 样品的纯度,现将 w1 g 样 品加热,其质量变为 w2 g,则该样品的纯度(质量分数)是( ) 第 1 页(共 21 页) A. C. B. D. 7.(5 分)有关下图所示化合物的说法不正确的是 ( ) A.既可以与 Br2 的 CCl4 溶液发生加成反应,又可以在光照下与 Br2 发生取代 反应 B.1mol 该化合物最多可以与 3molNaOH 反应 C.既可以催化加氢,又可以使酸性 KMnO4 溶液褪色 D.既可以与 FeCl3 溶液发生显色反应,又可以与 NaHCO3 溶液反应放出 CO2 气体 8.(5 分)右图表示反应 X(g) 4Y(g)+Z(g),△H<0,在某温度时 X 的浓度随时间变化的曲线: 下列有关该反应的描述正确的是( ) A.第 6min 后,反应就终止了 B.X 的平衡转化率为 85% C.若升高温度,X 的平衡转化率将大于 85% D.若降低温度,v 正和 v 逆将以同样倍数减小 第 2 页(共 21 页) 二、解答题(共 4 小题,满分 60 分) 9.(15 分)浓 H2SO4 和木炭在加热时发生反应的化学方程式是 2H2SO4(浓)+C CO2↑+2H2O+2SO2↑ 请从图中选用所需的仪器(可重复选用)组成一套进行该反应并要检出反应产物 的装置.现提供浓 H2SO4、木炭和酸性 KMnO4 溶液,其他固、液试剂自选. (连接和固定仪器所用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去) 将所选的仪器连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称 及其作用. 选用的仪器 (填字母) 加入的试剂 作用 10.(15 分)右图所示装置中,甲、乙、丙三个烧杯依次分别盛放 100g 5.00% 的 NaOH 溶液、足量的 CuSO4 溶液和 100g 10.00%的 K2SO4 溶液,电极均为 石墨电极. (1)接通电源,经过一段时间后,测得丙中 K2SO4 浓度为 10.47%,乙中 c 电极 质量增加.据此回答问题: ①电源的 N 端为 ②电极 b 上发生的电极反应为 ③列式计算电极 b 上生成的气体在标准状况下的体积: ④电极 c 的质量变化是 g; ⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因: 极; ; 甲溶液 乙溶液 丙溶液 ; ; ; 第 3 页(共 21 页) (2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么? . 11.(15 分)已知周期表中,元素 R、Q、W、Y 与元素 X 相邻.R 与 Y 同族. Y 的最高化合价氧化物的水化物是强酸.回答下列问题: (1)W 与 Q 可以形成一种高温结构陶瓷材料.W 的氯化物分子呈正四面体结 构,W 的氧化物的晶体类型是 ; (2)Q 的具有相同化合价且可以相互转变的氧化物是 ; (3)R 和 Y 形成的二种化合物中,Y 呈现最高化合价的化合物是化学式是 ;(4)这 5 个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到 低排列次序是(填化学式) ,其原因是 ②电子总数相同的氢化物的化学式和立体结构分别是 ; (5)W 和 Q 所形成的结构陶瓷材料的一种合成方法如下:W 的氯化物与 Q 的 氢化物加热反应,生成化合物 W(QH2)4 和 HCl 气体;W(QH2)4 在高温 下分解生成 Q 的氢化物和该陶瓷材料.上述相关反应的化学方程式(各物质 用化学式表示)是 . 12.(15 分)化合物 H 是一种香料,存在于金橘中,可用如下路线合成: 已知:R﹣CH=CH2 R﹣CH2CH2OH(B2 H6 为乙硼烷) 回答下列问题: 第 4 页(共 21 页) (1)11.2L(标准状况)的烃 A 在氧气中充分燃烧可以产生 88g CO2 和 45g H2O. A 的分子式是 (2)B 和 C 均为一氯代烃,它们的名称(系统命名)分别为 ; (3)在催化剂存在下 1mol F 与 2mol H2 反应,生成 3﹣苯基﹣1﹣丙醇.F 的结 构简式是 (4)反应①的反应类型是 (5)反应②的化学方程式为 ; (6)写出所有与 G 具有相同官能团的 G 的芳香类同分异构体的结构简式: . 第 5 页(共 21 页) 2009 年全国统一高考化学试卷(全国卷Ⅰ) 参考答案与试题解析 一、选择题(共 8 小题,每小题 5 分,满分 40 分) 1.(5 分)下列各组离子,在溶液中能大量共存、加入 NaOH 溶液后加热既有 气体放出又有沉淀生成的一组是( ) ﹣+﹣+﹣A.Ba2+、NO3 、NH4 、Cl﹣ B.Ca2+、HCO3 、NH4 、AlO2 ﹣+C.K+、Ba2+、Cl﹣、HSO3 D.Mg2+、NH4 、SO42﹣、K+ 【考点】DP:离子共存问题.菁优网版权所有 【专题】21:热点问题;52:元素及其化合物. 【分析】根据溶液中离子之间不能结合生成水、气体、沉淀、弱电解质,不能发 生氧化还原反应、不能促进电离来分析离子在溶液中能大量共存;然后根据 溶液中的离子与 NaOH 溶液反应既有气体放出又有沉淀生成的即为正确答案 .【解答】解:A、因该组离子之间不反应,则离子能大量共存,当加入 NaOH 会 +与 NH4 反应产生 NH3,但没有沉淀,故 A 错误; ﹣﹣B、因 AlO2 能促进 HCO3 的电离,生成 Al(OH)3 沉淀和碳酸根离子,则该 组离子不能大量共存,故 B 错误; ﹣C、因该组离子之间不反应,则离子能大量共存,当加入 NaOH 会与 HSO3 生成 SO32﹣,SO32﹣与 Ba2+可生成 BaSO3 沉淀,但无气体生成,故 C 错误; +D、因该组离子之间不反应,则离子能大量共存,当加入 NaOH 后,OH﹣与 NH4 产生 NH3,OH﹣与 Mg2+会产生 Mg(OH)2 沉淀,符合题意,故 D 正确; 故选:D。 【点评】本题考查离子的共存问题及复分解反应,明确题意中原离子组能共存, 当加入碱既有气体又有沉淀生成两个条件来分析解答,熟悉离子的性质及常 第 6 页(共 21 页) 见离子之间的反应是解答的关键. 2.(5 分)将 15mL 2mol•L﹣1 Na2CO3 溶液逐滴加入到 40mL 0.5mol•L﹣1 MCln 盐 溶液中,恰好将溶液中的 Mn+离子完全沉淀为碳酸盐,则 MCln 中 n 值是( )A.4 B.3 C.2 D.1 【考点】5B:离子方程式的有关计算.菁优网版权所有 【分析】根据 Na2CO3 溶液与 MCln 盐溶液反应时,恰好将溶液中的 Mn+离子完 全沉淀为碳酸盐,利用化合价得出 Mn+离子与 nCO32﹣离子的关系,然后利用 物质的量来计算解答. 【 解 答 】 解 : Na2CO3 溶 液 中CO32﹣ 离 子 的 物 质 的 量 为15mL × 10﹣3 2mol•L﹣1=0.03mol, ×MCln 盐溶液中 Mn+离子的物质的量为 40mL×10﹣3×0.5mol•L﹣1=0.02mol, 由反应中恰好将溶液中的 Mn+离子完全沉淀为碳酸盐,及 M 的化合价为+n, 则 Na2CO3 与 MCln 反应对应的关系式为: 2﹣ 2Mn+~nCO3 2n0.02mol 0.03mol ,解得 n=3, 故选:B。 【点评】本题考查学生利用溶液中的离子之间的反应来进行简单计算,明确离子 之间的关系是解答的关键,并应熟悉离子的物质的量的计算来解答即可. 3.(5 分)下列表示溶液中发生反应的化学方程式错误的是( ) A.2Al+2NaOH+2H2O=2NaAlO2+3H2↑ B.KMnO4+HCOOH+KOH=2K2MnO4+CO2↑+H2O 第 7 页(共 21 页) C.MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O D.K2Cr2O7+6FeSO4+7H2SO4=Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O 【考点】45:分子式;48:化学方程式的书写;49:离子方程式的书写.菁优网版权所有 【分析】根据所学元素化合物的知识及氧化还原反应的基本规律,并且具有对简 单氧化还原反应运用化合价的升降配平的技能等来解答此题; 【解答】解:A、因铝既能与强酸反应又能与强碱反应,则铝与氢氧化钠反应生 成偏铝酸钠和氢气,遵循质量守恒定律及氧化还原反应中电子守恒,故 A 对; B、由化学方程式要遵循质量守恒定律,B 项没配平;或应知在碱性条件下,不 可能产生 CO2 气体,而应是 CO32﹣,故 B 错; C、实验室制取氯气的反应原理可知,二氧化锰与浓盐酸反应制取氢气,遵循质 量守恒定律及氧化还原反应中电子守恒,故 C 对; D、根据常见氧化剂、还原剂以及转化规律,D 中发生氧化还原反应,遵循质量 守恒定律及氧化还原反应中电子守恒,故 D 对; 故选:B。 【点评】本题考查了化学方程式的问题,实则为元素化合物的知识以及氧化还原 反应等知识点,本考点为高中化学的主干知识,为必考考点,但也是难点; 学习过程中应重视元素化合物知识及氧化还原反应的基本规律。 4.(5 分)现有乙酸和两种链状单烯烃的混合物,若其中氧的质量分数为 a,则 碳的质量分数是( ) A. B. C. D. 【考点】5E:元素质量分数的计算.菁优网版权所有 【专题】536:有机物分子组成通式的应用规律. 【分析】根据乙酸的化学式为 C2H4O2,烯烃的通式为 CnH2n,则在混合物中碳、 氢存在固定的质量比,混合物中一共有三种元素,氧的质量分数为 a,碳、氢 元素的质量分数之和为 1﹣a,然后可计算出碳元素的质量分数. 第 8 页(共 21 页) 【解答】解:由乙酸的化学式为 C2H4O2,而单烯烃的通式为 CnH2n, 则从化学式可以发现两者中,C 与 H 之间的数目比为 1:2,其质量比为 12×1: 1×2=6:1, 又混合物中共三种元素,氧的质量分数为 a,碳、氢元素的质量分数之和为 1﹣a ,则碳元素的质量分数为 ×(1﹣a)= ,故选:C。 【点评】本题考查学生利用有机物的组成来进行计算,明确碳、氢的固定组成是 解答的关键,较好的训练学生分析问题、解决问题的能力. 5.(5 分)用 0.10mol•L﹣1 的盐酸滴定 0.10mol•L﹣1 的氨水,滴定过程中不可能 出现的结果是( ) +A.c(NH4 )>c(Cl﹣),c(OH﹣)>c(H+) +B.c(NH4 )=c(Cl﹣),c(OH﹣)=c(H+) +C.c(Cl﹣)>c(NH4 ),c(OH﹣)>c(H+) +D.c(Cl﹣)>c(NH4 ),c(H+)>c(OH﹣) 【考点】DN:离子浓度大小的比较;DO:酸碱混合时的定性判断及有关 ph 的 计算.菁优网版权所有 【分析】根据酸碱滴定中,无论溶液中的溶质是氯化铵、氯化铵和氯化氢、氯化 铵和一水合氨,该溶液一定不显电性,则利用遵循电荷守恒来分析解答. 【解答】解:A、若滴定后溶液中的溶质为氯化铵和一水合氨,则一般溶液显碱 +性,即 c(OH﹣)>c(H+),溶液中弱电解质的电离>盐的水解,即 c(NH4 )>c(Cl﹣),则符合电荷守恒,故 A 是可能出现的结果; B、若滴定后溶液中的溶质为氯化铵和一水合氨,当溶液中弱电解质的电离程度 与盐的水解程度相同时,溶液为中性,则 第 9 页(共 21 页) +c(OH﹣)=c(H+),由电荷守恒可知 c(NH4 )=c(Cl﹣),故 B 是可能出现 的结果; +C、当 c(Cl﹣)>c(NH4 ),c(OH﹣)>c(H+),则溶液中阴离子带的电荷 总数就大于阳离子带的电荷总数,显然与电荷守恒矛盾,故 C 是不可能出现 的结果; D、若滴定后溶液中的溶质为氯化铵,由铵根离子水解则溶液显酸性,即 c(H+) >c(OH﹣),又水解的程度很弱,则 +c(Cl﹣)>c(NH4 ),且符合电荷守恒,故 D 是可能出现的结果; 故选:C。 【点评】本题考查酸碱滴定后溶液中离子浓度的关系,明确溶液中的弱电解质的 电离及盐的水解来分析,利用电荷守恒则可知溶液中不可能出现阴离子均大 于阳离子的情况即可解答. 6.(5 分)为了检验某含有 NaHCO3 杂质的 Na2CO3 样品的纯度,现将 w1 g 样 品加热,其质量变为 w2 g,则该样品的纯度(质量分数)是( ) A. C. B. D. 【考点】GF:钠的重要化合物;M3:有关混合物反应的计算.菁优网版权所有 【专题】1A:计算题;45:差量法. 【分析】根据碳酸氢钠加热分解,而碳酸钠在加热时不反应,则利用反应前后固 体的质量差来计算碳酸氢钠的质量,再计算碳酸钠样品的纯度. 【解答】解:设样品中含有 NaHCO3 杂质的质量为 x,则 2NaHCO3 Na2CO3+CO2↑+H2O△m(减少) 106 2×84 62 x(w1g﹣w2g) 第 10 页(共 21 页) ,解得 x= ,则 w(Na2CO3)= 故选:A。 =,【点评】本题考查学生利用反应前后的固体的质量查来进行计算,明确发生的化 学反应及固体质量差的应用是解答的关键. 7.(5 分)有关下图所示化合物的说法不正确的是 ( ) A.既可以与 Br2 的 CCl4 溶液发生加成反应,又可以在光照下与 Br2 发生取代 反应 B.1mol 该化合物最多可以与 3molNaOH 反应 C.既可以催化加氢,又可以使酸性 KMnO4 溶液褪色 D.既可以与 FeCl3 溶液发生显色反应,又可以与 NaHCO3 溶液反应放出 CO2 气体 【考点】HD:有机物的结构和性质.菁优网版权所有 【专题】16:压轴题. 【分析】A、含有碳碳双键,可以与 Br2 发生加成反应; B、酯基可以和氢氧化钠溶液发生水解反应; C、苯环可以被氢加成,碳碳双键可以使 KMnO4 褪色; D、羧基能与 NaHCO3 放出 CO2 气体,酚羟基可以与 FeCl3 溶液发生显色反应. 【解答】解:A、有机物含有碳碳双键,故可以与 Br2 发生加成反应,又含有甲 基,故可以与 Br2 光照发生取代反应,故 A 正确; B、酚羟基要消耗一个 NaOH,两个酯基要消耗两个 NaOH,1mol 该化合物最多 可以与 3molNaOH 反应,故 B 正确; 第 11 页(共 21 页) C、苯环可以催化加氢,碳碳双键可以使 KMnO4 褪色,故 C 正确; D、该有机物中不存在羧基,并且酚羟基酸性比碳酸弱,故不能与 NaHCO3 放出 CO2 气体,故 D 错误。 故选:D。 【点评】本题考查学生有关官能团决定性质的知识,要要求学生熟记官能团具有 的性质,并熟练运用. 8.(5 分)右图表示反应 X(g) 4Y(g)+Z(g),△H<0,在某温度时 X 的浓度随时间变化的曲线: 下列有关该反应的描述正确的是( ) A.第 6min 后,反应就终止了 B.X 的平衡转化率为 85% C.若升高温度,X 的平衡转化率将大于 85% D.若降低温度,v 正和 v 逆将以同样倍数减小 【考点】CK:物质的量或浓度随时间的变化曲线.菁优网版权所有 【专题】13:图像图表题;16:压轴题;36:平衡思想;51E:化学平衡专题. 【分析】根据图可知,X 的浓度在随时间逐渐减少,到第 6min 浓度不再变化, 则反应达到化学平衡;利用 X 变化的量来计算转化率,再利用温度对反应的 影响来分析转化率的变化及反应速率的变化. 【解答】解:A、6min 时反应达平衡,但未停止,故 A 错; B、X 的变化量为 1mol/L﹣0.15mol/L=0.85mol/L,则 X 的转化率为 ×第 12 页(共 21 页) 100%=85%,故 B 正确; C、△H<0,反应为放热,故升高温度,平衡将逆向移动,则 X 的转化率减小, 故 C 错; D、降温时,正、逆反应速率同时减小,但是降温平衡正向移动,故 V 正>V 逆 ,即逆反应减小的倍数大,故 D 错误; 故选:B。 【点评】本题考查物质的浓度随时间的变化图象,明确纵横坐标的意义及影响化 学平衡和化学反应速率的因素是解答的关键,尤其注意温度对反应速率及平 衡移动的影响,不可混淆. 二、解答题(共 4 小题,满分 60 分) 9.(15 分)浓 H2SO4 和木炭在加热时发生反应的化学方程式是 2H2SO4(浓)+C CO2↑+2H2O+2SO2↑ 请从图中选用所需的仪器(可重复选用)组成一套进行该反应并要检出反应产物 的装置.现提供浓 H2SO4、木炭和酸性 KMnO4 溶液,其他固、液试剂自选. (连接和固定仪器所用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去) 将所选的仪器连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称 及其作用. 选用的仪器 (填字母) 加入的试剂 作用 C 浓硫酸和木炭 产生反应物 【考点】PF:常见气体的检验;Q4:气体的净化和干燥;S6:浓硫酸的性质实 验.菁优网版权所有 第 13 页(共 21 页) 【专题】523:氧族元素. 【分析】该反应为固液加热,故选用 C 带有支管的试管做反应容器,加入浓硫 酸和木炭;检验产物水可用无水硫酸铜;检验二氧化硫,可用品红溶液;在 洗气瓶中装有酸性高锰酸钾溶液用来吸收余下二氧化硫;在洗气瓶中装有澄 清石灰水溶液用来检验二氧化碳.在检验时要考虑检验的顺序. 【解答】解:成套装置包括反应装置,检验装置和尾气处理装置.C 中加入浓硫 硫和木炭作为反应物的发生器,产物中必须先检验水,因为在检验其他物质 时会在其它试剂中混入水,可选用装置 B,放入无水硫酸铜,若变蓝则说明 有水.接着检验 SO2 气体,用装置 A,放入品红检验,若品红褪色,则说明 有 SO2 气体产生,再用装置 A,放入酸性 KMnO4 溶液以除去 SO2,然后再用 装置 A,放入品红,检验品红是否除尽,因为 CO2 是用澄清石灰水来检验的, 而 SO2 也可以使澄清石灰水变浑,故先要除去 SO2.最后洗气瓶中装有澄清 石灰水溶液用来检验二氧化碳. 故答案为: 所选用仪器的名称(填字母) 加入的试剂名称 浓硫酸和木炭 无水硫酸铜 品红溶液 作用 CBAAAA产生反应物 检验是否有水 检验 SO2 酸性 KMnO4 品红溶液 除去 SO2 检验 SO2 是否除尽 检验 CO2 的存在 澄清石灰水 【点评】本题考查浓硫酸的性质,掌握相关产物的检验是解题的关键.易错点是 检验的顺序的选择. 10.(15 分)右图所示装置中,甲、乙、丙三个烧杯依次分别盛放 100g 5.00% 的 NaOH 溶液、足量的 CuSO4 溶液和 100g 10.00%的 K2SO4 溶液,电极均为 石墨电极. (1)接通电源,经过一段时间后,测得丙中 K2SO4 浓度为 10.47%,乙中 c 电极 质量增加.据此回答问题: 第 14 页(共 21 页) ①电源的 N 端为 正 极; ②电极 b 上发生的电极反应为 4OH﹣﹣4e﹣=2H2O+O2↑ ; ③列式计算电极 b 上生成的气体在标准状况下的体积: 2.8L ④电极 c 的质量变化是 16 g; ⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因: 甲溶液 甲增大,因为相当于电解水 ; 乙溶液 乙减小,OH﹣放电,H+增多 ; 丙溶液 丙不变,相当于电解水 ; (2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么? 可以, 铜全部析出,可以继续电解 H2SO4,有电解液即可电解 . 【考点】DI:电解原理.菁优网版权所有 【分析】(1)①乙中 C 电极质量增加,则 c 处发生的反应为:Cu2++2e﹣=Cu, 即 C 处为阴极,由此可推出 b 为阳极,a 为阴极,M 为负极,N 为正极.丙 中为 K2SO4,相当于电解水,设电解的水的质量为 x.由电解前后溶质质量相 等有,100×10%=(100﹣x)×10.47%,得 x=4.5g,故为 0.25mol.由方程式 2H2+O2═2H2O 可知,生成 2molH2O,转移 4mol 电子,所以整个反应中转化 0.5mol 电子,而整个电路是串联的,故每个烧杯中的电极上转移电子数是相 等的. ② 甲 中 为NaOH , 相 当 于 电 解H2O , 阳 极b 处 为 阴 离 子OH﹣ 放 电 , 即 4OH﹣﹣4e﹣=2H2O+O2↑. ③转移 0.5mol 电子,则生成 O2 为 0.5/4=0.125mol,标况下的体积为 0.125× 22.4=2.8L. 第 15 页(共 21 页) ④Cu2++2e﹣=Cu,转移 0.5mol 电子,则生成的 m(Cu)= ×64=16g. ⑤甲中相当于电解水,故 NaOH 的浓度增大,pH 变大.乙中阴极为 Cu2+放电, 阳极为 OH﹣放电,所以 H+增多,故 pH 减小.丙中为电解水,对于 K2SO4 而 言,其 pH 几乎不变. (2)铜全部析出,可以继续电解 H2SO4,有电解液即可电解. 【解答】解:(1)①乙杯中 c 质量增加,说明 Cu 沉积在 c 电极上,电子是从 b﹣c 移动,M 是负极,N 为正极,故答案为:正极; ② 甲 中 为NaOH , 相 当 于 电 解H2O , 阳 极b 处 为 阴 离 子OH﹣ 放 电 , 即 4OH﹣﹣4e﹣=2H2O+O2↑,故答案为:4OH﹣﹣4e﹣=2H2O+O2↑; ③丙中为 K2SO4,相当于电解水,设电解的水的质量为 x.由电解前后溶质质量 相等有,100×10%=(100﹣x)×10.47%,得 x=4.5g,故为 0.25mol.由方程 式 2H2+O2═2H2O 可知,生成 2molH2O,转移 4mol 电子,所以整个反应中转化 0.5mol 电子,则生成 O2 为 0.5/4=0.125mol,标况下的体积为 0.125×22.4=2.8L,故答案为:答案 2.8L; ④整个电路是串联的,所以每个烧杯中的电极上转移电子数是相等的,根据电极 反应:Cu2++2e﹣=Cu,可知转移 0.5mol 电子生成的 m(Cu)= ×64=16g, 故答案为:16; ⑤甲中相当于电解水,故 NaOH 的浓度增大,pH 变大.乙中阴极为 Cu2+放电, 阳极为 OH﹣放电,电解方程式为:2CuSO4+2H2O 2Cu+O2↑+2H2SO4, 所以 H+增多,故 pH 减小.丙中为电解水,对于 K2SO4 而言,其 pH 几乎不 变. 故答案为:甲增大,因为相当于电解水;乙减小,OH﹣放电,H+增多.丙不变, 相当于电解水; (2)当铜全部析出时,溶液中仍有电解质硫酸,可以继续电解,故答案为:可 以; 铜全部析出,可以继续电解H2SO4,有电解液即可电解. 【点评】本题为电化学知识的综合应用,做题时要注意根据电极反应现象判断出 第 16 页(共 21 页) 电解池的阴阳级,进而判断出电源的正负极,要注意三个电解池为串联电路, 各电极上得失电子的数目相等.做题时要正确写出电极方程式,准确判断两 极上离子的放电顺序. 11.(15 分)已知周期表中,元素 R、Q、W、Y 与元素 X 相邻.R 与 Y 同族. Y 的最高化合价氧化物的水化物是强酸.回答下列问题: (1)W 与 Q 可以形成一种高温结构陶瓷材料.W 的氯化物分子呈正四面体结 构,W 的氧化物的晶体类型是 原子晶体 ; (2)Q 的具有相同化合价且可以相互转变的氧化物是 NO2 和 N2O4 ; (3)R 和 Y 形成的二种化合物中,Y 呈现最高化合价的化合物是化学式是 SO3 ;(4)这 5 个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到 低排列次序是(填化学式) NH3>PH3,H2O>H2S ,其原因是 因为前者 中含有氢键 ②电子总数相同的氢化物的化学式和立体结构分别是 NH3 和 H2O 分别为三角 锥和 V 形;SiH4、PH3 和 H2S 结构分别为正四面体,三角锥和 V 形 ; (5)W 和 Q 所形成的结构陶瓷材料的一种合成方法如下:W 的氯化物与 Q 的 氢化物加热反应,生成化合物 W(QH2)4 和 HCl 气体;W(QH2)4 在高温 下分解生成 Q 的氢化物和该陶瓷材料.上述相关反应的化学方程式(各物质 用化学式表示)是 SiCl4+4NH3=Si(NH2)+4HCl,3Si(NH2)=8NH3+Si3N4 44.【考点】8J:位置结构性质的相互关系应用.菁优网版权所有 【专题】16:压轴题. 【分析】(1)根据 W 与 Q 可以形成一种高温结构陶瓷材料,及 W 的氯化物分 子呈正四面体结构可知 W 为硅,然后分析二氧化硅的晶体类型; (2)根据高温结构陶瓷材料可知 Q 可能为氮元素,则二氧化氮与四氧化二氮可 以相互转变; (3)根据位置及 Y 的最高化合价氧化物的水化物是强酸、R 和 Y 形成的二价化 第 17 页(共 21 页) 合物来推断 R; (4)根据氢键的存在来比较氢化物的沸点,并根据最外层电子数来分析结构; (5)根据 W 的氯化物与 Q 的氢化物加热反应,生成化合物 W(QH2)4 和 HCl 气;W(QH2) 在高温下分解生成 Q 的氢化物和该陶瓷材料,利用反应物与 4生成物来书写化学反应方程式. 【解答】解:(1)W 的氯化物为正四面体型,则应为 SiCl4 或 CCl4,又 W 与 Q 形成高温陶瓷,故可推断 W 为 Si,W 的氧化物为 SiO2,原子之间以共价键 结合成空间网状结构,则为原子晶体, 故答案为:原子晶体; (2)高温陶瓷可联想到 Si3N4,Q 为 N,则有 NO2 与 N2O4 之间的相互转化关系 ,故答案为:NO2 和 N2O4; (3)Y 的最高价氧化的水化物为强酸,且与 Si 相邻,则 R 只能是 O,Y 为 S, 其最外层电子数为 6,则最高化合价为+6,所以 Y 的最高价化合物应为 SO3, 故答案为:SO3; (4)Q、R、W、Y 与元素 X 相邻,W 为 Si,Q 为 N,R 为 O,Y 为 S,则 X 为 P 元素,①氢化物沸点顺序为 NH3>PH3,H2O>H2S,因为前者中含有氢 键.②NH3 和 H2O 的电子数均为 10,结构分别为三角锥和 V 形,SiH4、PH3 和 H2S 的电子数均为 18,结构分别为正四面体,三角锥和 V 形,故答案为: NH3>PH3,H2O>H2S;因为前者中含有氢键;NH3 和 H2O 分别为三角锥和 V 形;SiH4、PH3 和 H2S 结构分别为正四面体,三角锥和 V 形; (5)由信息可知,四氯化硅与氨气反应生成 W(QH2) 和 HCl,Si(NH2) 在 44高温下分解生成氨气和氮化硅,故答案为:SiCl4+4NH3=Si(NH2)+4HCl,3Si 4(NH2)4=8NH3+Si3N4. 【点评】本题考查位置、结构、性质的关系及应用,明确物质的性质及元素的位 置来推断元素是解答的关键,并注意与元素化合物知识、原子结构与性质相 联系来分析解答即可. 12.(15 分)化合物 H 是一种香料,存在于金橘中,可用如下路线合成: 第 18 页(共 21 页) 已知:R﹣CH=CH2 R﹣CH2CH2OH(B2 H6 为乙硼烷) 回答下列问题: (1)11.2L(标准状况)的烃 A 在氧气中充分燃烧可以产生 88g CO2 和 45g H2O .A 的分子式是 C4H10 (2)B 和 C 均为一氯代烃,它们的名称(系统命名)分别为 2﹣甲基﹣1﹣氯 丙烷、2﹣甲基﹣2﹣氯丙烷 ; (3)在催化剂存在下 1mol F 与 2mol H2 反应,生成 3﹣苯基﹣1﹣丙醇.F 的结 构简式是 (4)反应①的反应类型是 消去反应 ; (5)反应②的化学方程式为 (6)写出所有与 G 具有相同官能团的 G 的芳香类同分异构体的结构简式: 、、、 . 第 19 页(共 21 页) 【考点】HB:有机物的推断;HC:有机物的合成.菁优网版权所有 【专题】16:压轴题;534:有机物的化学性质及推断. 【分析】(1)分别计算 A、CO2 和 H2O 的物质的量,则可求得 C、H、O 的原 子个数比,进而求得化学式; (2)C4H10 存在正丁烷和异丁烷两种,A 与 Cl2 光照取代时有两种产物,且在 NaOH 醇溶液作用下的产物只有一种,则只能是异丁烷.取代后的产物为 2﹣ 甲基﹣1﹣氯丙烷和 2﹣甲基﹣2﹣氯丙烷; (3)F 可以与 Cu(OH)2 反应,故应为醛基,与 H2 之间为 1:2 加成,则应含 有碳碳双键.从生成的产物 3﹣苯基﹣1﹣丙醇分析; (4)由反应条件判断应为消去反应; (5)根据推断 G 的结构为 ,可以将官能团作相应的位置 变换而得出其芳香类的同分异构体. 【解答】解:(1)88gCO2 为 2mol,45gH2O 为 2.5mol,标准 11.2L,即为 0.5mol ,所以烃 A 中含碳原子为 4,H 原子数为 10,则化学式为 C4H10.故答案为: C4H10; (2)C4H10 存在正丁烷和异丁烷两种,但从框图上看,A 与 Cl2 光照取代时有两 种产物,且在 NaOH 醇溶液作用下的产物只有一种,则只能是异丁烷.取代 后的产物为 2﹣甲基﹣1﹣氯丙烷和 2﹣甲基﹣2﹣氯丙烷.故答案为:2﹣甲 基﹣1﹣氯丙烷、2﹣甲基﹣2﹣氯丙烷; (3)F 可以与 Cu(OH)2 反应,故应为醛基,与 H2 之间为 1:2 加成,则应含 有碳碳双键.从生成的产物 3﹣苯基﹣1﹣丙醇分析,F 的结构简式为 .故答案为: ;(4)反应①为卤代烃在醇溶液中的消去反应.故答案为:消去反应; (5)F 被新制的 Cu(OH)2 氧化成羧酸,D 至 E 为然后与信息相同的条件,则 类比可不难得出 E 的结构为 .E 与 G 在浓硫酸作用下可以 第 20 页(共 21 页) 发;生酯化反应.故答案为:(5)G 中含有官能团有碳碳双键和羧基,可以将官能团作相应的位置变换而得 出其芳香类的同分异构体.故答案为: 、、、..【点评】本题考查有机物的合成及推断,涉及分子式的判断、反应类型、化学方 程式的书写以及同分异构体的判断等,注意把握推断题的关键点和题中重要 信息,积累基础知识,以及知识的综合利用. 第 21 页(共 21 页)
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





