

 2009 年全国统一高考化学试卷(全国卷Ⅱ) 一、选择题 1.(3 分)物质的量之比为 2:5 的锌与稀硝酸反应,若硝酸被还原的产物为 N2O ,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物 质的量之比是( ) A.1:4 B.1:5 C.2:3 D.2:5 2.(3 分)下列关于溶液和胶体的叙述,正确的是( ) A.溶液是电中性的,胶体是带电的 B.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一 极移动 C.溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗 运动 D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 3.(3 分)下列叙述中正确的是( ) A.向含有 CaCO3 沉淀的水中通入 CO2 至沉淀恰好溶解,再向溶液中加入 NaHCO3 饱和溶液,又有 CaCO3 沉淀生成 B.向 Na2CO3 溶液中逐滴加入等物质的量的稀盐酸,生成的 CO2 与原 Na2CO3 的物质的量之比为 1:2 C.等质量的 NaHCO3 和 Na2CO3 分别与足量盐酸反应,在同温同压下,生成 的 CO2 体积相同 D.向 Na2CO3 饱和溶液中通入 CO2,有 NaHCO3 结晶析出 4.(3 分)某元素只存在两种天然同位素,且在自然界它们的含量相近,其相 对原子质量为 152.0,原子核外的电子数为 63.下列叙述中错误的是( ) A.它是副族元素 B.它是第六周期元素 C.它的原子核内有 63 个质子 D.它的一种同位素的核内有 89 个中子 5.(3 分)现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤ 碳酸钠,⑥碳酸氢钠.按溶液 pH 由小到大排列正确的是( ) 第 1 页(共 23 页) A.①④②③⑥⑤ B.④①②⑥⑤③ C.①④②⑥③⑤ D.④①②③⑥⑤ 6.(3 分)已知: 2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ•mol﹣1; CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJ•mol﹣1. 现有 H2 与 CH4 的混合气体 112L(标准状况),使其完全燃烧生成 CO2 和 H2O( l),若实验测得反应放热 3695kJ,则原混合气体中 H2 与 CH4 的物质的量之 比是( ) A.1:1 B.1:3 C.1:4 D.2:3 7.(3 分)1mol 与足量的 NaOH 溶液充分反应, 消耗的 NaOH 的物质的量为( ) A.5 molB.4 mol C.3 mol D.2 mol 8.(3 分)根据已知回答 24﹣25 题 已知:2Fe2++Cl2=2Cl﹣+2Fe3+,2Br﹣+Cl2=Br2+2Cl﹣,2Fe2++Br2=2Br﹣+2Fe3+. 含有 amol FeBr2 的溶液中,通入 xmol Cl2.下列各项为通 Cl2 过程中,溶液内发 生反应的离子方程式,其中不正确的是( ) A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl﹣ B.x=0.6a,2Br﹣+Cl2=Br2+2Cl﹣ C.x=a,2Fe2++2Br﹣+2Cl2=Br2+2Fe3++4Cl﹣ D.x=1.5a,2Fe2++4Br﹣+3Cl2=2Br2+2Fe3++6Cl﹣ 二、非选题 9.(15 分)某温度时,在 2L 密闭容器中气态物质 X 和 Y 反应生成气态物质 Z ,它们的物质的量随时间的变化如表所示. t/min 0X/mol 1.00 Y/mol 1.00 Z/mol 0.00 第 2 页(共 23 页) 130.90 0.75 0.65 0.55 0.55 0.55 0.80 0.50 0.30 0.10 0.10 0.10 0.20 0.50 0.70 0.90 0.90 0.90 5910 14 (1)根据左表中数据,在图 1 中画出 X、Y、Z 的物质的量(n)随时间(t)变 化的曲线: (2)体系中发生反应的化学方程式是 ; (3)列式计算该反应在 0﹣3min 时间内产物 Z 的平均反应速率: (4)该反应达到平衡时反应物 X 的转化率 α 等于 ; ; (5)如果该反应是放热反应.改变实验条件(温度、压强、催化剂)得到 Z 随 时间变化的曲线①、②、③(如图 2 所示)则曲线①、②、③所对应的实验 条件改变分别是:① ② ③ . 10.(15 分)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中 的装置可以实现该反应. 第 3 页(共 23 页) 回答下列问题: (1)A 中加入的物质是 (2)B 中加入的物质是 发生反应的化学方程式是 ,其作用是 (3)实验时在 C 中观察到得现象是 (4)实验时在 D 中观察到得现象是 发生反应的化学方程式是 ; D 中收集到的物质是 检验该 物质的方法和现象是 . 11.(15 分)现有 A、B、C、D、E、F 六种化合物,已知它们的阳离子有 K+, 2﹣ Ag+,Ca2+,Ba2+,Fe2+,Al3+,阴离子有 Cl﹣,OH﹣,CH3COO﹣,NO3 ,SO4 ﹣,CO32﹣,现将它们分别配成 0.1mol•L﹣1 的溶液,进行如下实验: ①测得溶液 A、C、E 呈碱性,且碱性为 A>E>C; ②向 B 溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失; ③向 D 溶液中滴加 Ba(NO3)2 溶液,无明显现象; ④向 F 溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红 褐色. 根据上述实验现象,回答下列问题: (1)实验②中反应的化学方程式是 (2)E 溶液是 ,判断依据是 (3)写出下列四种化合物的化学式:A ; 、C 、D 、F . 12.(15 分)化合物 A 相对分子质量为 86,碳的质量分数为 55.8%,氢为 7.0% ,其余为氧.A 的相关反应如图所示: 已知 R﹣CH=CHOH(烯醇)不稳定,很快转化为 R﹣CH2CHO. 根据以上信息回答下列问题: (1)A 的分子式为 (2)反应②的化学方程式是 (3)A 的结构简式是 ; (4)反应①的化学方程式是 ; ; ; (5)A 有多种同分异构体,写出四个同时满足(i)能发生水解反应(ii)能使 溴的四氯化碳溶液褪色两个条件的同分异构体的结构简式: 、 、 第 4 页(共 23 页) 、 (6)A 的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简 式为 . ; 第 5 页(共 23 页) 2009 年全国统一高考化学试卷(全国卷Ⅱ) 参考答案与试题解析 一、选择题 1.(3 分)物质的量之比为 2:5 的锌与稀硝酸反应,若硝酸被还原的产物为 N2O ,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物 质的量之比是( ) A.1:4 B.1:5 C.2:3 D.2:5 【考点】BQ:氧化还原反应的计算;EG:硝酸的化学性质.菁优网版权所有 【专题】515:氧化还原反应专题;524:氮族元素. 【分析】锌与稀硝酸反应时硝酸既表现酸性又表现氧化性,根据原子守恒和电子 守恒规律来解决. 【解答】解:锌与稀硝酸反应时硝酸既表现酸性又表现氧化性,根据原子守恒和 电子守恒,2mol 锌失去 4mol 电子,生成 2mol 锌离子,由于生成硝酸锌,则 其结合的硝酸根离子是 4mol,则剩余的 1mol 的硝酸被还原为 N2O 就得到 4mol 电子,硝酸也全部反应,则该反应中被还原的硝酸与未被还原的硝酸的 物质的量之比是 1:4,即 4Zn+10HNO3(一般稀)=4Zn(NO3)+N2O↑+5H2O 2.故选 A。 【点评】本题是对硝酸的氧化性知识的考查,注意电子守恒思想在氧化还原反应 中的运用. 2.(3 分)下列关于溶液和胶体的叙述,正确的是( ) A.溶液是电中性的,胶体是带电的 B.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一 极移动 C.溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗 运动 第 6 页(共 23 页) D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 【考点】66:胶体的重要性质.菁优网版权所有 【专题】51A:溶液和胶体专题. 【分析】A、胶体是电中性的; B、通电时溶质电离出的阴阳离子分别移向两极,溶质是非电解质时不移向任何 电极; C、溶液中溶质分子运动无规律 D、胶体能发生丁达尔现象,溶液没有; 【解答】解:A、溶液是电中性的,胶体也是电中性的,胶体粒子吸附了带电的 离子,故 A 错误; B、通电时,溶液中的溶质粒子是电解质,电离出的阴阳离子分别向两极移动, 若溶质是非电解质不移向电极,胶体中的分散质粒子向某一极移动,故 B 错 误; C、胶体的分散质粒子在显微镜观察下呈现无规则运动,这就是胶体的布朗运动 特性。溶液中的离子呈现自由态,其运动是无规律可言的。故 C 错误; D、溶液没有丁达尔现象而胶体存在,故胶体出现明显的光带,故 D 正确; 故选:D。 【点评】本题考查了胶体、溶液的性质区别,较简单,注意胶体粒子的吸附离子 作用. 3.(3 分)下列叙述中正确的是( ) A.向含有 CaCO3 沉淀的水中通入 CO2 至沉淀恰好溶解,再向溶液中加入 NaHCO3 饱和溶液,又有 CaCO3 沉淀生成 B.向 Na2CO3 溶液中逐滴加入等物质的量的稀盐酸,生成的 CO2 与原 Na2CO3 的物质的量之比为 1:2 C.等质量的 NaHCO3 和 Na2CO3 分别与足量盐酸反应,在同温同压下,生成 的 CO2 体积相同 D.向 Na2CO3 饱和溶液中通入 CO2,有 NaHCO3 结晶析出 第 7 页(共 23 页) 【考点】GF:钠的重要化合物.菁优网版权所有 【专题】527:几种重要的金属及其化合物. 【分析】A、碳酸氢钙与碳酸氢钠不发生反应; B 、 Na2 CO3 溶 液 中 逐 滴 加 入 等 物 质 的 量 的 稀 盐 酸 , 发 生 反 应 Na2CO3+HCl=NaHCO3+NaCl; C、NaHCO3 和 Na2CO3 的摩尔质量不同,二者相同质量,物质的量不同; D、发生反应 Na2CO3+CO2+H2O═2NaHCO3,生成碳酸氢钠的质量比碳酸钠多, 反应消耗水,碳酸氢钠的溶解度小于碳酸钠. 【解答】解:A、CaCO3 沉淀的水中通入 CO2 至沉淀恰好溶解,生成碳酸氢钙溶 液,再加入 NaHCO3 饱和溶液,碳酸氢钙与碳酸氢钠不发生反应,不能生成 碳酸钙沉淀,故 A 错误; B 、 Na2CO3 溶 液 中 逐 滴 加 入 等 物 质 的 量 的 稀 盐 酸 , 发 生 反 应 Na2CO3+HCl=NaHCO3+NaCl,没有二氧化碳生成,故 B 错误; C、NaHCO3 和 Na2CO3 的摩尔质量不同,二者相同质量,物质的量不同,与盐酸 反应都生成二氧化碳,由碳元素守恒可知,生成二氧化碳的物质的量之比与 摩尔质量成反比为 106:84=53:42,即同温同压下,体积之比为 53:42, 故 C 错误; D、发生反应 Na2CO3+CO2+H2O═2NaHCO3,生成碳酸氢钠的质量比碳酸钠多, 反应消耗水,碳酸氢钠的溶解度小于碳酸钠,故会有碳酸氢钠析出,故 D 正 确。 故选:D。 【点评】本题考查钠的重要化合物性质、化学计算等,难度中等,注意 B 选项 中滴加顺序不同,发生反应不同,实质是与量有关导致反应不同. 4.(3 分)某元素只存在两种天然同位素,且在自然界它们的含量相近,其相 对原子质量为 152.0,原子核外的电子数为 63.下列叙述中错误的是( ) A.它是副族元素 B.它是第六周期元素 C.它的原子核内有 63 个质子 第 8 页(共 23 页) D.它的一种同位素的核内有 89 个中子 【考点】33:同位素及其应用;72:元素周期表的结构及其应用;85:质量数与 质子数、中子数之间的相互关系.菁优网版权所有 【专题】51B:原子组成与结构专题. 【分析】A、根据元素在周期表中的位置; B、根据元素在周期表中的位置; C、根据核外电子数等于其质子数; D、同种元素的不同核素质量数不同; 【解答】解:A、因核外电子数等于其质子数为 63,用质子数分别减去各周期所 含有的元素种类,63﹣2﹣8﹣8﹣18﹣18=9,显然其属于第六周期,从左到右 的第 9 种,而第六周期中包含镧系,所以它应属于副族,故 A 正确; B、因核外电子数等于其质子数为 63,用质子数分别减去各周期所含有的元素种 类,63﹣2﹣8﹣8﹣18﹣18=9,显然其属于第六周期,从左到右的第 9 种,而 第六周期中包含镧系,所以它应属于副族,故 B 正确; C、核外电子数等于其质子数,故 C 正确; D、同种元素的不同核素质量数不同,不能用元素的相对原子质量代表某种核素 的质量数,故 D 错误; 故选:D。 【点评】本题需要掌握根据原子序数推知元素在周期表中的位置,熟悉元素周期 表的结构,这是解题的关键. 5.(3 分)现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤ 碳酸钠,⑥碳酸氢钠.按溶液 pH 由小到大排列正确的是( ) A.①④②③⑥⑤ B.④①②⑥⑤③ C.①④②⑥③⑤ D.④①②③⑥⑤ 【考点】D5:弱电解质在水溶液中的电离平衡;DD:盐类水解的应用.菁优网版权所有 【专题】51G:电离平衡与溶液的 pH 专题;51H:盐类的水解专题. 【分析】先将物质按酸和盐进行分类,再把酸按酸的强弱进行排序,酸性越强的 第 9 页(共 23 页) 酸其 pH 值越小;把盐按其阴离子的水解程度进行排序,盐水解程度越大的其 碱性越强,溶液的 pH 值越大. 【解答】解:①醋酸、②苯酚、④碳酸是酸,等浓度的三种溶液,醋酸的酸性大 于碳酸,碳酸的酸性大于苯酚,所以 pH 值由小到大的顺序是:①醋酸<④碳 酸<②苯酚; ③苯酚钠、⑤碳酸钠、⑥碳酸氢钠是盐,碳酸的酸性大于苯酚,碳酸的第一步电 离程度大于第二步电离程度,碳酸根离子对应的酸是碳酸氢根离子,所以等 浓度的三种盐,苯酚钠的水解程度小于碳酸钠,碳酸氢钠的水解程度小于苯 酚钠,所以 pH 值由小到大的顺序是:⑥碳酸氢钠<③苯酚钠<⑤碳酸钠,所 以这六种溶液 pH 由小到大排列正确的是①④②⑥③⑤,故选 C。 【点评】本题考查了等浓度的酸、盐 pH 值大小的顺序,解题规律是:按照强酸 ﹣﹣弱酸﹣﹣水解显酸性的盐﹣﹣中性的盐﹣﹣水解显碱性的盐﹣﹣弱碱 ﹣﹣强碱的顺序将各物质进行排列,明确苯酚钠的水解程度小于碳酸钠的水 解程度,导致同浓度的苯酚钠和碳酸钠溶液,碳酸钠的碱性大于苯酚钠,此 点为易错点. 6.(3 分)已知: 2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ•mol﹣1; CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJ•mol﹣1. 现有 H2 与 CH4 的混合气体 112L(标准状况),使其完全燃烧生成 CO2 和 H2O( l),若实验测得反应放热 3695kJ,则原混合气体中 H2 与 CH4 的物质的量之 比是( ) A.1:1 B.1:3 C.1:4 D.2:3 【考点】5D:有关反应热的计算.菁优网版权所有 【专题】517:化学反应中的能量变化. 【分析】H2 与 CH4 的混合气体 112L,n= =5mol,设 H2 与 CH4 的物质 的量分别为 x、y,代入热化学反应方程式中计算热量即可解答. 第 10 页(共 23 页) 【解答】解:H2 与 CH4 的混合气体 112L,n= =5mol,设 H2 与 CH4 的 物质的量分别为 x、y, 2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJ•mol﹣1, 2×571.6kJ 285.8x CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890kJ•mol﹣1, 1y890kJ 890ykJ 则,解得 x=1.25mol,y=3.75mol, 原混合气体中 H2 与 CH4 的物质的量之比是 1.25mol:3.75mol=1:3, 故选:B。 【点评】本题考查反应热的有关计算,明确物质的量与热量的关系是解答本题的 关键,学会利用列方程组来解答即可,难度不大. 7.(3 分)1mol 与足量的 NaOH 溶液充分反应, 消耗的 NaOH 的物质的量为( ) A.5 mol B.4 mol C.3 mol D.2 mol 【考点】HD:有机物的结构和性质.菁优网版权所有 【专题】16:压轴题;534:有机物的化学性质及推断. 【分析】由有机物的结构可知,碱性条件下发生水解,产物中含酚﹣OH、﹣COOH 均能与 NaOH 发生反应,以此来解答. 【解答】解:由有机物的结构可知,碱性条件下发生水解,产物中含酚﹣OH、 ﹣COOH 均能与 NaOH 发生反应, 1mol 酚﹣OH 消耗 1molNaOH,1mol﹣COOH 消耗 1molNaOH, 第 11 页(共 23 页) 1mol 该有机物及水解产物中共 3mol 酚﹣OH、2mol﹣COOH, 所以消耗的 NaOH 的物质的量为 5mol, 故选:A。 【点评】本题考查有机物的结构和性质,明确酚及酯的性质是解答本题的关键, 注意水解产物的酸性,题目难度不大. 8.(3 分)根据已知回答 24﹣25 题 已知:2Fe2++Cl2=2Cl﹣+2Fe3+,2Br﹣+Cl2=Br2+2Cl﹣,2Fe2++Br2=2Br﹣+2Fe3+. 含有 amol FeBr2 的溶液中,通入 xmol Cl2.下列各项为通 Cl2 过程中,溶液内发 生反应的离子方程式,其中不正确的是( ) A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl﹣ B.x=0.6a,2Br﹣+Cl2=Br2+2Cl﹣ C.x=a,2Fe2++2Br﹣+2Cl2=Br2+2Fe3++4Cl﹣ D.x=1.5a,2Fe2++4Br﹣+3Cl2=2Br2+2Fe3++6Cl﹣ 【考点】49:离子方程式的书写;BQ:氧化还原反应的计算.菁优网版权所有 【专题】16:压轴题;515:氧化还原反应专题;516:离子反应专题. 【分析】由于还原性:Fe2+>Br﹣,通入 Cl2,依次发生 2Fe2++Cl2=2Fe3++2Cl﹣, 2Br﹣+Cl2=Br2+2Cl﹣, 当 n(Cl2):n(FeBr2)≤ 时,只氧化Fe2+,当 n(Cl2):n(FeBr2)≥ 时, Fe2+和 Br﹣被完全氧化,介于二者之间时, Fe2+被完全氧化,Br﹣被部分氧化,结合反应物物质的量之间的关系解答该题. 【解答】解:由于还原性:Fe2+>Br﹣,通入 Cl2,依次发生 2Fe2++Cl2=2Fe3++2Cl﹣ ,2Br﹣+Cl2=Br2+2Cl﹣, 第 12 页(共 23 页) 当 n(Cl2):n(FeBr2)≤ 时,只氧化Fe2+,当 n(Cl2):n(FeBr2)≥ 时,Fe2+ 和 Br﹣被完全氧化,介于二者之间时, Fe2+被完全氧化,Br﹣被部分氧化,则 A.x=0.4a,n(Cl2):n(FeBr2)=0.4< ,只氧化Fe2+,故 A 正确; B.x=0.6a,n(Cl2):n(FeBr2)介于 ~ ,Fe2+被完全氧化,Br﹣被部分氧化 ,故 B 错误; C.x=a,n(Cl2):n(FeBr2)介于 ~ ,Fe2+被完全氧化,amolFe2+被氧化消 耗 0.5amolCl2,剩余 0.5amolCl2 可与 amolBr﹣发生氧化还原反应,则反应的离 子方程式为 2Fe2++2Br﹣+2Cl2=Br2+2Fe3++4Cl﹣,故 C 正确; D . x=1.5a , Fe2+ 和 Br﹣ 恰 好 被 完 全 氧 化 , 反 应 的 离 子 方 程 式 为 2Fe2++4Br﹣+3Cl2=2Br2+2Fe3++6Cl﹣,故 D 正确。 故选:B。 【点评】本题考查氧化还原反应,题目难度较大,本题注意把握物质的还原性强 弱,此为解答该题的关键,答题时注意氧化剂和还原剂物质的量之间的关系, 此为易错点. 二、非选题 9.某温度时,在 2L 密闭容器中气态物质 X 和 Y 反应生成气态物质 Z,它们的 物质的量随时间的变化如表所示. t/min X/mol 1.00 0.90 0.75 0.65 0.55 Y/mol 1.00 0.80 0.50 0.30 0.10 Z/mol 0.00 0.20 0.50 0.70 0.90 01359第 13 页(共 23 页) 10 14 0.55 0.55 0.10 0.10 0.90 0.90 (1)根据左表中数据,在图 1 中画出 X、Y、Z 的物质的量(n)随时间(t)变 化的曲线: (2)体系中发生反应的化学方程式是 X+2Y⇌2Z ; ( 3 ) 列 式 计 算 该 反 应 在0﹣3min 时 间 内 产 物Z 的 平 均 反 应 速 率 :0.083mol•L﹣1•min﹣1 ; (4)该反应达到平衡时反应物 X 的转化率 α 等于 45% ; (5)如果该反应是放热反应.改变实验条件(温度、压强、催化剂)得到 Z 随 时间变化的曲线①、②、③(如图 2 所示)则曲线①、②、③所对应的实验 条件改变分别是:① 升高温度 ② 加入催化剂 ③ 增大压强 . 【考点】CB:化学平衡的影响因素;CP:化学平衡的计算.菁优网版权所有 【专题】51E:化学平衡专题. 第 14 页(共 23 页) 【分析】(1)根据 X、Z 的物质的量(n)随时间(t)变化画出变化曲线; (2)由表中数据可知,X、Y 为反应物,Z 为生成物,1min 时△n(X) =1mol﹣0.9mol=0.1mol,△n(Y)=1mol﹣0.8mol=0.2mol,△n(Z)=0.2mol, 9min 后各物质的物质的量不再变化,且反应物不为 0,故为可逆反应,物质 的量变化量之比等于化学计量数之比,根据物质的量的变化与化学计量数呈 正比书写化学方程式; (3)依据化学反应速率= ,结合图表数据计算; (4)依据图表数据分析当反应进行到 9min 时反应已达到平衡,转化率等于消耗 量除以原来起始量; (5)根据平衡是 Z 的物质的量的变化,结合反应正反应为放热反应,且为气体 体积增大的反应.分析平衡的移动,进而判断改变的条件. 【解答】解:(1)由表中数据可知,X、Y 为反应物,Z 为生成物,1min 时△n (X)=1mol﹣0.9mol=0.1mol,△n(Y)=1mol﹣0.8mol=0.2mol,△n(Z) =0.2mol,所以 X、Y、Z 在相同时间内的变化量之比为 1:2:2,9min 后各 物质的物质的量不再变化,平衡时 X、Y、Z 的物质的量分别为:0.55mol、 0.1mol、0.9mol. 横坐标为时间,从坐标为 X、Z 的物质的量(n),根据表中数据可画出曲线为: ,第 15 页(共 23 页) 故答案为: ;(2)由表中数据看出反应从开始到平衡,X 的物质的量减小,应为反应物,0~ 1min 物质的量变化值为 1.00mol﹣0.90mol=0.10mol,Y 的物质的量减小,应 为反应物,0~1min 物质的量变化值为 1.00mol﹣0.80mol=0.20mol,Z 的物质 的量增多,应为是生成物,物质的量的变化值为 0.20mol,9min 后各物质的 物质的量不再变化,且反应物不为 0,故为可逆反应,根据物质的量的变化与 化学计量数呈正比,则 n(X):n(Y):n(Z)=0.10mol:0.20mol:0.20mol=1 :2:2,反应方程式为 X+2Y⇌2Z, 故答案为:X+2Y⇌2Z; (3)0﹣3min 内 Z 的反应速率= 0.083mol•L﹣1•min﹣1; ==0.083mol•L﹣1•min﹣1,故答案为: (4)由图表数据可知反应到 9min,反应达到平衡,反应达到平衡时反应物 X 的 转化率 α= ×100%=45%,故答案为:45%; (5)该可逆反应正反应为放热反应,且为气体体积增大的反应. 由表中数据可知,平衡时 Z 的物质的量为 0.9mol,由图 2 可知曲线①平衡后,Z 的物质的量为 0.6,Z 的物质的量减小,故平衡向逆反应移动,应是升高温度 ;曲线②平衡后,Z 的物质的量为 0.9mol,Z 的物质的量未变,应是使用催化 剂;曲线③平衡后,Z 的物质的量为 0.95mol,Z 的物质的量增大,应是增大 压强, 故答案为:升高温度;加入催化剂;增大压强. 【点评】本题考查化学平衡移动、外界条件对平衡的影响、化学平衡图象及作图 第 16 页(共 23 页) 能力,反应速率计算应用等,难度中等,(1)中作图注意起点、平衡时各物 质的物质的量以及 X、Y、Z 在相同时间内的变化量关系. 10.已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以 实现该反应. 回答下列问题: (1)A 中加入的物质是 固体 NH4Cl 和 Ca(OH)发生反应的化学方程式是 22NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O (2)B 中加入的物质是 碱石灰 ,其作用是 除去氨气中的水蒸气 (3)实验时在 C 中观察到得现象是 黑色粉末逐渐变为红色 发生反应的化学 方程式是 2NH3+3CuO N2+3H2O+3Cu ; (4)实验时在 D 中观察到得现象是 出现无色液体 D 中收集到的物质是 氨 水 检验该物质的方法和现象是 用红色石蕊试纸检验,试纸变蓝,用无水 硫酸铜检验,无水硫酸铜变蓝 . 【考点】S7:氨的制取和性质.菁优网版权所有 【专题】524:氮族元素. 【分析】根据实验目的:氨与灼热的氧化铜反应得到氮气和金属铜,所以 A 处 是产生氨气的反应,用氯化铵和氢氧化钙来制取氨气,氨气中混有水蒸气, 用碱石灰干燥,氨气易液化,极易吸收水成为氨水,氨水具有碱性,能使红 色石蕊试纸变蓝,其中的结晶水会使无水硫酸铜变蓝. 【解答】解:(1)根据实验目的:氨与灼热的氧化铜反应得到氮气和金属铜, 可知 A 中加入的是氯化铵和氢氧化钙的固体混合物,加热来制取氨气,发生 反应的化学方程式是:2NH4Cl+Ca(OH)2 CaCl2+NH3↑+2H2O, 第 17 页(共 23 页) 故 答 案 为 : 固 体NH4Cl 和 Ca ( OH ) ;2NH4Cl+Ca ( OH ) 2CaCl2+2NH3↑+2H2O; 2(2)制得的氨气中含有杂质水,可以用碱石灰来吸收,故答案为:碱石灰;除 去氨气中的水蒸气; (3)氨气和氧化铜在加热的条件下发生反应生成金属铜、水以及氮气,黑色粉 末逐渐变为红色, 故答案为:黑色粉末逐渐变为红色;2NH3+3CuO N2+3H2O+3Cu; (4)氨气还原氧化铜之后剩余的氨气和产生的水蒸气在冷凝时会形成氨水,具 有氨气分子和结晶水的成分,氨水可以使使红色石蕊试纸变蓝,其中的结晶 水会使无水硫酸铜变蓝, 故答案为:出现无色液体;氨水;用红色石蕊试纸检验,试纸变蓝,用无水硫酸 铜检验,无水硫酸铜变蓝. 【点评】本题考查学生氨气的实验室制法、干燥以及氨气的还原性方面的知识, 结合实验来考查,增加了难度. 11.现有 A、B、C、D、E、F 六种化合物,已知它们的阳离子有 K+,Ag+,Ca2+ 2﹣ ,Ba2+,Fe2+,Al3+,阴离子有 Cl﹣,OH﹣,CH3COO﹣,NO3 ,SO42﹣,CO3 ﹣,现将它们分别配成 0.1mol•L﹣1 的溶液,进行如下实验: ①测得溶液 A、C、E 呈碱性,且碱性为 A>E>C; ②向 B 溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失; ③向 D 溶液中滴加 Ba(NO3)2 溶液,无明显现象; ④向 F 溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红 褐色. 根据上述实验现象,回答下列问题: (1)实验②中反应的化学方程式是 AgNO3+NH3•H2O=AgOH↓+NH4NO3 ; AgOH+2NH3•H2O=Ag(NH3)2OH+2H2O (2)E 溶液是 碳酸钾 ,判断依据是 由①中碱性强弱的顺序可知,E 是碳 酸盐,六种阳离子中可以与碳酸根形成可溶性盐的只有钾离子,所以 E 是碳 第 18 页(共 23 页) 酸钾 ; (3)写出下列四种化合物的化学式:A Ba(OH) 、C Ca(CH3COO) 、 22D AlCl3 、F FeSO4 . 【考点】DG:常见离子的检验方法;GS:无机物的推断.菁优网版权所有 【专题】16:压轴题;516:离子反应专题. 【分析】①测得溶液 A、C、E 呈碱性,三种溶液为碱液或水解呈碱性的溶液, 且碱性为 A>E>C,则 A 为碱,溶液中含有大量的 OH﹣离子,OH﹣离子与 Ag+ ,Ca2+,Fe2+,Al3+等离子不能大量共存,故 A 只能为 Ba(OH) ,根据越弱 2越水解,E 应为碳酸盐,根据离子共存,只能为 K2CO3,C 为醋酸盐; ②向 B 溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失,则 B 中含 有 银 离 子 , 应 为 硝 酸 银 溶 液 , 加 入 氨 水 发 生 的 反 应 为 AgNO3+NH3•H2O=AgOH↓+NH4NO3; AgOH+2NH3•H2O=Ag(NH3)2OH+2H2O; ③向 D 溶液中滴加 Ba(NO3) 溶液,无明显现象,说明 D 中不含 SO42﹣离子; 2④向 F 溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红 褐色,说明 F 中含有 Fe2+离子; 综上分析可知,A 为 Ba(OH),B 为 AgNO3,C 为 Ca(CH3COO),D 为 AlCl3 22,E 为 K2CO3,F 为 FeSO4. 【解答】解:①测得溶液 A、C、E 呈碱性,三种溶液为碱液或水解呈碱性的溶 液,且碱性为 A>E>C,则 A 为碱,溶液中含有大量的 OH﹣离子,OH﹣离 子与 Ag+,Ca2+,Fe2+,Al3+等离子不能大量共存,故 A 只能为 Ba(OH)2, 根据越弱越水解,E 应为碳酸盐,根据离子共存,只能为 K2CO3,C 为醋酸盐 ;②向 B 溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失,则 B 中含 有 银 离 子 , 应 为 硝 酸 银 溶 液 , 加 入 氨 水 发 生 的 反 应 为 AgNO3+NH3•H2O=AgOH↓+NH4NO3; AgOH+2NH3•H2O=Ag(NH3)2OH+2H2O; 第 19 页(共 23 页) ③向 D 溶液中滴加 Ba(NO3) 溶液,无明显现象,说明 D 中不含 SO42﹣离子; 2④向 F 溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红 褐色,说明 F 中含有 Fe2+离子; 综上分析可知,A 为 Ba(OH),B 为 AgNO3,C 为 Ca(CH3COO),D 为 AlCl3 22,E 为 K2CO3,F 为 FeSO4. (1)在硝酸银溶液中加入氨水生成氢氧化银沉淀,加入过量氨水后生成银氨络 离 子 , 反 应 的 化 学 方 程 式 为AgNO3+NH3•H2O=AgOH↓+NH4NO3 ; AgOH+2NH3•H2O=Ag(NH3)2OH+2H2O, 故答案为:AgNO3+NH3•H2O=AgOH↓+NH4NO3; AgOH+2NH3•H2O=Ag(NH3) 2OH+2H2O; (2)E 应为碳酸盐,六种阳离子中可以与碳酸根形成可溶性盐的只有钾离子, 故 E 为 K2CO3, 故答案为:碳酸钾;由①中碱性强弱的顺序可知,E 是碳酸盐,六种阳离子中可 以与碳酸根形成可溶性盐的只有钾离子,所以 E 是碳酸钾; (3)根据以上分析可知 A 为 Ba(OH) ,B 为 AgNO3,C 为 Ca(CH3COO) , 22D 为 AlCl3,E 为 K2CO3,F 为 FeSO4, 故答案为:Ba(OH)2;Ca(CH3COO)2;AlCl3;FeSO4. 【点评】本题考查物质的推断,题目较难,注意从物质的性质以及反应现象推断 . 12.化合物 A 相对分子质量为 86,碳的质量分数为 55.8%,氢为 7.0%,其余为 氧.A 的相关反应如图所示: 已知 R﹣CH=CHOH(烯醇)不稳定,很快转化为 R﹣CH2CHO. 根据以上信息回答下列问题: (1)A 的分子式为 C4H6O2 ; (2)反应②的化学方程式是 CH3CHO+2Cu(OH)2 CH3COOH+Cu2O+2H2O ;(3)A 的结构简式是 CH3COOCH=CH2 ; (4)反应①的化学方程式是 第 20 页(共 23 页) ; (5)A 有多种同分异构体,写出四个同时满足(i)能发生水解反应(ii)能使 溴 的 四 氯 化 碳 溶 液 褪 色 两 个 条 件 的 同 分 异 构 体 的 结 构 简 式 : 、 、 、 ; (6)A 的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简 式为 . 【考点】HB:有机物的推断.菁优网版权所有 【专题】16:压轴题;534:有机物的化学性质及推断. 【分析】化合物 A 相对分子质量为 86,碳的质量分数为 55.8%,氢为 7.0%,其 余为氧,A 中 C、H、O 原子的原子个数之比= :=2:3: 1,结合 A 的相对分子质量知,A 的分子式为 C4H6O2,A 能发生聚合反应生 成 B,说明 A 中含有碳碳双键,A 能水解生成 C 和 D,C 能和新制氢氧化铜 反应生成 D,说明 C 中含有醛基,A 为酯,且 C 和 D 中碳原子个数相同,所 以 C 是乙醛,D 是乙酸,因为 R﹣CH=CHOH(烯醇)不稳定,很快转化为 R﹣CH2CHO,所以 A 的结构简式为 CH3COOCH=CH2,A 发生聚合反应生成 B,所以 B 的结构简式为: ,B 水解生成乙酸和 E 聚乙烯醇, 第 21 页(共 23 页) E 的结构简式为: 【解答】解:化合物 A 相对分子质量为 86,碳的质量分数为 55.8%,氢为 7.0% ,其余为氧,A 中 C、H、O 原子的原子个数之比= =2: .:3:1,结合 A 的相对分子质量知,A 的分子式为 C4H6O2,A 能发生聚合反应 生成 B,说明 A 中含有碳碳双键,A 能水解生成 C 和 D,C 能和新制氢氧化 铜反应生成 D,说明 C 中含有醛基,A 为酯,且 C 和 D 中碳原子个数相同, 所以 C 是乙醛,D 是乙酸,因为 R﹣CH=CHOH(烯醇)不稳定,很快转化 为 R﹣CH2CHO,所以 A 的结构简式为 CH3COOCH=CH2,A 发生聚合反应生 成 B,所以 B 的结构简式为: 醇,E 的结构简式为: ,B 水解生成乙酸和 E 聚乙烯 .(1)通过以上分析知,A 的分子式 C4H6O2,故答案为:C4H6O2; (2)C 是乙醛,乙醛和氢氧化铜反应生成乙酸、氧化亚铜和水,反应方程式为: CH3CHO+2Cu(OH)2 CH3COOH+Cu2O+2H2O, CH3COOH+Cu2O+2H2O; 故答案为:CH3CHO+2Cu(OH)2 (3)通过以上分析知,A 的结构简式为:CH3COOCH=CH2 ,故答案为: CH3COOCH=CH2; (4)B 的结构简式为: ,B 水解生成乙酸和 E 聚乙烯醇,反应 方程式为: ,故答案为: ;第 22 页(共 23 页) (5)A 有多种同分异构体,写出两个同时满足(i)能发生水解反应,说明含有 酯基,(ii)能使溴的四氯化碳溶液褪色,说明含有碳碳双键,则符合这两个 条件的A的同分异构体的结构简式为,故答案为:;(6)A 的另一种同分异构体,其分子中所有碳原子在一条直线上,说明含有碳 碳 三 键 , 则 两 个 氧 原 子 形 成 两 个 羟 基 , 所 以 它 的 结 构 简 式 为 ,故答案为: .【点评】本题考查有机物推断,涉及反应方程式的书写、同分异构体的判断等知 识点,反应方程式的书写、同分异构体的判断是高考的热点,应熟练掌握此 知识点. 第 23 页(共 23 页)
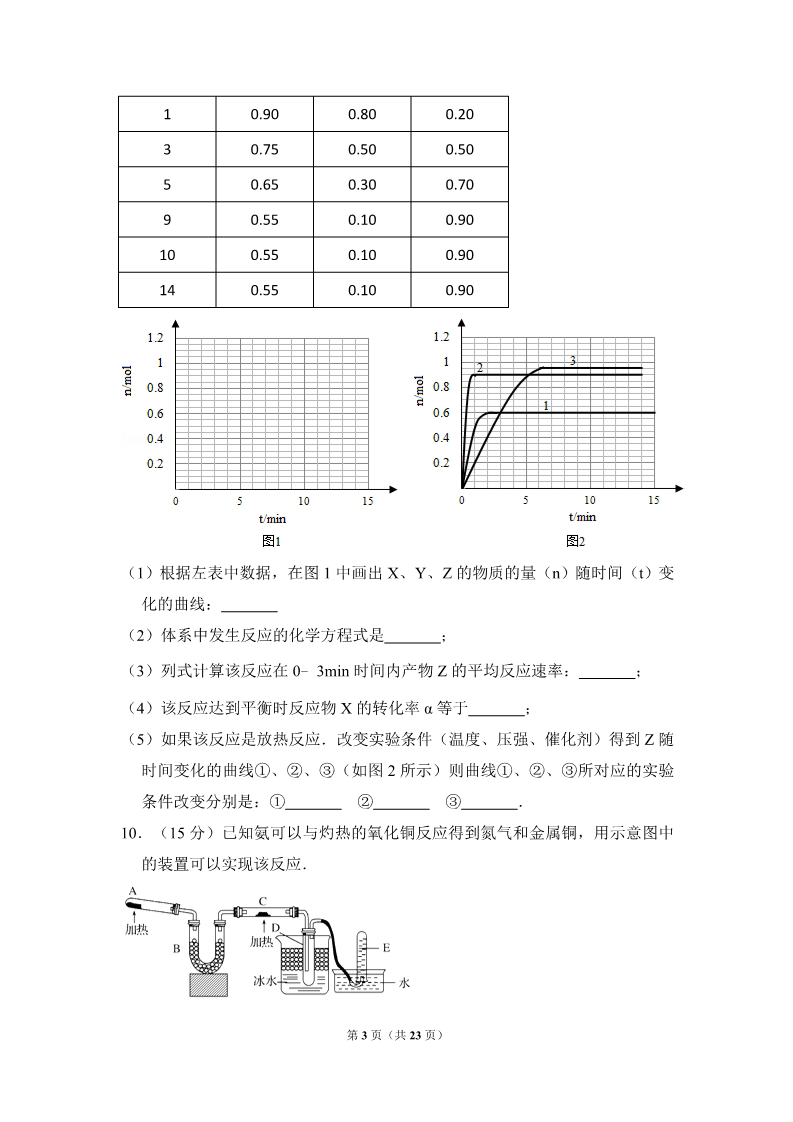
2009 年全国统一高考化学试卷(全国卷Ⅱ) 一、选择题 1.(3 分)物质的量之比为 2:5 的锌与稀硝酸反应,若硝酸被还原的产物为 N2O ,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物 质的量之比是( ) A.1:4 B.1:5 C.2:3 D.2:5 2.(3 分)下列关于溶液和胶体的叙述,正确的是( ) A.溶液是电中性的,胶体是带电的 B.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一 极移动 C.溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗 运动 D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 3.(3 分)下列叙述中正确的是( ) A.向含有 CaCO3 沉淀的水中通入 CO2 至沉淀恰好溶解,再向溶液中加入 NaHCO3 饱和溶液,又有 CaCO3 沉淀生成 B.向 Na2CO3 溶液中逐滴加入等物质的量的稀盐酸,生成的 CO2 与原 Na2CO3 的物质的量之比为 1:2 C.等质量的 NaHCO3 和 Na2CO3 分别与足量盐酸反应,在同温同压下,生成 的 CO2 体积相同 D.向 Na2CO3 饱和溶液中通入 CO2,有 NaHCO3 结晶析出 4.(3 分)某元素只存在两种天然同位素,且在自然界它们的含量相近,其相 对原子质量为 152.0,原子核外的电子数为 63.下列叙述中错误的是( ) A.它是副族元素 B.它是第六周期元素 C.它的原子核内有 63 个质子 D.它的一种同位素的核内有 89 个中子 5.(3 分)现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤ 碳酸钠,⑥碳酸氢钠.按溶液 pH 由小到大排列正确的是( ) 第 1 页(共 23 页) A.①④②③⑥⑤ B.④①②⑥⑤③ C.①④②⑥③⑤ D.④①②③⑥⑤ 6.(3 分)已知: 2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ•mol﹣1; CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJ•mol﹣1. 现有 H2 与 CH4 的混合气体 112L(标准状况),使其完全燃烧生成 CO2 和 H2O( l),若实验测得反应放热 3695kJ,则原混合气体中 H2 与 CH4 的物质的量之 比是( ) A.1:1 B.1:3 C.1:4 D.2:3 7.(3 分)1mol 与足量的 NaOH 溶液充分反应, 消耗的 NaOH 的物质的量为( ) A.5 molB.4 mol C.3 mol D.2 mol 8.(3 分)根据已知回答 24﹣25 题 已知:2Fe2++Cl2=2Cl﹣+2Fe3+,2Br﹣+Cl2=Br2+2Cl﹣,2Fe2++Br2=2Br﹣+2Fe3+. 含有 amol FeBr2 的溶液中,通入 xmol Cl2.下列各项为通 Cl2 过程中,溶液内发 生反应的离子方程式,其中不正确的是( ) A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl﹣ B.x=0.6a,2Br﹣+Cl2=Br2+2Cl﹣ C.x=a,2Fe2++2Br﹣+2Cl2=Br2+2Fe3++4Cl﹣ D.x=1.5a,2Fe2++4Br﹣+3Cl2=2Br2+2Fe3++6Cl﹣ 二、非选题 9.(15 分)某温度时,在 2L 密闭容器中气态物质 X 和 Y 反应生成气态物质 Z ,它们的物质的量随时间的变化如表所示. t/min 0X/mol 1.00 Y/mol 1.00 Z/mol 0.00 第 2 页(共 23 页) 130.90 0.75 0.65 0.55 0.55 0.55 0.80 0.50 0.30 0.10 0.10 0.10 0.20 0.50 0.70 0.90 0.90 0.90 5910 14 (1)根据左表中数据,在图 1 中画出 X、Y、Z 的物质的量(n)随时间(t)变 化的曲线: (2)体系中发生反应的化学方程式是 ; (3)列式计算该反应在 0﹣3min 时间内产物 Z 的平均反应速率: (4)该反应达到平衡时反应物 X 的转化率 α 等于 ; ; (5)如果该反应是放热反应.改变实验条件(温度、压强、催化剂)得到 Z 随 时间变化的曲线①、②、③(如图 2 所示)则曲线①、②、③所对应的实验 条件改变分别是:① ② ③ . 10.(15 分)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中 的装置可以实现该反应. 第 3 页(共 23 页) 回答下列问题: (1)A 中加入的物质是 (2)B 中加入的物质是 发生反应的化学方程式是 ,其作用是 (3)实验时在 C 中观察到得现象是 (4)实验时在 D 中观察到得现象是 发生反应的化学方程式是 ; D 中收集到的物质是 检验该 物质的方法和现象是 . 11.(15 分)现有 A、B、C、D、E、F 六种化合物,已知它们的阳离子有 K+, 2﹣ Ag+,Ca2+,Ba2+,Fe2+,Al3+,阴离子有 Cl﹣,OH﹣,CH3COO﹣,NO3 ,SO4 ﹣,CO32﹣,现将它们分别配成 0.1mol•L﹣1 的溶液,进行如下实验: ①测得溶液 A、C、E 呈碱性,且碱性为 A>E>C; ②向 B 溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失; ③向 D 溶液中滴加 Ba(NO3)2 溶液,无明显现象; ④向 F 溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红 褐色. 根据上述实验现象,回答下列问题: (1)实验②中反应的化学方程式是 (2)E 溶液是 ,判断依据是 (3)写出下列四种化合物的化学式:A ; 、C 、D 、F . 12.(15 分)化合物 A 相对分子质量为 86,碳的质量分数为 55.8%,氢为 7.0% ,其余为氧.A 的相关反应如图所示: 已知 R﹣CH=CHOH(烯醇)不稳定,很快转化为 R﹣CH2CHO. 根据以上信息回答下列问题: (1)A 的分子式为 (2)反应②的化学方程式是 (3)A 的结构简式是 ; (4)反应①的化学方程式是 ; ; ; (5)A 有多种同分异构体,写出四个同时满足(i)能发生水解反应(ii)能使 溴的四氯化碳溶液褪色两个条件的同分异构体的结构简式: 、 、 第 4 页(共 23 页) 、 (6)A 的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简 式为 . ; 第 5 页(共 23 页) 2009 年全国统一高考化学试卷(全国卷Ⅱ) 参考答案与试题解析 一、选择题 1.(3 分)物质的量之比为 2:5 的锌与稀硝酸反应,若硝酸被还原的产物为 N2O ,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物 质的量之比是( ) A.1:4 B.1:5 C.2:3 D.2:5 【考点】BQ:氧化还原反应的计算;EG:硝酸的化学性质.菁优网版权所有 【专题】515:氧化还原反应专题;524:氮族元素. 【分析】锌与稀硝酸反应时硝酸既表现酸性又表现氧化性,根据原子守恒和电子 守恒规律来解决. 【解答】解:锌与稀硝酸反应时硝酸既表现酸性又表现氧化性,根据原子守恒和 电子守恒,2mol 锌失去 4mol 电子,生成 2mol 锌离子,由于生成硝酸锌,则 其结合的硝酸根离子是 4mol,则剩余的 1mol 的硝酸被还原为 N2O 就得到 4mol 电子,硝酸也全部反应,则该反应中被还原的硝酸与未被还原的硝酸的 物质的量之比是 1:4,即 4Zn+10HNO3(一般稀)=4Zn(NO3)+N2O↑+5H2O 2.故选 A。 【点评】本题是对硝酸的氧化性知识的考查,注意电子守恒思想在氧化还原反应 中的运用. 2.(3 分)下列关于溶液和胶体的叙述,正确的是( ) A.溶液是电中性的,胶体是带电的 B.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一 极移动 C.溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗 运动 第 6 页(共 23 页) D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 【考点】66:胶体的重要性质.菁优网版权所有 【专题】51A:溶液和胶体专题. 【分析】A、胶体是电中性的; B、通电时溶质电离出的阴阳离子分别移向两极,溶质是非电解质时不移向任何 电极; C、溶液中溶质分子运动无规律 D、胶体能发生丁达尔现象,溶液没有; 【解答】解:A、溶液是电中性的,胶体也是电中性的,胶体粒子吸附了带电的 离子,故 A 错误; B、通电时,溶液中的溶质粒子是电解质,电离出的阴阳离子分别向两极移动, 若溶质是非电解质不移向电极,胶体中的分散质粒子向某一极移动,故 B 错 误; C、胶体的分散质粒子在显微镜观察下呈现无规则运动,这就是胶体的布朗运动 特性。溶液中的离子呈现自由态,其运动是无规律可言的。故 C 错误; D、溶液没有丁达尔现象而胶体存在,故胶体出现明显的光带,故 D 正确; 故选:D。 【点评】本题考查了胶体、溶液的性质区别,较简单,注意胶体粒子的吸附离子 作用. 3.(3 分)下列叙述中正确的是( ) A.向含有 CaCO3 沉淀的水中通入 CO2 至沉淀恰好溶解,再向溶液中加入 NaHCO3 饱和溶液,又有 CaCO3 沉淀生成 B.向 Na2CO3 溶液中逐滴加入等物质的量的稀盐酸,生成的 CO2 与原 Na2CO3 的物质的量之比为 1:2 C.等质量的 NaHCO3 和 Na2CO3 分别与足量盐酸反应,在同温同压下,生成 的 CO2 体积相同 D.向 Na2CO3 饱和溶液中通入 CO2,有 NaHCO3 结晶析出 第 7 页(共 23 页) 【考点】GF:钠的重要化合物.菁优网版权所有 【专题】527:几种重要的金属及其化合物. 【分析】A、碳酸氢钙与碳酸氢钠不发生反应; B 、 Na2 CO3 溶 液 中 逐 滴 加 入 等 物 质 的 量 的 稀 盐 酸 , 发 生 反 应 Na2CO3+HCl=NaHCO3+NaCl; C、NaHCO3 和 Na2CO3 的摩尔质量不同,二者相同质量,物质的量不同; D、发生反应 Na2CO3+CO2+H2O═2NaHCO3,生成碳酸氢钠的质量比碳酸钠多, 反应消耗水,碳酸氢钠的溶解度小于碳酸钠. 【解答】解:A、CaCO3 沉淀的水中通入 CO2 至沉淀恰好溶解,生成碳酸氢钙溶 液,再加入 NaHCO3 饱和溶液,碳酸氢钙与碳酸氢钠不发生反应,不能生成 碳酸钙沉淀,故 A 错误; B 、 Na2CO3 溶 液 中 逐 滴 加 入 等 物 质 的 量 的 稀 盐 酸 , 发 生 反 应 Na2CO3+HCl=NaHCO3+NaCl,没有二氧化碳生成,故 B 错误; C、NaHCO3 和 Na2CO3 的摩尔质量不同,二者相同质量,物质的量不同,与盐酸 反应都生成二氧化碳,由碳元素守恒可知,生成二氧化碳的物质的量之比与 摩尔质量成反比为 106:84=53:42,即同温同压下,体积之比为 53:42, 故 C 错误; D、发生反应 Na2CO3+CO2+H2O═2NaHCO3,生成碳酸氢钠的质量比碳酸钠多, 反应消耗水,碳酸氢钠的溶解度小于碳酸钠,故会有碳酸氢钠析出,故 D 正 确。 故选:D。 【点评】本题考查钠的重要化合物性质、化学计算等,难度中等,注意 B 选项 中滴加顺序不同,发生反应不同,实质是与量有关导致反应不同. 4.(3 分)某元素只存在两种天然同位素,且在自然界它们的含量相近,其相 对原子质量为 152.0,原子核外的电子数为 63.下列叙述中错误的是( ) A.它是副族元素 B.它是第六周期元素 C.它的原子核内有 63 个质子 第 8 页(共 23 页) D.它的一种同位素的核内有 89 个中子 【考点】33:同位素及其应用;72:元素周期表的结构及其应用;85:质量数与 质子数、中子数之间的相互关系.菁优网版权所有 【专题】51B:原子组成与结构专题. 【分析】A、根据元素在周期表中的位置; B、根据元素在周期表中的位置; C、根据核外电子数等于其质子数; D、同种元素的不同核素质量数不同; 【解答】解:A、因核外电子数等于其质子数为 63,用质子数分别减去各周期所 含有的元素种类,63﹣2﹣8﹣8﹣18﹣18=9,显然其属于第六周期,从左到右 的第 9 种,而第六周期中包含镧系,所以它应属于副族,故 A 正确; B、因核外电子数等于其质子数为 63,用质子数分别减去各周期所含有的元素种 类,63﹣2﹣8﹣8﹣18﹣18=9,显然其属于第六周期,从左到右的第 9 种,而 第六周期中包含镧系,所以它应属于副族,故 B 正确; C、核外电子数等于其质子数,故 C 正确; D、同种元素的不同核素质量数不同,不能用元素的相对原子质量代表某种核素 的质量数,故 D 错误; 故选:D。 【点评】本题需要掌握根据原子序数推知元素在周期表中的位置,熟悉元素周期 表的结构,这是解题的关键. 5.(3 分)现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤ 碳酸钠,⑥碳酸氢钠.按溶液 pH 由小到大排列正确的是( ) A.①④②③⑥⑤ B.④①②⑥⑤③ C.①④②⑥③⑤ D.④①②③⑥⑤ 【考点】D5:弱电解质在水溶液中的电离平衡;DD:盐类水解的应用.菁优网版权所有 【专题】51G:电离平衡与溶液的 pH 专题;51H:盐类的水解专题. 【分析】先将物质按酸和盐进行分类,再把酸按酸的强弱进行排序,酸性越强的 第 9 页(共 23 页) 酸其 pH 值越小;把盐按其阴离子的水解程度进行排序,盐水解程度越大的其 碱性越强,溶液的 pH 值越大. 【解答】解:①醋酸、②苯酚、④碳酸是酸,等浓度的三种溶液,醋酸的酸性大 于碳酸,碳酸的酸性大于苯酚,所以 pH 值由小到大的顺序是:①醋酸<④碳 酸<②苯酚; ③苯酚钠、⑤碳酸钠、⑥碳酸氢钠是盐,碳酸的酸性大于苯酚,碳酸的第一步电 离程度大于第二步电离程度,碳酸根离子对应的酸是碳酸氢根离子,所以等 浓度的三种盐,苯酚钠的水解程度小于碳酸钠,碳酸氢钠的水解程度小于苯 酚钠,所以 pH 值由小到大的顺序是:⑥碳酸氢钠<③苯酚钠<⑤碳酸钠,所 以这六种溶液 pH 由小到大排列正确的是①④②⑥③⑤,故选 C。 【点评】本题考查了等浓度的酸、盐 pH 值大小的顺序,解题规律是:按照强酸 ﹣﹣弱酸﹣﹣水解显酸性的盐﹣﹣中性的盐﹣﹣水解显碱性的盐﹣﹣弱碱 ﹣﹣强碱的顺序将各物质进行排列,明确苯酚钠的水解程度小于碳酸钠的水 解程度,导致同浓度的苯酚钠和碳酸钠溶液,碳酸钠的碱性大于苯酚钠,此 点为易错点. 6.(3 分)已知: 2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ•mol﹣1; CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJ•mol﹣1. 现有 H2 与 CH4 的混合气体 112L(标准状况),使其完全燃烧生成 CO2 和 H2O( l),若实验测得反应放热 3695kJ,则原混合气体中 H2 与 CH4 的物质的量之 比是( ) A.1:1 B.1:3 C.1:4 D.2:3 【考点】5D:有关反应热的计算.菁优网版权所有 【专题】517:化学反应中的能量变化. 【分析】H2 与 CH4 的混合气体 112L,n= =5mol,设 H2 与 CH4 的物质 的量分别为 x、y,代入热化学反应方程式中计算热量即可解答. 第 10 页(共 23 页) 【解答】解:H2 与 CH4 的混合气体 112L,n= =5mol,设 H2 与 CH4 的 物质的量分别为 x、y, 2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJ•mol﹣1, 2×571.6kJ 285.8x CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890kJ•mol﹣1, 1y890kJ 890ykJ 则,解得 x=1.25mol,y=3.75mol, 原混合气体中 H2 与 CH4 的物质的量之比是 1.25mol:3.75mol=1:3, 故选:B。 【点评】本题考查反应热的有关计算,明确物质的量与热量的关系是解答本题的 关键,学会利用列方程组来解答即可,难度不大. 7.(3 分)1mol 与足量的 NaOH 溶液充分反应, 消耗的 NaOH 的物质的量为( ) A.5 mol B.4 mol C.3 mol D.2 mol 【考点】HD:有机物的结构和性质.菁优网版权所有 【专题】16:压轴题;534:有机物的化学性质及推断. 【分析】由有机物的结构可知,碱性条件下发生水解,产物中含酚﹣OH、﹣COOH 均能与 NaOH 发生反应,以此来解答. 【解答】解:由有机物的结构可知,碱性条件下发生水解,产物中含酚﹣OH、 ﹣COOH 均能与 NaOH 发生反应, 1mol 酚﹣OH 消耗 1molNaOH,1mol﹣COOH 消耗 1molNaOH, 第 11 页(共 23 页) 1mol 该有机物及水解产物中共 3mol 酚﹣OH、2mol﹣COOH, 所以消耗的 NaOH 的物质的量为 5mol, 故选:A。 【点评】本题考查有机物的结构和性质,明确酚及酯的性质是解答本题的关键, 注意水解产物的酸性,题目难度不大. 8.(3 分)根据已知回答 24﹣25 题 已知:2Fe2++Cl2=2Cl﹣+2Fe3+,2Br﹣+Cl2=Br2+2Cl﹣,2Fe2++Br2=2Br﹣+2Fe3+. 含有 amol FeBr2 的溶液中,通入 xmol Cl2.下列各项为通 Cl2 过程中,溶液内发 生反应的离子方程式,其中不正确的是( ) A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl﹣ B.x=0.6a,2Br﹣+Cl2=Br2+2Cl﹣ C.x=a,2Fe2++2Br﹣+2Cl2=Br2+2Fe3++4Cl﹣ D.x=1.5a,2Fe2++4Br﹣+3Cl2=2Br2+2Fe3++6Cl﹣ 【考点】49:离子方程式的书写;BQ:氧化还原反应的计算.菁优网版权所有 【专题】16:压轴题;515:氧化还原反应专题;516:离子反应专题. 【分析】由于还原性:Fe2+>Br﹣,通入 Cl2,依次发生 2Fe2++Cl2=2Fe3++2Cl﹣, 2Br﹣+Cl2=Br2+2Cl﹣, 当 n(Cl2):n(FeBr2)≤ 时,只氧化Fe2+,当 n(Cl2):n(FeBr2)≥ 时, Fe2+和 Br﹣被完全氧化,介于二者之间时, Fe2+被完全氧化,Br﹣被部分氧化,结合反应物物质的量之间的关系解答该题. 【解答】解:由于还原性:Fe2+>Br﹣,通入 Cl2,依次发生 2Fe2++Cl2=2Fe3++2Cl﹣ ,2Br﹣+Cl2=Br2+2Cl﹣, 第 12 页(共 23 页) 当 n(Cl2):n(FeBr2)≤ 时,只氧化Fe2+,当 n(Cl2):n(FeBr2)≥ 时,Fe2+ 和 Br﹣被完全氧化,介于二者之间时, Fe2+被完全氧化,Br﹣被部分氧化,则 A.x=0.4a,n(Cl2):n(FeBr2)=0.4< ,只氧化Fe2+,故 A 正确; B.x=0.6a,n(Cl2):n(FeBr2)介于 ~ ,Fe2+被完全氧化,Br﹣被部分氧化 ,故 B 错误; C.x=a,n(Cl2):n(FeBr2)介于 ~ ,Fe2+被完全氧化,amolFe2+被氧化消 耗 0.5amolCl2,剩余 0.5amolCl2 可与 amolBr﹣发生氧化还原反应,则反应的离 子方程式为 2Fe2++2Br﹣+2Cl2=Br2+2Fe3++4Cl﹣,故 C 正确; D . x=1.5a , Fe2+ 和 Br﹣ 恰 好 被 完 全 氧 化 , 反 应 的 离 子 方 程 式 为 2Fe2++4Br﹣+3Cl2=2Br2+2Fe3++6Cl﹣,故 D 正确。 故选:B。 【点评】本题考查氧化还原反应,题目难度较大,本题注意把握物质的还原性强 弱,此为解答该题的关键,答题时注意氧化剂和还原剂物质的量之间的关系, 此为易错点. 二、非选题 9.某温度时,在 2L 密闭容器中气态物质 X 和 Y 反应生成气态物质 Z,它们的 物质的量随时间的变化如表所示. t/min X/mol 1.00 0.90 0.75 0.65 0.55 Y/mol 1.00 0.80 0.50 0.30 0.10 Z/mol 0.00 0.20 0.50 0.70 0.90 01359第 13 页(共 23 页) 10 14 0.55 0.55 0.10 0.10 0.90 0.90 (1)根据左表中数据,在图 1 中画出 X、Y、Z 的物质的量(n)随时间(t)变 化的曲线: (2)体系中发生反应的化学方程式是 X+2Y⇌2Z ; ( 3 ) 列 式 计 算 该 反 应 在0﹣3min 时 间 内 产 物Z 的 平 均 反 应 速 率 :0.083mol•L﹣1•min﹣1 ; (4)该反应达到平衡时反应物 X 的转化率 α 等于 45% ; (5)如果该反应是放热反应.改变实验条件(温度、压强、催化剂)得到 Z 随 时间变化的曲线①、②、③(如图 2 所示)则曲线①、②、③所对应的实验 条件改变分别是:① 升高温度 ② 加入催化剂 ③ 增大压强 . 【考点】CB:化学平衡的影响因素;CP:化学平衡的计算.菁优网版权所有 【专题】51E:化学平衡专题. 第 14 页(共 23 页) 【分析】(1)根据 X、Z 的物质的量(n)随时间(t)变化画出变化曲线; (2)由表中数据可知,X、Y 为反应物,Z 为生成物,1min 时△n(X) =1mol﹣0.9mol=0.1mol,△n(Y)=1mol﹣0.8mol=0.2mol,△n(Z)=0.2mol, 9min 后各物质的物质的量不再变化,且反应物不为 0,故为可逆反应,物质 的量变化量之比等于化学计量数之比,根据物质的量的变化与化学计量数呈 正比书写化学方程式; (3)依据化学反应速率= ,结合图表数据计算; (4)依据图表数据分析当反应进行到 9min 时反应已达到平衡,转化率等于消耗 量除以原来起始量; (5)根据平衡是 Z 的物质的量的变化,结合反应正反应为放热反应,且为气体 体积增大的反应.分析平衡的移动,进而判断改变的条件. 【解答】解:(1)由表中数据可知,X、Y 为反应物,Z 为生成物,1min 时△n (X)=1mol﹣0.9mol=0.1mol,△n(Y)=1mol﹣0.8mol=0.2mol,△n(Z) =0.2mol,所以 X、Y、Z 在相同时间内的变化量之比为 1:2:2,9min 后各 物质的物质的量不再变化,平衡时 X、Y、Z 的物质的量分别为:0.55mol、 0.1mol、0.9mol. 横坐标为时间,从坐标为 X、Z 的物质的量(n),根据表中数据可画出曲线为: ,第 15 页(共 23 页) 故答案为: ;(2)由表中数据看出反应从开始到平衡,X 的物质的量减小,应为反应物,0~ 1min 物质的量变化值为 1.00mol﹣0.90mol=0.10mol,Y 的物质的量减小,应 为反应物,0~1min 物质的量变化值为 1.00mol﹣0.80mol=0.20mol,Z 的物质 的量增多,应为是生成物,物质的量的变化值为 0.20mol,9min 后各物质的 物质的量不再变化,且反应物不为 0,故为可逆反应,根据物质的量的变化与 化学计量数呈正比,则 n(X):n(Y):n(Z)=0.10mol:0.20mol:0.20mol=1 :2:2,反应方程式为 X+2Y⇌2Z, 故答案为:X+2Y⇌2Z; (3)0﹣3min 内 Z 的反应速率= 0.083mol•L﹣1•min﹣1; ==0.083mol•L﹣1•min﹣1,故答案为: (4)由图表数据可知反应到 9min,反应达到平衡,反应达到平衡时反应物 X 的 转化率 α= ×100%=45%,故答案为:45%; (5)该可逆反应正反应为放热反应,且为气体体积增大的反应. 由表中数据可知,平衡时 Z 的物质的量为 0.9mol,由图 2 可知曲线①平衡后,Z 的物质的量为 0.6,Z 的物质的量减小,故平衡向逆反应移动,应是升高温度 ;曲线②平衡后,Z 的物质的量为 0.9mol,Z 的物质的量未变,应是使用催化 剂;曲线③平衡后,Z 的物质的量为 0.95mol,Z 的物质的量增大,应是增大 压强, 故答案为:升高温度;加入催化剂;增大压强. 【点评】本题考查化学平衡移动、外界条件对平衡的影响、化学平衡图象及作图 第 16 页(共 23 页) 能力,反应速率计算应用等,难度中等,(1)中作图注意起点、平衡时各物 质的物质的量以及 X、Y、Z 在相同时间内的变化量关系. 10.已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以 实现该反应. 回答下列问题: (1)A 中加入的物质是 固体 NH4Cl 和 Ca(OH)发生反应的化学方程式是 22NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O (2)B 中加入的物质是 碱石灰 ,其作用是 除去氨气中的水蒸气 (3)实验时在 C 中观察到得现象是 黑色粉末逐渐变为红色 发生反应的化学 方程式是 2NH3+3CuO N2+3H2O+3Cu ; (4)实验时在 D 中观察到得现象是 出现无色液体 D 中收集到的物质是 氨 水 检验该物质的方法和现象是 用红色石蕊试纸检验,试纸变蓝,用无水 硫酸铜检验,无水硫酸铜变蓝 . 【考点】S7:氨的制取和性质.菁优网版权所有 【专题】524:氮族元素. 【分析】根据实验目的:氨与灼热的氧化铜反应得到氮气和金属铜,所以 A 处 是产生氨气的反应,用氯化铵和氢氧化钙来制取氨气,氨气中混有水蒸气, 用碱石灰干燥,氨气易液化,极易吸收水成为氨水,氨水具有碱性,能使红 色石蕊试纸变蓝,其中的结晶水会使无水硫酸铜变蓝. 【解答】解:(1)根据实验目的:氨与灼热的氧化铜反应得到氮气和金属铜, 可知 A 中加入的是氯化铵和氢氧化钙的固体混合物,加热来制取氨气,发生 反应的化学方程式是:2NH4Cl+Ca(OH)2 CaCl2+NH3↑+2H2O, 第 17 页(共 23 页) 故 答 案 为 : 固 体NH4Cl 和 Ca ( OH ) ;2NH4Cl+Ca ( OH ) 2CaCl2+2NH3↑+2H2O; 2(2)制得的氨气中含有杂质水,可以用碱石灰来吸收,故答案为:碱石灰;除 去氨气中的水蒸气; (3)氨气和氧化铜在加热的条件下发生反应生成金属铜、水以及氮气,黑色粉 末逐渐变为红色, 故答案为:黑色粉末逐渐变为红色;2NH3+3CuO N2+3H2O+3Cu; (4)氨气还原氧化铜之后剩余的氨气和产生的水蒸气在冷凝时会形成氨水,具 有氨气分子和结晶水的成分,氨水可以使使红色石蕊试纸变蓝,其中的结晶 水会使无水硫酸铜变蓝, 故答案为:出现无色液体;氨水;用红色石蕊试纸检验,试纸变蓝,用无水硫酸 铜检验,无水硫酸铜变蓝. 【点评】本题考查学生氨气的实验室制法、干燥以及氨气的还原性方面的知识, 结合实验来考查,增加了难度. 11.现有 A、B、C、D、E、F 六种化合物,已知它们的阳离子有 K+,Ag+,Ca2+ 2﹣ ,Ba2+,Fe2+,Al3+,阴离子有 Cl﹣,OH﹣,CH3COO﹣,NO3 ,SO42﹣,CO3 ﹣,现将它们分别配成 0.1mol•L﹣1 的溶液,进行如下实验: ①测得溶液 A、C、E 呈碱性,且碱性为 A>E>C; ②向 B 溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失; ③向 D 溶液中滴加 Ba(NO3)2 溶液,无明显现象; ④向 F 溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红 褐色. 根据上述实验现象,回答下列问题: (1)实验②中反应的化学方程式是 AgNO3+NH3•H2O=AgOH↓+NH4NO3 ; AgOH+2NH3•H2O=Ag(NH3)2OH+2H2O (2)E 溶液是 碳酸钾 ,判断依据是 由①中碱性强弱的顺序可知,E 是碳 酸盐,六种阳离子中可以与碳酸根形成可溶性盐的只有钾离子,所以 E 是碳 第 18 页(共 23 页) 酸钾 ; (3)写出下列四种化合物的化学式:A Ba(OH) 、C Ca(CH3COO) 、 22D AlCl3 、F FeSO4 . 【考点】DG:常见离子的检验方法;GS:无机物的推断.菁优网版权所有 【专题】16:压轴题;516:离子反应专题. 【分析】①测得溶液 A、C、E 呈碱性,三种溶液为碱液或水解呈碱性的溶液, 且碱性为 A>E>C,则 A 为碱,溶液中含有大量的 OH﹣离子,OH﹣离子与 Ag+ ,Ca2+,Fe2+,Al3+等离子不能大量共存,故 A 只能为 Ba(OH) ,根据越弱 2越水解,E 应为碳酸盐,根据离子共存,只能为 K2CO3,C 为醋酸盐; ②向 B 溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失,则 B 中含 有 银 离 子 , 应 为 硝 酸 银 溶 液 , 加 入 氨 水 发 生 的 反 应 为 AgNO3+NH3•H2O=AgOH↓+NH4NO3; AgOH+2NH3•H2O=Ag(NH3)2OH+2H2O; ③向 D 溶液中滴加 Ba(NO3) 溶液,无明显现象,说明 D 中不含 SO42﹣离子; 2④向 F 溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红 褐色,说明 F 中含有 Fe2+离子; 综上分析可知,A 为 Ba(OH),B 为 AgNO3,C 为 Ca(CH3COO),D 为 AlCl3 22,E 为 K2CO3,F 为 FeSO4. 【解答】解:①测得溶液 A、C、E 呈碱性,三种溶液为碱液或水解呈碱性的溶 液,且碱性为 A>E>C,则 A 为碱,溶液中含有大量的 OH﹣离子,OH﹣离 子与 Ag+,Ca2+,Fe2+,Al3+等离子不能大量共存,故 A 只能为 Ba(OH)2, 根据越弱越水解,E 应为碳酸盐,根据离子共存,只能为 K2CO3,C 为醋酸盐 ;②向 B 溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失,则 B 中含 有 银 离 子 , 应 为 硝 酸 银 溶 液 , 加 入 氨 水 发 生 的 反 应 为 AgNO3+NH3•H2O=AgOH↓+NH4NO3; AgOH+2NH3•H2O=Ag(NH3)2OH+2H2O; 第 19 页(共 23 页) ③向 D 溶液中滴加 Ba(NO3) 溶液,无明显现象,说明 D 中不含 SO42﹣离子; 2④向 F 溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红 褐色,说明 F 中含有 Fe2+离子; 综上分析可知,A 为 Ba(OH),B 为 AgNO3,C 为 Ca(CH3COO),D 为 AlCl3 22,E 为 K2CO3,F 为 FeSO4. (1)在硝酸银溶液中加入氨水生成氢氧化银沉淀,加入过量氨水后生成银氨络 离 子 , 反 应 的 化 学 方 程 式 为AgNO3+NH3•H2O=AgOH↓+NH4NO3 ; AgOH+2NH3•H2O=Ag(NH3)2OH+2H2O, 故答案为:AgNO3+NH3•H2O=AgOH↓+NH4NO3; AgOH+2NH3•H2O=Ag(NH3) 2OH+2H2O; (2)E 应为碳酸盐,六种阳离子中可以与碳酸根形成可溶性盐的只有钾离子, 故 E 为 K2CO3, 故答案为:碳酸钾;由①中碱性强弱的顺序可知,E 是碳酸盐,六种阳离子中可 以与碳酸根形成可溶性盐的只有钾离子,所以 E 是碳酸钾; (3)根据以上分析可知 A 为 Ba(OH) ,B 为 AgNO3,C 为 Ca(CH3COO) , 22D 为 AlCl3,E 为 K2CO3,F 为 FeSO4, 故答案为:Ba(OH)2;Ca(CH3COO)2;AlCl3;FeSO4. 【点评】本题考查物质的推断,题目较难,注意从物质的性质以及反应现象推断 . 12.化合物 A 相对分子质量为 86,碳的质量分数为 55.8%,氢为 7.0%,其余为 氧.A 的相关反应如图所示: 已知 R﹣CH=CHOH(烯醇)不稳定,很快转化为 R﹣CH2CHO. 根据以上信息回答下列问题: (1)A 的分子式为 C4H6O2 ; (2)反应②的化学方程式是 CH3CHO+2Cu(OH)2 CH3COOH+Cu2O+2H2O ;(3)A 的结构简式是 CH3COOCH=CH2 ; (4)反应①的化学方程式是 第 20 页(共 23 页) ; (5)A 有多种同分异构体,写出四个同时满足(i)能发生水解反应(ii)能使 溴 的 四 氯 化 碳 溶 液 褪 色 两 个 条 件 的 同 分 异 构 体 的 结 构 简 式 : 、 、 、 ; (6)A 的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简 式为 . 【考点】HB:有机物的推断.菁优网版权所有 【专题】16:压轴题;534:有机物的化学性质及推断. 【分析】化合物 A 相对分子质量为 86,碳的质量分数为 55.8%,氢为 7.0%,其 余为氧,A 中 C、H、O 原子的原子个数之比= :=2:3: 1,结合 A 的相对分子质量知,A 的分子式为 C4H6O2,A 能发生聚合反应生 成 B,说明 A 中含有碳碳双键,A 能水解生成 C 和 D,C 能和新制氢氧化铜 反应生成 D,说明 C 中含有醛基,A 为酯,且 C 和 D 中碳原子个数相同,所 以 C 是乙醛,D 是乙酸,因为 R﹣CH=CHOH(烯醇)不稳定,很快转化为 R﹣CH2CHO,所以 A 的结构简式为 CH3COOCH=CH2,A 发生聚合反应生成 B,所以 B 的结构简式为: ,B 水解生成乙酸和 E 聚乙烯醇, 第 21 页(共 23 页) E 的结构简式为: 【解答】解:化合物 A 相对分子质量为 86,碳的质量分数为 55.8%,氢为 7.0% ,其余为氧,A 中 C、H、O 原子的原子个数之比= =2: .:3:1,结合 A 的相对分子质量知,A 的分子式为 C4H6O2,A 能发生聚合反应 生成 B,说明 A 中含有碳碳双键,A 能水解生成 C 和 D,C 能和新制氢氧化 铜反应生成 D,说明 C 中含有醛基,A 为酯,且 C 和 D 中碳原子个数相同, 所以 C 是乙醛,D 是乙酸,因为 R﹣CH=CHOH(烯醇)不稳定,很快转化 为 R﹣CH2CHO,所以 A 的结构简式为 CH3COOCH=CH2,A 发生聚合反应生 成 B,所以 B 的结构简式为: 醇,E 的结构简式为: ,B 水解生成乙酸和 E 聚乙烯 .(1)通过以上分析知,A 的分子式 C4H6O2,故答案为:C4H6O2; (2)C 是乙醛,乙醛和氢氧化铜反应生成乙酸、氧化亚铜和水,反应方程式为: CH3CHO+2Cu(OH)2 CH3COOH+Cu2O+2H2O, CH3COOH+Cu2O+2H2O; 故答案为:CH3CHO+2Cu(OH)2 (3)通过以上分析知,A 的结构简式为:CH3COOCH=CH2 ,故答案为: CH3COOCH=CH2; (4)B 的结构简式为: ,B 水解生成乙酸和 E 聚乙烯醇,反应 方程式为: ,故答案为: ;第 22 页(共 23 页) (5)A 有多种同分异构体,写出两个同时满足(i)能发生水解反应,说明含有 酯基,(ii)能使溴的四氯化碳溶液褪色,说明含有碳碳双键,则符合这两个 条件的A的同分异构体的结构简式为,故答案为:;(6)A 的另一种同分异构体,其分子中所有碳原子在一条直线上,说明含有碳 碳 三 键 , 则 两 个 氧 原 子 形 成 两 个 羟 基 , 所 以 它 的 结 构 简 式 为 ,故答案为: .【点评】本题考查有机物推断,涉及反应方程式的书写、同分异构体的判断等知 识点,反应方程式的书写、同分异构体的判断是高考的热点,应熟练掌握此 知识点. 第 23 页(共 23 页)
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





