
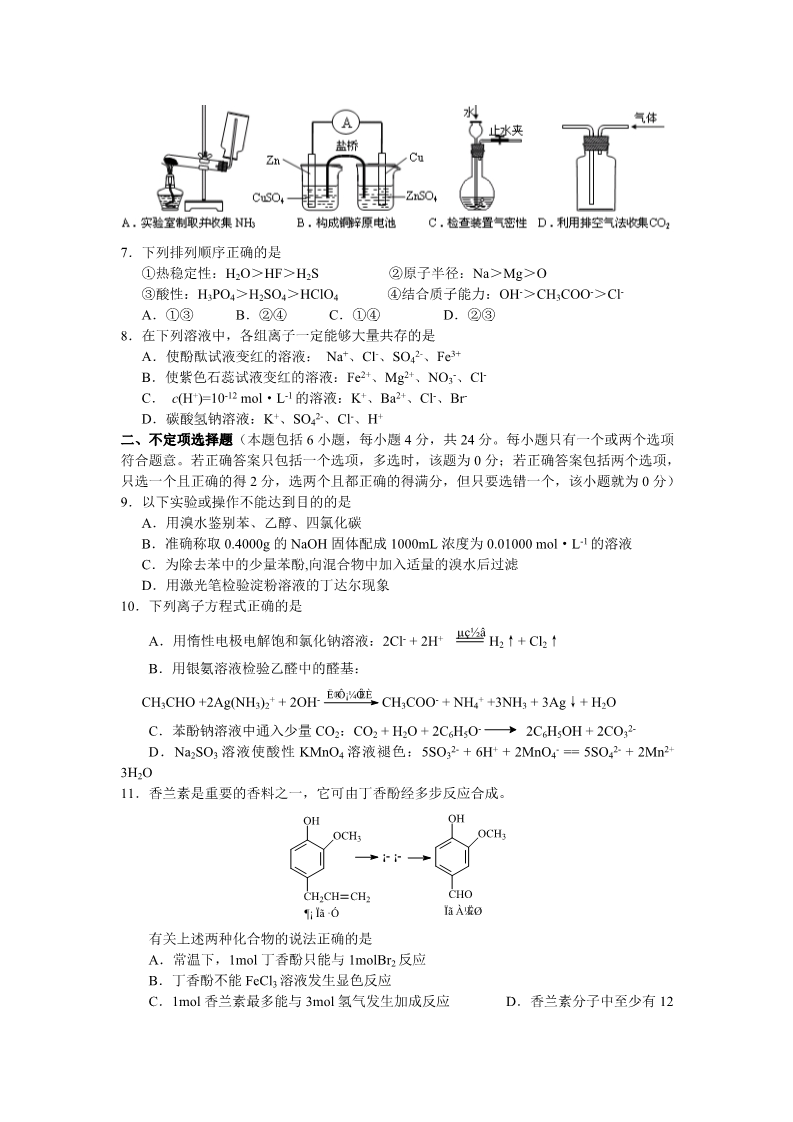
 2008年全国高等院校招生统一考试(江苏化学试卷) 可能用到的相对原子质量:H 1C12 N14 O16 Na 23 Mg 24 Al 27 127 S32 Cl 35.5 Ca 40 Fe 56 Cu 64 Br 80 Ag 108 IBa 137 一、单项选择题:(本题包括 8 小题,每题 3 分,共 24 分。每小题只有一个选项符合题意) 1.化学与生活、社会密切相关。下列说法不正确的是 A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 B.凡含有食品添加剂的食物对人体健康均有害,不可食用 C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 D.提倡人们购物时不用塑料袋,是为了防止白色污染 2.下列文字表述与反应方程式对应且正确的是 A.溴乙烷中滴入 AgNO3 溶液检验其中的溴元素:Br-+Ag+==AgBr↓ B.用醋酸除去水垢:CaCO3 + 2H+==Ca2+ + H2O + CO2↑ C.利用腐蚀法制作印刷线路板:Fe3+ + Cu == Fe2+ + Cu2+ Br + HBr FeBr3 D.实验室用液溴和苯在催化剂作用下制溴苯: + Br2 3.用 NA 表示阿伏加德罗常数的值。下列叙述正确的是 A.常温常压下的 33.6L 氯气与 27g 铝充分反应,转移电子数为 3NA B.标准状况下,22.4L 己烷中共价键数目为 19NA C.由 CO2 和 O2 组成的混合物中共有 NA 个分子,其中的氧原子数为 2NA 2- D.1L 浓度为 1mol·L-1 的 Na2CO3 溶液中含有 NA 个 CO3 4.下列现象或事实可用同一原理解释的是 A.浓硫酸和浓盐酸长期暴露在空气中浓度降低 B.氯水和活性炭使红墨水褪色 C.漂白粉和水玻璃长期暴露在变 质D.乙炔和乙烯使溴的四氯化炭溶液褪色 5.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为 ·Åµç KOH 溶 液 , 其 充 、 放 电 按 下 式 进 行 : Cd + 2NiOOH + 2H2O Cd(OH)2 + ³ä µç 2Ni(OH)2 有关该电池的说法正确的是 A.充电时阳极反应:Ni(OH)2 -e— + OH- == NiOOH + H2O B.充电过程是化学能转化为电能的过程 C.放电时负极附近溶液 的碱性不变 D.放电时电解质溶液中的 OH-向正极移动 6.下列装置或操作能达到实验目的的是 7.下列排列顺序正确的是 ①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O ④结合质子能力:OH->CH3COO->Cl- C.①④ D.②③ ③酸性:H3PO4>H2SO4>HClO4 A.①③ B.②④ 8.在下列溶液中,各组离子一定能够大量共存的是 2- A.使酚酞试液变红的溶液: Na+、Cl-、SO4 、Fe3+ -B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3 、Cl- C. c(H+)=10-12 mol·L-1 的溶液:K+、Ba2+、Cl-、Br- 2- D.碳酸氢钠溶液:K+、SO4 、Cl-、H+ 二、不定项选择题(本题包括 6 小题,每小题 4 分,共 24 分。每小题只有一个或两个选项 符合题意。若正确答案只包括一个选项,多选时,该题为 0 分;若正确答案包括两个选项, 只选一个且正确的得 2 分,选两个且都正确的得满分,但只要选错一个,该小题就为 0 分) 9.以下实验或操作不能达到目的的是 A.用溴水鉴别苯、乙醇、四氯化碳 B.准确称取 0.4000g 的 NaOH 固体配成 1000mL 浓度为 0.01000 mol·L-1 的溶液 C.为除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤 D.用激光笔检验淀粉溶液的丁达尔现象 10.下列离子方程式正确的是 µç½â A.用惰性电极电解饱和氯化钠溶液:2Cl- + 2H+ H2↑+ Cl2↑ B.用银氨溶液检验乙醛中的醛基: ˮԡ¼ÓÈÈ CH3CHO +2Ag(NH3)2+ + 2OH- CH3COO- + NH4+ +3NH3 + 3Ag↓+ H2O 2- C.苯酚钠溶液中通入少量 CO2:CO2 + H2O + 2C6H5O- 2C6H5OH + 2CO3 2- -2- D.Na2SO3 溶液使酸性 KMnO4 溶液褪色:5SO3 + 6H+ + 2MnO4 == 5SO4 + 2Mn2+ 3H2O 11.香兰素是重要的香料之一,它可由丁香酚经多步反应合成。 OH OH OCH3 OCH3 ¡- ¡- CHO CH2CH CH2 ¶¡ Ïã ·Ó Ïã À¼ËØ 有关上述两种化合物的说法正确的是 A.常温下,1mol 丁香酚只能与 1molBr2 反应 B.丁香酚不能 FeCl3 溶液发生显色反应 C.1mol 香兰素最多能与 3mol 氢气发生加成反应 D.香兰素分子中至少有 12 个原子共平面 12.下列溶液中有关物质的量浓度关系正确的是 A.pH=2 的 HA 溶液与 pH=12 的 MOH 溶液任意比混合: c(H+) + c(M+) == c(OH-) + c(A-) B.pH 相等的 CH3COONa、NaOH 和 Na2CO3 三种溶液: c(NaOH)<c(CH3COONa)<c(Na2CO3) C.物质的量浓度相等 CH3COOH 和 CH3COONa 溶液等体积混合: c(CH3COO-) +2c(OH-) == 2c(H+) + c(CH3COOH) D.0.1mol·L-1 的 NaHA 溶液,其 pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) 13.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形 象的效果。下列表达不正确的是 12n (C u O ) n (C ) A.密闭容器中 CuO 和 C 高温反应的气体产物: C O C O C O 2 C O 2 11 .5 n (C l2) n (F e) B.Fe 在 Cl2 中的燃烧产物: F eC l2 F eC l3 F eC l2 F eC l3 3Al(OH)3 Al3+ 4n(NaOH) n(AlCl3) -Al(OH)3 AlO2 C.AlCl3 溶液中滴加 NaOH 后铝的存在形式: -AlO2 21n(NH3 H2O) n(SO2) D.氨水与 SO2 反应后溶液中的铵盐: NH HSO NH4HSO4 (NH ) SO4 4244(NH ) SO4 4214.某有机样品 3.1g 完全燃烧,燃烧后的混合物通入过量的澄清石灰水,石灰水共增重 7.1g,经过滤得到 10g 沉淀。该有机样品可能是 A.乙二醇 B.乙醇 C.乙醛 D.甲醇和丙三醇的混合物 第二卷(非选择题 共72 分) 三、(本题包括 1 小题,共 10 分) 15.(10 分)金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以 HCN、CN -和金属离子的配离子 M(CN)nm-的形式存在于水中。测定污水中含氰化合物含 量的实验步骤如下: ①水样预处理:水样中加入磷酸和 EDTA,在 pH<2 的条件下加热蒸馏,蒸出所有的 HCN, 并用 NaOH 溶液吸收。 ②滴定:将吸收液调节至 pH>11,以试银灵作指示剂,用 AgNO3 标准溶液滴定 Ag++2CN – == [Ag(CN)2] – 终点时,溶液由黄色变成橙红色。 根据以上知识回答下列问题: ⑴水样预处理的目的是 。⑵水样预处理的装置如右图,细导管插入吸收液中是为了 。⑶蒸馏瓶比吸收液面要高出很多,其目的是 ⑷如果用盐酸代替磷酸进行预处理,实验结果将 “偏高”、“无影响”或“偏低”)。 。(填 ⑸ 准 确 移 取 某 工 厂 污 水100mL ,经 处 理 后 用 浓 度 为 0.01000mol·L-1 的硝酸银标准溶液滴定,终点时消耗了 21.00mL。此水样中含氰化合 物的含量为 mg·L-1 的(以计,计算结果保留一位小数)。 的(以计,计算结果保留一位小数)。 四、(本题包括 2 小题,共 18 分) 16.(8 分)根据下列框图回答问题(答题时,方程式中的 M、E 用所对应的元素符号表 示): KOH Cl2 H2SO4 H2O2 ZK2EO4 MXMMSO4 À¶É«ÈÜÒº ºì É«½ðÊô KOH H2SO4 H2O2 KSCN YEºì É«ÈÜÒº ½ðÊô ⑴写出 M 溶于稀 H2SO4 和 H2O2 混合液的化学方程式: ⑵某同学取 X 的溶液,酸化后加入 KI、淀粉溶液,变为蓝色。写出与上述变化过程相关 。的离子方程式: 、。。⑶写出 Cl2 将 Z 氧化为 K2EO4 的化学方程式: ⑷由 E 制备的 E(C2H5)2 的结构如右图,其中氢原子的化学环境完全相同。 EE但早期人们却错误地认为它的结构为: 。核磁共振法 能够区分这两种结构。在核磁共振氢谱中,正确的结构有 峰,错误的结构有 种峰。 17.(10 分)工业上制备 BaCl2 的工艺流程图如下: 种ÑÎËá Ì¿ ÂËÒº Öؾ§Ê¯¿ó ²ú Îï ½á¾§ ¹ý ÂË Èܽâ ÆøÌå ¸ß Î±ºÉÕ Îü ÊÕ 某研究小组在实验室用重晶石(主要成分 BaSO4)对工业过程进行模拟实验。查表得 ¸ß ΠBaSO4(s) + 4C(s) 4CO(g) + BaS(s) △H1 = 571.2 kJ·mol-1 ①②¸ß ΠBaSO4(s) + 2C(s) 2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1 ⑴气体用过量 NaOH 溶液吸收,得到硫化钠。Na2S 水解的离子方程式为 c(Br-) 。⑵向 BaCl2 溶液中加入 AgNO3 和 KBr,当两种沉淀共存时, =。c(Cl-) [Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10] ¸ß Π⑶反应 C(s) + CO2(g) 2CO(g)的△H2= kJ·mol-1。 ⑷实际生产中必须加入过量的炭,同时还要通入空气,其目的是 ,。五、(本题包括 1 小题,共 10 分) 18.(10 分)“温室效应”是全球关注的环境问题之一。CO2 是目前大气中含量最高的一种 温室气体。因此,控制和治理 CO2 是解决温室效应的有效途径。 ⑴下列措施中,有利于降低大气中 CO2 浓度的有: 。(填字母) b.植树造林,增大植被面积 d.利用太阳能、风能 a.减少化石燃料的使用 c.采用节能技术 ⑵将 CO2 转化成有机物可有效实现碳循环。CO2 转化成有机物的例子很多,如: ¹â ºÏ ×÷Óà ´ß »¯¼Á ¡÷ a.6CO2 + 6H2O C6H12O6 CH3COOH 以上反应中,最节能的是 b.CO2 + 3H2 d.2CO2 + 6H2 CH3OH +H2O ´ß »¯¼Á ¡÷ ´ß »¯¼Á ¡÷ c.CO2 + CH4 CH2==CH2 + 4H2O ,原子利用率最高的是 。⑶文献报道某课题组利用 CO2 催化氢化制甲烷的研究过程如下: ÆøÌå ÊÕ¼¯ ¼ì²â ¼ì²â H2O Ìú ·Û Äø·Û 300¡æ 6h CO2 ÀäÈ´ ¹Ì Ìå ¹ý ÂË ÂËÒº ¼ì²â 反应结束后,气体中检测到 CH4 和 H2,滤液中检测到 HCOOH,固体中检测到镍粉和 Fe3O4。 CH4、HCOOH、H2 的产量和镍粉用量的关系如下图所示(仅改变镍粉用量,其他条件 不变): 研究人员根据实验结果得出结论: HCOOH 是 CO2 转化为 CH4 的中间体, ¢ò ¢ñ 即:CO2 HCOOH CH4 ①写出产生 H2 的反应方程式 。②由图可知,镍粉是 。(填字 母) a.反应的催化剂 b.反应的催化剂 c.反应的催化剂 d.不是催化剂 ③当镍粉用量从 1mmol 增加到 10mmol,反应速率的变化情况是 a.反应Ⅰ的速率增加,反应Ⅱ的速率不变 。(填字母) b.反应Ⅰ的速率不变,反应Ⅱ的速率增加 c.反应ⅠⅡ的速率均不变 d.反应ⅠⅡ的速率均增加,且反应Ⅰ的速率增加得快 e.反应ⅠⅡ的速率均增加,且反应Ⅱ的速率增加得快 f.反应Ⅰ的速率减小,反应Ⅱ的速率增加 六、(本题包括 1 小题,共 12 分) 19.(12 分)布噁布洛芬是一种消炎镇痛的药物。它的工业合成路线如下: H2 HNO3 CH3COOH HO CHCN CH3 HO O2N CHCN CH3 C9H10N2O Pd/C´ß »¯¼Á CAB1£©C2H5OH£¬H+ 2£©µ÷½ÚpH 1£©ÑÎËá HO CHCOOC2H5 CH3 C9H11NO3 2£©µ÷½ÚpH DEH2N Cl CHCOOH Cl COCl N1£©NaOH 2£©H+ CH3 C18H16NO3Cl ßÁठOFG²¼‡f ²¼Âå·Ò 请回答下列问题: ⑴A 长期暴露在空气中会变质,其原因是 。⑵有 A 到 B 的反应通常在低温时进行。温度升高时,多硝基取代副产物会增多。下列二 硝基取代物中,最可能生成的是 。(填字母) OH OH OH OH NO2 O2N NO2 O2N a. b.O N c. d. O N 2NO2 2O2N CH CN CH3 CH CN CH3 CH CN CH3 CH CN CH3 ⑶在 E 的下列同分异构体中,含有手性碳原子的分子是 。(填字母) HO CH2COOCH(CH3)2 HO CH2CHCOOCH3 CH3 a. b. H2N H2N CH3 CH3 HO CCH2COOH CH3 HO CHCHCOOH CH3 c. d. H2N H2N ⑷F 的结构简式 。⑸D 的同分异构体 H 是一种 α-氨基酸,H 可被酸性 KMnO4 溶液氧化成对苯二甲酸,则 H 的结构简式是 。高聚物 L 由 H 通过肽键连接而成,L 的结构简 式是 。七、(本题包括 1 小题,共 10 分) 20.(10 分)将一定量的 SO 和含 0.7mol 氧气的空气(忽略 CO2)放入一定体积的密闭容器 中,550℃时,在催化剂作用下发生反应:2SO2+O2 2SO3(正反应放热)。反应达 到平衡后,将容器中的混合气体通过过量 NaOH 溶液,气体体积减少了 21.28L;再将剩 余气体通过焦性没食子酸的碱性溶液吸收 O2,气体的体积又减少了 5.6L(以上气体体积 均为标准状况下的体积)。(计算结果保留一位小数) 请回答下列问题: (1)判断该反应达到平衡状态的标志是 a.SO2 和 SO3 浓度相等 。(填字母) b.SO2 百分含量保持不变 c.容器中气体的压强不变 d.SO3 的生成速率与 SO2 的消耗速率相等 e.容器中混合气体的密度保持不变 (2)欲提高 SO2 的转化率,下列措施可行的是 。(填字母) b.向装置中再充入 O2 d.生高温度 a.向装置中再充入 N2 c.改变反应的催化剂 (3)求该反应达到平衡时 SO3 的转化率(用百分数表示)。 (4)若将平衡混合气体的 5%通入过量的 BaCl2 溶液,生成沉淀多少克? 八、(本题包括 1小题,共 12分) 下列两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选 择其中一题作答,如果两题全做,则按 A 题评分。 21.(12 分) A. 已知 A、B、C、D、E 都是周期表中前四周期的元素,它们的核电荷数 A<B<C<D< E。其中 A、B、C 是同一周期的非金属元素。化合物 DC 的晶体为离子晶体,D 的二价 阳离子与 C 的阴离子具有相同的电子层结构。AC2 为非极性分子。B、C 的氢化物的沸 点比它们同族相邻周期元素氢化物的沸点高。E 的原子序数为 24,ECl3 能与 B、C 的氢 化物形成六配位的配合物,且两种配体的物质的量之比为 2∶1,三个氯离子位于外界。 请根据以上情况,回答下列问题:(答题时,A、B、C、D、E 用所对应的元素符号表示) (1)A、B、C 的第一电离能由小到大的顺序为 (2)B 的氢化物的分子空间构型是 (3)写出化合物 AC2 的电子式 。。其中心原子采取 杂化。 ;一种由 B、C 组成的化合物与 AC2 互为 等电子体,其化学式为 。(4)E 的核外电子排布式是 ,ECl3 形成的配合物的化学式为 。(5)B 的最高价氧化物对应的水化物的稀溶液与 D 的单质反应时,B 被还原到最低价, 该反应的化学方程式是 B.醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和 1-溴丁烷的反应如下: 。NaBr+H2SO4 R-OH+HBr HBr+NaHSO4 R-Br+H2O ①②可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br—被浓硫酸氧化为 Br2 等。 有关数据列表如下; 乙醇 溴乙烷 1.4604 38.4 正丁醇 0.8098 117.2 1- 溴 丁 1.2758 101.6 烷密/g·cm-3 度0.7893 78.5 沸点/℃ 请回答下列问题: (1)溴乙烷和 1-溴丁烷的制备实验中,下列仪器最不可能用到的是 。(填字母) a.圆底烧瓶 b.量筒 c.锥形瓶 d.布氏漏斗 (2)溴代烃的水溶性 (填“大于”、“等于”或“小于”);其原因是 。(3)将 1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在 层”、“下层”或“不分层”)。 (填“上 (4)制备操作中,加入的浓硫酸必需进行稀释,起目的是 。(填字母) a.减少副产物烯和醚的生成 c.减少 HBr 的挥发 b.减少 Br2 的生成 d.水是反应的催化剂 (5)欲除去溴代烷中的少量杂质 Br2,下列物质中最适合的是 a.NaI b.NaOH c.NaHSO3 d.KCl 。(填字母) ;但在 (6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于 制备 1-溴丁烷时却不能边反应边蒸出产物,其原因是 。2008 年全国高等院校招生统一考试(江苏化学试卷) 答案及解析 一、单项选择题:(本题包括 8 小题,每题 3 分,共 24 分。每小题只有一个选项符合题意) 1.【解析】食品添加剂是用于改善食品品质,延长食品保存期,添加食品营养成分的一类化 学合成或天然物质,所以含有食品添加剂的食物对人体的健康不一定有坏。 答案:B。 2.【解析】选项 A 中要检验溴乙烷中的溴原子,必须先将溴乙烷在 NaOH 溶液中水解,然 后用过量的 HNO3 综合 NaOH 溶液,再加入 AgNO3。选项 B 中 CH3COOH 为弱酸,在离子 方程式中不能改写;选项 C 中离子方程式的得失电子不守恒和电荷不守恒。 答案:D。 3.【解析】选项 A 中 n(Al)=1mol,Cl2 的物质的量不能确定,当 Cl2 的物质的量小于 1.5mol 时,转移的电子数小于 3NA,当 Cl2 的物质的量等于或大于 1.5mol 时,转移的电子数为 1.5mol; V己烷在标准状况下为液体,所以其物质的量不能用 n= 来确定;选项 C 中含有 NA 个分 22. 4子的 CO2 和 O2,其物质的量为 1mol,而不管是 CO2 还是 O2 1mol 中均含有 2mol 的 O,NA 个 CO2 和 O2 的混合气体所含的 O 数为 1mol;选项 D 中 CO32-为弱酸根离子,水解后使得 CO32-的物质的量小于 1mol,CO32-的个数小于 NA。 答案:C。 4.【解析】选项 A 中浓硫酸的浓度下降,是由于浓硫酸具有吸水性,而盐酸浓度的下降是 由于浓盐酸具有挥发性;选项 B 中氯水使红墨水褪色,是由于氯水中含有 HClO,HClO 具 有氧化性,破坏有色物质的结构,而活性炭使红墨水褪色,是由于活性炭具有吸附性,将红 墨水吸附在活性炭的表面;选项 C 中漂白粉和水玻璃均与空气中的 CO2 和 H2O 反应,但漂 白粉反应生成 CaCO3 和 HClO,HClO 分解生成 HCl 和 O2;选项 D 中乙烯、乙炔使溴的四 氯化碳溶液褪色,乙烯和乙炔与 Br2 发生了加成反应,它们的原理相同。 答案:D。 5.【解析】由充电时方程式中的 Cd 和 Ni 的化合价的变化可知,Ni(OH)2 作阳极,电解质溶 液为 KOH,所以电极反应式为:Ni(OH)2-e-+OH-==NiOOH+H2O;Cd(OH)2 作阴极, Cd(OH)2+2e-==Cd+2OH-;充电的过程是将电能转化为化学能,放电时,Cd 作负极,Cd -2e-+ 2OH- == Cd(OH)2,Cd 周围的 c(OH-)下降,OH-向负极移动。 答案:A。 6.【解析】A中收集氨气装置无棉花,(棉花的目的是防止气体对流,在计短的时间内收集 满氨气);B 中右边烧杯中电解质溶液应收硫酸铜,C 是实验中常见检查气密性的装置,C 对; 收集比空气重的气体应该是长进短出故 D 错。 答案:C。 7.【解析】①中 O 和 F 属于同周期元素,氢化物的稳定性:HF>H2O;②中 Na 和 Mg 为第 三周期元素,原子半径:Na>Mg,而 Mg 比 O 多一个电子层,所以 Mg>O;③P、S、Cl 属于同周期元素,其酸性:HClO4>H2SO4>H3PO4。 答案:B。 8.【解析】选项 A 中使酚酞溶液呈红色,则溶液必定呈碱性,则 OH-与 Fe3+不能共存;选 项 B 中使紫色的石蕊试液变红的溶液呈酸性,NO3-在酸性溶液中具有强氧化性与 Fe2+不能 共存;选项 C 中 c(H+)=10-12 mol·L-1 的溶液呈碱性,在碱性溶液中,这些离子均能共存; 选项 D 中 HCO3-与 H+不能共存。 答案:C。 二、不定项选择题 9.【解析】苯与溴水分层且苯在上层,乙醇与溴水互溶,四氯化碳与溴水分层且四氯化碳在 下层,可以鉴别,A 可以达到目的;天平的准确度只有 0.1 克,所以不能称取 0.4000g 的 NaOH 固体,故 B 不能达到目的;苯酚与溴水虽然能反应生成不溶于水的三溴苯酚白色沉淀,但 三溴苯酚又溶于苯中,所以 C 不能达到目的,淀粉是胶体可用丁达尔现象检验,故 D 能达 到目的。 答案:B、C。 10.【解析】选项 A 中水为弱电解质,书写离子方程式时不能改写;选项 C 中正确的离子方 程式为: --O-+CO2+H2O 答案:B、D。 -OH+HCO3 。 11.【解析】处于酚羟基的邻对位的 H 原子均可与 Br2 发生取代反应,甲子-CH2-CH=CH2 中含有一个 C=C,所以 1mol 丁香酚可与 2mol 分 Br2 发生反应;选项 B 中丁香酚中含有酚 羟基,能与 FeCl3 发生显色反应;选项 C 中含有 3 个 C=C 和一个 C=O,所以 1mol 的香兰 素可与 4molH2 发生加成反应;选项 D 中和苯环相连接的原子均在同一平面内,-CHO 的 H 和 O 原子也与它共面,所以香兰素分子中至少有 12 个原子共平面。 答案:D。 12.【解析】选项 A 中根据电荷守恒,此关系式正确;选项 B 中 pH 相等,溶液中的 c(OH -)相等,根据酸性越弱,水解越强,所以溶液中 c(Na2CO3)<c(CH3COONa);选项 C 中根据 电荷守恒得: c(H+)+c(Na+)=c(OH-)+c(CH3COO-)……①,由于 c(CH3COOH)=c(CH3COONa),且它们 等体积混合,由原子守恒得:2c(Na+)=c(CH3COO-)+c(CH3COOH)……②,将①×2-②得: c(CH3COO-) +2c(OH-) == 2c(H+) + c(CH3COOH);选项 D 中 NaHA 溶液的 pH=4,溶液呈 酸性,即 c(H+)>c(OH-),同时也可以判断 HA-以电离为主,所以离子浓度的大小顺序是: c(HA-)>c(A2-)>c(H+)>c(H2A)。 答案:A、C。 13.【解析】Fe 在 Cl2 中燃烧的产物与 Fe 和 Cl2 的用量无关,其产物只有 FeCl3。 答案:B。 14.【解析】n(CaCO3)=0.1mol,m(CO2)=4.4g,m(C)=1.2g,m(H2O)=7.1g-4.4g=2.7g, m(H)=0.3g , 所 以 有 机 物 中 含 氧 的 质 量 为 : 31g - 1.2g - 0.3g = 1.6g , 所 以 16g n(O)= =0.1mol,即 n(C)∶n(H)∶n(O)=0.1mol∶0.3mol∶0.1mol=1∶3∶1,选项 A -16g·mol 1中 C、H、O 的原子个数比为 1∶3∶1;选项 B 中的原子个数比为:2∶6∶1;选项 C 中的 原子个数比为:1∶2∶1;选项 D 中甲醇的原子个数比为:1∶4∶1,丙三醇中的原子个数 比为 3∶8∶3,其中甲醇的 H 原子个数大于 3,而丙三醇的 H 原子个数小于 3,满足题意要 求。 答案:A、D。 第二卷(非选择题 共72 分) 三、(本题包括 1 小题,共 10 分) 15.【解析】水样预处理的目的是,将污水中含的氰化合物 HCN、CN-和金属离子的配离子 M(CN)nm-的形式全部转化成 HCN,然后用 NaOH 溶液吸收将 HCN 全部转化为 CN-,很明 显将细导管插入吸收液中是为了充分吸收 HCN,防止气体排到空气中,引起大气污染,但 同时可能产生倒吸现象,为防止倒吸,可以将蒸馏瓶升至比吸收液面要高出很多。如果用盐 酸代替磷酸进行预处理,用 AgNO3 标准溶液滴定时,氯离子也消耗银离子,实验结果将偏 高。 答案:⑴将含氰化合物全部转化为 CN- ⑶防止倒吸 ⑷偏高⑸109.2 四、(本题包括 2 小题,共 18 分) ⑵完全吸收 HCN,防止气体放空气 16.【解析】M 为红色金属且生成蓝色溶液,H2SO4 提供酸性环境,H2O2 做氧化剂,反应的 化学方程式:Cu + H2O2 + H2SO4 == CuSO4 + 2H2O,E 为金属铁,原因是 Y 遇到硫氰化钾 呈红色,X 为铁置换铜后生成了 Fe2+,H2SO4 提供酸性环境,H2O2 做氧化剂,反应的化学方 程式:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O ,Cl2 将 Z 氧化为 K2EO4 的化学方程式:10KOH + E3Cl2 + 2Fe(OH)3 == 2K2FeO4 + 6KCl + 8H2O,错误的结构为: 中有几部份 为环五二烯,有三种等效氢原子,而正确的结构中为大π键,只有一种等效氢原子。 答案:⑴Cu + H2O2 + H2SO4 == CuSO4 + 2H2O ⑵4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O ⑶10KOH + 3Cl2 + 2Fe(OH)3 == 2K2FeO4 + 6KCl + 8H2O ⑷1 2Fe3+ + 2I— == 2Fe2+ + I2 317.【解析】Na2S 水解实际上是二元弱酸根 S2 水解,因分两步,向 BaCl2 溶液中加入 AgNO3 和 KBr , 当 两 种 沉 淀 共 存 时 , 两 种 沉 淀 的 平 衡 体 系 中 银 离 子 浓 度 是 一 样 的 , c(Br-) ¸ß Πc(Cl-) =[Ksp(AgBr) /Ksp(AgCl) =2.7×10-3, 反应 C(s) + CO2(g) 2CO(g)的△H3 等于 △H1 减去△H2。实际生产中必须加入过量的炭,同时还要通入空气,其目的是炭和氧气反 应放热维持反应所需高温来维持反应①②所需热量。 HS- + H2O 答案:⑴S2-+ H2O ⑵2.7×10-3 HS- +OH- H2S +OH-(可不写) ⑶172.5 ⑷使 BaSO4 得到充分的还原(或提高 BaS 的产量) ①②为吸热反应,炭和氧气反应放热维持反应所需高温 五、(本题包括 1 小题,共 10 分) 18.【解析】控制和治理 CO2 是解决温室效应的有效途径可以控制源头,也可以吸收大气中 CO2,光合作用利用了太阳能为最节能,反应物中的原子全部转化为有机物,为原子利用率 300¡æ 最高。由反应原料为铁和水,故 3Fe+4H2O Fe3O4+2H2,使用催化剂可加快反应速率, 根据 CH4、HCOOH、H2 的产量和镍粉用量的关系图可知,反应Ⅱ的速率均增加得快。 300¡æ 答案:⑴abcd ⑵a c⑶①3Fe+4H2O Fe3O4+2H2 ②c ③e 六、(本题包括 1 小题,共 12 分) 19.【解析】⑴A 中含有酚羟基,属于酚类化合物。暴露在空气中变质的原因是因为其被空 气中的 O2 氧化了;⑵由 A 到 B 的反应其实就是硝基取代酚类化合物邻、对位上的氢,因此 答案应选(a)。⑶手性碳原子就是该碳原子四条键连有四个不同的原子或原子团。观察备选 答案只能选择(a)、(c)。⑷应该不难确定 F 至 G 的反应属于酯的水解,H+的作用是将羧基 恢复,在此整个反应中碳个数及碳骨架不会改变,因此由 G 的结构即可确定 F 的结构应该 是: CHCOOC2H5 CH3 NOCl ,C 到 D 的过程其实就是—CN 转化为—COOH 的 ,D 的同分异构体 H 既然是一种 α-氨基酸,又 过程,所以,D 应为 可 以 被 酸 性KMnO4 溶 液 氧 化 成 对 苯 二 甲 酸 , 所 以H 的 结 构 简 式 是 只 能 是 : HOCH2 CHCOOH NH2 , 由H 通 过 肽 键 连 接 而 成 的 高 聚 物L 即 可 确 立 为 OCNH CH nCH2OH 。答案:⑴酚类化合物易被空气中的 O2 氧化 ⑵a ⑶ac CHCOOC2H5 NCH3 Cl O⑷OOCHNH CH C OH NH CH nHOCH2 CHCOOH NH2 CH2OH CH2OH ⑸或七、(本题包括 1 小题,共 10 分) 20.【解析】化学平衡是动态平衡,处于平衡状态的化学反应,并没有停止反应,化学平衡 状态的“定”,指的是平衡状态时反应物中各组分的质量分数、物质的量、物质的量分数、 总压强、浓度等保持不变,而平衡时的上述各种量的比较关系取决于多种条件,不一定是相 等的。且平衡状态的正逆反应速率一定相同。向装置中再充入 N2 和改变反应的催化剂,不 能使化学平衡移动,升高温度使化学平衡移动逆向移动, 5.6L 0.7mol 0.45mol 22.4L/ mol 消耗的 O2 物质的量: 。0.45mol 2 0.9mol 21.28L 生成的 SO3 物质的量: 0.95mol 22.4L/ mol SO2 和 SO3 的物质的量和: 0.95mol 反应前的 SO2 物质的量: 0.9mol 100% 94.7% 0.95mol SO2 的转化率: 在给定的条件下,溶液呈强酸性,BaSO3 不会沉淀。因此 BaSO4 的质量 0.9mol 0.05 233g / mol 10.5g 答案:(1)bc (2)b 5.6L 0.7mol 0.45mol 22.4L/ mol (3)消耗的 O2 物质的量: 0.45mol 2 0.9mol 21.28L 生成的 SO3 物质的量: 0.95mol 22.4L/ mol SO2 和 SO3 的物质的量和: 0.95mol 反应前的 SO2 物质的量: 0.9mol 100% 94.7% 0.95mol SO2 的转化率: (4)在给定的条件下,溶液呈强酸性,BaSO3 不会沉淀。因此 BaSO4 的质量 0.9mol 0.05 233g / mol 10.5g 八、(本题包括 1 小题,共 12 分) 21.(12 分) 【解析】A:化合物 DC 的晶体为离子晶体,D 的二价阳离子与 C 的阴离子具有相同的电子层 结构,推知 C 为氧元素,D 为镁元素,AC2 为非极性分应为二氧化碳,A 为碳元素。B、C 的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高,推出 B 氮元素,NH3 分子空间 构型是三角锥形,氮原子 sp3 杂化,E 的原子序数为 24,ECl3 能与 B、C 的氢化物形成六配 位的配合物,且两种配体的物质的量之比为 2∶1,三个氯离子位于外界,E 为铬元素,二 氧化碳分子应满足 8 电子稳定态。 答案: A.(1)C<O<N (4)1s22s22p63s23p63d54s1(或[Ar] 3d54s1) (5)4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O (2)三角锥形 sp3 (3) N2O [Cr(NH3)4(H2O)2]Cl3 【解析】B:布氏漏斗是用来过滤和干燥,醇羟基可与水分子形成氢键,溴代烃分子不能与水 分子形成氢键,溴代烷的密度大于水的密度,浓硫酸会使醇发生脱水而生成烯和醚等副产物, 且浓硫酸有强氧化性,反应过程中能将 HBr 氧化成 Br2,反应过程中浓硫酸会放出大量的热, HBr 易挥发,可减少 HBr 的挥发,欲除去溴代烷中的少量杂质 Br2 应选的适合试剂是可以与 Br2 反应而溴代烷与不反应,该反应是可逆反应,采用边反应边蒸出产物的方法,其有利于 平衡向生成溴乙烷的方向移动。正丁醇和 1-溴丁烷的沸点相接近,会正丁醇将蒸出。 答案: B.(1)d (2)小于;醇分子可与水分子形成氢键,溴代烃分子不能与水分子形成氢键。 (3)下层 (4)abc (5)c (6)平衡向生成溴乙烷的方向移动(或反应②向右移动)
2008年全国高等院校招生统一考试(江苏化学试卷) 可能用到的相对原子质量:H 1C12 N14 O16 Na 23 Mg 24 Al 27 127 S32 Cl 35.5 Ca 40 Fe 56 Cu 64 Br 80 Ag 108 IBa 137 一、单项选择题:(本题包括 8 小题,每题 3 分,共 24 分。每小题只有一个选项符合题意) 1.化学与生活、社会密切相关。下列说法不正确的是 A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 B.凡含有食品添加剂的食物对人体健康均有害,不可食用 C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 D.提倡人们购物时不用塑料袋,是为了防止白色污染 2.下列文字表述与反应方程式对应且正确的是 A.溴乙烷中滴入 AgNO3 溶液检验其中的溴元素:Br-+Ag+==AgBr↓ B.用醋酸除去水垢:CaCO3 + 2H+==Ca2+ + H2O + CO2↑ C.利用腐蚀法制作印刷线路板:Fe3+ + Cu == Fe2+ + Cu2+ Br + HBr FeBr3 D.实验室用液溴和苯在催化剂作用下制溴苯: + Br2 3.用 NA 表示阿伏加德罗常数的值。下列叙述正确的是 A.常温常压下的 33.6L 氯气与 27g 铝充分反应,转移电子数为 3NA B.标准状况下,22.4L 己烷中共价键数目为 19NA C.由 CO2 和 O2 组成的混合物中共有 NA 个分子,其中的氧原子数为 2NA 2- D.1L 浓度为 1mol·L-1 的 Na2CO3 溶液中含有 NA 个 CO3 4.下列现象或事实可用同一原理解释的是 A.浓硫酸和浓盐酸长期暴露在空气中浓度降低 B.氯水和活性炭使红墨水褪色 C.漂白粉和水玻璃长期暴露在变 质D.乙炔和乙烯使溴的四氯化炭溶液褪色 5.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为 ·Åµç KOH 溶 液 , 其 充 、 放 电 按 下 式 进 行 : Cd + 2NiOOH + 2H2O Cd(OH)2 + ³ä µç 2Ni(OH)2 有关该电池的说法正确的是 A.充电时阳极反应:Ni(OH)2 -e— + OH- == NiOOH + H2O B.充电过程是化学能转化为电能的过程 C.放电时负极附近溶液 的碱性不变 D.放电时电解质溶液中的 OH-向正极移动 6.下列装置或操作能达到实验目的的是 7.下列排列顺序正确的是 ①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O ④结合质子能力:OH->CH3COO->Cl- C.①④ D.②③ ③酸性:H3PO4>H2SO4>HClO4 A.①③ B.②④ 8.在下列溶液中,各组离子一定能够大量共存的是 2- A.使酚酞试液变红的溶液: Na+、Cl-、SO4 、Fe3+ -B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3 、Cl- C. c(H+)=10-12 mol·L-1 的溶液:K+、Ba2+、Cl-、Br- 2- D.碳酸氢钠溶液:K+、SO4 、Cl-、H+ 二、不定项选择题(本题包括 6 小题,每小题 4 分,共 24 分。每小题只有一个或两个选项 符合题意。若正确答案只包括一个选项,多选时,该题为 0 分;若正确答案包括两个选项, 只选一个且正确的得 2 分,选两个且都正确的得满分,但只要选错一个,该小题就为 0 分) 9.以下实验或操作不能达到目的的是 A.用溴水鉴别苯、乙醇、四氯化碳 B.准确称取 0.4000g 的 NaOH 固体配成 1000mL 浓度为 0.01000 mol·L-1 的溶液 C.为除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤 D.用激光笔检验淀粉溶液的丁达尔现象 10.下列离子方程式正确的是 µç½â A.用惰性电极电解饱和氯化钠溶液:2Cl- + 2H+ H2↑+ Cl2↑ B.用银氨溶液检验乙醛中的醛基: ˮԡ¼ÓÈÈ CH3CHO +2Ag(NH3)2+ + 2OH- CH3COO- + NH4+ +3NH3 + 3Ag↓+ H2O 2- C.苯酚钠溶液中通入少量 CO2:CO2 + H2O + 2C6H5O- 2C6H5OH + 2CO3 2- -2- D.Na2SO3 溶液使酸性 KMnO4 溶液褪色:5SO3 + 6H+ + 2MnO4 == 5SO4 + 2Mn2+ 3H2O 11.香兰素是重要的香料之一,它可由丁香酚经多步反应合成。 OH OH OCH3 OCH3 ¡- ¡- CHO CH2CH CH2 ¶¡ Ïã ·Ó Ïã À¼ËØ 有关上述两种化合物的说法正确的是 A.常温下,1mol 丁香酚只能与 1molBr2 反应 B.丁香酚不能 FeCl3 溶液发生显色反应 C.1mol 香兰素最多能与 3mol 氢气发生加成反应 D.香兰素分子中至少有 12 个原子共平面 12.下列溶液中有关物质的量浓度关系正确的是 A.pH=2 的 HA 溶液与 pH=12 的 MOH 溶液任意比混合: c(H+) + c(M+) == c(OH-) + c(A-) B.pH 相等的 CH3COONa、NaOH 和 Na2CO3 三种溶液: c(NaOH)<c(CH3COONa)<c(Na2CO3) C.物质的量浓度相等 CH3COOH 和 CH3COONa 溶液等体积混合: c(CH3COO-) +2c(OH-) == 2c(H+) + c(CH3COOH) D.0.1mol·L-1 的 NaHA 溶液,其 pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) 13.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形 象的效果。下列表达不正确的是 12n (C u O ) n (C ) A.密闭容器中 CuO 和 C 高温反应的气体产物: C O C O C O 2 C O 2 11 .5 n (C l2) n (F e) B.Fe 在 Cl2 中的燃烧产物: F eC l2 F eC l3 F eC l2 F eC l3 3Al(OH)3 Al3+ 4n(NaOH) n(AlCl3) -Al(OH)3 AlO2 C.AlCl3 溶液中滴加 NaOH 后铝的存在形式: -AlO2 21n(NH3 H2O) n(SO2) D.氨水与 SO2 反应后溶液中的铵盐: NH HSO NH4HSO4 (NH ) SO4 4244(NH ) SO4 4214.某有机样品 3.1g 完全燃烧,燃烧后的混合物通入过量的澄清石灰水,石灰水共增重 7.1g,经过滤得到 10g 沉淀。该有机样品可能是 A.乙二醇 B.乙醇 C.乙醛 D.甲醇和丙三醇的混合物 第二卷(非选择题 共72 分) 三、(本题包括 1 小题,共 10 分) 15.(10 分)金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以 HCN、CN -和金属离子的配离子 M(CN)nm-的形式存在于水中。测定污水中含氰化合物含 量的实验步骤如下: ①水样预处理:水样中加入磷酸和 EDTA,在 pH<2 的条件下加热蒸馏,蒸出所有的 HCN, 并用 NaOH 溶液吸收。 ②滴定:将吸收液调节至 pH>11,以试银灵作指示剂,用 AgNO3 标准溶液滴定 Ag++2CN – == [Ag(CN)2] – 终点时,溶液由黄色变成橙红色。 根据以上知识回答下列问题: ⑴水样预处理的目的是 。⑵水样预处理的装置如右图,细导管插入吸收液中是为了 。⑶蒸馏瓶比吸收液面要高出很多,其目的是 ⑷如果用盐酸代替磷酸进行预处理,实验结果将 “偏高”、“无影响”或“偏低”)。 。(填 ⑸ 准 确 移 取 某 工 厂 污 水100mL ,经 处 理 后 用 浓 度 为 0.01000mol·L-1 的硝酸银标准溶液滴定,终点时消耗了 21.00mL。此水样中含氰化合 物的含量为 mg·L-1 的(以计,计算结果保留一位小数)。 的(以计,计算结果保留一位小数)。 四、(本题包括 2 小题,共 18 分) 16.(8 分)根据下列框图回答问题(答题时,方程式中的 M、E 用所对应的元素符号表 示): KOH Cl2 H2SO4 H2O2 ZK2EO4 MXMMSO4 À¶É«ÈÜÒº ºì É«½ðÊô KOH H2SO4 H2O2 KSCN YEºì É«ÈÜÒº ½ðÊô ⑴写出 M 溶于稀 H2SO4 和 H2O2 混合液的化学方程式: ⑵某同学取 X 的溶液,酸化后加入 KI、淀粉溶液,变为蓝色。写出与上述变化过程相关 。的离子方程式: 、。。⑶写出 Cl2 将 Z 氧化为 K2EO4 的化学方程式: ⑷由 E 制备的 E(C2H5)2 的结构如右图,其中氢原子的化学环境完全相同。 EE但早期人们却错误地认为它的结构为: 。核磁共振法 能够区分这两种结构。在核磁共振氢谱中,正确的结构有 峰,错误的结构有 种峰。 17.(10 分)工业上制备 BaCl2 的工艺流程图如下: 种ÑÎËá Ì¿ ÂËÒº Öؾ§Ê¯¿ó ²ú Îï ½á¾§ ¹ý ÂË Èܽâ ÆøÌå ¸ß Î±ºÉÕ Îü ÊÕ 某研究小组在实验室用重晶石(主要成分 BaSO4)对工业过程进行模拟实验。查表得 ¸ß ΠBaSO4(s) + 4C(s) 4CO(g) + BaS(s) △H1 = 571.2 kJ·mol-1 ①②¸ß ΠBaSO4(s) + 2C(s) 2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1 ⑴气体用过量 NaOH 溶液吸收,得到硫化钠。Na2S 水解的离子方程式为 c(Br-) 。⑵向 BaCl2 溶液中加入 AgNO3 和 KBr,当两种沉淀共存时, =。c(Cl-) [Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10] ¸ß Π⑶反应 C(s) + CO2(g) 2CO(g)的△H2= kJ·mol-1。 ⑷实际生产中必须加入过量的炭,同时还要通入空气,其目的是 ,。五、(本题包括 1 小题,共 10 分) 18.(10 分)“温室效应”是全球关注的环境问题之一。CO2 是目前大气中含量最高的一种 温室气体。因此,控制和治理 CO2 是解决温室效应的有效途径。 ⑴下列措施中,有利于降低大气中 CO2 浓度的有: 。(填字母) b.植树造林,增大植被面积 d.利用太阳能、风能 a.减少化石燃料的使用 c.采用节能技术 ⑵将 CO2 转化成有机物可有效实现碳循环。CO2 转化成有机物的例子很多,如: ¹â ºÏ ×÷Óà ´ß »¯¼Á ¡÷ a.6CO2 + 6H2O C6H12O6 CH3COOH 以上反应中,最节能的是 b.CO2 + 3H2 d.2CO2 + 6H2 CH3OH +H2O ´ß »¯¼Á ¡÷ ´ß »¯¼Á ¡÷ c.CO2 + CH4 CH2==CH2 + 4H2O ,原子利用率最高的是 。⑶文献报道某课题组利用 CO2 催化氢化制甲烷的研究过程如下: ÆøÌå ÊÕ¼¯ ¼ì²â ¼ì²â H2O Ìú ·Û Äø·Û 300¡æ 6h CO2 ÀäÈ´ ¹Ì Ìå ¹ý ÂË ÂËÒº ¼ì²â 反应结束后,气体中检测到 CH4 和 H2,滤液中检测到 HCOOH,固体中检测到镍粉和 Fe3O4。 CH4、HCOOH、H2 的产量和镍粉用量的关系如下图所示(仅改变镍粉用量,其他条件 不变): 研究人员根据实验结果得出结论: HCOOH 是 CO2 转化为 CH4 的中间体, ¢ò ¢ñ 即:CO2 HCOOH CH4 ①写出产生 H2 的反应方程式 。②由图可知,镍粉是 。(填字 母) a.反应的催化剂 b.反应的催化剂 c.反应的催化剂 d.不是催化剂 ③当镍粉用量从 1mmol 增加到 10mmol,反应速率的变化情况是 a.反应Ⅰ的速率增加,反应Ⅱ的速率不变 。(填字母) b.反应Ⅰ的速率不变,反应Ⅱ的速率增加 c.反应ⅠⅡ的速率均不变 d.反应ⅠⅡ的速率均增加,且反应Ⅰ的速率增加得快 e.反应ⅠⅡ的速率均增加,且反应Ⅱ的速率增加得快 f.反应Ⅰ的速率减小,反应Ⅱ的速率增加 六、(本题包括 1 小题,共 12 分) 19.(12 分)布噁布洛芬是一种消炎镇痛的药物。它的工业合成路线如下: H2 HNO3 CH3COOH HO CHCN CH3 HO O2N CHCN CH3 C9H10N2O Pd/C´ß »¯¼Á CAB1£©C2H5OH£¬H+ 2£©µ÷½ÚpH 1£©ÑÎËá HO CHCOOC2H5 CH3 C9H11NO3 2£©µ÷½ÚpH DEH2N Cl CHCOOH Cl COCl N1£©NaOH 2£©H+ CH3 C18H16NO3Cl ßÁठOFG²¼‡f ²¼Âå·Ò 请回答下列问题: ⑴A 长期暴露在空气中会变质,其原因是 。⑵有 A 到 B 的反应通常在低温时进行。温度升高时,多硝基取代副产物会增多。下列二 硝基取代物中,最可能生成的是 。(填字母) OH OH OH OH NO2 O2N NO2 O2N a. b.O N c. d. O N 2NO2 2O2N CH CN CH3 CH CN CH3 CH CN CH3 CH CN CH3 ⑶在 E 的下列同分异构体中,含有手性碳原子的分子是 。(填字母) HO CH2COOCH(CH3)2 HO CH2CHCOOCH3 CH3 a. b. H2N H2N CH3 CH3 HO CCH2COOH CH3 HO CHCHCOOH CH3 c. d. H2N H2N ⑷F 的结构简式 。⑸D 的同分异构体 H 是一种 α-氨基酸,H 可被酸性 KMnO4 溶液氧化成对苯二甲酸,则 H 的结构简式是 。高聚物 L 由 H 通过肽键连接而成,L 的结构简 式是 。七、(本题包括 1 小题,共 10 分) 20.(10 分)将一定量的 SO 和含 0.7mol 氧气的空气(忽略 CO2)放入一定体积的密闭容器 中,550℃时,在催化剂作用下发生反应:2SO2+O2 2SO3(正反应放热)。反应达 到平衡后,将容器中的混合气体通过过量 NaOH 溶液,气体体积减少了 21.28L;再将剩 余气体通过焦性没食子酸的碱性溶液吸收 O2,气体的体积又减少了 5.6L(以上气体体积 均为标准状况下的体积)。(计算结果保留一位小数) 请回答下列问题: (1)判断该反应达到平衡状态的标志是 a.SO2 和 SO3 浓度相等 。(填字母) b.SO2 百分含量保持不变 c.容器中气体的压强不变 d.SO3 的生成速率与 SO2 的消耗速率相等 e.容器中混合气体的密度保持不变 (2)欲提高 SO2 的转化率,下列措施可行的是 。(填字母) b.向装置中再充入 O2 d.生高温度 a.向装置中再充入 N2 c.改变反应的催化剂 (3)求该反应达到平衡时 SO3 的转化率(用百分数表示)。 (4)若将平衡混合气体的 5%通入过量的 BaCl2 溶液,生成沉淀多少克? 八、(本题包括 1小题,共 12分) 下列两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选 择其中一题作答,如果两题全做,则按 A 题评分。 21.(12 分) A. 已知 A、B、C、D、E 都是周期表中前四周期的元素,它们的核电荷数 A<B<C<D< E。其中 A、B、C 是同一周期的非金属元素。化合物 DC 的晶体为离子晶体,D 的二价 阳离子与 C 的阴离子具有相同的电子层结构。AC2 为非极性分子。B、C 的氢化物的沸 点比它们同族相邻周期元素氢化物的沸点高。E 的原子序数为 24,ECl3 能与 B、C 的氢 化物形成六配位的配合物,且两种配体的物质的量之比为 2∶1,三个氯离子位于外界。 请根据以上情况,回答下列问题:(答题时,A、B、C、D、E 用所对应的元素符号表示) (1)A、B、C 的第一电离能由小到大的顺序为 (2)B 的氢化物的分子空间构型是 (3)写出化合物 AC2 的电子式 。。其中心原子采取 杂化。 ;一种由 B、C 组成的化合物与 AC2 互为 等电子体,其化学式为 。(4)E 的核外电子排布式是 ,ECl3 形成的配合物的化学式为 。(5)B 的最高价氧化物对应的水化物的稀溶液与 D 的单质反应时,B 被还原到最低价, 该反应的化学方程式是 B.醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和 1-溴丁烷的反应如下: 。NaBr+H2SO4 R-OH+HBr HBr+NaHSO4 R-Br+H2O ①②可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br—被浓硫酸氧化为 Br2 等。 有关数据列表如下; 乙醇 溴乙烷 1.4604 38.4 正丁醇 0.8098 117.2 1- 溴 丁 1.2758 101.6 烷密/g·cm-3 度0.7893 78.5 沸点/℃ 请回答下列问题: (1)溴乙烷和 1-溴丁烷的制备实验中,下列仪器最不可能用到的是 。(填字母) a.圆底烧瓶 b.量筒 c.锥形瓶 d.布氏漏斗 (2)溴代烃的水溶性 (填“大于”、“等于”或“小于”);其原因是 。(3)将 1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在 层”、“下层”或“不分层”)。 (填“上 (4)制备操作中,加入的浓硫酸必需进行稀释,起目的是 。(填字母) a.减少副产物烯和醚的生成 c.减少 HBr 的挥发 b.减少 Br2 的生成 d.水是反应的催化剂 (5)欲除去溴代烷中的少量杂质 Br2,下列物质中最适合的是 a.NaI b.NaOH c.NaHSO3 d.KCl 。(填字母) ;但在 (6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于 制备 1-溴丁烷时却不能边反应边蒸出产物,其原因是 。2008 年全国高等院校招生统一考试(江苏化学试卷) 答案及解析 一、单项选择题:(本题包括 8 小题,每题 3 分,共 24 分。每小题只有一个选项符合题意) 1.【解析】食品添加剂是用于改善食品品质,延长食品保存期,添加食品营养成分的一类化 学合成或天然物质,所以含有食品添加剂的食物对人体的健康不一定有坏。 答案:B。 2.【解析】选项 A 中要检验溴乙烷中的溴原子,必须先将溴乙烷在 NaOH 溶液中水解,然 后用过量的 HNO3 综合 NaOH 溶液,再加入 AgNO3。选项 B 中 CH3COOH 为弱酸,在离子 方程式中不能改写;选项 C 中离子方程式的得失电子不守恒和电荷不守恒。 答案:D。 3.【解析】选项 A 中 n(Al)=1mol,Cl2 的物质的量不能确定,当 Cl2 的物质的量小于 1.5mol 时,转移的电子数小于 3NA,当 Cl2 的物质的量等于或大于 1.5mol 时,转移的电子数为 1.5mol; V己烷在标准状况下为液体,所以其物质的量不能用 n= 来确定;选项 C 中含有 NA 个分 22. 4子的 CO2 和 O2,其物质的量为 1mol,而不管是 CO2 还是 O2 1mol 中均含有 2mol 的 O,NA 个 CO2 和 O2 的混合气体所含的 O 数为 1mol;选项 D 中 CO32-为弱酸根离子,水解后使得 CO32-的物质的量小于 1mol,CO32-的个数小于 NA。 答案:C。 4.【解析】选项 A 中浓硫酸的浓度下降,是由于浓硫酸具有吸水性,而盐酸浓度的下降是 由于浓盐酸具有挥发性;选项 B 中氯水使红墨水褪色,是由于氯水中含有 HClO,HClO 具 有氧化性,破坏有色物质的结构,而活性炭使红墨水褪色,是由于活性炭具有吸附性,将红 墨水吸附在活性炭的表面;选项 C 中漂白粉和水玻璃均与空气中的 CO2 和 H2O 反应,但漂 白粉反应生成 CaCO3 和 HClO,HClO 分解生成 HCl 和 O2;选项 D 中乙烯、乙炔使溴的四 氯化碳溶液褪色,乙烯和乙炔与 Br2 发生了加成反应,它们的原理相同。 答案:D。 5.【解析】由充电时方程式中的 Cd 和 Ni 的化合价的变化可知,Ni(OH)2 作阳极,电解质溶 液为 KOH,所以电极反应式为:Ni(OH)2-e-+OH-==NiOOH+H2O;Cd(OH)2 作阴极, Cd(OH)2+2e-==Cd+2OH-;充电的过程是将电能转化为化学能,放电时,Cd 作负极,Cd -2e-+ 2OH- == Cd(OH)2,Cd 周围的 c(OH-)下降,OH-向负极移动。 答案:A。 6.【解析】A中收集氨气装置无棉花,(棉花的目的是防止气体对流,在计短的时间内收集 满氨气);B 中右边烧杯中电解质溶液应收硫酸铜,C 是实验中常见检查气密性的装置,C 对; 收集比空气重的气体应该是长进短出故 D 错。 答案:C。 7.【解析】①中 O 和 F 属于同周期元素,氢化物的稳定性:HF>H2O;②中 Na 和 Mg 为第 三周期元素,原子半径:Na>Mg,而 Mg 比 O 多一个电子层,所以 Mg>O;③P、S、Cl 属于同周期元素,其酸性:HClO4>H2SO4>H3PO4。 答案:B。 8.【解析】选项 A 中使酚酞溶液呈红色,则溶液必定呈碱性,则 OH-与 Fe3+不能共存;选 项 B 中使紫色的石蕊试液变红的溶液呈酸性,NO3-在酸性溶液中具有强氧化性与 Fe2+不能 共存;选项 C 中 c(H+)=10-12 mol·L-1 的溶液呈碱性,在碱性溶液中,这些离子均能共存; 选项 D 中 HCO3-与 H+不能共存。 答案:C。 二、不定项选择题 9.【解析】苯与溴水分层且苯在上层,乙醇与溴水互溶,四氯化碳与溴水分层且四氯化碳在 下层,可以鉴别,A 可以达到目的;天平的准确度只有 0.1 克,所以不能称取 0.4000g 的 NaOH 固体,故 B 不能达到目的;苯酚与溴水虽然能反应生成不溶于水的三溴苯酚白色沉淀,但 三溴苯酚又溶于苯中,所以 C 不能达到目的,淀粉是胶体可用丁达尔现象检验,故 D 能达 到目的。 答案:B、C。 10.【解析】选项 A 中水为弱电解质,书写离子方程式时不能改写;选项 C 中正确的离子方 程式为: --O-+CO2+H2O 答案:B、D。 -OH+HCO3 。 11.【解析】处于酚羟基的邻对位的 H 原子均可与 Br2 发生取代反应,甲子-CH2-CH=CH2 中含有一个 C=C,所以 1mol 丁香酚可与 2mol 分 Br2 发生反应;选项 B 中丁香酚中含有酚 羟基,能与 FeCl3 发生显色反应;选项 C 中含有 3 个 C=C 和一个 C=O,所以 1mol 的香兰 素可与 4molH2 发生加成反应;选项 D 中和苯环相连接的原子均在同一平面内,-CHO 的 H 和 O 原子也与它共面,所以香兰素分子中至少有 12 个原子共平面。 答案:D。 12.【解析】选项 A 中根据电荷守恒,此关系式正确;选项 B 中 pH 相等,溶液中的 c(OH -)相等,根据酸性越弱,水解越强,所以溶液中 c(Na2CO3)<c(CH3COONa);选项 C 中根据 电荷守恒得: c(H+)+c(Na+)=c(OH-)+c(CH3COO-)……①,由于 c(CH3COOH)=c(CH3COONa),且它们 等体积混合,由原子守恒得:2c(Na+)=c(CH3COO-)+c(CH3COOH)……②,将①×2-②得: c(CH3COO-) +2c(OH-) == 2c(H+) + c(CH3COOH);选项 D 中 NaHA 溶液的 pH=4,溶液呈 酸性,即 c(H+)>c(OH-),同时也可以判断 HA-以电离为主,所以离子浓度的大小顺序是: c(HA-)>c(A2-)>c(H+)>c(H2A)。 答案:A、C。 13.【解析】Fe 在 Cl2 中燃烧的产物与 Fe 和 Cl2 的用量无关,其产物只有 FeCl3。 答案:B。 14.【解析】n(CaCO3)=0.1mol,m(CO2)=4.4g,m(C)=1.2g,m(H2O)=7.1g-4.4g=2.7g, m(H)=0.3g , 所 以 有 机 物 中 含 氧 的 质 量 为 : 31g - 1.2g - 0.3g = 1.6g , 所 以 16g n(O)= =0.1mol,即 n(C)∶n(H)∶n(O)=0.1mol∶0.3mol∶0.1mol=1∶3∶1,选项 A -16g·mol 1中 C、H、O 的原子个数比为 1∶3∶1;选项 B 中的原子个数比为:2∶6∶1;选项 C 中的 原子个数比为:1∶2∶1;选项 D 中甲醇的原子个数比为:1∶4∶1,丙三醇中的原子个数 比为 3∶8∶3,其中甲醇的 H 原子个数大于 3,而丙三醇的 H 原子个数小于 3,满足题意要 求。 答案:A、D。 第二卷(非选择题 共72 分) 三、(本题包括 1 小题,共 10 分) 15.【解析】水样预处理的目的是,将污水中含的氰化合物 HCN、CN-和金属离子的配离子 M(CN)nm-的形式全部转化成 HCN,然后用 NaOH 溶液吸收将 HCN 全部转化为 CN-,很明 显将细导管插入吸收液中是为了充分吸收 HCN,防止气体排到空气中,引起大气污染,但 同时可能产生倒吸现象,为防止倒吸,可以将蒸馏瓶升至比吸收液面要高出很多。如果用盐 酸代替磷酸进行预处理,用 AgNO3 标准溶液滴定时,氯离子也消耗银离子,实验结果将偏 高。 答案:⑴将含氰化合物全部转化为 CN- ⑶防止倒吸 ⑷偏高⑸109.2 四、(本题包括 2 小题,共 18 分) ⑵完全吸收 HCN,防止气体放空气 16.【解析】M 为红色金属且生成蓝色溶液,H2SO4 提供酸性环境,H2O2 做氧化剂,反应的 化学方程式:Cu + H2O2 + H2SO4 == CuSO4 + 2H2O,E 为金属铁,原因是 Y 遇到硫氰化钾 呈红色,X 为铁置换铜后生成了 Fe2+,H2SO4 提供酸性环境,H2O2 做氧化剂,反应的化学方 程式:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O ,Cl2 将 Z 氧化为 K2EO4 的化学方程式:10KOH + E3Cl2 + 2Fe(OH)3 == 2K2FeO4 + 6KCl + 8H2O,错误的结构为: 中有几部份 为环五二烯,有三种等效氢原子,而正确的结构中为大π键,只有一种等效氢原子。 答案:⑴Cu + H2O2 + H2SO4 == CuSO4 + 2H2O ⑵4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O ⑶10KOH + 3Cl2 + 2Fe(OH)3 == 2K2FeO4 + 6KCl + 8H2O ⑷1 2Fe3+ + 2I— == 2Fe2+ + I2 317.【解析】Na2S 水解实际上是二元弱酸根 S2 水解,因分两步,向 BaCl2 溶液中加入 AgNO3 和 KBr , 当 两 种 沉 淀 共 存 时 , 两 种 沉 淀 的 平 衡 体 系 中 银 离 子 浓 度 是 一 样 的 , c(Br-) ¸ß Πc(Cl-) =[Ksp(AgBr) /Ksp(AgCl) =2.7×10-3, 反应 C(s) + CO2(g) 2CO(g)的△H3 等于 △H1 减去△H2。实际生产中必须加入过量的炭,同时还要通入空气,其目的是炭和氧气反 应放热维持反应所需高温来维持反应①②所需热量。 HS- + H2O 答案:⑴S2-+ H2O ⑵2.7×10-3 HS- +OH- H2S +OH-(可不写) ⑶172.5 ⑷使 BaSO4 得到充分的还原(或提高 BaS 的产量) ①②为吸热反应,炭和氧气反应放热维持反应所需高温 五、(本题包括 1 小题,共 10 分) 18.【解析】控制和治理 CO2 是解决温室效应的有效途径可以控制源头,也可以吸收大气中 CO2,光合作用利用了太阳能为最节能,反应物中的原子全部转化为有机物,为原子利用率 300¡æ 最高。由反应原料为铁和水,故 3Fe+4H2O Fe3O4+2H2,使用催化剂可加快反应速率, 根据 CH4、HCOOH、H2 的产量和镍粉用量的关系图可知,反应Ⅱ的速率均增加得快。 300¡æ 答案:⑴abcd ⑵a c⑶①3Fe+4H2O Fe3O4+2H2 ②c ③e 六、(本题包括 1 小题,共 12 分) 19.【解析】⑴A 中含有酚羟基,属于酚类化合物。暴露在空气中变质的原因是因为其被空 气中的 O2 氧化了;⑵由 A 到 B 的反应其实就是硝基取代酚类化合物邻、对位上的氢,因此 答案应选(a)。⑶手性碳原子就是该碳原子四条键连有四个不同的原子或原子团。观察备选 答案只能选择(a)、(c)。⑷应该不难确定 F 至 G 的反应属于酯的水解,H+的作用是将羧基 恢复,在此整个反应中碳个数及碳骨架不会改变,因此由 G 的结构即可确定 F 的结构应该 是: CHCOOC2H5 CH3 NOCl ,C 到 D 的过程其实就是—CN 转化为—COOH 的 ,D 的同分异构体 H 既然是一种 α-氨基酸,又 过程,所以,D 应为 可 以 被 酸 性KMnO4 溶 液 氧 化 成 对 苯 二 甲 酸 , 所 以H 的 结 构 简 式 是 只 能 是 : HOCH2 CHCOOH NH2 , 由H 通 过 肽 键 连 接 而 成 的 高 聚 物L 即 可 确 立 为 OCNH CH nCH2OH 。答案:⑴酚类化合物易被空气中的 O2 氧化 ⑵a ⑶ac CHCOOC2H5 NCH3 Cl O⑷OOCHNH CH C OH NH CH nHOCH2 CHCOOH NH2 CH2OH CH2OH ⑸或七、(本题包括 1 小题,共 10 分) 20.【解析】化学平衡是动态平衡,处于平衡状态的化学反应,并没有停止反应,化学平衡 状态的“定”,指的是平衡状态时反应物中各组分的质量分数、物质的量、物质的量分数、 总压强、浓度等保持不变,而平衡时的上述各种量的比较关系取决于多种条件,不一定是相 等的。且平衡状态的正逆反应速率一定相同。向装置中再充入 N2 和改变反应的催化剂,不 能使化学平衡移动,升高温度使化学平衡移动逆向移动, 5.6L 0.7mol 0.45mol 22.4L/ mol 消耗的 O2 物质的量: 。0.45mol 2 0.9mol 21.28L 生成的 SO3 物质的量: 0.95mol 22.4L/ mol SO2 和 SO3 的物质的量和: 0.95mol 反应前的 SO2 物质的量: 0.9mol 100% 94.7% 0.95mol SO2 的转化率: 在给定的条件下,溶液呈强酸性,BaSO3 不会沉淀。因此 BaSO4 的质量 0.9mol 0.05 233g / mol 10.5g 答案:(1)bc (2)b 5.6L 0.7mol 0.45mol 22.4L/ mol (3)消耗的 O2 物质的量: 0.45mol 2 0.9mol 21.28L 生成的 SO3 物质的量: 0.95mol 22.4L/ mol SO2 和 SO3 的物质的量和: 0.95mol 反应前的 SO2 物质的量: 0.9mol 100% 94.7% 0.95mol SO2 的转化率: (4)在给定的条件下,溶液呈强酸性,BaSO3 不会沉淀。因此 BaSO4 的质量 0.9mol 0.05 233g / mol 10.5g 八、(本题包括 1 小题,共 12 分) 21.(12 分) 【解析】A:化合物 DC 的晶体为离子晶体,D 的二价阳离子与 C 的阴离子具有相同的电子层 结构,推知 C 为氧元素,D 为镁元素,AC2 为非极性分应为二氧化碳,A 为碳元素。B、C 的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高,推出 B 氮元素,NH3 分子空间 构型是三角锥形,氮原子 sp3 杂化,E 的原子序数为 24,ECl3 能与 B、C 的氢化物形成六配 位的配合物,且两种配体的物质的量之比为 2∶1,三个氯离子位于外界,E 为铬元素,二 氧化碳分子应满足 8 电子稳定态。 答案: A.(1)C<O<N (4)1s22s22p63s23p63d54s1(或[Ar] 3d54s1) (5)4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O (2)三角锥形 sp3 (3) N2O [Cr(NH3)4(H2O)2]Cl3 【解析】B:布氏漏斗是用来过滤和干燥,醇羟基可与水分子形成氢键,溴代烃分子不能与水 分子形成氢键,溴代烷的密度大于水的密度,浓硫酸会使醇发生脱水而生成烯和醚等副产物, 且浓硫酸有强氧化性,反应过程中能将 HBr 氧化成 Br2,反应过程中浓硫酸会放出大量的热, HBr 易挥发,可减少 HBr 的挥发,欲除去溴代烷中的少量杂质 Br2 应选的适合试剂是可以与 Br2 反应而溴代烷与不反应,该反应是可逆反应,采用边反应边蒸出产物的方法,其有利于 平衡向生成溴乙烷的方向移动。正丁醇和 1-溴丁烷的沸点相接近,会正丁醇将蒸出。 答案: B.(1)d (2)小于;醇分子可与水分子形成氢键,溴代烃分子不能与水分子形成氢键。 (3)下层 (4)abc (5)c (6)平衡向生成溴乙烷的方向移动(或反应②向右移动)
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





