

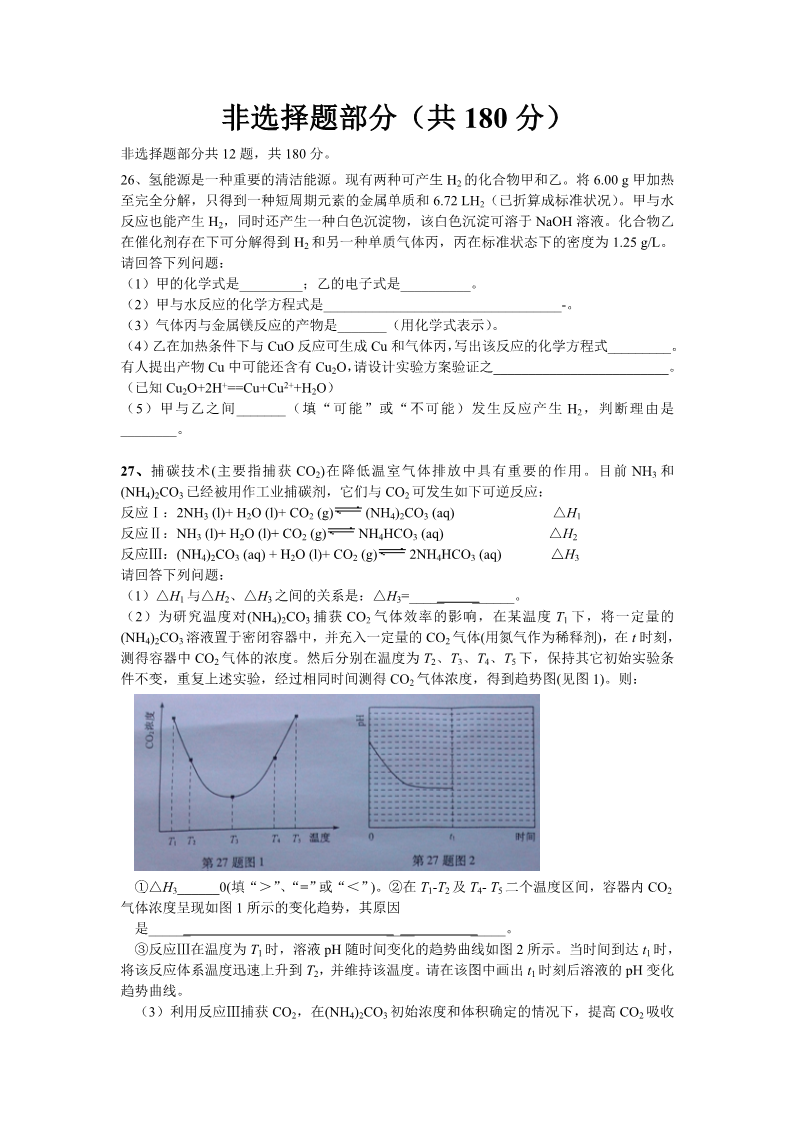
 2013 年普通高等学校招生全国统一考试 浙江理科综合能力测试 一、选择题(本题 17小题。在每小题给出的四个选项中,只有一项是符合题目 要求的。) 7.下列说法不正确的是 A.多孔碳可用氢氧燃料电池的电极材料 B.pH 计不能用于酸碱中和滴定终点的判断 ks5u C.科学家发现一种新细菌的 DNA 链中有砷(As)元素,该 As 元素最有可能取代了普通 DNA 链中的 P 元素 D.CH3CH—CH2 和 CO2 反应生成可降解聚合物[ O—CHCH2—O—C ]n,该反应符合绿 OCH3 O化学的原则 8.下列说法正确的是 ks5u A.实验室从海带提取单质碘的方法是:取样 灼烧 溶解 过滤 萃取 B.用乙醇和浓 H2SO4 制备乙烯时,可用水浴加热控制反应的温度 C.氯离子存在时,铝表面的氧化膜易被破坏,因此含盐腌制品不宜直接放在铝制容器 中D.将(NH4)2SO4、CuSO4 溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白 质变性 9.短周期元素 X、Y、Z、W、Q 在元素周期表的位置如表所示,其中 X 元素的原子内层电 子数是最外层电子数的一半,则下列说法正确的是 A.钠与 W 可能形成 Na2W2 化合物 XZYB.由 Z 与 Y 组成的物质在熔融时能导电 C.W 得电子能力比 Q 强 WQD.X 有多种同素异形体,而 Y 不存在同素异形体 10.下列说法正确的是 A.按系统命名法,化合物 的名称是 2,3,5,5-四甲基-4,4-二乙基己烷 B.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 C.苯与甲苯互为同系物,均能使 KMnO4 酸性溶液褪色 OH OH OH …… D.结构片段为 的高聚物,其单体是甲醛和苯酚 …… 11.电解装置如图所示,电解槽内装有 KI 及淀粉溶液,中间用阴离子交换膜隔开。在一定 的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐 变浅。 已知:3I2+6OH—==IO3—+5I—+3H2O 下列说法不正确的是 A.右侧发生的电极方程式:2H2O+2e—==H2↑+2OH— B.电解结束时,右侧溶液中含有 IO3— C.电解槽内发生反应的总化学方程式 KI+3H2O======KIO3+3H2↑ D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变 12.25℃时,用浓度为 0.1000mol/L 的 NaOH 溶液滴定 20.00 mL 浓度均为 0.1000 mol/L 的 三种酸 HX、HY、HZ,滴定曲线如图所示。下列说法正确的是 A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX B.根据滴定曲线,可得 Ka(HY)≈10—5 C.将上述 HX、HY 溶液等体积混合后,用 NaOH 溶液滴定至 HX 恰好完全反应时: c(X—)>c(Y—)>c(OH—)>c(H+) D.HY 与 HZ 混合,达到平衡时:c(H+)= Ka(HY)·c(HY) + c(Z—) +c(OH—) c(Y—) 13.现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合剂,某同学为了确认其成分, 取部分制剂作为试液,设计并完成了如下实验: 焰色反应 观察到黄色火焰(现象 1) 滤液 银氨溶液 无银镜产生(现象 2) NaOH (aq) 水浴加热 试液 NH3·H2O(aq) Na2CO3(aq) 无沉淀(现象 3) 气体 滤液 调节 H+ Na2CO3 (aq) 沉淀物 白色沉淀(现象 4) pH=4 沉淀物 H2O2 溶液 KSCN(aq) 血红色(现象 5) 已知:控制溶液 pH=4 时,Fe(OH)3 沉淀完全,Ca2+、Mg2+不沉淀。 该同学得出的结论正确的是 A.根据现象 1 可推出该试液中含有 Na+ B.根据现象 2 可推出该试液中并不含有葡萄糖酸根 C.根据现象 3 和 4 可推出该试液中含有 Ca2+,但没有 Mg2+ D.根据现象 5 可推出该试液中一定含有 Fe2+ 非选择题部分(共 180 分) 非选择题部分共 12 题,共 180 分。 26、氢能源是一种重要的清洁能源。现有两种可产生 H2 的化合物甲和乙。将 6.00 g 甲加热 至完全分解,只得到一种短周期元素的金属单质和 6.72 LH2(已折算成标准状况)。甲与水 反应也能产生 H2,同时还产生一种白色沉淀物,该白色沉淀可溶于 NaOH 溶液。化合物乙 在催化剂存在下可分解得到 H2 和另一种单质气体丙,丙在标准状态下的密度为 1.25 g/L。 请回答下列问题: (1)甲的化学式是_________;乙的电子式是__________。 (2)甲与水反应的化学方程式是__________________________________-。 (3)气体丙与金属镁反应的产物是_______(用化学式表示)。 (4)乙在加热条件下与 CuO 反应可生成 Cu 和气体丙,写出该反应的化学方程式_________。 有人提出产物 Cu 中可能还含有 Cu2O,请设计实验方案验证之_________________________。 (已知 Cu2O+2H+==Cu+Cu2++H2O) (5)甲与乙之间_______(填“可能”或“不可能)发生反应产生 H2,判断理由是 ________。 27、捕碳技术(主要指捕获 CO2)在降低温室气体排放中具有重要的作用。目前 NH3 和 (NH4)2CO3 已经被用作工业捕碳剂,它们与 CO2 可发生如下可逆反应: 反应Ⅰ:2NH3 (l)+ H2O (l)+ CO2 (g) 反应Ⅱ:NH3 (l)+ H2O (l)+ CO2 (g) (NH4)2CO3 (aq) NH4HCO3 (aq) △H1 △H2 △H3 反应Ⅲ:(NH4)2CO3 (aq) + H2O (l)+ CO2 (g) 2NH4HCO3 (aq) 请回答下列问题: (1)△H1 与△H2、△H3 之间的关系是:△H3=_____ ______。 (2)为研究温度对(NH4)2CO3 捕获 CO2 气体效率的影响,在某温度 T1 下,将一定量的 (NH4)2CO3 溶液置于密闭容器中,并充入一定量的 CO2 气体(用氮气作为稀释剂),在 t 时刻, 测得容器中 CO2 气体的浓度。然后分别在温度为 T2、T3、T4、T5 下,保持其它初始实验条 件不变,重复上述实验,经过相同时间测得 CO2 气体浓度,得到趋势图(见图 1)。则: ①△H3______0(填“>”、“=”或“<”)。②在 T1-T2 及 T4- T5 二个温度区间,容器内 CO2 气体浓度呈现如图 1 所示的变化趋势,其原因 是______ ____ _____。 ③反应Ⅲ在温度为 T1 时,溶液 pH 随时间变化的趋势曲线如图 2 所示。当时间到达 t1 时, 将该反应体系温度迅速上升到 T2,并维持该温度。请在该图中画出 t1 时刻后溶液的 pH 变化 趋势曲线。 (3)利用反应Ⅲ捕获 CO2,在(NH4)2CO3 初始浓度和体积确定的情况下,提高 CO2 吸收 量的措施有_____(写出 2 个)。 (4)下列物质中也可能作为 CO2 捕获剂的是 A.NH4Cl B.Na2CO3 C.HOCH2CH2OH D.HOCH2CH2NH2 28、利用废旧镀锌铁皮可制备磁性 Fe3O4 胶体粒子及副产物 ZnO。制备流程图如下: 调节 pH 溶液 A 废旧 镀锌 铁皮 Zn(OH)2 沉淀 …… ZnO NaOH (aq) △Fe3O4 NaOH (aq) 溶液 B (Fe2+、Fe2+) 调节 pH=1~2 适量 H2O2 稀 H2SO4 不溶物 胶体粒子 △已知:Zn 及其化合物的性质与 Al 及其化合物的性质相似。请回答下列问题: (1)用 NaOH 溶液处理废旧镀锌铁皮的作用有__ A.去除油污 B.溶解镀锌层 C.去除铁锈 D.钝化 _。 (2)调节溶液 A 的 pH 可产生 Zn(OH)2 沉淀,为制得 ZnO,后续操作步骤是___________。 (3)由溶液 B 制得 Fe3O4 胶体粒子的过程中,须持续通 N2,其原因是_______________。 (4)Fe3O4 胶体粒子能否用减压过滤法实现固液分离?_____(填“能”或“不能”),理由 是___________________________。 (5)用重铬酸钾法(一种氧化还原滴定法)可测得产物 Fe3O4 中二价铁含量。若需配制浓度 为 0.01000 mol/L 的 K2Cr2O7 的标准溶液 250 mL,应准确称取______g K2Cr2O7 (保留 4 位有 效数字,已知 MK2Cr2O7==294.0 g/mol)。配制该标准溶液时,下列仪器不必要用到的有_____(用 编号表示)。 ①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管 (6)滴定操作中,如果滴定前装有 K2Cr2O7 标准溶液的滴定管尖嘴部分有气泡,而滴定 结束后气泡消失,则测定结果将_______(填“偏大”、“偏小”或“不变”)。 29、某课题组以苯为主要原料,采取以下路线合成利胆药——柳胺酚。 回答下列问题: Cl2 HCl Fe 试剂 NaOH/H2O ABECDFeCl3 HCl FC7H6O3 C—NH— OOH OH NO2 NH2 柳胺酚 Fe 已知: HCl (1)对于柳胺酚,下列说法正确的是 ks5u A.1 mol 柳胺酚最多可以和 2 mol NaOH 反应 C.可发生水解反应 B.不发生硝化反应 D.可与溴发生取代反应 (2)写出 A B 反应所需的试剂______________。 (3)写出 B C的化学方程式__________________________________。 (4)写出化合物 F 的结构简式_____________________________。 (5)写出同时符合下列条件的 F 的同分异构体的结构简式____________(写出 3 种)。 ①属酚类化合物,且苯环上有三种不同化学环境的氢原子; ②能发生银镜反应 (6)以苯和乙烯为原料可合成聚苯乙烯,请设计合成路线(无机试剂及溶剂任选)。 注:合成路线的书写格式参照如下示例流程图: O2 CH3CH2OH CH3CHO CH3COOCH2CH3 CH3COOH 催化剂 浓 H2SO4 C—OH OOH 2013 年浙江高考化学试卷参考答案 7、B【解析】A 选项:氢氧燃料电池要求电极必须多孔具有很强的吸附能力,并具一定的 催化作用,同时增大气固的接触面积,提高反应速率。C 选项:As 和 P 同主族。甲基环氧 乙烷与二氧化碳在一定条件下反应生成聚碳酸酯,原子利用率达到 100%,生成的聚碳酸酯 易降解生成无毒无害物质,所以此反应符合绿色化学原则。B 选项:pH 计可用于酸碱中和 滴定终点的判断。 8、C【解析】A 选项:实验室从海带提取单质碘缺少了氧化过程,萃取后还要分液。B 选 项:用乙醇和浓 H2SO4 制备乙烯时必须使温度迅速提高至约 170℃,不可能是水浴加热(水 浴加热温度最高只能达到 100℃)。D 选项:蛋白质溶液中加入饱和(NH4)2SO4 溶液发生盐析 (盐析是可逆过程,不破坏蛋白质的生理活性,加水后又溶解),蛋白质溶液中加入 CuSO4 等 重金属盐溶液变性析出(变性是不可逆过程,蛋白质失去了生理活性,加水不再溶解)。C 选项:通常认为是 Cl—替换氧化铝中的 O2—而形成可溶性的氯化物,所以铝表面的氧化膜易 被 Cl—破坏。 9、A【解析】由“X 元素的原子内层电子数是最外层电子数的一半”可推出 X 为 C,因此 Y 为 O,Z 为 Si,W 为 S,Q 为 Cl。A 选项:Na 和 S 可形成类似于 Na2O 2 的 Na2S2。Z 与 Y 组成的物质是 SiO2,SiO2 是原子晶体,熔融时不能导电。C 选项:S 得电子能力比 Cl 弱。D 选项:C、O 元素都能形成多种同素异形体。 10、D【解析】A 选项:题给化合物正确的名称为 2,2,4,5-四甲基-3,3-二乙基己烷。B 选项: 苯甲酸的分子式为 C7H6O2,可将分子式变形为 C6H6·CO2,因此等物质的量的苯和苯甲酸完 全燃烧消耗氧气的量相等。C 选项:苯不能使酸性高锰酸钾溶液褪色。 11、D 【解析】电解的电极反应为:阳极 2I——2e—== I2 3I2+6OH—==IO3—+5I—+3H2O 一段时间后,蓝色变浅 左侧溶液变蓝色 阴离子交换膜 阴极 2H2O+2e—==H2↑+2OH— 向右侧移动 右侧放出氢气 如果用阳离子交换膜代替阴离子交换膜: 电极反应为:阳极 2I——2e—== I2 多余 K+ 通过阳离子交换膜迁移至阴极 阴极 2H2O+2e—==H2↑+2OH— 保证两边溶液呈电中性 12、B【解析】浓度均为 0.1000 mol/L 的三种酸 HX、HY、HZ,根据滴定曲线 0 点三种酸 的 pH 可得到 HZ 是强酸,HY 和 HX 是弱酸,但酸性:HY>HX。因此,同温同浓度时, 三种酸的导电性:HZ>HY>HX。B 选项:当 NaOH 溶液滴加到 10 mL 时,溶液中 c(HY)≈ c(Y—),即 Ka(HY)≈c(H+)=10—pH=10—5。C 选项:用 NaOH 溶液滴定至 HX 恰好完全反应时, HY 早被完全中和,所得溶液是 NaY 和 NaX 混合溶液,但因酸性:HY>HX,即 X—的水解 程度大于 Y—,溶液中 c(Y—)>c(X—)。D 选项:HY 与 HZ 混合,溶液的电荷守恒式为:c(H+)= c(Y—)+ c(Z—) +c(OH—),又根据 HY 的电离平衡常数: c(H+)·c(Y—) Ka(HY)·c(HY) Ka(HY)= 即有:c(Y—)= c(H+) c(HY) Ka(HY)·c(HY) 所以达平衡后:c(H+)= + c(Z—) +c(OH—) c(H+) 13、C【解析】A 选项:因加入了 NaOH (aq)和 Na2CO3(aq),在滤液中引入了 Na+,不能根 据滤液焰色反应的黄色火焰判断试液是否含 Na+。B 选项:试液是葡萄糖酸盐溶液,其中一 定含葡萄糖酸根,葡萄糖能发生银镜反应,葡萄糖酸根不能发生银镜反应。D 选项:溶液加 入 H2O2 后再滴加 KSCN(aq)显血红色,不能证明葡萄糖酸盐试液中是否含 Fe2+。正确的方法是:在 溶液中滴加 KSCN(aq)不显血红色,再滴入滴加 H2O2 显血红色,证明溶液中只含 Fe2+。若此 前各步均没有遇到氧化剂,则可说明葡萄糖酸盐试液中只含 Fe2+。C 选项:根据“控制溶液 pH=4 时,Fe(OH)3 沉淀完全,Ca2+、Mg2+不沉淀”信息,在过滤除去 Fe(OH)3 的滤液中分别 加入 NH3·H2O(aq)和 Na2CO3(aq),加入 NH3·H2O(aq)不产生沉淀说明滤液中不含 Mg2+,加入 Na2CO3 (aq)产生白色沉淀,说明滤液中含 Ca2+。 26、【解析】“单质气体丙在标准状态下的密度为 1.25 g/L”——丙为 N2,化合物乙分解得到 +H2 和 N2,化合物乙为 NH4H,NH4H 有 NH4 和 H—构成的离子化合物。6.00 g 化合物甲分解 得到短周期元素的金属单质和 0.3 molH2,而短周期元素的金属单质的质量为 5.4 g;化合物 甲与水反应生成的白色沉淀可溶于 NaOH 溶液,说明该沉淀可能是 Al(OH)3,进而可判定化 催化剂 △合物甲为 AlH3。涉及的反应为: △a.甲、乙受热分解:2AlH3 =======2Al+3H2↑ b.甲与水反应: 2AlH3+6H2O==2Al(OH)3+6H2↑ 2NH4H=========N2↑+5H2↑ △c.2NH4H+5CuO======5Cu+ N2↑+5H2O d. 化合物甲与乙可能发生的反应:2AlH3+ 2NH4H ======2Al+N2↑+8H2↑ 化合物甲和乙的组成中都含—1价 H,—1价 H 还原性很强,可发生氧化还原反应产生 H2; 且 2Al+3 化合价降低 6,2NH4H 中 8H+1 化合价降低 8,化合价共降低 14;2AlH3 中 6H—1 和 2NH4H 中 2H—化合价升高 8,2NH4H 中 2N—3 化合价升高 6,化合价共升高 14。 NH4H 电子式: 第(4)题的实验设计是 1992 年全国高考题的再现:Cu+在酸性溶液中不稳定,可发生自 身氧化还原反应生成 Cu2+和 Cu。现有浓硫酸、浓硝酸、稀硫酸、稀硝酸、FeCl3 稀溶液及 pH 试纸,而没有其它试剂。简述如何用最简便的实验方法来检验 CuO 经氢气还原所得到的红 色产物中是否含有碱性氧化物 Cu2O。 实验方案设计的关键是 Cu2O 溶解而 Cu 不溶解:①Cu2O 为碱性氧化物;②不能选用具有 强氧化性的试剂,否则 Cu 被氧化为 Cu2+。 实验方案设计的表述:简述操作步骤,复述实验现象,根据现象作出判断。 【答案】取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,证明产物 Cu 中含 有 Cu2O;若溶液不变蓝色,证明产物 Cu 中不含 Cu2O。 27.【解析】(1)将反应Ⅰ倒过来书写: (NH4)2CO3 (aq) 2NH3 (l)+ H2O (l)+ CO2 (g) —△H1 将反应Ⅱ×2: +) 2NH3 (l)+ 2H2O (l)+ 2CO2 (g) 2NH4HCO3 (aq) 2NH4HCO3 (aq) 2△H2 得:(NH4)2CO3 (aq) + H2O (l)+ CO2 (g) △H3 =2△H2—△H1 (2)由图 1 可知:在温度为 T3 时反应达平衡,此后温度升高,c(CO2)增大,平衡 逆向移动,说明反应Ⅲ是放热反应(△H3<0)。在 T3 前反应未建立平 衡,无论在什么温度下(NH4)2CO3 (aq)总是捕获 CO2,故 c(CO2)减小。 反应Ⅲ在温度为 T1 时建立平衡后(由图 2 可知:溶液 pH 不随 时间变化而变化),迅速上升到 T2 并维持温度不变,平衡逆向移动,溶 液 pH 增大,在 T2 时又建立新的平衡。 (3)根据平衡移动原理,降低温度或增大 c(CO2) (4)具有碱性的物质均能捕获 CO2,反应如下: Na2CO3 +CO2 +H2O===2NaHCO3 HOCH2CH2NH2 +CO2 +H2O== HOCH2CH2NH3+ HCO3— 【答案】(1)2△H2—△H1 (2)①< ②T1-T2 区间,化学反应未达到平衡,温 度越高,反应速率越快,所以 CO2 被捕获的量随温度的升而提高。T4- T5 区间,化学反应已 到达平衡,由于正反应是放热反应,温度升高,平衡向逆反应方向移动,所以不利于 CO2 的捕获。 ③(3)降低温度;增加 CO2 浓度(或压强) (4)BD 28.【解析】本题以“废旧镀锌铁皮可制备磁性 Fe3O4 胶体粒子及副产物 ZnO”为载体, 考查实验基本操作和技能。涉及标准溶液的配制及滴定的误差分析。试题主要取材于《实验 化学》模块中《镀锌铁皮镀层厚度的测定》。试题难度不大。 【答案】(1)AB (2)抽滤、洗涤、灼烧 (4)不能 (3)防止 Fe2+被氧化 胶体粒子太小,抽滤是透过滤纸 (5)0.7350 (0.01000 mol/L×0.250 L×294.0 g/mol) (6)偏大 ③⑦ 29.【解析】根据合成路线,由柳胺酚的分子结构可逆推出 F 为邻羟基苯甲酸 E 为 HO ,D 为 ,C 为 ,B 为 NO2 NH2 HO Cl NaO NO2 Cl NO2 ,A 为 。柳胺酚分子中含酚羟基——具有酸性、酰胺键(类似于肽键)——发生水解反应。1 mol 柳 胺酚最多可以和 3 mol NaOH 反应,苯环上可以发生硝化反应,苯环上酚羟基邻对位的氢可 以发生溴代反应,1mol 柳胺酚与 Br2 反应最多可以消耗 4 molBr2。 【答案】(1)CD (2)浓硝酸和浓硫酸 (3) H2O O2N Cl + 2NaOH + NaCl+H2O O2N ONa △(4)见解析 (5) HO —CHO HO— —CHO OH HO— —CHO —CHO OH HO OH OH (6) CH2=CH2 催化剂 催化剂 [ CH—CH2] n —CH=CH2 加成脱氢
2013 年普通高等学校招生全国统一考试 浙江理科综合能力测试 一、选择题(本题 17小题。在每小题给出的四个选项中,只有一项是符合题目 要求的。) 7.下列说法不正确的是 A.多孔碳可用氢氧燃料电池的电极材料 B.pH 计不能用于酸碱中和滴定终点的判断 ks5u C.科学家发现一种新细菌的 DNA 链中有砷(As)元素,该 As 元素最有可能取代了普通 DNA 链中的 P 元素 D.CH3CH—CH2 和 CO2 反应生成可降解聚合物[ O—CHCH2—O—C ]n,该反应符合绿 OCH3 O化学的原则 8.下列说法正确的是 ks5u A.实验室从海带提取单质碘的方法是:取样 灼烧 溶解 过滤 萃取 B.用乙醇和浓 H2SO4 制备乙烯时,可用水浴加热控制反应的温度 C.氯离子存在时,铝表面的氧化膜易被破坏,因此含盐腌制品不宜直接放在铝制容器 中D.将(NH4)2SO4、CuSO4 溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白 质变性 9.短周期元素 X、Y、Z、W、Q 在元素周期表的位置如表所示,其中 X 元素的原子内层电 子数是最外层电子数的一半,则下列说法正确的是 A.钠与 W 可能形成 Na2W2 化合物 XZYB.由 Z 与 Y 组成的物质在熔融时能导电 C.W 得电子能力比 Q 强 WQD.X 有多种同素异形体,而 Y 不存在同素异形体 10.下列说法正确的是 A.按系统命名法,化合物 的名称是 2,3,5,5-四甲基-4,4-二乙基己烷 B.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 C.苯与甲苯互为同系物,均能使 KMnO4 酸性溶液褪色 OH OH OH …… D.结构片段为 的高聚物,其单体是甲醛和苯酚 …… 11.电解装置如图所示,电解槽内装有 KI 及淀粉溶液,中间用阴离子交换膜隔开。在一定 的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐 变浅。 已知:3I2+6OH—==IO3—+5I—+3H2O 下列说法不正确的是 A.右侧发生的电极方程式:2H2O+2e—==H2↑+2OH— B.电解结束时,右侧溶液中含有 IO3— C.电解槽内发生反应的总化学方程式 KI+3H2O======KIO3+3H2↑ D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变 12.25℃时,用浓度为 0.1000mol/L 的 NaOH 溶液滴定 20.00 mL 浓度均为 0.1000 mol/L 的 三种酸 HX、HY、HZ,滴定曲线如图所示。下列说法正确的是 A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX B.根据滴定曲线,可得 Ka(HY)≈10—5 C.将上述 HX、HY 溶液等体积混合后,用 NaOH 溶液滴定至 HX 恰好完全反应时: c(X—)>c(Y—)>c(OH—)>c(H+) D.HY 与 HZ 混合,达到平衡时:c(H+)= Ka(HY)·c(HY) + c(Z—) +c(OH—) c(Y—) 13.现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合剂,某同学为了确认其成分, 取部分制剂作为试液,设计并完成了如下实验: 焰色反应 观察到黄色火焰(现象 1) 滤液 银氨溶液 无银镜产生(现象 2) NaOH (aq) 水浴加热 试液 NH3·H2O(aq) Na2CO3(aq) 无沉淀(现象 3) 气体 滤液 调节 H+ Na2CO3 (aq) 沉淀物 白色沉淀(现象 4) pH=4 沉淀物 H2O2 溶液 KSCN(aq) 血红色(现象 5) 已知:控制溶液 pH=4 时,Fe(OH)3 沉淀完全,Ca2+、Mg2+不沉淀。 该同学得出的结论正确的是 A.根据现象 1 可推出该试液中含有 Na+ B.根据现象 2 可推出该试液中并不含有葡萄糖酸根 C.根据现象 3 和 4 可推出该试液中含有 Ca2+,但没有 Mg2+ D.根据现象 5 可推出该试液中一定含有 Fe2+ 非选择题部分(共 180 分) 非选择题部分共 12 题,共 180 分。 26、氢能源是一种重要的清洁能源。现有两种可产生 H2 的化合物甲和乙。将 6.00 g 甲加热 至完全分解,只得到一种短周期元素的金属单质和 6.72 LH2(已折算成标准状况)。甲与水 反应也能产生 H2,同时还产生一种白色沉淀物,该白色沉淀可溶于 NaOH 溶液。化合物乙 在催化剂存在下可分解得到 H2 和另一种单质气体丙,丙在标准状态下的密度为 1.25 g/L。 请回答下列问题: (1)甲的化学式是_________;乙的电子式是__________。 (2)甲与水反应的化学方程式是__________________________________-。 (3)气体丙与金属镁反应的产物是_______(用化学式表示)。 (4)乙在加热条件下与 CuO 反应可生成 Cu 和气体丙,写出该反应的化学方程式_________。 有人提出产物 Cu 中可能还含有 Cu2O,请设计实验方案验证之_________________________。 (已知 Cu2O+2H+==Cu+Cu2++H2O) (5)甲与乙之间_______(填“可能”或“不可能)发生反应产生 H2,判断理由是 ________。 27、捕碳技术(主要指捕获 CO2)在降低温室气体排放中具有重要的作用。目前 NH3 和 (NH4)2CO3 已经被用作工业捕碳剂,它们与 CO2 可发生如下可逆反应: 反应Ⅰ:2NH3 (l)+ H2O (l)+ CO2 (g) 反应Ⅱ:NH3 (l)+ H2O (l)+ CO2 (g) (NH4)2CO3 (aq) NH4HCO3 (aq) △H1 △H2 △H3 反应Ⅲ:(NH4)2CO3 (aq) + H2O (l)+ CO2 (g) 2NH4HCO3 (aq) 请回答下列问题: (1)△H1 与△H2、△H3 之间的关系是:△H3=_____ ______。 (2)为研究温度对(NH4)2CO3 捕获 CO2 气体效率的影响,在某温度 T1 下,将一定量的 (NH4)2CO3 溶液置于密闭容器中,并充入一定量的 CO2 气体(用氮气作为稀释剂),在 t 时刻, 测得容器中 CO2 气体的浓度。然后分别在温度为 T2、T3、T4、T5 下,保持其它初始实验条 件不变,重复上述实验,经过相同时间测得 CO2 气体浓度,得到趋势图(见图 1)。则: ①△H3______0(填“>”、“=”或“<”)。②在 T1-T2 及 T4- T5 二个温度区间,容器内 CO2 气体浓度呈现如图 1 所示的变化趋势,其原因 是______ ____ _____。 ③反应Ⅲ在温度为 T1 时,溶液 pH 随时间变化的趋势曲线如图 2 所示。当时间到达 t1 时, 将该反应体系温度迅速上升到 T2,并维持该温度。请在该图中画出 t1 时刻后溶液的 pH 变化 趋势曲线。 (3)利用反应Ⅲ捕获 CO2,在(NH4)2CO3 初始浓度和体积确定的情况下,提高 CO2 吸收 量的措施有_____(写出 2 个)。 (4)下列物质中也可能作为 CO2 捕获剂的是 A.NH4Cl B.Na2CO3 C.HOCH2CH2OH D.HOCH2CH2NH2 28、利用废旧镀锌铁皮可制备磁性 Fe3O4 胶体粒子及副产物 ZnO。制备流程图如下: 调节 pH 溶液 A 废旧 镀锌 铁皮 Zn(OH)2 沉淀 …… ZnO NaOH (aq) △Fe3O4 NaOH (aq) 溶液 B (Fe2+、Fe2+) 调节 pH=1~2 适量 H2O2 稀 H2SO4 不溶物 胶体粒子 △已知:Zn 及其化合物的性质与 Al 及其化合物的性质相似。请回答下列问题: (1)用 NaOH 溶液处理废旧镀锌铁皮的作用有__ A.去除油污 B.溶解镀锌层 C.去除铁锈 D.钝化 _。 (2)调节溶液 A 的 pH 可产生 Zn(OH)2 沉淀,为制得 ZnO,后续操作步骤是___________。 (3)由溶液 B 制得 Fe3O4 胶体粒子的过程中,须持续通 N2,其原因是_______________。 (4)Fe3O4 胶体粒子能否用减压过滤法实现固液分离?_____(填“能”或“不能”),理由 是___________________________。 (5)用重铬酸钾法(一种氧化还原滴定法)可测得产物 Fe3O4 中二价铁含量。若需配制浓度 为 0.01000 mol/L 的 K2Cr2O7 的标准溶液 250 mL,应准确称取______g K2Cr2O7 (保留 4 位有 效数字,已知 MK2Cr2O7==294.0 g/mol)。配制该标准溶液时,下列仪器不必要用到的有_____(用 编号表示)。 ①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管 (6)滴定操作中,如果滴定前装有 K2Cr2O7 标准溶液的滴定管尖嘴部分有气泡,而滴定 结束后气泡消失,则测定结果将_______(填“偏大”、“偏小”或“不变”)。 29、某课题组以苯为主要原料,采取以下路线合成利胆药——柳胺酚。 回答下列问题: Cl2 HCl Fe 试剂 NaOH/H2O ABECDFeCl3 HCl FC7H6O3 C—NH— OOH OH NO2 NH2 柳胺酚 Fe 已知: HCl (1)对于柳胺酚,下列说法正确的是 ks5u A.1 mol 柳胺酚最多可以和 2 mol NaOH 反应 C.可发生水解反应 B.不发生硝化反应 D.可与溴发生取代反应 (2)写出 A B 反应所需的试剂______________。 (3)写出 B C的化学方程式__________________________________。 (4)写出化合物 F 的结构简式_____________________________。 (5)写出同时符合下列条件的 F 的同分异构体的结构简式____________(写出 3 种)。 ①属酚类化合物,且苯环上有三种不同化学环境的氢原子; ②能发生银镜反应 (6)以苯和乙烯为原料可合成聚苯乙烯,请设计合成路线(无机试剂及溶剂任选)。 注:合成路线的书写格式参照如下示例流程图: O2 CH3CH2OH CH3CHO CH3COOCH2CH3 CH3COOH 催化剂 浓 H2SO4 C—OH OOH 2013 年浙江高考化学试卷参考答案 7、B【解析】A 选项:氢氧燃料电池要求电极必须多孔具有很强的吸附能力,并具一定的 催化作用,同时增大气固的接触面积,提高反应速率。C 选项:As 和 P 同主族。甲基环氧 乙烷与二氧化碳在一定条件下反应生成聚碳酸酯,原子利用率达到 100%,生成的聚碳酸酯 易降解生成无毒无害物质,所以此反应符合绿色化学原则。B 选项:pH 计可用于酸碱中和 滴定终点的判断。 8、C【解析】A 选项:实验室从海带提取单质碘缺少了氧化过程,萃取后还要分液。B 选 项:用乙醇和浓 H2SO4 制备乙烯时必须使温度迅速提高至约 170℃,不可能是水浴加热(水 浴加热温度最高只能达到 100℃)。D 选项:蛋白质溶液中加入饱和(NH4)2SO4 溶液发生盐析 (盐析是可逆过程,不破坏蛋白质的生理活性,加水后又溶解),蛋白质溶液中加入 CuSO4 等 重金属盐溶液变性析出(变性是不可逆过程,蛋白质失去了生理活性,加水不再溶解)。C 选项:通常认为是 Cl—替换氧化铝中的 O2—而形成可溶性的氯化物,所以铝表面的氧化膜易 被 Cl—破坏。 9、A【解析】由“X 元素的原子内层电子数是最外层电子数的一半”可推出 X 为 C,因此 Y 为 O,Z 为 Si,W 为 S,Q 为 Cl。A 选项:Na 和 S 可形成类似于 Na2O 2 的 Na2S2。Z 与 Y 组成的物质是 SiO2,SiO2 是原子晶体,熔融时不能导电。C 选项:S 得电子能力比 Cl 弱。D 选项:C、O 元素都能形成多种同素异形体。 10、D【解析】A 选项:题给化合物正确的名称为 2,2,4,5-四甲基-3,3-二乙基己烷。B 选项: 苯甲酸的分子式为 C7H6O2,可将分子式变形为 C6H6·CO2,因此等物质的量的苯和苯甲酸完 全燃烧消耗氧气的量相等。C 选项:苯不能使酸性高锰酸钾溶液褪色。 11、D 【解析】电解的电极反应为:阳极 2I——2e—== I2 3I2+6OH—==IO3—+5I—+3H2O 一段时间后,蓝色变浅 左侧溶液变蓝色 阴离子交换膜 阴极 2H2O+2e—==H2↑+2OH— 向右侧移动 右侧放出氢气 如果用阳离子交换膜代替阴离子交换膜: 电极反应为:阳极 2I——2e—== I2 多余 K+ 通过阳离子交换膜迁移至阴极 阴极 2H2O+2e—==H2↑+2OH— 保证两边溶液呈电中性 12、B【解析】浓度均为 0.1000 mol/L 的三种酸 HX、HY、HZ,根据滴定曲线 0 点三种酸 的 pH 可得到 HZ 是强酸,HY 和 HX 是弱酸,但酸性:HY>HX。因此,同温同浓度时, 三种酸的导电性:HZ>HY>HX。B 选项:当 NaOH 溶液滴加到 10 mL 时,溶液中 c(HY)≈ c(Y—),即 Ka(HY)≈c(H+)=10—pH=10—5。C 选项:用 NaOH 溶液滴定至 HX 恰好完全反应时, HY 早被完全中和,所得溶液是 NaY 和 NaX 混合溶液,但因酸性:HY>HX,即 X—的水解 程度大于 Y—,溶液中 c(Y—)>c(X—)。D 选项:HY 与 HZ 混合,溶液的电荷守恒式为:c(H+)= c(Y—)+ c(Z—) +c(OH—),又根据 HY 的电离平衡常数: c(H+)·c(Y—) Ka(HY)·c(HY) Ka(HY)= 即有:c(Y—)= c(H+) c(HY) Ka(HY)·c(HY) 所以达平衡后:c(H+)= + c(Z—) +c(OH—) c(H+) 13、C【解析】A 选项:因加入了 NaOH (aq)和 Na2CO3(aq),在滤液中引入了 Na+,不能根 据滤液焰色反应的黄色火焰判断试液是否含 Na+。B 选项:试液是葡萄糖酸盐溶液,其中一 定含葡萄糖酸根,葡萄糖能发生银镜反应,葡萄糖酸根不能发生银镜反应。D 选项:溶液加 入 H2O2 后再滴加 KSCN(aq)显血红色,不能证明葡萄糖酸盐试液中是否含 Fe2+。正确的方法是:在 溶液中滴加 KSCN(aq)不显血红色,再滴入滴加 H2O2 显血红色,证明溶液中只含 Fe2+。若此 前各步均没有遇到氧化剂,则可说明葡萄糖酸盐试液中只含 Fe2+。C 选项:根据“控制溶液 pH=4 时,Fe(OH)3 沉淀完全,Ca2+、Mg2+不沉淀”信息,在过滤除去 Fe(OH)3 的滤液中分别 加入 NH3·H2O(aq)和 Na2CO3(aq),加入 NH3·H2O(aq)不产生沉淀说明滤液中不含 Mg2+,加入 Na2CO3 (aq)产生白色沉淀,说明滤液中含 Ca2+。 26、【解析】“单质气体丙在标准状态下的密度为 1.25 g/L”——丙为 N2,化合物乙分解得到 +H2 和 N2,化合物乙为 NH4H,NH4H 有 NH4 和 H—构成的离子化合物。6.00 g 化合物甲分解 得到短周期元素的金属单质和 0.3 molH2,而短周期元素的金属单质的质量为 5.4 g;化合物 甲与水反应生成的白色沉淀可溶于 NaOH 溶液,说明该沉淀可能是 Al(OH)3,进而可判定化 催化剂 △合物甲为 AlH3。涉及的反应为: △a.甲、乙受热分解:2AlH3 =======2Al+3H2↑ b.甲与水反应: 2AlH3+6H2O==2Al(OH)3+6H2↑ 2NH4H=========N2↑+5H2↑ △c.2NH4H+5CuO======5Cu+ N2↑+5H2O d. 化合物甲与乙可能发生的反应:2AlH3+ 2NH4H ======2Al+N2↑+8H2↑ 化合物甲和乙的组成中都含—1价 H,—1价 H 还原性很强,可发生氧化还原反应产生 H2; 且 2Al+3 化合价降低 6,2NH4H 中 8H+1 化合价降低 8,化合价共降低 14;2AlH3 中 6H—1 和 2NH4H 中 2H—化合价升高 8,2NH4H 中 2N—3 化合价升高 6,化合价共升高 14。 NH4H 电子式: 第(4)题的实验设计是 1992 年全国高考题的再现:Cu+在酸性溶液中不稳定,可发生自 身氧化还原反应生成 Cu2+和 Cu。现有浓硫酸、浓硝酸、稀硫酸、稀硝酸、FeCl3 稀溶液及 pH 试纸,而没有其它试剂。简述如何用最简便的实验方法来检验 CuO 经氢气还原所得到的红 色产物中是否含有碱性氧化物 Cu2O。 实验方案设计的关键是 Cu2O 溶解而 Cu 不溶解:①Cu2O 为碱性氧化物;②不能选用具有 强氧化性的试剂,否则 Cu 被氧化为 Cu2+。 实验方案设计的表述:简述操作步骤,复述实验现象,根据现象作出判断。 【答案】取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,证明产物 Cu 中含 有 Cu2O;若溶液不变蓝色,证明产物 Cu 中不含 Cu2O。 27.【解析】(1)将反应Ⅰ倒过来书写: (NH4)2CO3 (aq) 2NH3 (l)+ H2O (l)+ CO2 (g) —△H1 将反应Ⅱ×2: +) 2NH3 (l)+ 2H2O (l)+ 2CO2 (g) 2NH4HCO3 (aq) 2NH4HCO3 (aq) 2△H2 得:(NH4)2CO3 (aq) + H2O (l)+ CO2 (g) △H3 =2△H2—△H1 (2)由图 1 可知:在温度为 T3 时反应达平衡,此后温度升高,c(CO2)增大,平衡 逆向移动,说明反应Ⅲ是放热反应(△H3<0)。在 T3 前反应未建立平 衡,无论在什么温度下(NH4)2CO3 (aq)总是捕获 CO2,故 c(CO2)减小。 反应Ⅲ在温度为 T1 时建立平衡后(由图 2 可知:溶液 pH 不随 时间变化而变化),迅速上升到 T2 并维持温度不变,平衡逆向移动,溶 液 pH 增大,在 T2 时又建立新的平衡。 (3)根据平衡移动原理,降低温度或增大 c(CO2) (4)具有碱性的物质均能捕获 CO2,反应如下: Na2CO3 +CO2 +H2O===2NaHCO3 HOCH2CH2NH2 +CO2 +H2O== HOCH2CH2NH3+ HCO3— 【答案】(1)2△H2—△H1 (2)①< ②T1-T2 区间,化学反应未达到平衡,温 度越高,反应速率越快,所以 CO2 被捕获的量随温度的升而提高。T4- T5 区间,化学反应已 到达平衡,由于正反应是放热反应,温度升高,平衡向逆反应方向移动,所以不利于 CO2 的捕获。 ③(3)降低温度;增加 CO2 浓度(或压强) (4)BD 28.【解析】本题以“废旧镀锌铁皮可制备磁性 Fe3O4 胶体粒子及副产物 ZnO”为载体, 考查实验基本操作和技能。涉及标准溶液的配制及滴定的误差分析。试题主要取材于《实验 化学》模块中《镀锌铁皮镀层厚度的测定》。试题难度不大。 【答案】(1)AB (2)抽滤、洗涤、灼烧 (4)不能 (3)防止 Fe2+被氧化 胶体粒子太小,抽滤是透过滤纸 (5)0.7350 (0.01000 mol/L×0.250 L×294.0 g/mol) (6)偏大 ③⑦ 29.【解析】根据合成路线,由柳胺酚的分子结构可逆推出 F 为邻羟基苯甲酸 E 为 HO ,D 为 ,C 为 ,B 为 NO2 NH2 HO Cl NaO NO2 Cl NO2 ,A 为 。柳胺酚分子中含酚羟基——具有酸性、酰胺键(类似于肽键)——发生水解反应。1 mol 柳 胺酚最多可以和 3 mol NaOH 反应,苯环上可以发生硝化反应,苯环上酚羟基邻对位的氢可 以发生溴代反应,1mol 柳胺酚与 Br2 反应最多可以消耗 4 molBr2。 【答案】(1)CD (2)浓硝酸和浓硫酸 (3) H2O O2N Cl + 2NaOH + NaCl+H2O O2N ONa △(4)见解析 (5) HO —CHO HO— —CHO OH HO— —CHO —CHO OH HO OH OH (6) CH2=CH2 催化剂 催化剂 [ CH—CH2] n —CH=CH2 加成脱氢
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





