

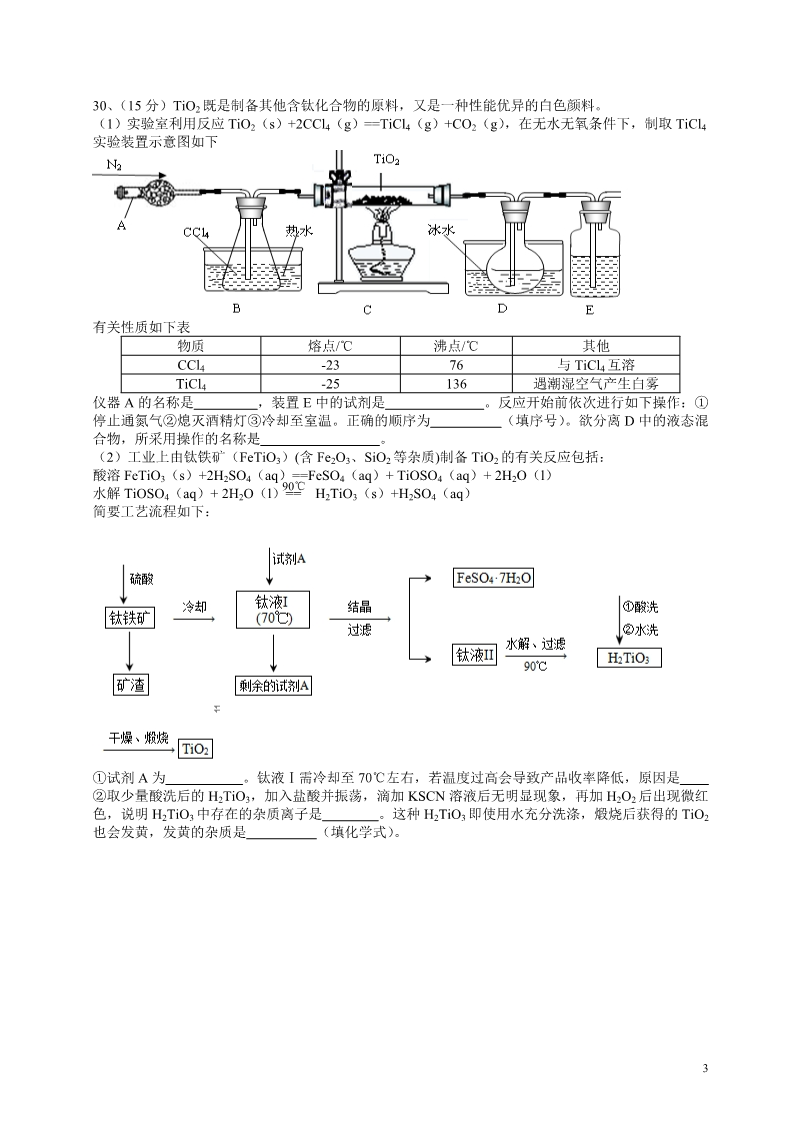
 2013 年普通高等学校招生统一考试(山东卷) 理科综合 第 I 卷(必做,共 87 分) 一、选择题(共 13 小题,每小题 4 分,共 52 分,每题只有一个选项符合题意) 7、化学与生活密切相关,下列说法正确的是( A.聚乙烯塑料的老化是由于发生了加成反应 )B.煤经过气化和液化等物理变化可以转化为清洁燃料 C.合成纤维、人造纤维及碳纤维都属于有机高分子材料 D.利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 8、W、X、Y、Z 四种短周期元素在元素周期表中的相对位置如图所示,W 的气态氢化物可与其最高 价含氧酸反应生成离子化合物,由此可知( )A.X、Y、Z 中最简单氢化物稳定性最弱的是 Y B.Z 元素氧化物对应水化物的酸性一定强于 Y C.X 元素形成的单核阴离子还原性强于 Y D.Z 元素单质在化学反应中只表现氧化性 W X YZ9、足量下列物质与等质量的铝反应,放出氢气且消耗溶质物质的量最少的是( A.氢氧化钠溶液 B.稀硫酸 C.盐酸 D.稀硝酸 )10、莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( A.分子式为 C7H6O5 )B.分子中含有两种官能团 C.可发生加成和取代反应 D.在水溶液中羟基和羧基均能电离出氢离子 11、利用实验器材(规格和数量不限),能完成相应实验的一项是 实验器材(省略夹持装置) 烧杯、玻璃棒、蒸发皿 相应实验 ABCD硫酸铜溶液的浓缩结晶 烧杯、玻璃棒、胶头滴管、滤纸 烧杯、玻璃棒、胶头滴管、容量瓶 用盐酸除去硫酸钡中的少量碳酸钡 用固体氯化钠配制 0.5mol/L 的溶液 烧杯、玻璃棒、胶头滴管、分液漏斗 用溴水和CCl4 除去 NaBr 溶液中的少量 NaI 12、CO(g)+H2O(g) H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下 A.加入催化剂,改变了反应的途径,反应的△H也随之改变( B.改变压强,平衡不发生移动,反应放出的热量不变 C.升高温度,反应速率加快,反应放出的热量不变 D.若在原电池中进行,反应放出的热量不变 )13 、 某 温 度 下 , 向 一 定 体 积0.1mol/L 醋 酸 溶 液 中 逐 滴 加 入 等 浓 度 的NaOH 溶 液 , 溶 液 中 pOH(pOH=-lg[OH-])与 pH 的变化关系如图所示,则( A.M 点所示溶液导电能力强于 Q 点 B.N 点所示溶液中 c(CH3COO-)﹥c(Na+) )C.M 点和 N 点所示溶液中水的电离程度相同 D.Q 点消耗 NaOH 溶液的体积等于醋酸溶液的体积 128、(12 分)金属冶炼和处理常涉及氧化还原反应。 (1)由下列物质冶炼相应金属时采用电解法的是 a.Fe2O3 b.NaCl c.Cu2S d.Al2O3 (2)辉铜矿(Cu2S)可发生反应 2Cu2S+2H2SO4+5O2==4CuSO4+2 H2O,该反应的还原剂是 ,当 1mol O2 发生反应时,还原剂所失电子的物质的量为 加入镁条时有气体生成,该气体是 mol。向 CuSO4 溶液中 (3)右图为电解精炼银的示意图, (填 a 或 b)极为含有杂质的粗银, 若 b 极有少量红棕色气体生成,则生成该气体的电极反应式为 (4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接 触,Ag2S 转化为 Ag,食盐水的作用为 29、(15 分)化学反应原理在科研和生产中有广泛应用 (1)利用“化学蒸气转移法”制备 TaS2 晶体,发生如下反应 TaS2(s)+2I2(g) TaI4(g)+S2(g)△H﹥0 (I) 反应(I)的平衡常数表达式 K= ,若 K=1,向某恒容密闭容器中加入 1mol I2(g)和足 量 TaS2(s),I2(g)的平衡转化率为 (2)如图所示,反应(I)在石英真空管中进行,先在温度为 T2 的 一端放入未提纯的 TaS2 粉末和少量 I2(g),一段时间后,在温度为 T1 的一端得到了纯净的 TaS2 晶体,则温度 T1 “﹤”或“=”)。上述反应体系中循环使用的物质是 T2 (填“﹥” 。(3)利用 I2 的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫 转化为 H2SO3 ,然后用一定浓度的 I2 溶液进行滴定,所用指示剂 为,滴定反应的离子方程式为 -(4)25℃时,H2SO3 常数 Kh= “增大”“减小”或“不变”)。 HSO3 +H+的电离常数 Ka=1×10-2mol/L,则该温度下 NaHSO3 的水解平衡 mol/L,若向 NaHSO3 溶液中加入少量的 I2,则溶液中 将(填 33、(8 分)【化学——有机化学基础】 聚酰胺—66 常用于生产帐篷、渔网、降落伞及弹力丝袜等织物,可利用下列路线合成: (1)能与银氨溶液反应的 B 的同分异构体的结构简式为 (2)D 的结构简式为 ,①的反应类型为 (3)为检验 D 中的官能团,所用试剂包括 NaOH 水溶液及 (4)由 F 和 G 生成 H 的反应方程式为 230、(15 分)TiO2 既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。 (1)实验室利用反应 TiO2(s)+2CCl4(g)==TiCl4(g)+CO2(g),在无水无氧条件下,制取 TiCl4 实验装置示意图如下 有关性质如下表 物质 CCl4 TiCl4 熔点/℃ 沸点/℃ 76 136 其他 -23 -25 与 TiCl4 互溶 遇潮湿空气产生白雾 仪器 A 的名称是 停止通氮气②熄灭酒精灯③冷却至室温。正确的顺序为 合物,所采用操作的名称是 ,装置 E 中的试剂是 。反应开始前依次进行如下操作:① (填序号)。欲分离 D 中的液态混 。(2)工业上由钛铁矿(FeTiO3)(含 Fe2O3、SiO2 等杂质)制备 TiO2 的有关反应包括: 酸溶 FeTiO3(s)+2H2SO4(aq)==FeSO4(aq)+ TiOSO4(aq)+ 2H2O(l) 90℃ 水解 TiOSO4(aq)+ 2H2O(l)== H2TiO3(s)+H2SO4(aq) 简要工艺流程如下: ①试剂 A 为 。钛液Ⅰ需冷却至 70℃左右,若温度过高会导致产品收率降低,原因是 ②取少量酸洗后的 H2TiO3,加入盐酸并振荡,滴加 KSCN 溶液后无明显现象,再加 H2O2 后出现微红 色,说明 H2TiO3 中存在的杂质离子是 也会发黄,发黄的杂质是 。这种 H2TiO3 即使用水充分洗涤,煅烧后获得的 TiO2 (填化学式)。 32013 年普通高等学校招生统一考试(山东卷) 7.解析:聚乙烯塑料的老化是因为被氧化所致,A 选项错;煤的气化是化学变化,B 错;碳纤维是碳 的单质,C 错;用粮食酿酒时,先在糖化酶作用下水解为葡萄糖,然后在酵母作用下转变为酒精,都 是化学变化。D 正确。 答案:D 8.解析:因为 W 的气态氢化物可与其最高价含氧酸生成离子化合物,这指的是铵盐,W 是 N 元素, 则 X、Y、Z 依次是 O、S、Cl。则其氢化物中 H2S 最不稳定,A 正确;只有氯元素的最高价含氧 酸才一定比 Y 的含氧酸酸性强,B 错;阴离子还原性 S2->O2-,C 错;Cl2 与水的反应中既表现氧 化性,也表现了还原性,D 错。 答案:A 9.解析:首先硝酸与金属铝反应不生成氢气,根据生成物的化学式:Na[Al(OH)4]、Al2(SO4)3、AlCl3, 通过物料守恒可直接判断出等量的铝消耗 NaOH 物质的量最少。答案:A 10.解析:根据莽草酸的结构式可确定其分子式为:C7H10O5,需要注意不存在苯环,A 错;有三种官 能团:羧基、羟基、碳碳双键,B 错;碳碳双键可以被加成,羧基、羟基可发生酯化反应,C 正确; 在水溶液中羧基可以电离出 H+,羟基不能发生电离,D 错。 答案:C 11.解析:硫酸铜溶液的浓缩结晶需要用到酒精灯,A 错;用盐酸出去 BaSO4 中的少量 BaCO3 需要进 行过滤,需要用到漏斗,B 错;用固体配制溶液需要用到托盘天平称量固体,C 错;D 中可以先进行 置换反应,然后进行萃取、分液,D 正确。 答案:D 12.解析:催化剂虽然改变了反应途径,但是△H 只取决于反应物、生成物的状态,△H 不变,A 错;这是一个反应前后气体物质的量不变的反应,改变压强,平衡不发生移动, 反应放出的热量也不变,B 正确;该反应是放热反应,升高温度,平衡左移,反应放出的 热量减小,C 错;若在原电池中进行,反应不放出热量,而是 为电能,D 错。 答案:B 转换 13.解析:由于醋酸是弱酸,电离程度很小,离子浓度也较小,M 点溶 导电能力最弱,A 错;N 点所示溶液为碱性,根据溶液电荷守恒易判断出此 (Na+)>c(CH3COO-)B,错;由于 M 点的 H+浓度等于 N 点的 OH-浓度, 液 的 时c对 水 的电离程度抑制能力相同,所以两点水电离程度相同,C 正确;Q 点的 pOH=pH,溶液为中性,而两 者等体积混合后生成醋酸钠,水解显碱性。则所加 NaOH 溶液体积略小于醋酸溶液的体积,D 错。 答案:C 28.解析:(1)NaCl 与 Al2O3 冶炼需要用电解法,Fe2O3 与 Cu2S 可以用热还原法,所以为 b、d。 (2)在该反应中,Cu 元素化合价由+1 升高到+2,S 元素由-2 升高到+6,Cu2S 做还原剂,当有 1molO2 参与反应转移的电子为 4mol,由于 Cu2+水解呈酸性,加入镁条时,镁与 H+反应生成了氢气。 (3)电解精炼时,不纯金属做阳极,这里就是 a 极;b 电极是阴极,发生还原反应,生成了红棕色气 –体是 NO,遇空气氧化生成的 NO2 ,电极反应:NO3 +3e- +4H+ =NO↑+2H2O。或 NO3 +e- +2H+ = NO2↑+H2O (4)做电解质溶液,形成原电池。 答案:(1)bd (2)Cu2S;4;氢气 -(3)a;NO3 +3e-+4H+=NO↑+2H2O (4)做电解质溶液,形成原电池。 c(TaI4) c(S2) [S2][TaI4] 29.解析:(1) 或,通过三行式法列出平衡浓度,带入 K 值可以得出转化率为 c2(I2) [I2]2 466.7%。 (2)由所给方程式可知该反应为吸热反应,通过题意温度 T2 端利于反应正向进行,为高温,温度 T1 端利于反应向左进行,为低温,所以 T1<T2。I2 是可以循环使用的物质. 2- (3)因为 I2 遇到淀粉会变蓝色,所以可以用淀粉溶液作指示剂.离子反应:H2SO3+I2+H2O=4H++SO4 + 2I-. [HSO3 – ]·[H + ] [H2SO3] [H2SO3]·Kw [HSO3 – ]·[H + ] -(4)Ka = ,HSO3 +H2O H2SO3 +OH-,Kb = =1.0×102×1.0×10-14 =[H2SO3] 1.0×10-12,当加入少量 I2 时,溶液酸性增强,[H+]增大,但是温度不变,Kb 不变,则 c(TaI4) c(S2) [S2][TaI4] 增大。 [HSO3 – ]答案:(1) 或,66.7% c2(I2) [I2]2 (2)<,I2 2- (3)淀粉溶液,H2SO3+I2+H2O=4H++SO4 +2I- (4)1.0×10-12,增大 30.解析:(1)仪器 A 是干燥管,因为 TiCl4 遇到水蒸气会水解,所以 E 中可以用浓硫酸来隔离空气。 对于气体的制取性质实验应该:组装仪器、检验气密性、加装药品。。。。。终止实验时为防止倒吸,应 先熄灭酒精灯,冷却到室温后再停止通入 N2。分离两种沸点不同的液体混合物应该用蒸馏。 (2)①因为矿石经硫酸溶解后得到的 Fe2(SO4)3,而后面过滤得到的是 FeSO4·7H2O,所以试剂 A 是铁 粉,把 Fe3+还原为 Fe2+。由于 TiOSO4 容易水解,若温度过高,则会有较多 TiOSO4 水解为固体 H2TiO3 而经过滤进入 FeSO4·7H2O 中导致 TiO2 产率降低。 ②加 KSCN 溶液无现象,加 H2O2 后出现红色,说明存在 Fe2+。经加热后 Fe2+氧化为 Fe2O3 而使产品发 黄。 答案:(1)干燥管;浓硫酸;检查气密性;②③①,蒸馏 (2)①铁粉,由于 TiOSO4 容易水解,若温度过高,则会有较多 TiOSO4 水解为固体 H2TiO3 而经过滤 进入 FeSO4·7H2O 中导致 TiO2 产率降低。 ②Fe2+,Fe2O3 33.解析:A 经 H2 加成得到环丁醚 B,与 HCl 取代得到 C 氯代丁醇,再进行一步取代得 D:丁二醇; 通过反应①取代得到己二腈,结合所给信息可知 F 是己二酸,G 是己二胺,通过缩聚反应得到 H:聚 酰胺-66。 (1) B 分子式是 C4H8O,符合饱和一元醛的通式,可以写出:CH3CH2CH2CHO。 (2) D 是 1,4-二氯丁醇:CH2ClCH2CH2CH2Cl;反应①是取代反应。 (3) 要检验氯代烃中氯元素,应先通过NaOH 溶液水解,然后用 AgNO3 溶液检验 Cl-。 剂催化 ―――→ ——nC C HO[ -(CH2)4 - -NH(CH2)6NH]H +(2n (4) nHOOC(CH2)4COOH+nNH2(CH2)6NH2 -1)H2O 答案:(1)CH3CH2CH2CHO (2)CH2ClCH2CH2CH2Cl;取代反应。 (3)AgNO3 溶液与稀硝酸 剂催化 ―――→ ——nCC(4)nHOOC(CH2)4COOH+nNH2(CH2)6NH2 HO[ -(CH2)4 - -NH(CH2)6NH]H+(2n- 1)H2O 5
2013 年普通高等学校招生统一考试(山东卷) 理科综合 第 I 卷(必做,共 87 分) 一、选择题(共 13 小题,每小题 4 分,共 52 分,每题只有一个选项符合题意) 7、化学与生活密切相关,下列说法正确的是( A.聚乙烯塑料的老化是由于发生了加成反应 )B.煤经过气化和液化等物理变化可以转化为清洁燃料 C.合成纤维、人造纤维及碳纤维都属于有机高分子材料 D.利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 8、W、X、Y、Z 四种短周期元素在元素周期表中的相对位置如图所示,W 的气态氢化物可与其最高 价含氧酸反应生成离子化合物,由此可知( )A.X、Y、Z 中最简单氢化物稳定性最弱的是 Y B.Z 元素氧化物对应水化物的酸性一定强于 Y C.X 元素形成的单核阴离子还原性强于 Y D.Z 元素单质在化学反应中只表现氧化性 W X YZ9、足量下列物质与等质量的铝反应,放出氢气且消耗溶质物质的量最少的是( A.氢氧化钠溶液 B.稀硫酸 C.盐酸 D.稀硝酸 )10、莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( A.分子式为 C7H6O5 )B.分子中含有两种官能团 C.可发生加成和取代反应 D.在水溶液中羟基和羧基均能电离出氢离子 11、利用实验器材(规格和数量不限),能完成相应实验的一项是 实验器材(省略夹持装置) 烧杯、玻璃棒、蒸发皿 相应实验 ABCD硫酸铜溶液的浓缩结晶 烧杯、玻璃棒、胶头滴管、滤纸 烧杯、玻璃棒、胶头滴管、容量瓶 用盐酸除去硫酸钡中的少量碳酸钡 用固体氯化钠配制 0.5mol/L 的溶液 烧杯、玻璃棒、胶头滴管、分液漏斗 用溴水和CCl4 除去 NaBr 溶液中的少量 NaI 12、CO(g)+H2O(g) H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下 A.加入催化剂,改变了反应的途径,反应的△H也随之改变( B.改变压强,平衡不发生移动,反应放出的热量不变 C.升高温度,反应速率加快,反应放出的热量不变 D.若在原电池中进行,反应放出的热量不变 )13 、 某 温 度 下 , 向 一 定 体 积0.1mol/L 醋 酸 溶 液 中 逐 滴 加 入 等 浓 度 的NaOH 溶 液 , 溶 液 中 pOH(pOH=-lg[OH-])与 pH 的变化关系如图所示,则( A.M 点所示溶液导电能力强于 Q 点 B.N 点所示溶液中 c(CH3COO-)﹥c(Na+) )C.M 点和 N 点所示溶液中水的电离程度相同 D.Q 点消耗 NaOH 溶液的体积等于醋酸溶液的体积 128、(12 分)金属冶炼和处理常涉及氧化还原反应。 (1)由下列物质冶炼相应金属时采用电解法的是 a.Fe2O3 b.NaCl c.Cu2S d.Al2O3 (2)辉铜矿(Cu2S)可发生反应 2Cu2S+2H2SO4+5O2==4CuSO4+2 H2O,该反应的还原剂是 ,当 1mol O2 发生反应时,还原剂所失电子的物质的量为 加入镁条时有气体生成,该气体是 mol。向 CuSO4 溶液中 (3)右图为电解精炼银的示意图, (填 a 或 b)极为含有杂质的粗银, 若 b 极有少量红棕色气体生成,则生成该气体的电极反应式为 (4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接 触,Ag2S 转化为 Ag,食盐水的作用为 29、(15 分)化学反应原理在科研和生产中有广泛应用 (1)利用“化学蒸气转移法”制备 TaS2 晶体,发生如下反应 TaS2(s)+2I2(g) TaI4(g)+S2(g)△H﹥0 (I) 反应(I)的平衡常数表达式 K= ,若 K=1,向某恒容密闭容器中加入 1mol I2(g)和足 量 TaS2(s),I2(g)的平衡转化率为 (2)如图所示,反应(I)在石英真空管中进行,先在温度为 T2 的 一端放入未提纯的 TaS2 粉末和少量 I2(g),一段时间后,在温度为 T1 的一端得到了纯净的 TaS2 晶体,则温度 T1 “﹤”或“=”)。上述反应体系中循环使用的物质是 T2 (填“﹥” 。(3)利用 I2 的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫 转化为 H2SO3 ,然后用一定浓度的 I2 溶液进行滴定,所用指示剂 为,滴定反应的离子方程式为 -(4)25℃时,H2SO3 常数 Kh= “增大”“减小”或“不变”)。 HSO3 +H+的电离常数 Ka=1×10-2mol/L,则该温度下 NaHSO3 的水解平衡 mol/L,若向 NaHSO3 溶液中加入少量的 I2,则溶液中 将(填 33、(8 分)【化学——有机化学基础】 聚酰胺—66 常用于生产帐篷、渔网、降落伞及弹力丝袜等织物,可利用下列路线合成: (1)能与银氨溶液反应的 B 的同分异构体的结构简式为 (2)D 的结构简式为 ,①的反应类型为 (3)为检验 D 中的官能团,所用试剂包括 NaOH 水溶液及 (4)由 F 和 G 生成 H 的反应方程式为 230、(15 分)TiO2 既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。 (1)实验室利用反应 TiO2(s)+2CCl4(g)==TiCl4(g)+CO2(g),在无水无氧条件下,制取 TiCl4 实验装置示意图如下 有关性质如下表 物质 CCl4 TiCl4 熔点/℃ 沸点/℃ 76 136 其他 -23 -25 与 TiCl4 互溶 遇潮湿空气产生白雾 仪器 A 的名称是 停止通氮气②熄灭酒精灯③冷却至室温。正确的顺序为 合物,所采用操作的名称是 ,装置 E 中的试剂是 。反应开始前依次进行如下操作:① (填序号)。欲分离 D 中的液态混 。(2)工业上由钛铁矿(FeTiO3)(含 Fe2O3、SiO2 等杂质)制备 TiO2 的有关反应包括: 酸溶 FeTiO3(s)+2H2SO4(aq)==FeSO4(aq)+ TiOSO4(aq)+ 2H2O(l) 90℃ 水解 TiOSO4(aq)+ 2H2O(l)== H2TiO3(s)+H2SO4(aq) 简要工艺流程如下: ①试剂 A 为 。钛液Ⅰ需冷却至 70℃左右,若温度过高会导致产品收率降低,原因是 ②取少量酸洗后的 H2TiO3,加入盐酸并振荡,滴加 KSCN 溶液后无明显现象,再加 H2O2 后出现微红 色,说明 H2TiO3 中存在的杂质离子是 也会发黄,发黄的杂质是 。这种 H2TiO3 即使用水充分洗涤,煅烧后获得的 TiO2 (填化学式)。 32013 年普通高等学校招生统一考试(山东卷) 7.解析:聚乙烯塑料的老化是因为被氧化所致,A 选项错;煤的气化是化学变化,B 错;碳纤维是碳 的单质,C 错;用粮食酿酒时,先在糖化酶作用下水解为葡萄糖,然后在酵母作用下转变为酒精,都 是化学变化。D 正确。 答案:D 8.解析:因为 W 的气态氢化物可与其最高价含氧酸生成离子化合物,这指的是铵盐,W 是 N 元素, 则 X、Y、Z 依次是 O、S、Cl。则其氢化物中 H2S 最不稳定,A 正确;只有氯元素的最高价含氧 酸才一定比 Y 的含氧酸酸性强,B 错;阴离子还原性 S2->O2-,C 错;Cl2 与水的反应中既表现氧 化性,也表现了还原性,D 错。 答案:A 9.解析:首先硝酸与金属铝反应不生成氢气,根据生成物的化学式:Na[Al(OH)4]、Al2(SO4)3、AlCl3, 通过物料守恒可直接判断出等量的铝消耗 NaOH 物质的量最少。答案:A 10.解析:根据莽草酸的结构式可确定其分子式为:C7H10O5,需要注意不存在苯环,A 错;有三种官 能团:羧基、羟基、碳碳双键,B 错;碳碳双键可以被加成,羧基、羟基可发生酯化反应,C 正确; 在水溶液中羧基可以电离出 H+,羟基不能发生电离,D 错。 答案:C 11.解析:硫酸铜溶液的浓缩结晶需要用到酒精灯,A 错;用盐酸出去 BaSO4 中的少量 BaCO3 需要进 行过滤,需要用到漏斗,B 错;用固体配制溶液需要用到托盘天平称量固体,C 错;D 中可以先进行 置换反应,然后进行萃取、分液,D 正确。 答案:D 12.解析:催化剂虽然改变了反应途径,但是△H 只取决于反应物、生成物的状态,△H 不变,A 错;这是一个反应前后气体物质的量不变的反应,改变压强,平衡不发生移动, 反应放出的热量也不变,B 正确;该反应是放热反应,升高温度,平衡左移,反应放出的 热量减小,C 错;若在原电池中进行,反应不放出热量,而是 为电能,D 错。 答案:B 转换 13.解析:由于醋酸是弱酸,电离程度很小,离子浓度也较小,M 点溶 导电能力最弱,A 错;N 点所示溶液为碱性,根据溶液电荷守恒易判断出此 (Na+)>c(CH3COO-)B,错;由于 M 点的 H+浓度等于 N 点的 OH-浓度, 液 的 时c对 水 的电离程度抑制能力相同,所以两点水电离程度相同,C 正确;Q 点的 pOH=pH,溶液为中性,而两 者等体积混合后生成醋酸钠,水解显碱性。则所加 NaOH 溶液体积略小于醋酸溶液的体积,D 错。 答案:C 28.解析:(1)NaCl 与 Al2O3 冶炼需要用电解法,Fe2O3 与 Cu2S 可以用热还原法,所以为 b、d。 (2)在该反应中,Cu 元素化合价由+1 升高到+2,S 元素由-2 升高到+6,Cu2S 做还原剂,当有 1molO2 参与反应转移的电子为 4mol,由于 Cu2+水解呈酸性,加入镁条时,镁与 H+反应生成了氢气。 (3)电解精炼时,不纯金属做阳极,这里就是 a 极;b 电极是阴极,发生还原反应,生成了红棕色气 –体是 NO,遇空气氧化生成的 NO2 ,电极反应:NO3 +3e- +4H+ =NO↑+2H2O。或 NO3 +e- +2H+ = NO2↑+H2O (4)做电解质溶液,形成原电池。 答案:(1)bd (2)Cu2S;4;氢气 -(3)a;NO3 +3e-+4H+=NO↑+2H2O (4)做电解质溶液,形成原电池。 c(TaI4) c(S2) [S2][TaI4] 29.解析:(1) 或,通过三行式法列出平衡浓度,带入 K 值可以得出转化率为 c2(I2) [I2]2 466.7%。 (2)由所给方程式可知该反应为吸热反应,通过题意温度 T2 端利于反应正向进行,为高温,温度 T1 端利于反应向左进行,为低温,所以 T1<T2。I2 是可以循环使用的物质. 2- (3)因为 I2 遇到淀粉会变蓝色,所以可以用淀粉溶液作指示剂.离子反应:H2SO3+I2+H2O=4H++SO4 + 2I-. [HSO3 – ]·[H + ] [H2SO3] [H2SO3]·Kw [HSO3 – ]·[H + ] -(4)Ka = ,HSO3 +H2O H2SO3 +OH-,Kb = =1.0×102×1.0×10-14 =[H2SO3] 1.0×10-12,当加入少量 I2 时,溶液酸性增强,[H+]增大,但是温度不变,Kb 不变,则 c(TaI4) c(S2) [S2][TaI4] 增大。 [HSO3 – ]答案:(1) 或,66.7% c2(I2) [I2]2 (2)<,I2 2- (3)淀粉溶液,H2SO3+I2+H2O=4H++SO4 +2I- (4)1.0×10-12,增大 30.解析:(1)仪器 A 是干燥管,因为 TiCl4 遇到水蒸气会水解,所以 E 中可以用浓硫酸来隔离空气。 对于气体的制取性质实验应该:组装仪器、检验气密性、加装药品。。。。。终止实验时为防止倒吸,应 先熄灭酒精灯,冷却到室温后再停止通入 N2。分离两种沸点不同的液体混合物应该用蒸馏。 (2)①因为矿石经硫酸溶解后得到的 Fe2(SO4)3,而后面过滤得到的是 FeSO4·7H2O,所以试剂 A 是铁 粉,把 Fe3+还原为 Fe2+。由于 TiOSO4 容易水解,若温度过高,则会有较多 TiOSO4 水解为固体 H2TiO3 而经过滤进入 FeSO4·7H2O 中导致 TiO2 产率降低。 ②加 KSCN 溶液无现象,加 H2O2 后出现红色,说明存在 Fe2+。经加热后 Fe2+氧化为 Fe2O3 而使产品发 黄。 答案:(1)干燥管;浓硫酸;检查气密性;②③①,蒸馏 (2)①铁粉,由于 TiOSO4 容易水解,若温度过高,则会有较多 TiOSO4 水解为固体 H2TiO3 而经过滤 进入 FeSO4·7H2O 中导致 TiO2 产率降低。 ②Fe2+,Fe2O3 33.解析:A 经 H2 加成得到环丁醚 B,与 HCl 取代得到 C 氯代丁醇,再进行一步取代得 D:丁二醇; 通过反应①取代得到己二腈,结合所给信息可知 F 是己二酸,G 是己二胺,通过缩聚反应得到 H:聚 酰胺-66。 (1) B 分子式是 C4H8O,符合饱和一元醛的通式,可以写出:CH3CH2CH2CHO。 (2) D 是 1,4-二氯丁醇:CH2ClCH2CH2CH2Cl;反应①是取代反应。 (3) 要检验氯代烃中氯元素,应先通过NaOH 溶液水解,然后用 AgNO3 溶液检验 Cl-。 剂催化 ―――→ ——nC C HO[ -(CH2)4 - -NH(CH2)6NH]H +(2n (4) nHOOC(CH2)4COOH+nNH2(CH2)6NH2 -1)H2O 答案:(1)CH3CH2CH2CHO (2)CH2ClCH2CH2CH2Cl;取代反应。 (3)AgNO3 溶液与稀硝酸 剂催化 ―――→ ——nCC(4)nHOOC(CH2)4COOH+nNH2(CH2)6NH2 HO[ -(CH2)4 - -NH(CH2)6NH]H+(2n- 1)H2O 5
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





