
 2013年全国普通高等学校招生统一考试 上海化学试卷 考生注意: 1.本试卷满分 l50分,考试时问 120分钟· 2.本考试设试卷和答题纸两部分,试卷包括试题与答题要求;所有答题必须涂(选择 题)或写(非选择题)在答题纸上;做在试卷上一律不得分。 3.答题前,考生务必在答题纸上用钢笔或圆珠笔清楚填写姓名、准考证号,并将核对后 的条形码贴在指定位置上。 4.答题纸与试卷在试题编号上是一一对应的,答题时应特别注意,不能错位。 相对原子质量:H-1 C-12 O-16 Na-23 S-32 Ca-40 Fe-56Ni-59 Cu-64 Br-80 Ba-137 一、选择题(本题共 10 分,每小题 2 分,每题只有一个正确选项) 1.2013 年 4 月 24 日,东航首次成功进行了由地沟油生产的生物航空燃油的验证飞行。能区 别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是( A.点燃,能燃烧的是矿物油 )B.测定沸点,有固定沸点的是矿物油 C.加入水中,浮在水面上的是地沟油 D.加入足量氢氧化钠溶液共热,不分层的是地沟油 2.氰酸铵(NH4OCN)与尿素[CO(NH2)2] ( A.都是共价化合物 )B.都是离子化合物 D.互为同素异形体 C.互为同分异构体 3.230Th 和 232Th 是钍的两种同位素,232Th 可以转化成 233U。下列有关 Th 的说法正确的是 ()A.Th 元素的质量数是 232 C.232Th 转换成 233U 是化学变化 B.Th 元素的相对原子质量是 231 D.230Th 和 232Th 的化学性质相同 )4.下列变化需克服相同类型作用力的是( A.碘和干冰的升华 B.硅和 C60 的熔化 C.氯化氢和氯化钠的溶解 D.溴和汞的气化 5.374℃、22.1MPa 以上的超临界水具有很强的溶解有机物的能力,并含有较多的 H+和 OH-,由此可知超临界水( A.显中性,pH 等于 7 C.显酸性,pH 小于 7 )B.表现出非极性溶剂的特性 D.表现出极性溶剂的特性 二、选择题(本大题共 36 分,每小题 3 分,每题只有一个正确选项) 6.与索尔维制碱法相比,侯德榜制碱法最突出的优点是( )A.原料利用率高 B.设备少 C.循环利用的物质多 D.原料易得 7.将 X 气体通入 BaCl2 溶液,未见沉淀生成,然后通入 Y 气体,有沉淀生成。X、Y 不可能 是( )选项 AXYSO2 Cl2 H2S CO2 CO2 Cl2 BCNH3 SO2 D8.糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸 氧腐蚀相同。下列分析正确的是( )A.脱氧过程是吸热反应,可降低温度,延长糕点保质期 B.脱氧过程中铁作原电池正极,电极反应为:Fe-3e→Fe3+ C.脱氧过程中碳作原电池负极,电极反应为:2H2O+O2+4e→4OH- D.含有 1.12g 铁粉的脱氧剂,理论上最多能吸收氧气 336mL(标准状况) 9.将盛有 NH4HCO3 粉末的小烧杯放入盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐 酸,反应剧烈,醋酸逐渐凝固。由此可知( A.NH4HCO3 和盐酸的反应是放热反应 B.该反应中,热能转化为产物内部的能量 C.反应物的总能量高于生成物的总能量 )D.反应的热化学方程式为:NH4HCO3+HCl→NH4Cl+CO2↑+H2O-Q 10.下列关于实验室制备乙酸乙酯和乙酸丁酯的描述正确的是( )A.均采用水浴加热 B.制备乙酸丁酯时正丁醇过量 C.均采用边反应边蒸馏的方法 D.制备乙酸乙酯时乙醇过量 – +-+2- 11.H2S 水溶液中存在电离平衡 H2S H +HS和 HS H +S 。若向 H2S 溶液中( )A.加水,平衡向右移动,溶液中氢离子浓度增大 B.通入过量 SO2 气体,平衡向左移动,溶液 pH 值增大 C.滴加新制氯水,平衡向左移动,溶液 pH 值减小 D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小 12.根据有机化合物的命名原则,下列命名正确的是( )A. 3-甲基-1,3-丁二烯 B. 2-羟基丁烷 2-乙基戊烷 3-氨基丁酸 C.CH3CH(C2H5)CH2CH2CH3 D.CH3CH(NH2)CH2COOH 13.X、Y、Z、W 是短周期元素,X 元素原子的最外层未达到 8 电子稳定结构,工业上通过 分离液态空气获得其单质;Y 元素原子最外电子层上 s、p 电子数相等;Z 元素+2 价阳离子 的核外电子排布与氖原子相同;W 元素原子的 M 层有 1 个未成对的 p 电子。下列有关这些 元素性质的说法一定正确的是( )A.X 元素的氢化物的水溶液显碱性 B.Z 元素的离子半径大于 W 元素的离子半径 C.Z 元素的单质在一定条件下能与 X 元素的单质反应 D.Y 元素最高价氧化物的晶体具有很高的熔点和沸点 14.为测定镀锌铁皮锌镀层的厚度,将镀锌皮与足量盐酸反应,待产生的气泡明显减少时取 出,洗涤,烘干,称重。关于该实验的操作对测定结果的影响判断正确的是 A.铁皮未及时取出,会导致测定结果偏小 B.铁皮未洗涤干净,会导致测定结果偏大 C.烘干时间过长,会导致测定结果偏小 D.若把盐酸换成硫酸,会导致测定结果偏大 15.NA 代表阿伏伽德罗常数。已知 C2H4 和 C3H6 的混合物的质量为 ag,则该混合物 A.所含共用电子对数目为(a/7+1)NA C.燃烧时消耗的 O2 一定是 33.6a/14 L B.所含碳氢键数目为 aNA/7 D.所含原子总数为 aNA/14 16.已知氧化性 Br2>Fe3+。FeBr2 溶液中通入一定量的 Cl2,发生反应的离子方程式为: a Fe2++b Br-+c Cl2→d Fe3++ e Br2+ f Cl- 下列选项中的数字与离子方程式中的 a、b、c、d、e、f 一一对应,其中不符合反应实 际的是 A.2 43226B.0 21012C.2 01202D.2 222142- 2- +17.某溶液可能含有 Cl-、SO4 、CO3 、NH4 、Fe3+、Al3+和 K+。取该溶液 100mL,加入过 量 NaOH 溶液,加热,得到 0.02mol 气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得 到 1.6 g 固体;向上述滤液中加足量 BaCl2 溶液,得到 4.66 g 不溶于盐酸的沉淀。由此可知 原溶液中 A.至少存在 5 种离子 B.Cl-一定存在,且 c(Cl-)≥0.4 mol/L 2- +C.SO4 、NH4 一定存在,Cl-可能不存在 2- D.CO3 、Al3+一定不存在,K+可能存在 三、选择题(本题共 20 分,每小题 4 分,每小题有一个或两个正确选项。只有一个正确选 项的,多选不给分;有两个正确选项的,选对一个给 2 分,选错一个,该小题不给分) 18.汽车剧烈碰撞时,安全气囊中发生反应 10NaN3+2KNO3→K2O+5Na2O+16N2↑。若氧 化产物比还原产物多 1.75 mol,则下列判断正确的是 A.生成 40.0 L N2(标准状况) B.有 0.250molKNO3 被氧化 C.转移电子的物质的量为 1.25 mol D.被氧化的 N 原子的物质的量为 3.75 mol 19.部分弱酸的电离平衡常数如下表: 弱酸 HCOOH HCN H2CO3 电离平衡常数 Ki=1.77×10-4 Ki=4.9×10-10 Ki1=4.3×10-7 (25℃) Ki2=5.6×10-11 下列选项错误的是 2- A.2CN-+H2O+CO2→2HCN+CO3 2- B.2HCOOH+CO3 →2HCOO-+H2O+CO2↑ C.中和等体积、等 pH 的 HCOOH 和 HCN 消耗 NaOH 的量前者小于后者 D.等体积、等浓度的 HCOONa 和 NaCN 溶液中所含离子总数前者小于后者 20.某恒温密闭容器中,可逆反应 A(s) B+C(g)-Q 达到平衡。缩小容器体积,重新达 到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是 A.产物 B 的状态只能为固态或液态 B.平衡时,单位时间内 n(A)消耗﹕n(C)消耗=1﹕1 C.保持体积不变,向平衡体系中加入 B,平衡可能向逆反应方向移动 D.若开始时向容器中加入 1 mol B 和 1 mol C,达到平衡时放出热量 Q 21.一定条件下,将 0.1 L CO、0.2 L CO2、0.1 L NO、0.2 L NO2 和 0.2 L NH3 混合,然后通 过分别盛有足量蒸馏水、饱和碳酸氢钠溶液和氢氧化钠溶液的三个洗气瓶(洗气瓶排列顺 序不确定)。假设气体通过每个洗气瓶都能充分反应则尾气(已干燥) A.可能是单一气体 B.不可能含有一氧化碳 C.可能存在原气体中的两种气体 D.成分和洗气瓶的排列顺序无关 22.一定量的 CuS 和 Cu2S 的混合物投入足量的 HNO3 中,收集到气体 VL(标准状况),向 2- 反应后的溶液中(存在 Cu2+和 SO4 )加入足量 NaOH,产生蓝色沉淀,过滤,洗涤,灼 烧,得到 CuO 12.0 g,若上述气体为 NO 和 NO2 的混合物,且体积比为 1﹕1,则 V 可能 为A.9.0L B.13.5L C.15.7L D.16.8L 四、(本题共 8 分) 金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。 完成下列填空: 23.铝原子核外电子云有 种不同的伸展方向,有 种不同运动状态的电子。 24.镓(Ga)与铝同主族。写出镓的氯化物和氨水反应的化学方程式。 25.硅与铝同周期。SiO2 是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14 也可写成 Na2O·CaO·6SiO2。盛放 NaOH 溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法 打开,发生反应的化学方程式 。长石是铝硅酸盐,不同类长石其氧原子的物质的量分数相同。由钠长石化学式 NaAlSi3O8 可推知钙长石的化学式为 26.用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如: 2Al+4BaO 高温 3Ba↑+BaO·Al2O3 常温下 Al 的金属性比 Ba 的金属性 (选填“强”、“弱”)。利用上述方法 可制取 Ba 的主要原因是 。a.高温时 Al 的活泼性大于 Ba b.高温有利于 BaO 分解 c.高温时 BaO•Al2O3 比 Al2O3 稳定 五、(本题共 8 分) d.Ba 的沸点比 Al 的低 溴主要以 Br-形式存在于海水中,海水呈弱碱性。工业上制备的 Br2 的操作步骤为: ①一定条件下,将 Cl2 通入浓缩的海水中,生成 Br2 ②利用热空气将 Br2 吹出,并用浓 Na2CO3 溶液吸收,生成 NaBr、NaBrO3 等 ③用硫酸酸化步骤②得到的混合物 完成下列填空: 27.Cl2 氧化 Br-应在 条件下进行,目的是为了避免 28.Br2 可用热空气吹出,其原因是 29.写出步骤③所发生的化学反应方程式。 用硫酸而不用盐酸酸化的原因可能是 。步骤②的产 品有时运输到目的地后再酸化,主要是因为 30.为了除去工业 Br2 中微量的 Cl2,可向工业 Br2 中 a.通入 HBr b.加入 Na2CO3 溶液 d.加入 Na2SO3 溶液 c.加入 NaBr 溶液 六、(本题共 8 分) 镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯 粗镍涉及的两步反应依次为: 50℃ 230℃ (1)Ni(s)+4CO(g) Ni(CO)4(g)+Q (2)Ni(CO)4(g) Ni(S)+4CO(g) 完成下列填空: 31 . 在 温 度 不 变 的 情 况 下 , 要 提 高 反 应 ( 1 ) 中Ni(CO4) 的 产 率 , 可 采 取 的 措 施 有、。32.已知在一定条件下的 2L 密闭容器中制备 Ni(CO)4,粗镍(纯度 98.5%,所含杂质不与 CO 反应)剩余质量和反应时间的关系如右图所示。Ni(CO)4 在 0~10min 的平均反应速率为 。33.若反应(2)达到平衡后,保持其他条件不变,降低温度,重新达到平衡时 a.平衡常数 K 增大 b.CO 的浓度减小 c.Ni 的质量减小 。d.v 逆[Ni(CO)4] 增大 34.简述羰基法提纯粗镍的操作过程。 七、(本题共 12 分) 溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质。实验室用工业大理石 (含有少量 Al3+、Fe3+等杂质)制备溴化钙的主要流程如下: 完成下列填空: 35.上述使用的氢溴酸的质量分数为 26%,若用 47%的氢溴酸配置 26%的氢溴酸的氢溴酸 500 mL,所需的玻璃仪器有玻璃棒、___________。 +36.已知步骤Ⅲ的滤液中不含 NH4 。步骤Ⅱ加入的试剂 a 是___________,控制溶液的 pH 约为 8.0 的目的是___________、___________。 37.试剂 b 是___________,步骤Ⅳ的目的是______________________。 38.步骤Ⅴ所含的操作依次是___________、___________。 39.制得的溴化钙可以通过如下步骤测定其纯度: ①称取 4.00 g 无水溴化钙样品;②溶解;③滴入足量 Na2CO3 溶液,充分反应后过滤;④ ______________________ ; ⑤ 称 量 。 若 得 到1.88 g 碳 酸 钙 , 则 溴 化 钙 的 质 量 分 数 为 ___________(保留两位小数)。 若实验操作规范而测定结果偏低,其原因是______________________。 八、(本题共 12 分) 二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成 酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重 要。 完成下列填空: 40.实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。 如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发 生装置是___________(填写字母)。 41.若用硫酸和亚硫酸钠反应制取 3.36 L(标准状况)二氧化硫,至少需要称取亚硫酸钠 ___________g(保留一位小数);如果已有 4.0%亚硫酸钠(质量分数)被氧化成硫酸钠,则 至少需称取该亚硫酸钠___________g(保留一位小数)。 42.实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰-石膏法和碱法是常用 的烟气脱硫法。 石灰-石膏法的吸收反应为 SO2+Ca(OH)2→CaSO3↓+H2O。吸收产物亚硫酸钙由管道输 送至氧化塔氧化,反应为 2CaSO3+O2+4H2O→2CaSO4·2H2O。其流程如下图: 碱法的吸收反应为 SO2+2NaOH→Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收 快、效率高。其流程如下图: 已知: 试剂 Ca(OH)2 0.36 NaOH 2.90 价格(元/kg) 吸收 SO2 的成本(元/mol) 0.027 0.232 石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是______________________。和 碱法相比,石灰-石膏法的优点是______________________,缺点是______________________。 43.在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用 流程图表示)。 九、(本题共 10 分) 异构化可得到三元乙丙橡胶的第三单体 。由 A (C5H6)和 B 经 Diels-Alder 反应制得。Diels-Alder 反应为共轭双烯与含有烯键或炔键的化合 物 相 互 作 生 成 六 元 环 状 化 合 物 的 反 应 , 最 简 单 的Diels-Alder 反 应 是 。完成下列填空: 44 . Diels-Alder 反 应 属 于 _____________ 反 应 ( 填 反 应 类 型 ); A 的 结 构 简 式 为 _____________。 45.写出与 互为同分异构,且一溴代物只有两种的芳香烃的名称。 写出生成这两种一溴代物所需要的反应试剂和反应条件。 46.B 与 Cl2 的 1,2-加成产物消去 HCl 得到 2-氯代二烯烃,该二烯烃和丙烯酸(CH2=CHCOOH) 聚合得到的聚合物可改进氯丁橡胶的耐寒性和加工性能,写出该聚合物的结构简式。 47.写出实验室由 的属于芳香烃的同分异构体的同系物制备 的合成 反应试剂 反应试剂 路线,(合成路线常用的表示方式为:A B…… 目标产物) 反应条件 反应条件 十、(本题共 12 分) 沐舒坦(结构简式为 ,不考虑立体异构)是临床上使用广 泛的祛痰药,下图所示的其多条合成路线中的一条(反应试剂和反应条件均未标出)。 完成下列填空: 48.写出反应试剂和反应条件。 反应①_____________ 49.写出反应类型。 反应③_____________ 50.写出结构简式。 反应⑤_____________ 反应⑥_____________ A__________________________ B__________________________ 51.反应⑥中除加入反应试剂 C 外,还需要加入 K2CO3,其目的是为了中和___________, 防止__________________________。 52.写出两种 C 的能发生水解反应,且只含 3 种不同化学环境氢原子的同分异构体的结构简 式。 53 . 反 应 ② 、 反 应 ③ 的 顺 序 不 能 颠 倒 , 其 原 因 是 _________________________ 、 _________________________。 十一、(本题共 14 分) 碳酸氢钠俗称“小苏打”,是氨碱法和联合制碱法制纯碱的中间产物,可用作膨松剂、 制酸剂、灭火剂等。工业上用纯碱溶液碳酸化制取碳酸氢钠。 54.某碳酸氢钠样品中含有少量氯化钠。称取该样品,用 0.1000 mol/L 盐酸滴定,耗用盐酸 20.00 mL。若改用 0.05618 mol/L 硫酸滴定,需用硫酸___________mL(保留两位小数)。 55.某溶液组成如表一: 表一 Na2CO3 814.8 NaHCO 化合物 NaCl 97.3 3质量(kg) 400.3 向该溶液通入二氧化碳,析出碳酸氢钠晶体。取出晶体后溶液组成如表二: 表二 NaHCO 化合物 Na2CO3 NaCl 97.3 3质量(kg) 137.7 428.8 计算析出的碳酸氢钠晶体的质量(保留 1 位小数)。 56.将组成如表二的溶液加热,使碳酸氢钠部分分解,溶液中 NaHCO3 的质量由 428.8 kg 降 为 400.3 kg,补加适量碳酸钠,使溶液组成回到表一状态。计算补加的碳酸钠质量(保留 1 位小数)。 57.某种由碳酸钠和碳酸氢钠组成的晶体 452 kg 溶于水,然后通入二氧化碳,吸收二氧化碳 44.8×103 L(标准状况),获得纯的碳酸氢钠溶液,测得溶液中含碳酸氢钠 504 kg。通过计算 确定该晶体的化学式。 2013年全国普通高等学校招生统一考试 上海化学试卷参考答案 Ⅰ卷(66 分) 一、单项选择题(本题包括 1-5 题,共 10 分,每小题 2 分。) 12345DCDAB二、单项选择题(本题包括 6-17 题,共 36 分,每小题 3 分。) 678910 D11 C12 D13 C14 C15 B16 B17 BABDB三、不定项选择题(本题包括 18-22 题,共 20 分,每小题 4 分。每小题有一个或两个正确 选项。只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给 2 分,选错一个 该小题不给分。) 18 19 20 21 22 ACD AD BC AC Ⅱ卷(84 分) 四、(本题共 8 分) 23.4;13 24.GaCl3+3NH3+3H2O→Ga(OH)3↓+3NH4Cl 25.SiO2+2NaOH→Na2SiO3+H2O;GaAl2Si2O8 26.弱;d。 五、(本题共 8 分) 27.酸性;Cl2 歧化(或 Br2 歧化) 28.Br2 易挥发(或 Br2 沸点低) 29.5NaBr+NaBrO3+3H2SO4→3Br2+3Na2SO4+3H2O;溴酸能将氯离子氧化成氯气;溴具有 强氧化性(或强腐蚀性) 30.ac 六、(本题共 8 分) 31.加压;及时移走 Ni(CO)4 32.0.05mol/(L•min) 33.bc 34.先将粗镍与 CO 在 50℃反应生成羰基镍,然后将羰基镍转移到另一容器中,升温到 230 ℃,热解得到纯镍。 七、(本题共 12 分) 35.烧杯、量筒 36.氢氧化钙;确保 Fe3+和 Al3+沉淀完全,防止氢氧化铝溶解 37.氢溴酸;除去过量的氢氧化钙 38.蒸发浓缩,冷却结晶;过滤 39.烘干、冷却;0.94;溴化钙吸水 八、(本题共 12 分) 40.ae 41.18.9;19.8 42.碱和酸性氧化物的反应;成本低;亚硫酸钙在输送中容易造成管道堵塞 43.答案示例: 九、(本题共 10 分) 44.加成; 45.1,3,5-三甲苯(或均三甲苯、间三甲苯);Br2/光照、Br2/Fe(反应试剂和条件前后可以 颠倒) 46. (合理即给分) 47. (合理即给 分) 十、(本题共 12 分) 48.浓硝酸/浓硫酸,加热;Br2/CH3COOH(或 Br2/Fe 或 CH3OH/浓硫酸,加热) 49.还原反应;取代反应 50. 51.HCl;反应物 52. 与HCl成盐 (任写两种,合理即给分) 53.苯环上的氨基易被氧化;苯环上的羧基不易被还原 十一、(本题共 14 分) 54.17.80 55.(814.8-137.7) ÷106×84.0×2-(428.8-400.3)=1044.6(kg) 56.814.8-137.7-(428.8-400.3)×106÷168=659.1(kg) 57.设该晶体的化学式为 aNa2CO3·bNaHCO3·nH2O n(Na2CO3)=n(CO2)=44.8×103÷22.4=2000(mol) n(NaHCO3)=504÷84.4×1000-2000×2=2000(mol) n(H2O)=[452000-(106×2000+84.0×2000)]÷18.0=4000(mol) ∴a:b:n=2:2:4=1:1:2 该晶体的化学式为 Na2CO3·NaHCO3·2H2O 2013年全国普通高等学校招生统一考试 上海化学试卷解析 考生注意: 1.本试卷满分 l50分,考试时问 120分钟· 2.本考试设试卷和答题纸两部分,试卷包括试题与答题要求;所有答题必须涂(选择 题)或写(非选择题)在答题纸上;做在试卷上一律不得分。 3.答题前,考生务必在答题纸上用钢笔或圆珠笔清楚填写姓名、准考证号,并将核对 后的条形码贴在指定位置上。 4.答题纸与试卷在试题编号上是一一对应的,答题时应特别注意,不能错位。 相对原子质量:H-1 C-12 O-16 Na-23 S-32 Ca-40 Fe-56Ni-59 Cu-64 Br-80 Ba-137 一、选择题(本题共 10 分,每小题 2 分,每题只有一个正确选项) 1.2013 年 4 月 24 日,东航首次成功进行了由地沟油生产的生物航空燃油的验证飞行。能区 别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是( A.点燃,能燃烧的是矿物油 )B.测定沸点,有固定沸点的是矿物油 C.加入水中,浮在水面上的是地沟油 D.加入足量氢氧化钠溶液共热,不分层的是地沟油 解析:知识点:生活与化学,考察有机物知识,主要是油脂和矿物油区别。 难易程度:简单,注重基础知识掌握,没有大的陷阱。 正确答案:D 分析原因:地沟油的主要成分是油脂,矿物油的主要成分是烃的混合物。A、油脂和 烃都可以燃烧,故无法区分;B、矿物油主要成分是烃的混合物,没有固 定的沸点;C、油脂和烃的密度都比水小,都浮在水上面;D、油脂在氢 氧化钠溶液可水解而不分层,矿物油不溶于氢氧化钠溶液,分层。故正确 答案为:D 易错点:无法区分地沟油和矿物油的主要成分。 2.氰酸铵(NH4OCN)与尿素[CO(NH2)2] ( A.都是共价化合物 )B.都是离子化合物 D.互为同素异形体 C.互为同分异构体 解析:知识点:物质的分类,考察共价化合物、离子化合物、同分异构体、同素异形体的概 念。 难易程度:简单,注重基础知识概念。 正确答案:C +分析原因:氰酸铵中含有 NH4 离子,故氰酸铵是离子化合物,而尿素是共价化合物, 故 A、B 都错误;B、;C、同分异构体是化学式相同、结构不同的物质, 故氰酸铵(NH4OCN)与尿素[CO(NH2)2]是同分异构体;D、同素异形体 是同种元素组成的不同单质,故不是同素异形体。故正确答案为:C 易错点:不会区分共价化合物和离子化合物。 3.230Th 和 232Th 是钍的两种同位素,232Th 可以转化成 233U。下列有关 Th 的说法正确的是 ()A.Th 元素的质量数是 232 C.232Th 转换成 233U 是化学变化 B.Th 元素的相对原子质量是 231 D.230Th 和 232Th 的化学性质相同 解析:知识点:同位素,考察质量数、相对原子质量、化学变化和化学性质。 难易程度:比较简单,注重基础知识掌握,C 有陷阱。 正确答案:D 分析原因:A、由于 Th 元素有两种同位素原子,所以质量数应指定是哪一种同位素 原子,才能确定;B、Th 元素的相对原子质量不是同位素原子质量数的平 均值,而需要按照各种同位素原子的丰度计算得到的;C、原子是化学变 化中的最小微粒,而 232Th 转换成 233U 的过程中,原子发生变化,故不是 化学变化(化学变化过程中原子种类不变的);D、230Th 和 232Th 是同种 元素的原子,所以化学性质相同。故正确答案为:D 易错点:遗忘了化学变化的本质。 4.下列变化需克服相同类型作用力的是( A.碘和干冰的升华 )B.硅和 C60 的熔化 D.溴和汞的气化 C.氯化氢和氯化钠的溶解 解析:知识点:化学键,考察范德华力、共价键、离子键的知识。 难易程度:比较简单,注重基础知识掌握。 正确答案:A 分析原因:A、“碘和干冰的升华”需克服的作用力都是范德华力;B、单质硅是原子 晶体,熔化时克服共价键,C60 是分子晶体,熔化需克服共价键 C、氯化 氢是分子晶体,溶解时共价键断裂,氯化钠都是离子晶体,溶解需克服离 子键;D、溴气化需克服范德华力,而汞气化需克服金属键。故正确答案 为:A 易错点:不清楚硅和 C60 的熔化需克服的作用力。 5.374℃、22.1MPa 以上的超临界水具有很强的溶解有机物的能力,并含有较多的 H+和 OH-,由此可知超临界水( A.显中性,pH 等于 7 C.显酸性,pH 小于 7 )B.表现出非极性溶剂的特性 D.表现出极性溶剂的特性 解析:知识点:物质的分类,考察共价化合物、离子化合物、同分异构体、同素异形体的概 念。 难易程度:中等,考察的是知识的灵活迁移。 正确答案:B 分析原因:A、C:温度为 374℃、22.1MPa 以上的超临界水,已经超过室温,此时的 PH 值已经小于 7,但溶液中的 H+和 OH-始终相等,故显中性;B、D: 由于 374℃、22.1MPa 以上的超临界水具有很强的溶解有机物的能力,而 有机物多数为非极性的,所以表现出非极性溶剂的特性。故正确答案为: B易错点:不清楚水的离子积与 pH 的关系。 二、选择题(本大题共 36 分,每小题 3 分,每题只有一个正确选项) 6.与索尔维制碱法相比,侯德榜制碱法最突出的优点是( )A.原料利用率高 B.设备少 C.循环利用的物质多 D.原料易得 解析:知识点:索维尔制碱法和侯氏制碱法的对比。 难易程度:简单,对比学习的综合应用。 正确答案:A 分析原因:A、B、C、D 都是侯氏制碱法的优点,但最突出的优点是原料利用率高。 工业生产都是以最少的原料获得最多的产物。故正确答案为:A 易错点:不清楚侯氏制碱法和索尔维制碱法的区别。 7.将 X 气体通入 BaCl2 溶液,未见沉淀生成,然后通入 Y 气体,有沉淀生成。X、Y 不可能 是( )选项 AXYSO2 Cl2 H2S CO2 CO2 Cl2 BCNH3 SO2 D解析:知识点:元素及化合物的性质。 难易程度:简单,注重基础知识掌握,没有大的陷阱。 正确答案:B 分析原因:A、将 SO2 通入 BaCl2 溶液,不反应,但通入的 H2S 发生反应生成 2H2S+ SO2→3S↓+2H2O 生成 S 沉淀;B、始终不反应无现象;C、反应为 2NH3+ H2O+ CO2 + BaCl2→2NH4Cl+BaCO3↓ ; D 项 发 生 反 应 : SO2+Cl2+2H2O→H2SO4+2HCl2,BaCl2+H2SO4→BaSO4↓+2HCl。因此选 B 易错点:容易误选 C,不清楚 C 中发生的反应。 8.糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸 氧腐蚀相同。下列分析正确的是( )A.脱氧过程是吸热反应,可降低温度,延长糕点保质期 B.脱氧过程中铁作原电池正极,电极反应为:Fe-3e→Fe3+ C.脱氧过程中碳作原电池负极,电极反应为:2H2O+O2+4e→4OH- D.含有 1.12g 铁粉的脱氧剂,理论上最多能吸收氧气 336mL(标准状况) 解析:知识点:氧化还原反应中铁的吸氧腐蚀。 难易程度:一般,注重基础知识掌握,D 选项容易忘了 Fe(OH)2 可以进一步被氧化。 正确答案:D 分析原因:A、吸氧腐蚀时是放热反应;B、正极反应为Fe-2e→Fe2+;C、脱氧过程中, 铁 作 原 电 池 负 极 , 碳 作 原 电 池 的 正 极 , 电 极 反 应 为 : 2H2O+O2+4e→4OH-;D、总反应生成Fe(OH)2,但Fe(OH)2可以进一步被 氧化:4Fe(OH)2+O2+2H2O→4Fe(OH)3,所以消耗氧气的总量在标准状况 下为336mL。故正确答案为:D 易错点:不清楚反应是最终产物是 Fe(OH)3。 9.将盛有 NH4HCO3 粉末的小烧杯放入盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐 酸,反应剧烈,醋酸逐渐凝固。由此可知( A.NH4HCO3 和盐酸的反应是放热反应 B.该反应中,热能转化为产物内部的能量 C.反应物的总能量高于生成物的总能量 )D.反应的热化学方程式为:NH4HCO3+HCl→NH4Cl+CO2↑+H2O-Q 解析:知识点:热化学方程式。 难易程度:简单,注重概念的理解。 正确答案:B 分析原因:A、反应后醋酸逐渐凝固,故该反应为吸热反应;B、吸热反应,能量转 化为产物内部能量;C、是吸热反应则反应物的总能量低于生成物的总能 量;D、热化学方程式需要标注反应物和生成物的状态。故正确答案为: B易错点:不了解反应中的热效应。 10.下列关于实验室制备乙酸乙酯和乙酸丁酯的描述正确的是( )A.均采用水浴加热 B.制备乙酸丁酯时正丁醇过量 D.制备乙酸乙酯时乙醇过量 C.均采用边反应边蒸馏的方法 解析:知识点:有机物的制备。 难易程度:中等,注重基础知识掌握。 正确答案:D 分析原因:A、制备乙酸乙酯需要的温度是 60℃—70℃可水浴加热,制备乙酸丁酯需 要的温度是 115℃—125℃,超过 100℃,只能用空气浴,直接加热;B、D: 制备乙酸丁酯时,乙酸需要过量,因为温度高时,醇过量脱水引入新杂质; 制备乙酸乙酯时,乙醇需要过量,一方面是乙醇相对乙酸成本较低,另一 方面是乙酸过量可能会使乙酸乙酯在酸性条件下发生水解;C、只有制备 乙酸丁酯利用了蒸馏方法;故正确答案为:D 易错点:不熟悉乙酸丁酯的实验室制法。 – +-+2- 11.H2S 水溶液中存在电离平衡 H2S H +HS和 HS H +S 。若向 H2S 溶液中( )A.加水,平衡向右移动,溶液中氢离子浓度增大 B.通入过量 SO2 气体,平衡向左移动,溶液 pH 值增大 C.滴加新制氯水,平衡向左移动,溶液 pH 值减小 D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小 解析:知识点:电离平衡和化学平衡。 难易程度:中等,C 理解有一定的争议。 正确答案:C 分析原因:A、加水,平衡向右移动,但溶液中氢离子浓度减小;B、通入过量 SO2 气体,平衡向左移动,溶液 pH 值减小;C、滴加新制氯水,溶液中 H+ 浓度增大,平衡向左移动,溶液 pH 值减小;D、加入少量硫酸铜固体 (忽略体积变化),由于生产 CuS 沉淀,平衡向右移动,溶液中 H+、S2- 浓度都减小,但 OH-浓度增大。故正确答案为:C 易错点:不清楚影响平衡移动的原因。 12.根据有机化合物的命名原则,下列命名正确的是( )A. 3-甲基-1,3-丁二烯 B. 2-羟基丁烷 2-乙基戊烷 3-氨基丁酸 C.CH3CH(C2H5)CH2CH2CH3 D.CH3CH(NH2)CH2COOH 解析:知识点:有机化合物命名。 难易程度:简单,对命名总结。 正确答案:D 分析原因:A、2-甲基-1,3-丁二烯;B、2-丁醇;C、2-甲基己烷。故正确答案为:D 易错点:没有以最长碳链为主链去命名。 13.X、Y、Z、W 是短周期元素,X 元素原子的最外层未达到 8 电子稳定结构,工业上通过 分离液态空气获得其单质;Y 元素原子最外电子层上 s、p 电子数相等;Z 元素+2 价阳离子 的核外电子排布与氖原子相同;W 元素原子的 M 层有 1 个未成对的 p 电子。下列有关这些 元素性质的说法一定正确的是( )A.X 元素的氢化物的水溶液显碱性 B.Z 元素的离子半径大于 W 元素的离子半径 C.Z 元素的单质在一定条件下能与 X 元素的单质反应 D.Y 元素最高价氧化物的晶体具有很高的熔点和沸点 解析:知识点:物质结构和元素周期律。 难易程度:中等,比较注重基础知识掌握。 正确答案:C 分析原因:A、X 元素为 O 或 N,氢化物的水溶液显中性或碱性;B、Z 元素为 Mg, W 元素为 Al 或 Cl,离子半径无法比较;C、Mg 在一定条件下能与 O2 或 N2 反应;D、Y 元素为 C 或 Si,其中最高价氧化物 CO2 为分子晶体,熔 沸点都低。故正确答案为:C 易错点:没有判断出 X 元素有两种可能。 14.为测定镀锌铁皮锌镀层的厚度,将镀锌皮与足量盐酸反应,待产生的气泡明显减少时取 出,洗涤,烘干,称重。关于该实验的操作对测定结果的影响判断正确的是 A.铁皮未及时取出,会导致测定结果偏小 B.铁皮未洗涤干净,会导致测定结果偏大 C.烘干时间过长,会导致测定结果偏小 D.若把盐酸换成硫酸,会导致测定结果偏大 解析:知识点:定量试验之镀锌铁皮锌的厚度测定,测定原理:利用镀锌铁皮质量差除以表 面积除以 2 难易程度:中 正确答案:C 分析原因: A 选项会导致质量差偏大以致结果偏大 B 选项会导致质量差偏小以致结果偏小, C 烘干时间过长可能铁被氧化质量增重致质量差偏小以致结果偏小, D 对测定结果无影响 易错点:测定原理不能熟练应用 15.NA 代表阿伏伽德罗常数。已知 C2H4 和 C3H6 的混合物的质量为 ag,则该混合物 A.所含共用电子对数目为(a/7+1)NA B.所含碳氢键数目为 aNA/7 D.所含原子总数为 aNA/14 C.燃烧时消耗的 O2 一定是 33.6a/14 L 解析:知识点:原子结构相关考点 难易程度:易 正确答案:B 分析原因:依题意知乙烯与丙烯的混合比例与题无关,可设烯烃的分子式为 CnH2n , 则 混 合 物 的 物 质 的 量 为 : a/14n A. 共 用 电 子 对 数 目 为3n * NA *a/14n=3a/14.B.氢键数目为 2n*NA*a/14n=aNA/7 C.非标况下不能用气体 摩尔体积 22.4L/mol.D.所含原子总数为 3n*NA*a/14n=3a/14 易错点:相关概念理解不清 16.已知氧化性 Br2>Fe3+。FeBr2 溶液中通入一定量的 Cl2,发生反应的离子方程式为: a Fe2++b Br-+c Cl2→d Fe3++ e Br2+ f Cl- 下列选项中的数字与离子方程式中的 a、b、c、d、e、f 一一对应,其中不符合反应实 际的是 A.2 C.2 4031222062B.0 D.2 2212021124解析:知识点:氧化还原反应 难易程度:中 正确答案:B 分析原因:由氧化性 Br2>Fe3+知还原性 Fe2+>Br-,则亚铁优先与 Cl2 反应,则 先发 生 2Fe2++Cl2→2Fe3++ 2Cl-,C 选项正确,亚铁反应完之后,Br-与 Cl2 反应, 则可能发生 2Fe2++2Br-+2Cl2→2 Fe3++ Br2+ 4Cl- (Cl2 量不足,Br-部分被 氧化) D 选项正确,也可能发生 2Fe2++4Br-+3Cl2→2 Fe3++ 2Br2+ 6Cl- (Cl2 量充足,Br-被全部氧化),A 选项正确。B 选项是 Br-优先与 Cl2 反应, 错误 易错点:氧化还原氧化性还原性强弱比较不清楚,反应物量对反应的影响没有考虑到。 2- 2- +17.某溶液可能含有 Cl-、SO4 、CO3 、NH4 、Fe3+、Al3+和 K+。取该溶液 100mL,加入过 量 NaOH 溶液,加热,得到 0.02mol 气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得 到 1.6 g 固体;向上述滤液中加足量 BaCl2 溶液,得到 4.66 g 不溶于盐酸的沉淀。由此可知 原溶液中 A.至少存在 5 种离子 B.Cl-一定存在,且 c(Cl-)≥0.4 mol/L 2- +C.SO4 、NH4 一定存在,Cl-可能不存在 2- D.CO3 、Al3+一定不存在,K+可能存在 解析:知识点:溶液中离子间的反应及其计算 难易程度:易 正确答案:B +分析原因:分析知 0.02mol 气体为 NH3.则原溶液中含有 NH4 0.02mol,红褐色沉淀 灼烧,得到 1.6 g 固体,可计算知 Fe3+0.02mol,4.66 g 不溶于盐酸的沉淀知 2- 2- 原溶液中有 SO4 0.02mol,由离子共存知 CO3 一定不存在,由电荷守恒知 Cl-一定存在。Al3+、K+可能存在。 A、至少存在 4 种离子,错误。 +2- B、当只存在 NH4 、Fe3+、SO4 、Cl-四种离子时,计算出 Cl-浓度等于 0.4 mol/L,假如原溶液还含有 Al3+或 K+等,则 c(Cl-)>0.4 mol/L。故 B 正确 C、错误。Cl-一定存在 D、错误。Al3+、K+可能存在。 易错点:这种溶液中无化合价升降的离子反应较易,分析清楚一般不会做错。 三、选择题(本题共 20 分,每小题 4 分,每小题有一个或两个正确选项。只有一个正确选 项的,多选不给分;有两个正确选项的,选对一个给 2 分,选错一个,该小题不给分) 18.汽车剧烈碰撞时,安全气囊中发生反应 10NaN3+2KNO3→K2O+5Na2O+16N2↑。若氧 化产物比还原产物多 1.75 mol,则下列判断正确的是 A.生成 40.0 L N2(标准状况) B.有 0.250molKNO3 被氧化 C.转移电子的物质的量为 1.25 mol D.被氧化的 N 原子的物质的量为 3.75 mol 解析:知识点:氧化还原反应的有关计算 难易程度:难 正确答案:CD 分析原因:首先分析出氧化产物与还原产物均为 N2,设还原产物为 Xmol,则氧化产物 为(X+1.75)mol,利用关系式 30X=2*(X+1.75)得 X=0.125mol A、生成氮气物质的量=16×0.125mol=2mol V=22.4L/mol×2mol=44.8L B、错误。有 0.250molKNO3 被还原 C 、 2molKNO3 被 还 原 时 转 移10mol 电 子 , 则 转 移 电 子 的 物 质 的 量 =0.250mol×5=1.25mol D、被氧化的 NaN3 的物质的量为 y,则 10/y=16/2 可得 y=1.25mol,则被氧化 的氮原子的物质的量=1.25mol×3=3.75mol 易错点:对氧化还原反应中氧化剂、氧化产物,还原剂,还原产物的判断不熟练。 不会分析反应中得失电子的量 19.部分弱酸的电离平衡常数如下表: 弱酸 HCOOH HCN H2CO3 电离平衡常数 (25℃) Ki=1.77×10-4 Ki=4.9×10-10 Ki1=4.3×10-7 Ki2=5.6×10-11 下列选项错误的是 2- A.2CN-+H2O+CO2→2HCN+CO3 2- B.2HCOOH+CO3 →2HCOO-+H2O+CO2↑ C.中和等体积、等 pH 的 HCOOH 和 HCN 消耗 NaOH 的量前者小于后者 D.等体积、等浓度的 HCOONa 和 NaCN 溶液中所含离子总数前者小于后者 解析:知识点:电离平衡常数 难易程度:难 正确答案:AD 分析原因:根据电离平衡常数,离子反应向着离子总量减小的方向进行,即强制弱。 -HCOOH >H2CO3 >HCN > HCO3 -2- A、 H2CO3 制 HCN ,合理,但产物是 HCO3 而不是 CO3 故不正确 B、 HCOOH 制 H2CO3 ,合理,H2CO3 不稳定,分解为 H2O 和 CO2 正 确C、 HCOOH 的酸浓度较大, 故 D、 电 离 常 数HCOOH HCOOH,故 NaCN 溶液中所含离子总数较多,选项不正确 易错点:容易漏选 A >HCN 等体积、等 pH 的 HCOOH 和 HCN,HCN 消耗 NaOH 的量多,正确 >HCN , 则 水 解 程 度HCN > 20.某恒温密闭容器中,可逆反应 A(s) B+C(g)-Q 达到平衡。缩小容器体积,重新达 到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是 A.产物 B 的状态只能为固态或液态 B.平衡时,单位时间内 n(A)消耗﹕n(C)消耗=1﹕1 C.保持体积不变,向平衡体系中加入 B,平衡可能向逆反应方向移动 D.若开始时向容器中加入 1 mol B 和 1 mol C,达到平衡时放出热量 Q 解析:知识点:化学反应速率及化学平衡 难易程度:易 正确答案:BC 分析原因:由题意知:缩小体积平衡向逆反应方向移动了,即平衡向体积减小的方向 移动。 不正确。产物 B 固、液、气三态均可,平衡时,正,逆反应速率相等, 正确 假如 B 是气态,则反应向逆反应方向移动,若 B 是固态或液态,则平衡 不移动。故选项 C 正确首先没有告诉 B,C 状态,其次状态相同达到等效 平衡状态,由于转化率不等,放出或吸收的热量也不等。故 D 不正确 易错点:相对较易,审题思路清晰容易做对 21.一定条件下,将 0.1 L CO、0.2 L CO2、0.1 L NO、0.2 L NO2 和 0.2 L NH3 混合,然后通 过分别盛有足量蒸馏水、饱和碳酸氢钠溶液和氢氧化钠溶液的三个洗气瓶(洗气瓶排列顺 序不确定)。假设气体通过每个洗气瓶都能充分反应则尾气(已干燥) A.可能是单一气体 B.不可能含有一氧化碳 C.可能存在原气体中的两种气体 解析:知识点:气体的除杂 难易程度:难 D.成分和洗气瓶的排列顺序无关 正确答案:AC 分析原因: A、CO2 可以被氢氧化钠溶液完全吸收,若混合气体最先通入氢氧化钠溶液则 NO 和 NO2 可以被强氧化钠完全吸收:NO + NO2 + 2NaOH →2NaNO2 + H2O 2NO2+2NaOH→NaNO3+NaNO2+H2O NH3 可以被饱和碳酸氢钠溶液完全吸 收。可能尾气只含 CO。B、不正确。尾气一定有 CO。C、若混合气体先通 过蒸馏水再通入氢氧化钠溶液中则尾气中可能 NO、CO 均有。D、分析 A、 C 选项知 D 选项错误。 易错点:容易漏选 A 22.一定量的 CuS 和 Cu2S 的混合物投入足量的 HNO3 中,收集到气体 VL(标准状况),向 2- 反应后的溶液中(存在 Cu2+和 SO4 )加入足量 NaOH,产生蓝色沉淀,过滤,洗涤,灼 烧,得到 CuO 12.0 g,若上述气体为 NO 和 NO2 的混合物,且体积比为 1﹕1,则 V 可能 为A.9.0L B.13.5L C.15.7L D.16.8L 解析:知识点:氧化还原反应的有关计算 难易程度:中 考察氧化还原反应得失电子相等的计算题 正确答案:A 分析原因:由 CuO 12.0 g 知铜元素的物质的量=12g/80g/mol=0.15mol 该题使用极值 法1、假设原混合物全部是 CuS,设生成 NO 物质的量为 X,则 NO2 物质的量 为 X 根据电子得失列等式:3X+X=0.15×8 得 x=0.3mol 则生成气体体 积=0.3×2×22.4L=13.44L 2、假设原混合物全部是 Cu2S,设生成 NO 物质的量为 X,则 NO2 物质的 量为 X 根据电子得失列等式:3X+X=0.15×1+0.15÷2×8 得 x=0.1875mol 则生成气体体积=0.1875×2×22.4L=8.4L 由 8.4<V<13.44 可知 A 选项正确 易错点:在第 2 种假设时容易误以为 Cu2S 为 0.15mol,误得 B 选项 四、(本题共 8 分) 金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。 完成下列填空: 23.铝原子核外电子云有 种不同的伸展方向,有 种不同运动状态的电子。 24.镓(Ga)与铝同主族。写出镓的氯化物和氨水反应的化学方程式。 25.硅与铝同周期。SiO2 是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14 也可写成 Na2O·CaO·6SiO2。盛放 NaOH 溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法 打开,发生反应的化学方程式 。长石是铝硅酸盐,不同类长石其氧原子的物质的量分数相同。由钠长石化学式 NaAlSi3O8 可推知钙长石的化学式为 26.用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如: 2Al+4BaO 高温 3Ba↑+BaO·Al2O3 常温下 Al 的金属性比 Ba 的金属性 (选填“强”、“弱”)。利用上述方法 可制取 Ba 的主要原因是 。a.高温时 Al 的活泼性大于 Ba b.高温有利于 BaO 分解 d.Ba 的沸点比 Al 的低 c.高温时 BaO•Al2O3 比 Al2O3 稳定 解析:知识点: 23、核外电子的排布情况 24、相似化学方程式推测和书写 25、正确化学式的判断 26、金属活动性的判断和低沸点制高沸点的原理 难易程度: 23 题第一问较难,第二问简单,24 简单,25 较难,26,简单但易错。 正确答案: 23.4,13。 24,GaCl3+3NH3+3H2O→Ga(OH)3↓+3NH4Cl。 25.SiO2+2NaOH→Na2SiO3+H2O,GaAl2Si2O8 26.弱,d 分析原因: 23.铝原子核外电子云有 s、p,分别有 1、3 种伸展方向,其核外有 13 个 电子,则有 13 种不同运动状态; 24.类似氯化铝与氨水溶液的反应; 25.根据不同类长石其氧原子的物质的量分数相同,结合化合价代数和是 0 可写出钙长石的化学式假设钙长石中的氧原子个数也为 8,则有 Ca、 Al、Si 三者的原子数之和为 5,且其阳离子所带电荷总数为 8*2=16,分 别设其原子数为 x、y、z 列方程组得:x+y+z=5,2x+3y+4z=16 有 y+2z=6, 设 y=2,则 z=2,其他值均不符合题意,所以 x=1。故其化学式为 CaAl2Si2O8。 26.该反应是利用 Ba 的沸点比 Al 的低,以气体逸出,使平衡右移 易错点: 23、第一空容易错填 25、容易写错化学式 26、容易多选 五、(本题共 8 分) 溴主要以 Br-形式存在于海水中,海水呈弱碱性。工业上制备的 Br2 的操作步骤为: ①一定条件下,将 Cl2 通入浓缩的海水中,生成 Br2 ②利用热空气将 Br2 吹出,并用浓 Na2CO3 溶液吸收,生成 NaBr、NaBrO3 等 ③用硫酸酸化步骤②得到的混合物 完成下列填空: 27.Cl2 氧化 Br-应在 条件下进行,目的是为了避免 28.Br2 可用热空气吹出,其原因是 29.写出步骤③所发生的化学反应方程式。 用硫酸而不用盐酸酸化的原因可能是 。步骤②的产 品有时运输到目的地后再酸化,主要是因为 30.为了除去工业 Br2 中微量的 Cl2,可向工业 Br2 中 a.通入 HBr b.加入 Na2CO3 溶液 c.加入 NaBr 溶液 d.加入 Na2SO3 溶 液解析:知识点: 27、氧化还原反应的条件选择和原因 28、溴单质的易挥发性 29、氧化还原的书写,硫酸的氧化性和盐酸的还原性 30、除杂的原理 难易程度:总体较简单,就是容易答不全,还有就是 30 题容易漏选。 正确答案: 27.酸性;Cl2 歧化(或 Br2 歧化) 28.Br2 易挥发(或 Br2 沸点低) 29.5NaBr+NaBrO3+3H2SO4→3Br2+3Na2SO4+3H2O;溴酸能将氯离子 氧化成氯气;溴单质具有强氧化性(或强腐蚀性) 30.ac 分析原因: 27、需在酸性条件下否则容易发生反应使得生成的溴单质再变成溴离子 28、能用空气吹,说明溴单质以挥发 29、实验的目的是为了制取溴单质,所以可以推测其中的一个产物是溴单 -质,那么说明是溴离子和 BrO3 发生氧化还原反应生成的,从而确定 了反应物和生成物,就可以写出化学方程式了,由于氯离子有还原性 会被氧化成氯气,所以应该用硫酸,在酸性条件下,溴具有腐蚀性, 所以应运输后再氧化 30、利用氧化还原的性质,知道氯气可以氧化溴离子,所以可以用带溴离 子的化合物来除杂 易错点: 29、化学方程式的产物容易判断错误 30、容易漏选 a 六、(本题共 8 分) 镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯 粗镍涉及的两步反应依次为: 50℃ 230℃ (1)Ni(s)+4CO(g) Ni(CO)4(g)+Q (2)Ni(CO)4(g) Ni(S)+4CO(g) 完成下列填空: 31 . 在 温 度 不 变 的 情 况 下 , 要 提 高 反 应 ( 1 ) 中Ni(CO4) 的 产 率 , 可 采 取 的 措 施 有、。32.已知在一定条件下的 2L 密闭容器中制备 Ni(CO)4,粗镍(纯度 98.5%,所含杂质不与 CO 反应)剩余质量和反应时间的关系如右图所示。Ni(CO)4 在 0~10min 的平均反应速率为 。33.若反应(2)达到平衡后,保持其他条件不变,降低温度,重新达到平衡时 a.平衡常数 K 增大 b.CO 的浓度减小 c.Ni 的质量减小 。d.v 逆[Ni(CO)4] 增大 34.简述羰基法提纯粗镍的操作过程。 解析: 知识点: 31、影响化学平衡的因素 32、平衡速率的计算 33、影响化学平衡的因素 34、化学的理解和归纳 难易程度:整体都比较简单。 正确答案: 31.加压;及时移走 Ni(CO)4,增大 CO 浓度 32.0.05mol/(L•min) 33.bc 34.先将粗镍与 CO 在 50℃反应生成羰基镍,然后将羰基镍转移到另一容器 中,升温到 230℃,热解得到纯镍。 分析原因: 31.反应(1)是正向气体体积缩小的放热反应,因此,根据平衡移动原理在温 度不变的情况下采取可增大 CO 浓度,加压的方法提高产率; 32.根据题意,反应的 Ni 为 1mol,则生成 Ni(CO) 4 为 1mol,反应速率为 1/ (2 ×10)=0.05 mol/(L•min); 33.反应(2)正向气体体积增大的吸热反应,则,降低温度平衡逆向移动,平 衡常数 K、CO 的浓度、Ni 的质量、v 逆[Ni(CO)4]减小;根据反应(1)(2) 的特点可提纯粗镍。 易错点: 33,容易多选一个 d,34 容易答不全 七、(本题共 12 分) 溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质。实验室用工业大理石 (含有少量 Al3+、Fe3+等杂质)制备溴化钙的主要流程如下: 完成下列填空: 35.上述使用的氢溴酸的质量分数为 26%,若用 47%的氢溴酸配置 26%的氢溴酸的氢溴酸 500 mL,所需的玻璃仪器有玻璃棒、___________。 +36.已知步骤Ⅲ的滤液中不含 NH4 。步骤Ⅱ加入的试剂 a 是___________,控制溶液的 pH 约为 8.0 的目的是___________、___________。 37.试剂 b 是___________,步骤Ⅳ的目的是______________________。 38.步骤Ⅴ所含的操作依次是___________、___________。 39.制得的溴化钙可以通过如下步骤测定其纯度: ①称取 4.00 g 无水溴化钙样品;②溶解;③滴入足量 Na2CO3 溶液,充分反应后过滤;④ ______________________ ; ⑤ 称 量 。 若 得 到1.88 g 碳 酸 钙 , 则 溴 化 钙 的 质 量 分 数 为 ___________(保留两位小数)。 若实验操作规范而测定结果偏低,其原因是______________________。 解析: 知识点: 此题考查化工生产流程的原理,涉及溶液的稀释、除杂的方法、结晶的方 法、定量分析和误差分析。 难易程度:中等,但是考查的知识点很细,要求孩子对每个实验步骤都有一个比较深 刻的理解。 正确答案:35.量筒、胶头滴管、烧杯、500ml 容量瓶。 36.石灰水,沉淀 Al3+、Fe3+ 37.氢溴酸,除去过量的氢氧化钙。 38.蒸发浓缩,冷却结晶。 39.洗涤、烘干、冷却;0.94;溴化钙吸水。 分析原因:35 题考查溶液稀释时用到的玻璃仪器:玻璃棒、烧杯、量筒、胶头滴管、 500ml 容量瓶。 36 题,结合题目中给出的杂质,要除去则需要加碱沉淀,滤液中不还铵根, 为不引入新杂质只能选择石灰水。控制溶液 pH 的目的也正是为了使之 沉淀完全。 37 题,本实验目的是为了制备氯化钙,所以溶液中过量的 Ca(OH) 属于 2杂质必须出去。氢溴酸具有挥发性,在结晶过程中不会产生影响,所以 即使过量了也不会产生影响。 38 题,溴化钙溶解度随温度的升高而增大,随意应该采用降温结晶的方法 得到晶体,具体步骤是:蒸发浓缩,然后冷却结晶。 39 题,过滤后表面存在滤液,故需要洗涤,后面需要称量,故需要烘干、 冷却。从生成的 1.88g 碳酸钙物质的量为 0.0188mol,所以原样品中溴化 钙也为 0.0188mol,其质量是 3.76g,所以质量分数为 0.94.。测定结果偏 低的原因可以从已知条件寻找突破口,溴化钙易潮解吸水是样品质量增 大,所以误差偏低。 易错点:易错点之一,步骤Ⅴ所含的操作,因为溴化钙是随温度升高溶解度增大的 物质,所以从应选用冷却热饱和溶液的结晶方法,然后过滤。易错点之二, 关于溴化钙纯度的测定结果偏低的误差原因分析,因为操作规范,所以重 点在于过程中由于物质性质造成的误差,从溴化钙、碳酸钙的性质来分析, 溴化钙易潮解,所以称取的4.00g 样品可能因为潮解而使得含量偏低。 八、(本题共 12 分) 二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成 酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重 要。 完成下列填空: 40.实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。 如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发 生装置是___________(填写字母)。 41.若用硫酸和亚硫酸钠反应制取 3.36 L(标准状况)二氧化硫,至少需要称取亚硫酸钠 ___________g(保留一位小数);如果已有 4.0%亚硫酸钠(质量分数)被氧化成硫酸钠,则 至少需称取该亚硫酸钠___________g(保留一位小数)。 42.实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰-石膏法和碱法是常用 的烟气脱硫法。 石灰-石膏法的吸收反应为 SO2+Ca(OH)2→CaSO3↓+H2O。吸收产物亚硫酸钙由管道输 送至氧化塔氧化,反应为 2CaSO3+O2+4H2O→2CaSO4·2H2O。其流程如下图: 碱法的吸收反应为 SO2+2NaOH→Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收 快、效率高。其流程如下图: 已知: 试剂 Ca(OH)2 0.36 NaOH 2.90 价格(元/kg) 吸收 SO2 的成本(元/mol) 0.027 0.232 石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是______________________。和 碱法相比,石灰-石膏法的优点是______________________,缺点是______________________。 43.在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用 流程图表示)。 解析:知识点:此题考查二氧化硫的制备、尾气处理、方案的评价和流程设计。 难易程度:本题相对来说难度中等偏上,偏重探究能力和思维能力的考察。 正确答案:40.ae 41.18.9 ,33.1 42.酸性氧化物与碱的反应。成本低;吸收慢,效率低。 43. 分析原因: 40 题,用硫酸和亚硫酸钠反应制取二氧化硫,不需加热,所以 a 排除; 亚硫酸钠易溶于水不能选启普发生器或其简易装置,所以 c 排除;b 不 能控制反应速率,不合题意。 41 题,3.36 升二氧化硫为 0.15mol,根据硫元素守恒,所需亚硫酸钠也为 0.15mol,质量为 18.9g。设含 40%的亚硫酸钠的样品质量为 100g,则生 成硫酸钠的质量为 45.1g,则这时亚硫酸钠的质量分数为(100-40) /100-40+45.1=57.1%,则至少需称取该亚硫酸钠 18.9/57.1%=33.1g。 42 题,相同之处都是酸性氧化物与碱反应;由框图知石灰-石膏法更便宜, 但是效率低,速度慢。 43 题,两种方法各有优缺点,设计改进的方案就可以综合两种方法的优 点从而得出结论。 易错点:易错点之一,石灰-石膏法的缺点判断,容易将氢氧化钠的特点反过来作为 石灰–石膏法的缺点,而事实上,应结合题干信息“吸收产物亚硫酸钙由 管道输送至氧化塔氧化”,根据亚硫酸钙是沉淀的来判断主要问题是可能 堵塞管道。易错点之二,烟气脱硫方案的流程图,因为要实现物料循环, 结合两种方法的优点和弊端多种因素考虑,先用氢氧化钠吸收,然后转化 成硫酸钙,将成本较高的氢氧化钠循环使用,既降低了成本、吸收效果又 好、还有副产物石膏。 九、(本题共 10 分) 异构化可得到三元乙丙橡胶的第三单体 。由 A (C5H6)和 B 经 Diels-Alder 反应制得。Diels-Alder 反应为共轭双烯与含有烯键或炔键的化合 物 相 互 作 生 成 六 元 环 状 化 合 物 的 反 应 , 最 简 单 的Diels-Alder 反 应 是 。完成下列填空: 44 . Diels-Alder 反 应 属 于 _____________ 反 应 ( 填 反 应 类 型 ); A 的 结 构 简 式 为 _____________。 45.写出与 互为同分异构,且一溴代物只有两种的芳香烃的名称。 写出生成这两种一溴代物所需要的反应试剂和反应条件。 46.B 与 Cl2 的 1,2-加成产物消去 HCl 得到 2-氯代二烯烃,该二烯烃和丙烯酸(CH2=CHCOOH) 聚合得到的聚合物可改进氯丁橡胶的耐寒性和加工性能,写出该聚合物的结构简式。 47.写出实验室由 的属于芳香烃的同分异构体的同系物制备 的合成 反应试剂 反应试剂 路线,(合成路线常用的表示方式为:A B…… 目标产物) 反应条件 反应条件 解析:知识点:考查有机物的性质、结构、转化、同分异构、反应类型、合成路线的设计等, 考查推理能力及提取信息的能力。 难易程度:中等,考察的基本还是比较基础的,平时的练习中有关 D-A 的反应也会有练 习正确答案:44.加成; 45.1,3,5-三甲苯(或均三甲苯、间三甲苯);Br2/光照、Br2/Fe(反应试剂 和条件前后可以颠倒) 46. (合理即给分) 47 .(合理即给分) 分析原因:44 从题干中 1,3-丁二烯与乙烯反应生成环己烯可知该反应两个分子生成 一个新的分子且原子全部利用,符合加成反应的特点;利用该反应的原理逆 推可知 A 的结构为 45 的分子式为 C 9 H12 ,不饱和度为 4,所以除了含有苯环外, 剩余的均为饱和结构,且能够满足一溴代物有两种的只有 1,3,5—三甲 苯,一种是取代到苯环上,条件是在铁做催化剂的时候,一种是取代到烷 烃上,条件是光照。 46 B物质是 1,3-丁二烯,与氯气加成后又消去一分子 HCl,得到的是 2-氯 -1,3-丁二烯,其与丙烯酸的加聚得到 47 目标产物是苯甲醛,我们可以采用逆推法,可知苯甲醛←苯甲醇←一氯甲 苯←甲苯 易错点 :本题 45 题在做的时候有可能出错,两种情况估计会考虑不全面。 十、(本题共 12 分) 沐舒坦(结构简式为 ,不考虑立体异构)是临床上使用广 泛的祛痰药,下图所示的其多条合成路线中的一条(反应试剂和反应条件均未标出)。 完成下列填空: 48.写出反应试剂和反应条件。 反应①_____________ 49.写出反应类型。 反应③_____________ 50.写出结构简式。 反应⑤_____________ 反应⑥_____________ A__________________________ B__________________________ 51.反应⑥中除加入反应试剂 C 外,还需要加入 K2CO3,其目的是为了中和___________, 防止__________________________。 52.写出两种 C 的能发生水解反应,且只含 3 种不同化学环境氢原子的同分异构体的结构简 式。 53 . 反 应 ② 、 反 应 ③ 的 顺 序 不 能 颠 倒 , 其 原 因 是 _________________________ 、 _________________________。 解析:知识点:考查有机物的性质、结构简式、转化、同分异构、反应类型、反应条件控制 等,考查推理能力,有序思维能力、提取信息的能力、分析问题解决问题的 能力。 难易程度:本题相对来说难度中等偏上,偏重推理能力和思维能力的考察。 正确答案:48.浓硝酸/浓硫酸,加热;Br2/CH3COOH(或 Br2/Fe 或 CH3OH/浓硫酸, 加热) 49.还原反应;取代反应 50. 51.HCl;反应物 52. 与HCl成盐 (任写两种,合理即给分) 53.苯环上的氨基易被氧化;苯环上的羧基不易被还原 分析原因: 48 本题运用正逆推相结合的方法可知 C7H8 是甲苯,通过反应 1,少了一 个氢,多了硝基,可知是硝化反应,所以反应 1 条件为浓硝酸,浓硫酸, 水浴加热;通过反映 2 后多了两个氧,少了两个氢,前后观察,并结合已 知条件可知反应 2 是甲基的氧化,通过反应 3,少了两个氧,多了两个氢, 可知为还原过程,即硝基的还原,又从反应后的产物可知 A 为邻氨基苯 甲酸,通过反应 4 和 5 ,分别是溴化和酯化的过程,其先后顺序对反应 无大的影响,所以反应 5 的条件为 Br 2 加热,或甲醇,浓硫酸,加热 49 通过以上分析可知反应 3 为还原反应,反应 6 为取代反应 50 根据以上分析,A 为 ,B 为 51 根据沐舒坦的结构可知反应 6 为取代反应,生成的副产物还有盐酸,所 以加入碳酸钾的目的是中和 HCl,防止产品不纯, 52 能发生水解的可以是酯,或者酰胺,但是 C 中只含有一个氧,所以只 能是酰胺的结构,因为只含有三种不同环境的氢,所以结构必须高度对 称,所以可以写出一下几种结构(CH3)CONHCH3、(CH3)CH2CONH2、 32(CH3)2CHCON(CH3)2、 CH3CON(CH2CH3)2 53 –NH2 有还原性,易被氧化,因此,-NO2 的还原性在-NH2 的氧化之后, 即反应②,反应③的顺序不能颠倒。 易错点:本题相对来说 B 物质的推断不是很好推,最后一问是两空,很多学生都 答出来氨基易被氧化,但是羧基不易被还原可能答不出来。 十一、(本题共 14 分) 碳酸氢钠俗称“小苏打”,是氨碱法和联合制碱法制纯碱的中间产物,可用作膨松剂、 制酸剂、灭火剂等。工业上用纯碱溶液碳酸化制取碳酸氢钠。 54.某碳酸氢钠样品中含有少量氯化钠。称取该样品,用 0.1000 mol/L 盐酸滴定,耗用盐酸 20.00 mL。若改用 0.05618 mol/L 硫酸滴定,需用硫酸___________mL(保留两位小数)。 55.某溶液组成如表一: 表一 NaHCO 化合物 Na2CO3 NaCl 97.3 3质量(kg) 814.8 400.3 向该溶液通入二氧化碳,析出碳酸氢钠晶体。取出晶体后溶液组成如表二: 表二 NaHCO 化合物 Na2CO3 137.7 NaCl 97.3 3质量(kg) 428.8 计算析出的碳酸氢钠晶体的质量(保留 1 位小数)。 56.将组成如表二的溶液加热,使碳酸氢钠部分分解,溶液中 NaHCO3 的质量由 428.8 kg 降 为 400.3 kg,补加适量碳酸钠,使溶液组成回到表一状态。计算补加的碳酸钠质量(保留 1 位小数)。 57.某种由碳酸钠和碳酸氢钠组成的晶体 452 kg 溶于水,然后通入二氧化碳,吸收二氧化碳 44.8×103 L(标准状况),获得纯的碳酸氢钠溶液,测得溶液中含碳酸氢钠 504 kg。通过计算 确定该晶体的化学式。 解析:知识点:碳酸氢钠的滴定计算、化学方程式的计算、化学式的计算 难易程度:54、简单 55、中等,两个方程式即可以得出相关结果 56、中等,与 55 类似 57、较难,一方面数值比较大,另一方面方法 正确答案:54.17.80 55. 1044.6(kg) 56. 659.1(kg) 57. Na2CO3·NaHCO3·2H2O 分析原因: 54、根据反应可知消耗的 H2SO4 质量是 HCl 的一半,即 0.1×20×0.5=0.05618 ×V,V=17.80mL 55、有表一和表二中 Na2CO3 的量可知,反应消耗的 m(Na2CO3 ) =814.8kg—137.7kg=677.1kg;设通入 CO2 后生成的 NaHCO3 的质量为 xkg, 由: Na2CO3+CO2+H2O→2 Na H CO3 106 168 677.1g x得 x=1073.1kg 则 析 出 的 碳 酸 氢 钠 晶 体 的 质 量 : m ( NaHCO3 ) =1073.1kg— (428.8kg—400.3kg)= 1044.6kg; 56、表二中 NaH CO3 的质量比表一多 428.8kg—400.3kg=28.5kg,加热分解 可到 Na2CO3 的质量设为 ykg 2 Na H CO3→Na2CO3+CO2+H2O 168 106 y28.5kg 得 y=17.98kg 则补加的碳酸纳质量(814.8kg-137.7kg)-17.98kg=659.1kg 57、设改晶体的化学式为 aNa2CO3·bNaHCO3·cH2O,则根据题意: 通入 CO2 的物质的量 n(CO2)=44.8×103 L÷22.4mol/L=2000mol 则 n(Na2CO3)=n(CO2)=2000mol 设通入 CO2 后生成的 NaHCO3 的物质的量为 zmol,由: Na2CO3+CO2+H2O→2 Na H CO3 122000mol z得 z=4000mol 则原来的 NaHCO3 的物质的量 n(NaHCO3)=(504000g÷84mol/g) 水 的 物 质 的 量n ( H2O ) =[452000—( 106×2000+84×2000 ) ] ÷ 所 以a ︰ b ︰ c=1 ︰ 1 ︰ 2 , 故 该 晶 体 的 化 学 式 为 —4000mol=2000mol 18=4000mol Na2CO3·NaHCO3·2H2O 易错点: 计算题的分值由 16 分减少到 14 分,难度不大,常见的题型。但是由于前 面的题相对来说比较难,以至于没有时间来做,使得原来可以得到的分白 白失去。
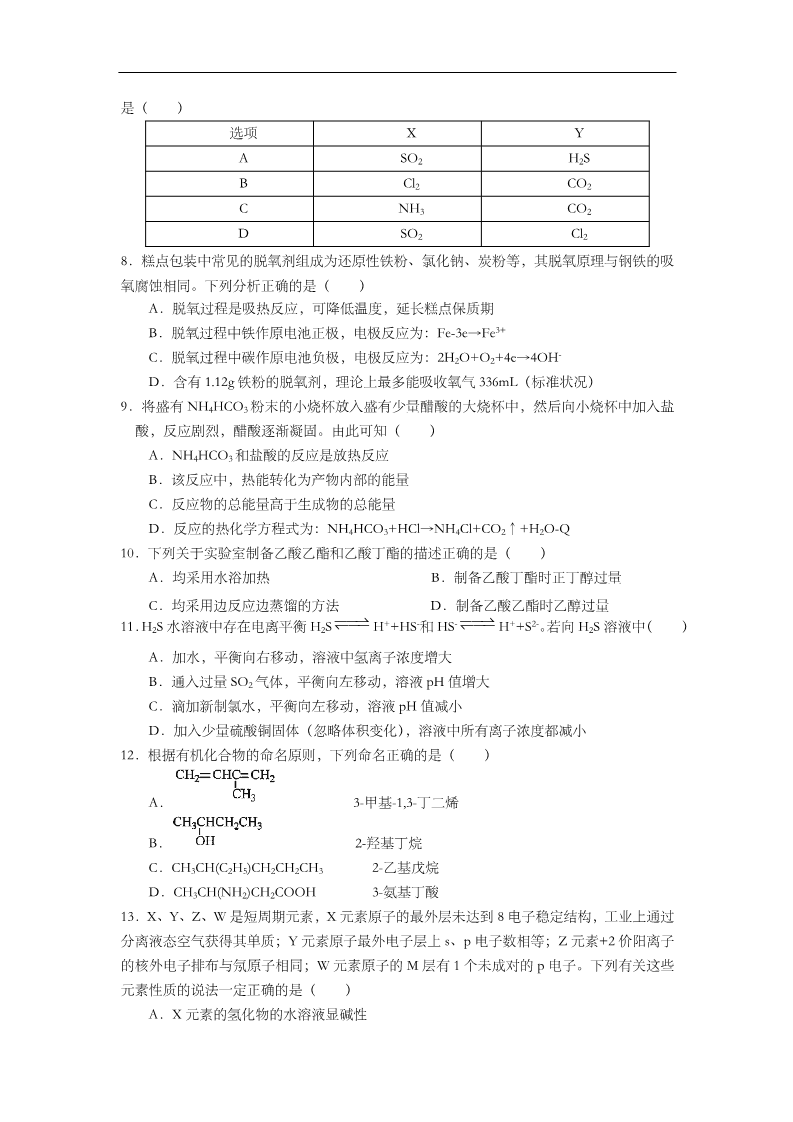
2013年全国普通高等学校招生统一考试 上海化学试卷 考生注意: 1.本试卷满分 l50分,考试时问 120分钟· 2.本考试设试卷和答题纸两部分,试卷包括试题与答题要求;所有答题必须涂(选择 题)或写(非选择题)在答题纸上;做在试卷上一律不得分。 3.答题前,考生务必在答题纸上用钢笔或圆珠笔清楚填写姓名、准考证号,并将核对后 的条形码贴在指定位置上。 4.答题纸与试卷在试题编号上是一一对应的,答题时应特别注意,不能错位。 相对原子质量:H-1 C-12 O-16 Na-23 S-32 Ca-40 Fe-56Ni-59 Cu-64 Br-80 Ba-137 一、选择题(本题共 10 分,每小题 2 分,每题只有一个正确选项) 1.2013 年 4 月 24 日,东航首次成功进行了由地沟油生产的生物航空燃油的验证飞行。能区 别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是( A.点燃,能燃烧的是矿物油 )B.测定沸点,有固定沸点的是矿物油 C.加入水中,浮在水面上的是地沟油 D.加入足量氢氧化钠溶液共热,不分层的是地沟油 2.氰酸铵(NH4OCN)与尿素[CO(NH2)2] ( A.都是共价化合物 )B.都是离子化合物 D.互为同素异形体 C.互为同分异构体 3.230Th 和 232Th 是钍的两种同位素,232Th 可以转化成 233U。下列有关 Th 的说法正确的是 ()A.Th 元素的质量数是 232 C.232Th 转换成 233U 是化学变化 B.Th 元素的相对原子质量是 231 D.230Th 和 232Th 的化学性质相同 )4.下列变化需克服相同类型作用力的是( A.碘和干冰的升华 B.硅和 C60 的熔化 C.氯化氢和氯化钠的溶解 D.溴和汞的气化 5.374℃、22.1MPa 以上的超临界水具有很强的溶解有机物的能力,并含有较多的 H+和 OH-,由此可知超临界水( A.显中性,pH 等于 7 C.显酸性,pH 小于 7 )B.表现出非极性溶剂的特性 D.表现出极性溶剂的特性 二、选择题(本大题共 36 分,每小题 3 分,每题只有一个正确选项) 6.与索尔维制碱法相比,侯德榜制碱法最突出的优点是( )A.原料利用率高 B.设备少 C.循环利用的物质多 D.原料易得 7.将 X 气体通入 BaCl2 溶液,未见沉淀生成,然后通入 Y 气体,有沉淀生成。X、Y 不可能 是( )选项 AXYSO2 Cl2 H2S CO2 CO2 Cl2 BCNH3 SO2 D8.糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸 氧腐蚀相同。下列分析正确的是( )A.脱氧过程是吸热反应,可降低温度,延长糕点保质期 B.脱氧过程中铁作原电池正极,电极反应为:Fe-3e→Fe3+ C.脱氧过程中碳作原电池负极,电极反应为:2H2O+O2+4e→4OH- D.含有 1.12g 铁粉的脱氧剂,理论上最多能吸收氧气 336mL(标准状况) 9.将盛有 NH4HCO3 粉末的小烧杯放入盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐 酸,反应剧烈,醋酸逐渐凝固。由此可知( A.NH4HCO3 和盐酸的反应是放热反应 B.该反应中,热能转化为产物内部的能量 C.反应物的总能量高于生成物的总能量 )D.反应的热化学方程式为:NH4HCO3+HCl→NH4Cl+CO2↑+H2O-Q 10.下列关于实验室制备乙酸乙酯和乙酸丁酯的描述正确的是( )A.均采用水浴加热 B.制备乙酸丁酯时正丁醇过量 C.均采用边反应边蒸馏的方法 D.制备乙酸乙酯时乙醇过量 – +-+2- 11.H2S 水溶液中存在电离平衡 H2S H +HS和 HS H +S 。若向 H2S 溶液中( )A.加水,平衡向右移动,溶液中氢离子浓度增大 B.通入过量 SO2 气体,平衡向左移动,溶液 pH 值增大 C.滴加新制氯水,平衡向左移动,溶液 pH 值减小 D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小 12.根据有机化合物的命名原则,下列命名正确的是( )A. 3-甲基-1,3-丁二烯 B. 2-羟基丁烷 2-乙基戊烷 3-氨基丁酸 C.CH3CH(C2H5)CH2CH2CH3 D.CH3CH(NH2)CH2COOH 13.X、Y、Z、W 是短周期元素,X 元素原子的最外层未达到 8 电子稳定结构,工业上通过 分离液态空气获得其单质;Y 元素原子最外电子层上 s、p 电子数相等;Z 元素+2 价阳离子 的核外电子排布与氖原子相同;W 元素原子的 M 层有 1 个未成对的 p 电子。下列有关这些 元素性质的说法一定正确的是( )A.X 元素的氢化物的水溶液显碱性 B.Z 元素的离子半径大于 W 元素的离子半径 C.Z 元素的单质在一定条件下能与 X 元素的单质反应 D.Y 元素最高价氧化物的晶体具有很高的熔点和沸点 14.为测定镀锌铁皮锌镀层的厚度,将镀锌皮与足量盐酸反应,待产生的气泡明显减少时取 出,洗涤,烘干,称重。关于该实验的操作对测定结果的影响判断正确的是 A.铁皮未及时取出,会导致测定结果偏小 B.铁皮未洗涤干净,会导致测定结果偏大 C.烘干时间过长,会导致测定结果偏小 D.若把盐酸换成硫酸,会导致测定结果偏大 15.NA 代表阿伏伽德罗常数。已知 C2H4 和 C3H6 的混合物的质量为 ag,则该混合物 A.所含共用电子对数目为(a/7+1)NA C.燃烧时消耗的 O2 一定是 33.6a/14 L B.所含碳氢键数目为 aNA/7 D.所含原子总数为 aNA/14 16.已知氧化性 Br2>Fe3+。FeBr2 溶液中通入一定量的 Cl2,发生反应的离子方程式为: a Fe2++b Br-+c Cl2→d Fe3++ e Br2+ f Cl- 下列选项中的数字与离子方程式中的 a、b、c、d、e、f 一一对应,其中不符合反应实 际的是 A.2 43226B.0 21012C.2 01202D.2 222142- 2- +17.某溶液可能含有 Cl-、SO4 、CO3 、NH4 、Fe3+、Al3+和 K+。取该溶液 100mL,加入过 量 NaOH 溶液,加热,得到 0.02mol 气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得 到 1.6 g 固体;向上述滤液中加足量 BaCl2 溶液,得到 4.66 g 不溶于盐酸的沉淀。由此可知 原溶液中 A.至少存在 5 种离子 B.Cl-一定存在,且 c(Cl-)≥0.4 mol/L 2- +C.SO4 、NH4 一定存在,Cl-可能不存在 2- D.CO3 、Al3+一定不存在,K+可能存在 三、选择题(本题共 20 分,每小题 4 分,每小题有一个或两个正确选项。只有一个正确选 项的,多选不给分;有两个正确选项的,选对一个给 2 分,选错一个,该小题不给分) 18.汽车剧烈碰撞时,安全气囊中发生反应 10NaN3+2KNO3→K2O+5Na2O+16N2↑。若氧 化产物比还原产物多 1.75 mol,则下列判断正确的是 A.生成 40.0 L N2(标准状况) B.有 0.250molKNO3 被氧化 C.转移电子的物质的量为 1.25 mol D.被氧化的 N 原子的物质的量为 3.75 mol 19.部分弱酸的电离平衡常数如下表: 弱酸 HCOOH HCN H2CO3 电离平衡常数 Ki=1.77×10-4 Ki=4.9×10-10 Ki1=4.3×10-7 (25℃) Ki2=5.6×10-11 下列选项错误的是 2- A.2CN-+H2O+CO2→2HCN+CO3 2- B.2HCOOH+CO3 →2HCOO-+H2O+CO2↑ C.中和等体积、等 pH 的 HCOOH 和 HCN 消耗 NaOH 的量前者小于后者 D.等体积、等浓度的 HCOONa 和 NaCN 溶液中所含离子总数前者小于后者 20.某恒温密闭容器中,可逆反应 A(s) B+C(g)-Q 达到平衡。缩小容器体积,重新达 到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是 A.产物 B 的状态只能为固态或液态 B.平衡时,单位时间内 n(A)消耗﹕n(C)消耗=1﹕1 C.保持体积不变,向平衡体系中加入 B,平衡可能向逆反应方向移动 D.若开始时向容器中加入 1 mol B 和 1 mol C,达到平衡时放出热量 Q 21.一定条件下,将 0.1 L CO、0.2 L CO2、0.1 L NO、0.2 L NO2 和 0.2 L NH3 混合,然后通 过分别盛有足量蒸馏水、饱和碳酸氢钠溶液和氢氧化钠溶液的三个洗气瓶(洗气瓶排列顺 序不确定)。假设气体通过每个洗气瓶都能充分反应则尾气(已干燥) A.可能是单一气体 B.不可能含有一氧化碳 C.可能存在原气体中的两种气体 D.成分和洗气瓶的排列顺序无关 22.一定量的 CuS 和 Cu2S 的混合物投入足量的 HNO3 中,收集到气体 VL(标准状况),向 2- 反应后的溶液中(存在 Cu2+和 SO4 )加入足量 NaOH,产生蓝色沉淀,过滤,洗涤,灼 烧,得到 CuO 12.0 g,若上述气体为 NO 和 NO2 的混合物,且体积比为 1﹕1,则 V 可能 为A.9.0L B.13.5L C.15.7L D.16.8L 四、(本题共 8 分) 金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。 完成下列填空: 23.铝原子核外电子云有 种不同的伸展方向,有 种不同运动状态的电子。 24.镓(Ga)与铝同主族。写出镓的氯化物和氨水反应的化学方程式。 25.硅与铝同周期。SiO2 是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14 也可写成 Na2O·CaO·6SiO2。盛放 NaOH 溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法 打开,发生反应的化学方程式 。长石是铝硅酸盐,不同类长石其氧原子的物质的量分数相同。由钠长石化学式 NaAlSi3O8 可推知钙长石的化学式为 26.用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如: 2Al+4BaO 高温 3Ba↑+BaO·Al2O3 常温下 Al 的金属性比 Ba 的金属性 (选填“强”、“弱”)。利用上述方法 可制取 Ba 的主要原因是 。a.高温时 Al 的活泼性大于 Ba b.高温有利于 BaO 分解 c.高温时 BaO•Al2O3 比 Al2O3 稳定 五、(本题共 8 分) d.Ba 的沸点比 Al 的低 溴主要以 Br-形式存在于海水中,海水呈弱碱性。工业上制备的 Br2 的操作步骤为: ①一定条件下,将 Cl2 通入浓缩的海水中,生成 Br2 ②利用热空气将 Br2 吹出,并用浓 Na2CO3 溶液吸收,生成 NaBr、NaBrO3 等 ③用硫酸酸化步骤②得到的混合物 完成下列填空: 27.Cl2 氧化 Br-应在 条件下进行,目的是为了避免 28.Br2 可用热空气吹出,其原因是 29.写出步骤③所发生的化学反应方程式。 用硫酸而不用盐酸酸化的原因可能是 。步骤②的产 品有时运输到目的地后再酸化,主要是因为 30.为了除去工业 Br2 中微量的 Cl2,可向工业 Br2 中 a.通入 HBr b.加入 Na2CO3 溶液 d.加入 Na2SO3 溶液 c.加入 NaBr 溶液 六、(本题共 8 分) 镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯 粗镍涉及的两步反应依次为: 50℃ 230℃ (1)Ni(s)+4CO(g) Ni(CO)4(g)+Q (2)Ni(CO)4(g) Ni(S)+4CO(g) 完成下列填空: 31 . 在 温 度 不 变 的 情 况 下 , 要 提 高 反 应 ( 1 ) 中Ni(CO4) 的 产 率 , 可 采 取 的 措 施 有、。32.已知在一定条件下的 2L 密闭容器中制备 Ni(CO)4,粗镍(纯度 98.5%,所含杂质不与 CO 反应)剩余质量和反应时间的关系如右图所示。Ni(CO)4 在 0~10min 的平均反应速率为 。33.若反应(2)达到平衡后,保持其他条件不变,降低温度,重新达到平衡时 a.平衡常数 K 增大 b.CO 的浓度减小 c.Ni 的质量减小 。d.v 逆[Ni(CO)4] 增大 34.简述羰基法提纯粗镍的操作过程。 七、(本题共 12 分) 溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质。实验室用工业大理石 (含有少量 Al3+、Fe3+等杂质)制备溴化钙的主要流程如下: 完成下列填空: 35.上述使用的氢溴酸的质量分数为 26%,若用 47%的氢溴酸配置 26%的氢溴酸的氢溴酸 500 mL,所需的玻璃仪器有玻璃棒、___________。 +36.已知步骤Ⅲ的滤液中不含 NH4 。步骤Ⅱ加入的试剂 a 是___________,控制溶液的 pH 约为 8.0 的目的是___________、___________。 37.试剂 b 是___________,步骤Ⅳ的目的是______________________。 38.步骤Ⅴ所含的操作依次是___________、___________。 39.制得的溴化钙可以通过如下步骤测定其纯度: ①称取 4.00 g 无水溴化钙样品;②溶解;③滴入足量 Na2CO3 溶液,充分反应后过滤;④ ______________________ ; ⑤ 称 量 。 若 得 到1.88 g 碳 酸 钙 , 则 溴 化 钙 的 质 量 分 数 为 ___________(保留两位小数)。 若实验操作规范而测定结果偏低,其原因是______________________。 八、(本题共 12 分) 二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成 酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重 要。 完成下列填空: 40.实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。 如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发 生装置是___________(填写字母)。 41.若用硫酸和亚硫酸钠反应制取 3.36 L(标准状况)二氧化硫,至少需要称取亚硫酸钠 ___________g(保留一位小数);如果已有 4.0%亚硫酸钠(质量分数)被氧化成硫酸钠,则 至少需称取该亚硫酸钠___________g(保留一位小数)。 42.实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰-石膏法和碱法是常用 的烟气脱硫法。 石灰-石膏法的吸收反应为 SO2+Ca(OH)2→CaSO3↓+H2O。吸收产物亚硫酸钙由管道输 送至氧化塔氧化,反应为 2CaSO3+O2+4H2O→2CaSO4·2H2O。其流程如下图: 碱法的吸收反应为 SO2+2NaOH→Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收 快、效率高。其流程如下图: 已知: 试剂 Ca(OH)2 0.36 NaOH 2.90 价格(元/kg) 吸收 SO2 的成本(元/mol) 0.027 0.232 石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是______________________。和 碱法相比,石灰-石膏法的优点是______________________,缺点是______________________。 43.在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用 流程图表示)。 九、(本题共 10 分) 异构化可得到三元乙丙橡胶的第三单体 。由 A (C5H6)和 B 经 Diels-Alder 反应制得。Diels-Alder 反应为共轭双烯与含有烯键或炔键的化合 物 相 互 作 生 成 六 元 环 状 化 合 物 的 反 应 , 最 简 单 的Diels-Alder 反 应 是 。完成下列填空: 44 . Diels-Alder 反 应 属 于 _____________ 反 应 ( 填 反 应 类 型 ); A 的 结 构 简 式 为 _____________。 45.写出与 互为同分异构,且一溴代物只有两种的芳香烃的名称。 写出生成这两种一溴代物所需要的反应试剂和反应条件。 46.B 与 Cl2 的 1,2-加成产物消去 HCl 得到 2-氯代二烯烃,该二烯烃和丙烯酸(CH2=CHCOOH) 聚合得到的聚合物可改进氯丁橡胶的耐寒性和加工性能,写出该聚合物的结构简式。 47.写出实验室由 的属于芳香烃的同分异构体的同系物制备 的合成 反应试剂 反应试剂 路线,(合成路线常用的表示方式为:A B…… 目标产物) 反应条件 反应条件 十、(本题共 12 分) 沐舒坦(结构简式为 ,不考虑立体异构)是临床上使用广 泛的祛痰药,下图所示的其多条合成路线中的一条(反应试剂和反应条件均未标出)。 完成下列填空: 48.写出反应试剂和反应条件。 反应①_____________ 49.写出反应类型。 反应③_____________ 50.写出结构简式。 反应⑤_____________ 反应⑥_____________ A__________________________ B__________________________ 51.反应⑥中除加入反应试剂 C 外,还需要加入 K2CO3,其目的是为了中和___________, 防止__________________________。 52.写出两种 C 的能发生水解反应,且只含 3 种不同化学环境氢原子的同分异构体的结构简 式。 53 . 反 应 ② 、 反 应 ③ 的 顺 序 不 能 颠 倒 , 其 原 因 是 _________________________ 、 _________________________。 十一、(本题共 14 分) 碳酸氢钠俗称“小苏打”,是氨碱法和联合制碱法制纯碱的中间产物,可用作膨松剂、 制酸剂、灭火剂等。工业上用纯碱溶液碳酸化制取碳酸氢钠。 54.某碳酸氢钠样品中含有少量氯化钠。称取该样品,用 0.1000 mol/L 盐酸滴定,耗用盐酸 20.00 mL。若改用 0.05618 mol/L 硫酸滴定,需用硫酸___________mL(保留两位小数)。 55.某溶液组成如表一: 表一 Na2CO3 814.8 NaHCO 化合物 NaCl 97.3 3质量(kg) 400.3 向该溶液通入二氧化碳,析出碳酸氢钠晶体。取出晶体后溶液组成如表二: 表二 NaHCO 化合物 Na2CO3 NaCl 97.3 3质量(kg) 137.7 428.8 计算析出的碳酸氢钠晶体的质量(保留 1 位小数)。 56.将组成如表二的溶液加热,使碳酸氢钠部分分解,溶液中 NaHCO3 的质量由 428.8 kg 降 为 400.3 kg,补加适量碳酸钠,使溶液组成回到表一状态。计算补加的碳酸钠质量(保留 1 位小数)。 57.某种由碳酸钠和碳酸氢钠组成的晶体 452 kg 溶于水,然后通入二氧化碳,吸收二氧化碳 44.8×103 L(标准状况),获得纯的碳酸氢钠溶液,测得溶液中含碳酸氢钠 504 kg。通过计算 确定该晶体的化学式。 2013年全国普通高等学校招生统一考试 上海化学试卷参考答案 Ⅰ卷(66 分) 一、单项选择题(本题包括 1-5 题,共 10 分,每小题 2 分。) 12345DCDAB二、单项选择题(本题包括 6-17 题,共 36 分,每小题 3 分。) 678910 D11 C12 D13 C14 C15 B16 B17 BABDB三、不定项选择题(本题包括 18-22 题,共 20 分,每小题 4 分。每小题有一个或两个正确 选项。只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给 2 分,选错一个 该小题不给分。) 18 19 20 21 22 ACD AD BC AC Ⅱ卷(84 分) 四、(本题共 8 分) 23.4;13 24.GaCl3+3NH3+3H2O→Ga(OH)3↓+3NH4Cl 25.SiO2+2NaOH→Na2SiO3+H2O;GaAl2Si2O8 26.弱;d。 五、(本题共 8 分) 27.酸性;Cl2 歧化(或 Br2 歧化) 28.Br2 易挥发(或 Br2 沸点低) 29.5NaBr+NaBrO3+3H2SO4→3Br2+3Na2SO4+3H2O;溴酸能将氯离子氧化成氯气;溴具有 强氧化性(或强腐蚀性) 30.ac 六、(本题共 8 分) 31.加压;及时移走 Ni(CO)4 32.0.05mol/(L•min) 33.bc 34.先将粗镍与 CO 在 50℃反应生成羰基镍,然后将羰基镍转移到另一容器中,升温到 230 ℃,热解得到纯镍。 七、(本题共 12 分) 35.烧杯、量筒 36.氢氧化钙;确保 Fe3+和 Al3+沉淀完全,防止氢氧化铝溶解 37.氢溴酸;除去过量的氢氧化钙 38.蒸发浓缩,冷却结晶;过滤 39.烘干、冷却;0.94;溴化钙吸水 八、(本题共 12 分) 40.ae 41.18.9;19.8 42.碱和酸性氧化物的反应;成本低;亚硫酸钙在输送中容易造成管道堵塞 43.答案示例: 九、(本题共 10 分) 44.加成; 45.1,3,5-三甲苯(或均三甲苯、间三甲苯);Br2/光照、Br2/Fe(反应试剂和条件前后可以 颠倒) 46. (合理即给分) 47. (合理即给 分) 十、(本题共 12 分) 48.浓硝酸/浓硫酸,加热;Br2/CH3COOH(或 Br2/Fe 或 CH3OH/浓硫酸,加热) 49.还原反应;取代反应 50. 51.HCl;反应物 52. 与HCl成盐 (任写两种,合理即给分) 53.苯环上的氨基易被氧化;苯环上的羧基不易被还原 十一、(本题共 14 分) 54.17.80 55.(814.8-137.7) ÷106×84.0×2-(428.8-400.3)=1044.6(kg) 56.814.8-137.7-(428.8-400.3)×106÷168=659.1(kg) 57.设该晶体的化学式为 aNa2CO3·bNaHCO3·nH2O n(Na2CO3)=n(CO2)=44.8×103÷22.4=2000(mol) n(NaHCO3)=504÷84.4×1000-2000×2=2000(mol) n(H2O)=[452000-(106×2000+84.0×2000)]÷18.0=4000(mol) ∴a:b:n=2:2:4=1:1:2 该晶体的化学式为 Na2CO3·NaHCO3·2H2O 2013年全国普通高等学校招生统一考试 上海化学试卷解析 考生注意: 1.本试卷满分 l50分,考试时问 120分钟· 2.本考试设试卷和答题纸两部分,试卷包括试题与答题要求;所有答题必须涂(选择 题)或写(非选择题)在答题纸上;做在试卷上一律不得分。 3.答题前,考生务必在答题纸上用钢笔或圆珠笔清楚填写姓名、准考证号,并将核对 后的条形码贴在指定位置上。 4.答题纸与试卷在试题编号上是一一对应的,答题时应特别注意,不能错位。 相对原子质量:H-1 C-12 O-16 Na-23 S-32 Ca-40 Fe-56Ni-59 Cu-64 Br-80 Ba-137 一、选择题(本题共 10 分,每小题 2 分,每题只有一个正确选项) 1.2013 年 4 月 24 日,东航首次成功进行了由地沟油生产的生物航空燃油的验证飞行。能区 别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是( A.点燃,能燃烧的是矿物油 )B.测定沸点,有固定沸点的是矿物油 C.加入水中,浮在水面上的是地沟油 D.加入足量氢氧化钠溶液共热,不分层的是地沟油 解析:知识点:生活与化学,考察有机物知识,主要是油脂和矿物油区别。 难易程度:简单,注重基础知识掌握,没有大的陷阱。 正确答案:D 分析原因:地沟油的主要成分是油脂,矿物油的主要成分是烃的混合物。A、油脂和 烃都可以燃烧,故无法区分;B、矿物油主要成分是烃的混合物,没有固 定的沸点;C、油脂和烃的密度都比水小,都浮在水上面;D、油脂在氢 氧化钠溶液可水解而不分层,矿物油不溶于氢氧化钠溶液,分层。故正确 答案为:D 易错点:无法区分地沟油和矿物油的主要成分。 2.氰酸铵(NH4OCN)与尿素[CO(NH2)2] ( A.都是共价化合物 )B.都是离子化合物 D.互为同素异形体 C.互为同分异构体 解析:知识点:物质的分类,考察共价化合物、离子化合物、同分异构体、同素异形体的概 念。 难易程度:简单,注重基础知识概念。 正确答案:C +分析原因:氰酸铵中含有 NH4 离子,故氰酸铵是离子化合物,而尿素是共价化合物, 故 A、B 都错误;B、;C、同分异构体是化学式相同、结构不同的物质, 故氰酸铵(NH4OCN)与尿素[CO(NH2)2]是同分异构体;D、同素异形体 是同种元素组成的不同单质,故不是同素异形体。故正确答案为:C 易错点:不会区分共价化合物和离子化合物。 3.230Th 和 232Th 是钍的两种同位素,232Th 可以转化成 233U。下列有关 Th 的说法正确的是 ()A.Th 元素的质量数是 232 C.232Th 转换成 233U 是化学变化 B.Th 元素的相对原子质量是 231 D.230Th 和 232Th 的化学性质相同 解析:知识点:同位素,考察质量数、相对原子质量、化学变化和化学性质。 难易程度:比较简单,注重基础知识掌握,C 有陷阱。 正确答案:D 分析原因:A、由于 Th 元素有两种同位素原子,所以质量数应指定是哪一种同位素 原子,才能确定;B、Th 元素的相对原子质量不是同位素原子质量数的平 均值,而需要按照各种同位素原子的丰度计算得到的;C、原子是化学变 化中的最小微粒,而 232Th 转换成 233U 的过程中,原子发生变化,故不是 化学变化(化学变化过程中原子种类不变的);D、230Th 和 232Th 是同种 元素的原子,所以化学性质相同。故正确答案为:D 易错点:遗忘了化学变化的本质。 4.下列变化需克服相同类型作用力的是( A.碘和干冰的升华 )B.硅和 C60 的熔化 D.溴和汞的气化 C.氯化氢和氯化钠的溶解 解析:知识点:化学键,考察范德华力、共价键、离子键的知识。 难易程度:比较简单,注重基础知识掌握。 正确答案:A 分析原因:A、“碘和干冰的升华”需克服的作用力都是范德华力;B、单质硅是原子 晶体,熔化时克服共价键,C60 是分子晶体,熔化需克服共价键 C、氯化 氢是分子晶体,溶解时共价键断裂,氯化钠都是离子晶体,溶解需克服离 子键;D、溴气化需克服范德华力,而汞气化需克服金属键。故正确答案 为:A 易错点:不清楚硅和 C60 的熔化需克服的作用力。 5.374℃、22.1MPa 以上的超临界水具有很强的溶解有机物的能力,并含有较多的 H+和 OH-,由此可知超临界水( A.显中性,pH 等于 7 C.显酸性,pH 小于 7 )B.表现出非极性溶剂的特性 D.表现出极性溶剂的特性 解析:知识点:物质的分类,考察共价化合物、离子化合物、同分异构体、同素异形体的概 念。 难易程度:中等,考察的是知识的灵活迁移。 正确答案:B 分析原因:A、C:温度为 374℃、22.1MPa 以上的超临界水,已经超过室温,此时的 PH 值已经小于 7,但溶液中的 H+和 OH-始终相等,故显中性;B、D: 由于 374℃、22.1MPa 以上的超临界水具有很强的溶解有机物的能力,而 有机物多数为非极性的,所以表现出非极性溶剂的特性。故正确答案为: B易错点:不清楚水的离子积与 pH 的关系。 二、选择题(本大题共 36 分,每小题 3 分,每题只有一个正确选项) 6.与索尔维制碱法相比,侯德榜制碱法最突出的优点是( )A.原料利用率高 B.设备少 C.循环利用的物质多 D.原料易得 解析:知识点:索维尔制碱法和侯氏制碱法的对比。 难易程度:简单,对比学习的综合应用。 正确答案:A 分析原因:A、B、C、D 都是侯氏制碱法的优点,但最突出的优点是原料利用率高。 工业生产都是以最少的原料获得最多的产物。故正确答案为:A 易错点:不清楚侯氏制碱法和索尔维制碱法的区别。 7.将 X 气体通入 BaCl2 溶液,未见沉淀生成,然后通入 Y 气体,有沉淀生成。X、Y 不可能 是( )选项 AXYSO2 Cl2 H2S CO2 CO2 Cl2 BCNH3 SO2 D解析:知识点:元素及化合物的性质。 难易程度:简单,注重基础知识掌握,没有大的陷阱。 正确答案:B 分析原因:A、将 SO2 通入 BaCl2 溶液,不反应,但通入的 H2S 发生反应生成 2H2S+ SO2→3S↓+2H2O 生成 S 沉淀;B、始终不反应无现象;C、反应为 2NH3+ H2O+ CO2 + BaCl2→2NH4Cl+BaCO3↓ ; D 项 发 生 反 应 : SO2+Cl2+2H2O→H2SO4+2HCl2,BaCl2+H2SO4→BaSO4↓+2HCl。因此选 B 易错点:容易误选 C,不清楚 C 中发生的反应。 8.糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸 氧腐蚀相同。下列分析正确的是( )A.脱氧过程是吸热反应,可降低温度,延长糕点保质期 B.脱氧过程中铁作原电池正极,电极反应为:Fe-3e→Fe3+ C.脱氧过程中碳作原电池负极,电极反应为:2H2O+O2+4e→4OH- D.含有 1.12g 铁粉的脱氧剂,理论上最多能吸收氧气 336mL(标准状况) 解析:知识点:氧化还原反应中铁的吸氧腐蚀。 难易程度:一般,注重基础知识掌握,D 选项容易忘了 Fe(OH)2 可以进一步被氧化。 正确答案:D 分析原因:A、吸氧腐蚀时是放热反应;B、正极反应为Fe-2e→Fe2+;C、脱氧过程中, 铁 作 原 电 池 负 极 , 碳 作 原 电 池 的 正 极 , 电 极 反 应 为 : 2H2O+O2+4e→4OH-;D、总反应生成Fe(OH)2,但Fe(OH)2可以进一步被 氧化:4Fe(OH)2+O2+2H2O→4Fe(OH)3,所以消耗氧气的总量在标准状况 下为336mL。故正确答案为:D 易错点:不清楚反应是最终产物是 Fe(OH)3。 9.将盛有 NH4HCO3 粉末的小烧杯放入盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐 酸,反应剧烈,醋酸逐渐凝固。由此可知( A.NH4HCO3 和盐酸的反应是放热反应 B.该反应中,热能转化为产物内部的能量 C.反应物的总能量高于生成物的总能量 )D.反应的热化学方程式为:NH4HCO3+HCl→NH4Cl+CO2↑+H2O-Q 解析:知识点:热化学方程式。 难易程度:简单,注重概念的理解。 正确答案:B 分析原因:A、反应后醋酸逐渐凝固,故该反应为吸热反应;B、吸热反应,能量转 化为产物内部能量;C、是吸热反应则反应物的总能量低于生成物的总能 量;D、热化学方程式需要标注反应物和生成物的状态。故正确答案为: B易错点:不了解反应中的热效应。 10.下列关于实验室制备乙酸乙酯和乙酸丁酯的描述正确的是( )A.均采用水浴加热 B.制备乙酸丁酯时正丁醇过量 D.制备乙酸乙酯时乙醇过量 C.均采用边反应边蒸馏的方法 解析:知识点:有机物的制备。 难易程度:中等,注重基础知识掌握。 正确答案:D 分析原因:A、制备乙酸乙酯需要的温度是 60℃—70℃可水浴加热,制备乙酸丁酯需 要的温度是 115℃—125℃,超过 100℃,只能用空气浴,直接加热;B、D: 制备乙酸丁酯时,乙酸需要过量,因为温度高时,醇过量脱水引入新杂质; 制备乙酸乙酯时,乙醇需要过量,一方面是乙醇相对乙酸成本较低,另一 方面是乙酸过量可能会使乙酸乙酯在酸性条件下发生水解;C、只有制备 乙酸丁酯利用了蒸馏方法;故正确答案为:D 易错点:不熟悉乙酸丁酯的实验室制法。 – +-+2- 11.H2S 水溶液中存在电离平衡 H2S H +HS和 HS H +S 。若向 H2S 溶液中( )A.加水,平衡向右移动,溶液中氢离子浓度增大 B.通入过量 SO2 气体,平衡向左移动,溶液 pH 值增大 C.滴加新制氯水,平衡向左移动,溶液 pH 值减小 D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小 解析:知识点:电离平衡和化学平衡。 难易程度:中等,C 理解有一定的争议。 正确答案:C 分析原因:A、加水,平衡向右移动,但溶液中氢离子浓度减小;B、通入过量 SO2 气体,平衡向左移动,溶液 pH 值减小;C、滴加新制氯水,溶液中 H+ 浓度增大,平衡向左移动,溶液 pH 值减小;D、加入少量硫酸铜固体 (忽略体积变化),由于生产 CuS 沉淀,平衡向右移动,溶液中 H+、S2- 浓度都减小,但 OH-浓度增大。故正确答案为:C 易错点:不清楚影响平衡移动的原因。 12.根据有机化合物的命名原则,下列命名正确的是( )A. 3-甲基-1,3-丁二烯 B. 2-羟基丁烷 2-乙基戊烷 3-氨基丁酸 C.CH3CH(C2H5)CH2CH2CH3 D.CH3CH(NH2)CH2COOH 解析:知识点:有机化合物命名。 难易程度:简单,对命名总结。 正确答案:D 分析原因:A、2-甲基-1,3-丁二烯;B、2-丁醇;C、2-甲基己烷。故正确答案为:D 易错点:没有以最长碳链为主链去命名。 13.X、Y、Z、W 是短周期元素,X 元素原子的最外层未达到 8 电子稳定结构,工业上通过 分离液态空气获得其单质;Y 元素原子最外电子层上 s、p 电子数相等;Z 元素+2 价阳离子 的核外电子排布与氖原子相同;W 元素原子的 M 层有 1 个未成对的 p 电子。下列有关这些 元素性质的说法一定正确的是( )A.X 元素的氢化物的水溶液显碱性 B.Z 元素的离子半径大于 W 元素的离子半径 C.Z 元素的单质在一定条件下能与 X 元素的单质反应 D.Y 元素最高价氧化物的晶体具有很高的熔点和沸点 解析:知识点:物质结构和元素周期律。 难易程度:中等,比较注重基础知识掌握。 正确答案:C 分析原因:A、X 元素为 O 或 N,氢化物的水溶液显中性或碱性;B、Z 元素为 Mg, W 元素为 Al 或 Cl,离子半径无法比较;C、Mg 在一定条件下能与 O2 或 N2 反应;D、Y 元素为 C 或 Si,其中最高价氧化物 CO2 为分子晶体,熔 沸点都低。故正确答案为:C 易错点:没有判断出 X 元素有两种可能。 14.为测定镀锌铁皮锌镀层的厚度,将镀锌皮与足量盐酸反应,待产生的气泡明显减少时取 出,洗涤,烘干,称重。关于该实验的操作对测定结果的影响判断正确的是 A.铁皮未及时取出,会导致测定结果偏小 B.铁皮未洗涤干净,会导致测定结果偏大 C.烘干时间过长,会导致测定结果偏小 D.若把盐酸换成硫酸,会导致测定结果偏大 解析:知识点:定量试验之镀锌铁皮锌的厚度测定,测定原理:利用镀锌铁皮质量差除以表 面积除以 2 难易程度:中 正确答案:C 分析原因: A 选项会导致质量差偏大以致结果偏大 B 选项会导致质量差偏小以致结果偏小, C 烘干时间过长可能铁被氧化质量增重致质量差偏小以致结果偏小, D 对测定结果无影响 易错点:测定原理不能熟练应用 15.NA 代表阿伏伽德罗常数。已知 C2H4 和 C3H6 的混合物的质量为 ag,则该混合物 A.所含共用电子对数目为(a/7+1)NA B.所含碳氢键数目为 aNA/7 D.所含原子总数为 aNA/14 C.燃烧时消耗的 O2 一定是 33.6a/14 L 解析:知识点:原子结构相关考点 难易程度:易 正确答案:B 分析原因:依题意知乙烯与丙烯的混合比例与题无关,可设烯烃的分子式为 CnH2n , 则 混 合 物 的 物 质 的 量 为 : a/14n A. 共 用 电 子 对 数 目 为3n * NA *a/14n=3a/14.B.氢键数目为 2n*NA*a/14n=aNA/7 C.非标况下不能用气体 摩尔体积 22.4L/mol.D.所含原子总数为 3n*NA*a/14n=3a/14 易错点:相关概念理解不清 16.已知氧化性 Br2>Fe3+。FeBr2 溶液中通入一定量的 Cl2,发生反应的离子方程式为: a Fe2++b Br-+c Cl2→d Fe3++ e Br2+ f Cl- 下列选项中的数字与离子方程式中的 a、b、c、d、e、f 一一对应,其中不符合反应实 际的是 A.2 C.2 4031222062B.0 D.2 2212021124解析:知识点:氧化还原反应 难易程度:中 正确答案:B 分析原因:由氧化性 Br2>Fe3+知还原性 Fe2+>Br-,则亚铁优先与 Cl2 反应,则 先发 生 2Fe2++Cl2→2Fe3++ 2Cl-,C 选项正确,亚铁反应完之后,Br-与 Cl2 反应, 则可能发生 2Fe2++2Br-+2Cl2→2 Fe3++ Br2+ 4Cl- (Cl2 量不足,Br-部分被 氧化) D 选项正确,也可能发生 2Fe2++4Br-+3Cl2→2 Fe3++ 2Br2+ 6Cl- (Cl2 量充足,Br-被全部氧化),A 选项正确。B 选项是 Br-优先与 Cl2 反应, 错误 易错点:氧化还原氧化性还原性强弱比较不清楚,反应物量对反应的影响没有考虑到。 2- 2- +17.某溶液可能含有 Cl-、SO4 、CO3 、NH4 、Fe3+、Al3+和 K+。取该溶液 100mL,加入过 量 NaOH 溶液,加热,得到 0.02mol 气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得 到 1.6 g 固体;向上述滤液中加足量 BaCl2 溶液,得到 4.66 g 不溶于盐酸的沉淀。由此可知 原溶液中 A.至少存在 5 种离子 B.Cl-一定存在,且 c(Cl-)≥0.4 mol/L 2- +C.SO4 、NH4 一定存在,Cl-可能不存在 2- D.CO3 、Al3+一定不存在,K+可能存在 解析:知识点:溶液中离子间的反应及其计算 难易程度:易 正确答案:B +分析原因:分析知 0.02mol 气体为 NH3.则原溶液中含有 NH4 0.02mol,红褐色沉淀 灼烧,得到 1.6 g 固体,可计算知 Fe3+0.02mol,4.66 g 不溶于盐酸的沉淀知 2- 2- 原溶液中有 SO4 0.02mol,由离子共存知 CO3 一定不存在,由电荷守恒知 Cl-一定存在。Al3+、K+可能存在。 A、至少存在 4 种离子,错误。 +2- B、当只存在 NH4 、Fe3+、SO4 、Cl-四种离子时,计算出 Cl-浓度等于 0.4 mol/L,假如原溶液还含有 Al3+或 K+等,则 c(Cl-)>0.4 mol/L。故 B 正确 C、错误。Cl-一定存在 D、错误。Al3+、K+可能存在。 易错点:这种溶液中无化合价升降的离子反应较易,分析清楚一般不会做错。 三、选择题(本题共 20 分,每小题 4 分,每小题有一个或两个正确选项。只有一个正确选 项的,多选不给分;有两个正确选项的,选对一个给 2 分,选错一个,该小题不给分) 18.汽车剧烈碰撞时,安全气囊中发生反应 10NaN3+2KNO3→K2O+5Na2O+16N2↑。若氧 化产物比还原产物多 1.75 mol,则下列判断正确的是 A.生成 40.0 L N2(标准状况) B.有 0.250molKNO3 被氧化 C.转移电子的物质的量为 1.25 mol D.被氧化的 N 原子的物质的量为 3.75 mol 解析:知识点:氧化还原反应的有关计算 难易程度:难 正确答案:CD 分析原因:首先分析出氧化产物与还原产物均为 N2,设还原产物为 Xmol,则氧化产物 为(X+1.75)mol,利用关系式 30X=2*(X+1.75)得 X=0.125mol A、生成氮气物质的量=16×0.125mol=2mol V=22.4L/mol×2mol=44.8L B、错误。有 0.250molKNO3 被还原 C 、 2molKNO3 被 还 原 时 转 移10mol 电 子 , 则 转 移 电 子 的 物 质 的 量 =0.250mol×5=1.25mol D、被氧化的 NaN3 的物质的量为 y,则 10/y=16/2 可得 y=1.25mol,则被氧化 的氮原子的物质的量=1.25mol×3=3.75mol 易错点:对氧化还原反应中氧化剂、氧化产物,还原剂,还原产物的判断不熟练。 不会分析反应中得失电子的量 19.部分弱酸的电离平衡常数如下表: 弱酸 HCOOH HCN H2CO3 电离平衡常数 (25℃) Ki=1.77×10-4 Ki=4.9×10-10 Ki1=4.3×10-7 Ki2=5.6×10-11 下列选项错误的是 2- A.2CN-+H2O+CO2→2HCN+CO3 2- B.2HCOOH+CO3 →2HCOO-+H2O+CO2↑ C.中和等体积、等 pH 的 HCOOH 和 HCN 消耗 NaOH 的量前者小于后者 D.等体积、等浓度的 HCOONa 和 NaCN 溶液中所含离子总数前者小于后者 解析:知识点:电离平衡常数 难易程度:难 正确答案:AD 分析原因:根据电离平衡常数,离子反应向着离子总量减小的方向进行,即强制弱。 -HCOOH >H2CO3 >HCN > HCO3 -2- A、 H2CO3 制 HCN ,合理,但产物是 HCO3 而不是 CO3 故不正确 B、 HCOOH 制 H2CO3 ,合理,H2CO3 不稳定,分解为 H2O 和 CO2 正 确C、 HCOOH 的酸浓度较大, 故 D、 电 离 常 数HCOOH HCOOH,故 NaCN 溶液中所含离子总数较多,选项不正确 易错点:容易漏选 A >HCN 等体积、等 pH 的 HCOOH 和 HCN,HCN 消耗 NaOH 的量多,正确 >HCN , 则 水 解 程 度HCN > 20.某恒温密闭容器中,可逆反应 A(s) B+C(g)-Q 达到平衡。缩小容器体积,重新达 到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是 A.产物 B 的状态只能为固态或液态 B.平衡时,单位时间内 n(A)消耗﹕n(C)消耗=1﹕1 C.保持体积不变,向平衡体系中加入 B,平衡可能向逆反应方向移动 D.若开始时向容器中加入 1 mol B 和 1 mol C,达到平衡时放出热量 Q 解析:知识点:化学反应速率及化学平衡 难易程度:易 正确答案:BC 分析原因:由题意知:缩小体积平衡向逆反应方向移动了,即平衡向体积减小的方向 移动。 不正确。产物 B 固、液、气三态均可,平衡时,正,逆反应速率相等, 正确 假如 B 是气态,则反应向逆反应方向移动,若 B 是固态或液态,则平衡 不移动。故选项 C 正确首先没有告诉 B,C 状态,其次状态相同达到等效 平衡状态,由于转化率不等,放出或吸收的热量也不等。故 D 不正确 易错点:相对较易,审题思路清晰容易做对 21.一定条件下,将 0.1 L CO、0.2 L CO2、0.1 L NO、0.2 L NO2 和 0.2 L NH3 混合,然后通 过分别盛有足量蒸馏水、饱和碳酸氢钠溶液和氢氧化钠溶液的三个洗气瓶(洗气瓶排列顺 序不确定)。假设气体通过每个洗气瓶都能充分反应则尾气(已干燥) A.可能是单一气体 B.不可能含有一氧化碳 C.可能存在原气体中的两种气体 解析:知识点:气体的除杂 难易程度:难 D.成分和洗气瓶的排列顺序无关 正确答案:AC 分析原因: A、CO2 可以被氢氧化钠溶液完全吸收,若混合气体最先通入氢氧化钠溶液则 NO 和 NO2 可以被强氧化钠完全吸收:NO + NO2 + 2NaOH →2NaNO2 + H2O 2NO2+2NaOH→NaNO3+NaNO2+H2O NH3 可以被饱和碳酸氢钠溶液完全吸 收。可能尾气只含 CO。B、不正确。尾气一定有 CO。C、若混合气体先通 过蒸馏水再通入氢氧化钠溶液中则尾气中可能 NO、CO 均有。D、分析 A、 C 选项知 D 选项错误。 易错点:容易漏选 A 22.一定量的 CuS 和 Cu2S 的混合物投入足量的 HNO3 中,收集到气体 VL(标准状况),向 2- 反应后的溶液中(存在 Cu2+和 SO4 )加入足量 NaOH,产生蓝色沉淀,过滤,洗涤,灼 烧,得到 CuO 12.0 g,若上述气体为 NO 和 NO2 的混合物,且体积比为 1﹕1,则 V 可能 为A.9.0L B.13.5L C.15.7L D.16.8L 解析:知识点:氧化还原反应的有关计算 难易程度:中 考察氧化还原反应得失电子相等的计算题 正确答案:A 分析原因:由 CuO 12.0 g 知铜元素的物质的量=12g/80g/mol=0.15mol 该题使用极值 法1、假设原混合物全部是 CuS,设生成 NO 物质的量为 X,则 NO2 物质的量 为 X 根据电子得失列等式:3X+X=0.15×8 得 x=0.3mol 则生成气体体 积=0.3×2×22.4L=13.44L 2、假设原混合物全部是 Cu2S,设生成 NO 物质的量为 X,则 NO2 物质的 量为 X 根据电子得失列等式:3X+X=0.15×1+0.15÷2×8 得 x=0.1875mol 则生成气体体积=0.1875×2×22.4L=8.4L 由 8.4<V<13.44 可知 A 选项正确 易错点:在第 2 种假设时容易误以为 Cu2S 为 0.15mol,误得 B 选项 四、(本题共 8 分) 金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。 完成下列填空: 23.铝原子核外电子云有 种不同的伸展方向,有 种不同运动状态的电子。 24.镓(Ga)与铝同主族。写出镓的氯化物和氨水反应的化学方程式。 25.硅与铝同周期。SiO2 是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14 也可写成 Na2O·CaO·6SiO2。盛放 NaOH 溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法 打开,发生反应的化学方程式 。长石是铝硅酸盐,不同类长石其氧原子的物质的量分数相同。由钠长石化学式 NaAlSi3O8 可推知钙长石的化学式为 26.用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如: 2Al+4BaO 高温 3Ba↑+BaO·Al2O3 常温下 Al 的金属性比 Ba 的金属性 (选填“强”、“弱”)。利用上述方法 可制取 Ba 的主要原因是 。a.高温时 Al 的活泼性大于 Ba b.高温有利于 BaO 分解 d.Ba 的沸点比 Al 的低 c.高温时 BaO•Al2O3 比 Al2O3 稳定 解析:知识点: 23、核外电子的排布情况 24、相似化学方程式推测和书写 25、正确化学式的判断 26、金属活动性的判断和低沸点制高沸点的原理 难易程度: 23 题第一问较难,第二问简单,24 简单,25 较难,26,简单但易错。 正确答案: 23.4,13。 24,GaCl3+3NH3+3H2O→Ga(OH)3↓+3NH4Cl。 25.SiO2+2NaOH→Na2SiO3+H2O,GaAl2Si2O8 26.弱,d 分析原因: 23.铝原子核外电子云有 s、p,分别有 1、3 种伸展方向,其核外有 13 个 电子,则有 13 种不同运动状态; 24.类似氯化铝与氨水溶液的反应; 25.根据不同类长石其氧原子的物质的量分数相同,结合化合价代数和是 0 可写出钙长石的化学式假设钙长石中的氧原子个数也为 8,则有 Ca、 Al、Si 三者的原子数之和为 5,且其阳离子所带电荷总数为 8*2=16,分 别设其原子数为 x、y、z 列方程组得:x+y+z=5,2x+3y+4z=16 有 y+2z=6, 设 y=2,则 z=2,其他值均不符合题意,所以 x=1。故其化学式为 CaAl2Si2O8。 26.该反应是利用 Ba 的沸点比 Al 的低,以气体逸出,使平衡右移 易错点: 23、第一空容易错填 25、容易写错化学式 26、容易多选 五、(本题共 8 分) 溴主要以 Br-形式存在于海水中,海水呈弱碱性。工业上制备的 Br2 的操作步骤为: ①一定条件下,将 Cl2 通入浓缩的海水中,生成 Br2 ②利用热空气将 Br2 吹出,并用浓 Na2CO3 溶液吸收,生成 NaBr、NaBrO3 等 ③用硫酸酸化步骤②得到的混合物 完成下列填空: 27.Cl2 氧化 Br-应在 条件下进行,目的是为了避免 28.Br2 可用热空气吹出,其原因是 29.写出步骤③所发生的化学反应方程式。 用硫酸而不用盐酸酸化的原因可能是 。步骤②的产 品有时运输到目的地后再酸化,主要是因为 30.为了除去工业 Br2 中微量的 Cl2,可向工业 Br2 中 a.通入 HBr b.加入 Na2CO3 溶液 c.加入 NaBr 溶液 d.加入 Na2SO3 溶 液解析:知识点: 27、氧化还原反应的条件选择和原因 28、溴单质的易挥发性 29、氧化还原的书写,硫酸的氧化性和盐酸的还原性 30、除杂的原理 难易程度:总体较简单,就是容易答不全,还有就是 30 题容易漏选。 正确答案: 27.酸性;Cl2 歧化(或 Br2 歧化) 28.Br2 易挥发(或 Br2 沸点低) 29.5NaBr+NaBrO3+3H2SO4→3Br2+3Na2SO4+3H2O;溴酸能将氯离子 氧化成氯气;溴单质具有强氧化性(或强腐蚀性) 30.ac 分析原因: 27、需在酸性条件下否则容易发生反应使得生成的溴单质再变成溴离子 28、能用空气吹,说明溴单质以挥发 29、实验的目的是为了制取溴单质,所以可以推测其中的一个产物是溴单 -质,那么说明是溴离子和 BrO3 发生氧化还原反应生成的,从而确定 了反应物和生成物,就可以写出化学方程式了,由于氯离子有还原性 会被氧化成氯气,所以应该用硫酸,在酸性条件下,溴具有腐蚀性, 所以应运输后再氧化 30、利用氧化还原的性质,知道氯气可以氧化溴离子,所以可以用带溴离 子的化合物来除杂 易错点: 29、化学方程式的产物容易判断错误 30、容易漏选 a 六、(本题共 8 分) 镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯 粗镍涉及的两步反应依次为: 50℃ 230℃ (1)Ni(s)+4CO(g) Ni(CO)4(g)+Q (2)Ni(CO)4(g) Ni(S)+4CO(g) 完成下列填空: 31 . 在 温 度 不 变 的 情 况 下 , 要 提 高 反 应 ( 1 ) 中Ni(CO4) 的 产 率 , 可 采 取 的 措 施 有、。32.已知在一定条件下的 2L 密闭容器中制备 Ni(CO)4,粗镍(纯度 98.5%,所含杂质不与 CO 反应)剩余质量和反应时间的关系如右图所示。Ni(CO)4 在 0~10min 的平均反应速率为 。33.若反应(2)达到平衡后,保持其他条件不变,降低温度,重新达到平衡时 a.平衡常数 K 增大 b.CO 的浓度减小 c.Ni 的质量减小 。d.v 逆[Ni(CO)4] 增大 34.简述羰基法提纯粗镍的操作过程。 解析: 知识点: 31、影响化学平衡的因素 32、平衡速率的计算 33、影响化学平衡的因素 34、化学的理解和归纳 难易程度:整体都比较简单。 正确答案: 31.加压;及时移走 Ni(CO)4,增大 CO 浓度 32.0.05mol/(L•min) 33.bc 34.先将粗镍与 CO 在 50℃反应生成羰基镍,然后将羰基镍转移到另一容器 中,升温到 230℃,热解得到纯镍。 分析原因: 31.反应(1)是正向气体体积缩小的放热反应,因此,根据平衡移动原理在温 度不变的情况下采取可增大 CO 浓度,加压的方法提高产率; 32.根据题意,反应的 Ni 为 1mol,则生成 Ni(CO) 4 为 1mol,反应速率为 1/ (2 ×10)=0.05 mol/(L•min); 33.反应(2)正向气体体积增大的吸热反应,则,降低温度平衡逆向移动,平 衡常数 K、CO 的浓度、Ni 的质量、v 逆[Ni(CO)4]减小;根据反应(1)(2) 的特点可提纯粗镍。 易错点: 33,容易多选一个 d,34 容易答不全 七、(本题共 12 分) 溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质。实验室用工业大理石 (含有少量 Al3+、Fe3+等杂质)制备溴化钙的主要流程如下: 完成下列填空: 35.上述使用的氢溴酸的质量分数为 26%,若用 47%的氢溴酸配置 26%的氢溴酸的氢溴酸 500 mL,所需的玻璃仪器有玻璃棒、___________。 +36.已知步骤Ⅲ的滤液中不含 NH4 。步骤Ⅱ加入的试剂 a 是___________,控制溶液的 pH 约为 8.0 的目的是___________、___________。 37.试剂 b 是___________,步骤Ⅳ的目的是______________________。 38.步骤Ⅴ所含的操作依次是___________、___________。 39.制得的溴化钙可以通过如下步骤测定其纯度: ①称取 4.00 g 无水溴化钙样品;②溶解;③滴入足量 Na2CO3 溶液,充分反应后过滤;④ ______________________ ; ⑤ 称 量 。 若 得 到1.88 g 碳 酸 钙 , 则 溴 化 钙 的 质 量 分 数 为 ___________(保留两位小数)。 若实验操作规范而测定结果偏低,其原因是______________________。 解析: 知识点: 此题考查化工生产流程的原理,涉及溶液的稀释、除杂的方法、结晶的方 法、定量分析和误差分析。 难易程度:中等,但是考查的知识点很细,要求孩子对每个实验步骤都有一个比较深 刻的理解。 正确答案:35.量筒、胶头滴管、烧杯、500ml 容量瓶。 36.石灰水,沉淀 Al3+、Fe3+ 37.氢溴酸,除去过量的氢氧化钙。 38.蒸发浓缩,冷却结晶。 39.洗涤、烘干、冷却;0.94;溴化钙吸水。 分析原因:35 题考查溶液稀释时用到的玻璃仪器:玻璃棒、烧杯、量筒、胶头滴管、 500ml 容量瓶。 36 题,结合题目中给出的杂质,要除去则需要加碱沉淀,滤液中不还铵根, 为不引入新杂质只能选择石灰水。控制溶液 pH 的目的也正是为了使之 沉淀完全。 37 题,本实验目的是为了制备氯化钙,所以溶液中过量的 Ca(OH) 属于 2杂质必须出去。氢溴酸具有挥发性,在结晶过程中不会产生影响,所以 即使过量了也不会产生影响。 38 题,溴化钙溶解度随温度的升高而增大,随意应该采用降温结晶的方法 得到晶体,具体步骤是:蒸发浓缩,然后冷却结晶。 39 题,过滤后表面存在滤液,故需要洗涤,后面需要称量,故需要烘干、 冷却。从生成的 1.88g 碳酸钙物质的量为 0.0188mol,所以原样品中溴化 钙也为 0.0188mol,其质量是 3.76g,所以质量分数为 0.94.。测定结果偏 低的原因可以从已知条件寻找突破口,溴化钙易潮解吸水是样品质量增 大,所以误差偏低。 易错点:易错点之一,步骤Ⅴ所含的操作,因为溴化钙是随温度升高溶解度增大的 物质,所以从应选用冷却热饱和溶液的结晶方法,然后过滤。易错点之二, 关于溴化钙纯度的测定结果偏低的误差原因分析,因为操作规范,所以重 点在于过程中由于物质性质造成的误差,从溴化钙、碳酸钙的性质来分析, 溴化钙易潮解,所以称取的4.00g 样品可能因为潮解而使得含量偏低。 八、(本题共 12 分) 二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成 酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重 要。 完成下列填空: 40.实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。 如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发 生装置是___________(填写字母)。 41.若用硫酸和亚硫酸钠反应制取 3.36 L(标准状况)二氧化硫,至少需要称取亚硫酸钠 ___________g(保留一位小数);如果已有 4.0%亚硫酸钠(质量分数)被氧化成硫酸钠,则 至少需称取该亚硫酸钠___________g(保留一位小数)。 42.实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰-石膏法和碱法是常用 的烟气脱硫法。 石灰-石膏法的吸收反应为 SO2+Ca(OH)2→CaSO3↓+H2O。吸收产物亚硫酸钙由管道输 送至氧化塔氧化,反应为 2CaSO3+O2+4H2O→2CaSO4·2H2O。其流程如下图: 碱法的吸收反应为 SO2+2NaOH→Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收 快、效率高。其流程如下图: 已知: 试剂 Ca(OH)2 0.36 NaOH 2.90 价格(元/kg) 吸收 SO2 的成本(元/mol) 0.027 0.232 石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是______________________。和 碱法相比,石灰-石膏法的优点是______________________,缺点是______________________。 43.在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用 流程图表示)。 解析:知识点:此题考查二氧化硫的制备、尾气处理、方案的评价和流程设计。 难易程度:本题相对来说难度中等偏上,偏重探究能力和思维能力的考察。 正确答案:40.ae 41.18.9 ,33.1 42.酸性氧化物与碱的反应。成本低;吸收慢,效率低。 43. 分析原因: 40 题,用硫酸和亚硫酸钠反应制取二氧化硫,不需加热,所以 a 排除; 亚硫酸钠易溶于水不能选启普发生器或其简易装置,所以 c 排除;b 不 能控制反应速率,不合题意。 41 题,3.36 升二氧化硫为 0.15mol,根据硫元素守恒,所需亚硫酸钠也为 0.15mol,质量为 18.9g。设含 40%的亚硫酸钠的样品质量为 100g,则生 成硫酸钠的质量为 45.1g,则这时亚硫酸钠的质量分数为(100-40) /100-40+45.1=57.1%,则至少需称取该亚硫酸钠 18.9/57.1%=33.1g。 42 题,相同之处都是酸性氧化物与碱反应;由框图知石灰-石膏法更便宜, 但是效率低,速度慢。 43 题,两种方法各有优缺点,设计改进的方案就可以综合两种方法的优 点从而得出结论。 易错点:易错点之一,石灰-石膏法的缺点判断,容易将氢氧化钠的特点反过来作为 石灰–石膏法的缺点,而事实上,应结合题干信息“吸收产物亚硫酸钙由 管道输送至氧化塔氧化”,根据亚硫酸钙是沉淀的来判断主要问题是可能 堵塞管道。易错点之二,烟气脱硫方案的流程图,因为要实现物料循环, 结合两种方法的优点和弊端多种因素考虑,先用氢氧化钠吸收,然后转化 成硫酸钙,将成本较高的氢氧化钠循环使用,既降低了成本、吸收效果又 好、还有副产物石膏。 九、(本题共 10 分) 异构化可得到三元乙丙橡胶的第三单体 。由 A (C5H6)和 B 经 Diels-Alder 反应制得。Diels-Alder 反应为共轭双烯与含有烯键或炔键的化合 物 相 互 作 生 成 六 元 环 状 化 合 物 的 反 应 , 最 简 单 的Diels-Alder 反 应 是 。完成下列填空: 44 . Diels-Alder 反 应 属 于 _____________ 反 应 ( 填 反 应 类 型 ); A 的 结 构 简 式 为 _____________。 45.写出与 互为同分异构,且一溴代物只有两种的芳香烃的名称。 写出生成这两种一溴代物所需要的反应试剂和反应条件。 46.B 与 Cl2 的 1,2-加成产物消去 HCl 得到 2-氯代二烯烃,该二烯烃和丙烯酸(CH2=CHCOOH) 聚合得到的聚合物可改进氯丁橡胶的耐寒性和加工性能,写出该聚合物的结构简式。 47.写出实验室由 的属于芳香烃的同分异构体的同系物制备 的合成 反应试剂 反应试剂 路线,(合成路线常用的表示方式为:A B…… 目标产物) 反应条件 反应条件 解析:知识点:考查有机物的性质、结构、转化、同分异构、反应类型、合成路线的设计等, 考查推理能力及提取信息的能力。 难易程度:中等,考察的基本还是比较基础的,平时的练习中有关 D-A 的反应也会有练 习正确答案:44.加成; 45.1,3,5-三甲苯(或均三甲苯、间三甲苯);Br2/光照、Br2/Fe(反应试剂 和条件前后可以颠倒) 46. (合理即给分) 47 .(合理即给分) 分析原因:44 从题干中 1,3-丁二烯与乙烯反应生成环己烯可知该反应两个分子生成 一个新的分子且原子全部利用,符合加成反应的特点;利用该反应的原理逆 推可知 A 的结构为 45 的分子式为 C 9 H12 ,不饱和度为 4,所以除了含有苯环外, 剩余的均为饱和结构,且能够满足一溴代物有两种的只有 1,3,5—三甲 苯,一种是取代到苯环上,条件是在铁做催化剂的时候,一种是取代到烷 烃上,条件是光照。 46 B物质是 1,3-丁二烯,与氯气加成后又消去一分子 HCl,得到的是 2-氯 -1,3-丁二烯,其与丙烯酸的加聚得到 47 目标产物是苯甲醛,我们可以采用逆推法,可知苯甲醛←苯甲醇←一氯甲 苯←甲苯 易错点 :本题 45 题在做的时候有可能出错,两种情况估计会考虑不全面。 十、(本题共 12 分) 沐舒坦(结构简式为 ,不考虑立体异构)是临床上使用广 泛的祛痰药,下图所示的其多条合成路线中的一条(反应试剂和反应条件均未标出)。 完成下列填空: 48.写出反应试剂和反应条件。 反应①_____________ 49.写出反应类型。 反应③_____________ 50.写出结构简式。 反应⑤_____________ 反应⑥_____________ A__________________________ B__________________________ 51.反应⑥中除加入反应试剂 C 外,还需要加入 K2CO3,其目的是为了中和___________, 防止__________________________。 52.写出两种 C 的能发生水解反应,且只含 3 种不同化学环境氢原子的同分异构体的结构简 式。 53 . 反 应 ② 、 反 应 ③ 的 顺 序 不 能 颠 倒 , 其 原 因 是 _________________________ 、 _________________________。 解析:知识点:考查有机物的性质、结构简式、转化、同分异构、反应类型、反应条件控制 等,考查推理能力,有序思维能力、提取信息的能力、分析问题解决问题的 能力。 难易程度:本题相对来说难度中等偏上,偏重推理能力和思维能力的考察。 正确答案:48.浓硝酸/浓硫酸,加热;Br2/CH3COOH(或 Br2/Fe 或 CH3OH/浓硫酸, 加热) 49.还原反应;取代反应 50. 51.HCl;反应物 52. 与HCl成盐 (任写两种,合理即给分) 53.苯环上的氨基易被氧化;苯环上的羧基不易被还原 分析原因: 48 本题运用正逆推相结合的方法可知 C7H8 是甲苯,通过反应 1,少了一 个氢,多了硝基,可知是硝化反应,所以反应 1 条件为浓硝酸,浓硫酸, 水浴加热;通过反映 2 后多了两个氧,少了两个氢,前后观察,并结合已 知条件可知反应 2 是甲基的氧化,通过反应 3,少了两个氧,多了两个氢, 可知为还原过程,即硝基的还原,又从反应后的产物可知 A 为邻氨基苯 甲酸,通过反应 4 和 5 ,分别是溴化和酯化的过程,其先后顺序对反应 无大的影响,所以反应 5 的条件为 Br 2 加热,或甲醇,浓硫酸,加热 49 通过以上分析可知反应 3 为还原反应,反应 6 为取代反应 50 根据以上分析,A 为 ,B 为 51 根据沐舒坦的结构可知反应 6 为取代反应,生成的副产物还有盐酸,所 以加入碳酸钾的目的是中和 HCl,防止产品不纯, 52 能发生水解的可以是酯,或者酰胺,但是 C 中只含有一个氧,所以只 能是酰胺的结构,因为只含有三种不同环境的氢,所以结构必须高度对 称,所以可以写出一下几种结构(CH3)CONHCH3、(CH3)CH2CONH2、 32(CH3)2CHCON(CH3)2、 CH3CON(CH2CH3)2 53 –NH2 有还原性,易被氧化,因此,-NO2 的还原性在-NH2 的氧化之后, 即反应②,反应③的顺序不能颠倒。 易错点:本题相对来说 B 物质的推断不是很好推,最后一问是两空,很多学生都 答出来氨基易被氧化,但是羧基不易被还原可能答不出来。 十一、(本题共 14 分) 碳酸氢钠俗称“小苏打”,是氨碱法和联合制碱法制纯碱的中间产物,可用作膨松剂、 制酸剂、灭火剂等。工业上用纯碱溶液碳酸化制取碳酸氢钠。 54.某碳酸氢钠样品中含有少量氯化钠。称取该样品,用 0.1000 mol/L 盐酸滴定,耗用盐酸 20.00 mL。若改用 0.05618 mol/L 硫酸滴定,需用硫酸___________mL(保留两位小数)。 55.某溶液组成如表一: 表一 NaHCO 化合物 Na2CO3 NaCl 97.3 3质量(kg) 814.8 400.3 向该溶液通入二氧化碳,析出碳酸氢钠晶体。取出晶体后溶液组成如表二: 表二 NaHCO 化合物 Na2CO3 137.7 NaCl 97.3 3质量(kg) 428.8 计算析出的碳酸氢钠晶体的质量(保留 1 位小数)。 56.将组成如表二的溶液加热,使碳酸氢钠部分分解,溶液中 NaHCO3 的质量由 428.8 kg 降 为 400.3 kg,补加适量碳酸钠,使溶液组成回到表一状态。计算补加的碳酸钠质量(保留 1 位小数)。 57.某种由碳酸钠和碳酸氢钠组成的晶体 452 kg 溶于水,然后通入二氧化碳,吸收二氧化碳 44.8×103 L(标准状况),获得纯的碳酸氢钠溶液,测得溶液中含碳酸氢钠 504 kg。通过计算 确定该晶体的化学式。 解析:知识点:碳酸氢钠的滴定计算、化学方程式的计算、化学式的计算 难易程度:54、简单 55、中等,两个方程式即可以得出相关结果 56、中等,与 55 类似 57、较难,一方面数值比较大,另一方面方法 正确答案:54.17.80 55. 1044.6(kg) 56. 659.1(kg) 57. Na2CO3·NaHCO3·2H2O 分析原因: 54、根据反应可知消耗的 H2SO4 质量是 HCl 的一半,即 0.1×20×0.5=0.05618 ×V,V=17.80mL 55、有表一和表二中 Na2CO3 的量可知,反应消耗的 m(Na2CO3 ) =814.8kg—137.7kg=677.1kg;设通入 CO2 后生成的 NaHCO3 的质量为 xkg, 由: Na2CO3+CO2+H2O→2 Na H CO3 106 168 677.1g x得 x=1073.1kg 则 析 出 的 碳 酸 氢 钠 晶 体 的 质 量 : m ( NaHCO3 ) =1073.1kg— (428.8kg—400.3kg)= 1044.6kg; 56、表二中 NaH CO3 的质量比表一多 428.8kg—400.3kg=28.5kg,加热分解 可到 Na2CO3 的质量设为 ykg 2 Na H CO3→Na2CO3+CO2+H2O 168 106 y28.5kg 得 y=17.98kg 则补加的碳酸纳质量(814.8kg-137.7kg)-17.98kg=659.1kg 57、设改晶体的化学式为 aNa2CO3·bNaHCO3·cH2O,则根据题意: 通入 CO2 的物质的量 n(CO2)=44.8×103 L÷22.4mol/L=2000mol 则 n(Na2CO3)=n(CO2)=2000mol 设通入 CO2 后生成的 NaHCO3 的物质的量为 zmol,由: Na2CO3+CO2+H2O→2 Na H CO3 122000mol z得 z=4000mol 则原来的 NaHCO3 的物质的量 n(NaHCO3)=(504000g÷84mol/g) 水 的 物 质 的 量n ( H2O ) =[452000—( 106×2000+84×2000 ) ] ÷ 所 以a ︰ b ︰ c=1 ︰ 1 ︰ 2 , 故 该 晶 体 的 化 学 式 为 —4000mol=2000mol 18=4000mol Na2CO3·NaHCO3·2H2O 易错点: 计算题的分值由 16 分减少到 14 分,难度不大,常见的题型。但是由于前 面的题相对来说比较难,以至于没有时间来做,使得原来可以得到的分白 白失去。
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





