
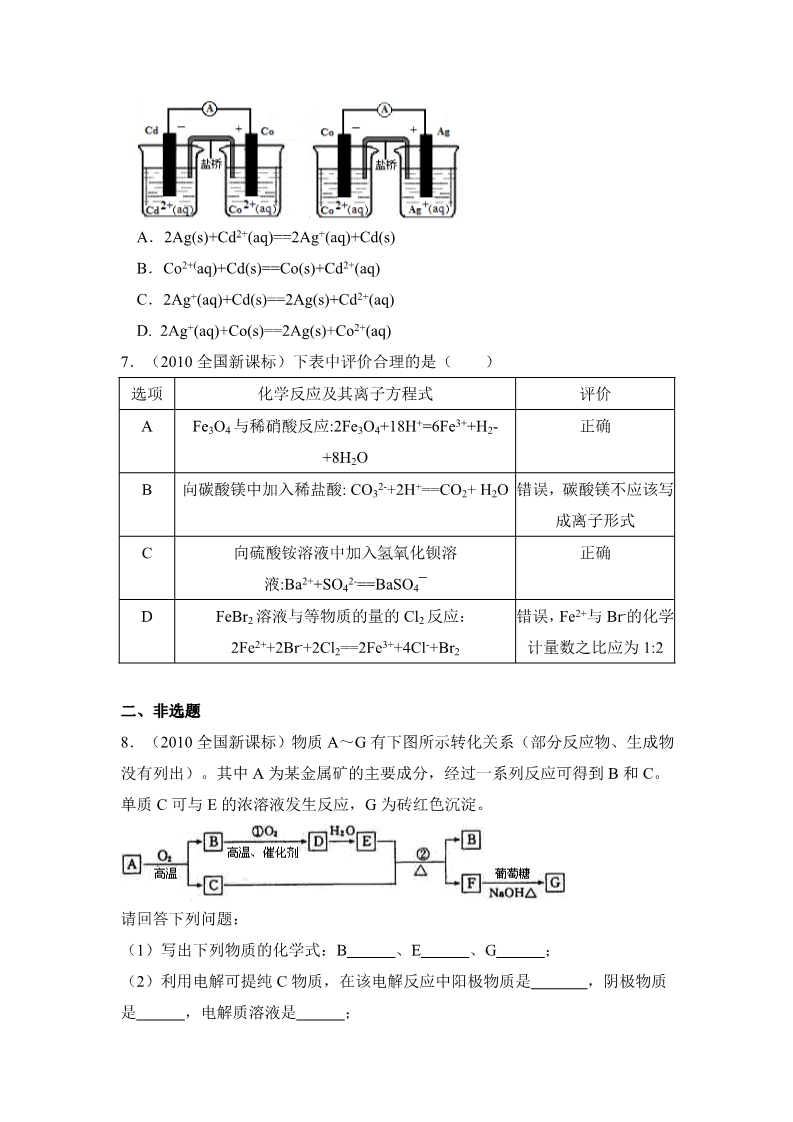
 2010 年高考全国新课标(宁夏、吉林、黑龙江)理综化学试卷 一、选择题 1.(2010 全国新课标)下列各项表达中正确的是( A.Na2O2 的电子式为 ) B.106g 的乙醇和丙醇混合液完全燃烧生成的 CO2 为 112L(标准状况) C.在氮原子中,质子数为 7 而中子数不一定为 7 D.Cl-的结构示意图为 2.(2010 新课标)分子式为 C3H6Cl2 的同分异构体共有(不考虑立体异构)( ) A.3 种 B.4 种 C.5 种 D.6 种 3.(2010 全国新课标)下列各组中的反应,属于同一反应类型的是( A.由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 ) B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 C.由氯代环己烷消去制环己烯;由丙烯加溴制 1,2-二溴丙烷 D.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇 4.(2010 全国新课标)把 500mL 有 BaCl2 和 KCl 的混合溶液分成 5 等份,取 一份加入含 amol 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含 bmol 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为( ) A.0.1(b-2a)mol/L C.10(b-a)mol/L B.10( 2a-b)mol/L D.10(b-2a)mol/L 5.(2010 全国新课标)己知:HCN(aq)与 NaOH(aq)反应的∆H=-12.1kJ/mol; HCl(aq)与 NaOH(aq)反应的∆H=-55.6kJ/mol。则 HCN 在水溶液中电离的∆H 等于 () A.-67.7 kJ/molB.-43.5 kJ/mol C.+43.5 kJ/mol D.+67.7kJ/mol 6.(2010 全国新课标)根据下图,可判断出下列离子方程式中错误的是( ) A.2Ag(s)+Cd2+(aq)==2Ag+(aq)+Cd(s) B.Co2+(aq)+Cd(s)==Co(s)+Cd2+(aq) C.2Ag+(aq)+Cd(s)==2Ag(s)+Cd2+(aq) D. 2Ag+(aq)+Co(s)==2Ag(s)+Co2+(aq) 7.(2010 全国新课标)下表中评价合理的是( )选项 化学反应及其离子方程式 评价 正确 AFe3O4 与稀硝酸反应:2Fe3O4+18H+=6Fe3++H2- +8H2O 2- BCD向碳酸镁中加入稀盐酸: CO3 +2H+==CO2+ H2O 错误,碳酸镁不应该写 成离子形式 向硫酸铵溶液中加入氢氧化钡溶 正确 液:Ba2++SO4 ==BaSO4¯ 2- FeBr2 溶液与等物质的量的 Cl2 反应: 错误,Fe2+与 Br-的化学 计量数之比应为 1:2 2Fe2++2Br-+2Cl2==2Fe3++4Cl-+Br2 二、非选题 8.(2010 全国新课标)物质 A~G 有下图所示转化关系(部分反应物、生成物 没有列出)。其中 A 为某金属矿的主要成分,经过一系列反应可得到 B 和 C。 单质 C 可与 E 的浓溶液发生反应,G 为砖红色沉淀。 请回答下列问题: (1)写出下列物质的化学式:B (2)利用电解可提纯 C 物质,在该电解反应中阳极物质是 ,电解质溶液是 、E 、G ;,阴极物质 是;(3)反应②的化学方程式是 。(4)将 0.23 mol B 和 0.11 mol 氧气放入容积为 1 L 的密闭容器中,发生反应①, 在一定温度下,反应达到平衡,得到 0.12 mol D,则反应的平衡常数 K= 若温度不变,再加入 0.50 mol 氧气后重新达到平衡,则 B 的平衡浓度 。(填 “增大”、“不变”或“减小”),氧气的转化率 (填“升高”、“不变”或“降 低”),D 的体积分数 (填“增大”、“不变”或“减小”)。 9.(2010 全国新课标) 某化学兴趣小组为探究 SO2 的性质,按下图所示装置进 行实验。 请到答 F 列问题: (1)装置 A 中盛放亚硫酸钠的仪器名称是 式为 (2)实验过程中,装置 B、C 中发生的现象分别是 ,其中发生反应的化学方程 ;、,这些现象 分别说明 SO2 具有的性质是 和;装置 B 中发生反应的离子方程式为 ;(3)装置 D 的目的是探究 SO2 与品红作用的可逆性,请写出实验操作及现象 ;(4)尾气可采用 溶液吸收。 10.(2010 全国新课标)某同学在用稀硫酸与锌制取氢气的实验中,发现加入 少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题: (1)上述实验中发生反应的化学方程式有 ;(2)硫酸铜溶液可以加快氢气生成速率的原因是 ;(3)实验室中现有 Na2SO3、MgSO4、Ag2SO4、K2SO4 等 4 中溶液,可与实验中 CuSO4 溶液起相似作用的是 (4)要加快上述实验中气体产生的速率,还可采取的措旌有 ;(答两种); (5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一 系列实验。将表中所给的混合溶液分别加入到 6 个盛有过量 Zn 粒的反应瓶中, 收集产生的气体,记录获得相同体积的气体所需时间。 实验 混合溶液 ABCDEF4mol/L H2SO4/mL 饱和 CuSO4 溶液/mL H2O/mL 30 0V1 0.5 V8 V2 2.5 V9 V3 5V4 V6 10 V5 20 0V7 V10 ①请完成此实验设计,其中:V1= ,V6= ,V9= ;②反应一段时间后,实验 A 中的金属呈 色,实验 E 中的金属呈 色; ③该同学最后得出的结论为:当加入少量 CuSO4 溶液时,生成氢气的速率会 大大提高。但当加入的 CuSO4 溶液超过一定量时,生成氢气的速率反而会下降。 请分析氢气生成速率下降的主要原因 .11.(2010 全国新课标)水是一种重要的自然资源,是人类赖以生存不可缺少 的物质,水质优劣直接影响人体健康。请回答下列问题: (1)天然水中溶解的气体主要有 、.(2)天然水在净化处理过程中加入的混凝剂可以是 (填两种物质的名称), 其净水作用的原理是 .(3)水的净化与软化的区别是 .(4)硬度为 1°的水是指每升水含 10mgCaO 或与之相当的物质(如 7.1mgMgO)。若 某天然水中 c(Ca2+)=1.2´10-3mol/L,c(Mg2+)=6´10-4mol/L,则此水的硬度为 .-(5)若(4)中的天然水还含有 c(HCO3 )=8´10-4mol/L,现要软化 10m3 这种天然水, 则需先加入 Ca(OH)2 g ,后加入 Na2CO3 g. 12.(2010 全国新课标)主族元素 W、X、Y、Z 的原子序数依次增大,W 原子 最外层电子数是次外层的 3 倍,X,Y 和 Z 分属于不同的周期,它们的原子序数 之和是 W 原子序数的 5 倍。在由元素 W、X、Y、Z 组成的所有二组分化合物中, 由元素 W、Y 形成的化合物 M 的熔点最高。请回答下列问题: (1)W 原子 L 层电子排布式为 (2)X 单质与水反应的主要化学方程式 (3)化合物 M 的化学式 其晶体结构与NaCl 相同,而熔点高于 NaCl。M 熔 点较高的原因是 。将一定是的化合物ZX 负载在 M 上可制得 ZX/M 催化剂, 用于催化碳酸二甲酯与月桂酸醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中, W3 空间构形是 ..碳原子采用的杂化方式有 .,O-C-O 的键角约 .(4) X、Y、Z 可形成立方晶体的化合物,其晶胞中 X 占有棱的中心,Y 位于 顶角,Z 位于体心位置,则该晶体的组成为 X:Y:Z= (5)含有元素 Z 的盐的焰色反应为 色,许多金属盐都可以发生焰色反应,其 原因是 ..13.(2010 全国新课标)PC 是一种可降解的聚碳酸酯类高分子材料,由于其具 有优良的耐冲击性和韧性,因而得到了广泛的应用。以下是某研究小组开发的生 产 PC 的合成路线: 已知以下信息: ①A 可使溴的 CCl4 溶液褪色; ②B 中有五种不同化学环境的氢; ③C 可与 FeCl3 溶液发生显色反应: ④D 不能使溴的 CCl4 褪色,其核磁共振氢谱为单峰。 请回答下列问题: (1)A 的化学名称是 (2)B 的结构简式为 ;;(3)C 与 D 反应生成 E 的化学方程式为 ;(4)D 有多种同分异构体,其中能发生银镜反应的是 (写出结构简式); (5)B 的同分异构体中含有苯环的还有 现丙两组峰,且峰面积之比为 3:1 的是 种,其中在核磁共振氢谱中出 (写出结构简式)。 2010 年全国统一高考化学试卷(新课标) 参考答案 (解析在后面) 一、选择题 1.C 2.B 3.D 4.D 5.C 6.A 7.B 二、非选题 8.(1)B.SO2 E.H2SO4 G.Cu2O (2)粗铜 精铜CuSO4 溶液 (3)Cu+2H2SO4(浓) DCuSO4+SO2+2H2O (4)k=23.8mol/L 减小 降低 减小 9.(1)蒸馏烧瓶 Na2SO3+H2SO4(浓)==Na2SO4+SO2+H2O (2)溶液由紫红色变为无色,无色溶液出现黄色浑浊 还原性和氧化性 -2- 5SO2+2MnO4 +2H2O==2SO4 +5Mn2++4H+ (3)品红溶液褪色后,关闭分液漏斗活塞,点燃酒精灯加热,溶液恢复红色 (4)NaOH 10.(1)Zn+CuSO4==ZnSO4+Cu Zn+H2SO4==ZnSO4+H2 (2)CuSO4 与 Zn 反应产生的铜与 Zn 形成微电池,加快了氢气产生的速度 (3)Ag2SO4 (4)升高反应温度,适当增加硫酸的浓度,增加锌粒的表面积(答两个) (5)①V1=30 V2=60 V3=17.5 ②灰黑色,暗红色 ③当加入一定量的 CuSO4 后,生成的单质铜会沉积在 Zn 的表面降低了 Zn 与溶 液接触的表面 11.(1)氧气 二氧化碳(或氮气) (2)明矾、硫酸铝、硫酸铁、硫酸亚铁(填其中任意两种) 铝盐或铁盐在水中发生 水解生成相应的氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他 带异电的胶体,使其聚沉达到净水的目的。 (3)水的净化是用混凝剂(如明矾)将水中胶体及悬浮物沉淀下来,而水的软化是除 去水中的钙离子和镁离子 (4)10° (5)740 1484 12.(1)2S22P4 V 形 (2)2F2+2H2O==4HF+O2 (3)MgO 晶格能大 SP3 和 SP2 120° (4)3:1:1 (5)紫 激发态的电子从能量高的轨道跃迁到能量低的轨道时,以一定的波长(可见 光区域)光的形式释放能量 13.(1)丙烯 (2) (3) (4)CH3CH2CHO (5)7 2010 年全国统一高考化学试卷(新课标) 参考答案与试题解析 可能用到的相对原子质量:H-1 B-11 C-12 N-14 O-16 Na-23 S -32 Cl-35.5 Ca-40 Cu-64 一、选择题 1.(2010 全国新课标)下列各项表达中正确的是( A.Na2O2 的电子式为 )B.106g 的乙醇和丙醇混合液完全燃烧生成的 CO2 为 112L(标准状况) C.在氮原子中,质子数为 7 而中子数不一定为 7 D.Cl-的结构示意图为 【答案】C 【解析】本题综合性强,考点属于化学基本概念.既考查了重要化学用语电子式、 微粒结构示意图、原子组成符号和同位素的概念,同时也考查了 Vm 的 概念、混合的法则和守恒思想。B 选项干扰性较强,它成立的前提是乙 醇和丙醇按 1∶1 的物质的量比混合。 2.(2010 全国新课标)分子式为 C3H6Cl2 的同分异构体共有(不考虑立体异构) ()A.3 种 B.4 种 C.5 种 D.6 种 【答案】B 【解析】考查同分异构体的书写。CH3CH2CH3 的氢原子环境有两种,由此可知 二氯取代发生在同一碳原子上和不同谈原子上的异构体各有 2 种,即 2+2=4 3.(2010 全国新课标)下列各组中的反应,属于同一反应类型的是( A.由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 C.由氯代环己烷消去制环己烯;由丙烯加溴制 1,2—二溴丙烷 D.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇 【答案】D )【解析】考查有机化学基本反应类型——取代、加成、氧化、消去。A 项前者为 取代反应,后者为加成反应;B 项前者为取代反应,后者为氧化反应; C 项前者为消去反应,后者为加成反应;D 项前者为酯化反应,后者为 水解反应,均属于取代反应。 4.(2010 全国新课标)把 500mL 含有 BaCl2 和 KCl 的混合溶液分成 5 等分, 取一份加入含 a mol 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含 b mol 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为 ()A. 0.1(b-2a)mol / LB. 10(2a-b)mol /LC. 10(b-a)mol / L D. 10(b-2a)mol /L 【答案】D 【解析】本题属于无机综合计算,着重考查了守恒思想(电荷守恒)和物质的量 浓度计算。一份溶液中 n(K+)=(b-2a)mol,故 c(K+)= n/V =(b-2a)/0.1 = 10(b-2a) mol·L-1。 5.(2010 全国新课标)已知:HCN(aq)与 NaOH(aq)反应的 ΔH = -12.1kJ /mol; HCl(aq)与 NaOH(aq)反应的 ΔH = -55.6kJ/ mol。则 HCN 在水溶液中电离的 H 等于( )A.-67.7 kJ /molB.-43.5kJ /molC.+43.5 kJ/ mol 【答案】C D.+67.7 kJ/ mol 【解析】考查了盖斯定律的应用和中和热的概念. 6.(2010 全国新课标)根据右图可判断下列离子方程式中错误的是( )A.2Ag(s)+Cd2+(aq)=2Ag+(aq)+Cd(s) B.Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq) C.2Ag+(aq)+Cd(s)=2Ag(s)+Cd2+(aq) D.2Ag+(aq)+Co(s)=2Ag(s)+Co2+(aq) 【答案】A 【解析】考查了原电池的概念、化学反应强弱规律和离子方程式的书写,命题角 度新。 7.(2010 全国新课标)下表中评价合理的是( )选化学反应及其离子方程式 评价 项Fe3O4 与稀硝酸反应: A正确 2Fe3O4+18H+=6Fe3++H2↑+8H2O 2- B向碳酸镁中加入稀盐酸:CO3 +2H+=CO2↑+H2O 错误,碳酸镁不应写成离 子形式 正确 向硫酸铵溶液中加入氢氧化钡溶液: CD2- Ba2++SO4 =BaSO4↓ FeBr2 溶液与等物质的量的 Cl2 反应: 错误,Fe2+与 Br—的化学 计量数之比应为 1:2 2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 【答案】B 【解析】考查离子方程式正误判定,呈现方式新颖。A 项违反化学事实,起氧化 -作用的是 NO3 而不是 H+;B 项正确;C 项中复杂离子方程式只写了一 半,错误;D 项离子方程式正确,考虑到了反应强弱规律和电子转移守 恒,评价错。 二、非选题 8.(2010 全国新课标)(14 分)物质 A~G 有下图所示转化关系(部分反应物、 生成物没有列出)。其中 A 为某金属矿的主要成分,经过一系列反应可得到 B 和 C。单质 C 可与 E 的浓溶液发生反应,G 为砖红色沉淀。 请回答下列问题: (1)写出下列物质的化学式:B_________、E________、G_________; (2)利用电解可提纯 C 物质,在该电解反应中阳极物质是_______,阴极物质是 _______,电解质溶液是___________; (3)反应②的化学方程式是 ______________________________________________; (4)将 0.23molB 和 0.11mol 氧气放入容积为 1L 的密闭容器中,发生反应①, 在一定温度下,反应达到平衡,得到 0.12molD,则反应的平衡常数 K=__________。若温度不变,再加入 0.50mol 氧气后重新达到平衡,则 B 的平衡浓度________(填“增大”、“不变”或“减小”),氧气的转化率_______ (填“升高”、“不变”或“降低”),D 的体积分数_________(填“增大”、“不 变”或“减小”). 【答案】(1)SO2 (2)粗铜 H2SO4 精铜 Cu2O CuSO4 溶液 (3) Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O (4)23.8 mol-1·L 减小 降低 减小 【解析】以无机框图推断为载体,综合考查浓硫酸的强氧化性、铜的电解精炼和 化学平衡相关知识,难度适中。 (1)根据已知条件走通转化关系图: ABCDEFG(Cu2S) SO2 Cu SO3 H2SO4 CuSO4 Cu2O 按题目要求在指定位置写出 B、E、G 的化学式。 (2)电解法精炼铜时,粗铜作阳极,精铜作阴极,电解质溶液为 CuSO4 (aq)。 (3)该反应中浓硫酸表现了酸性和强氧化性。 (4) [mol/L] SO2(g) + O2(g) SO3(g) 0起变平0.23 0.12 0.11 0.11 0.06 0.05 0.12 0.12 ∴[SO3 ]2 0.122 K 23.80mol L1 [SO2 ]2 [O2 ] 0.112 0.05 温度不变,再加入 0.50mol O2,平衡右移,重新达到平衡后,[SO2] 平减小,α(SO2)升高,但 α(O2)反而降低,由于机械作用强于 平衡移动,故 SO2 体积分数减小。 9.(2010 全国新课标)(15 分)某化学兴趣小组为探究 SO2 的性质,按下图所 示装置进行实验。 请回答下列问题: (1)装置 A 中盛放亚硫酸钠的仪器名称是__________ ,其中发生反应的化学方 程式为_______________________________________; (2)实验过程中,装置 B、C 中发生的现象分别是_________、__________,这 些现象分别说明 SO2 具有的性质是__________和__________;装置 B 中发 生反应的离子方程式为________________________________ ; (3)装置 D 的目的是探究 SO2 与品红作用的可逆性,请写出实验操作及现象 _________; (4)尾气可采用___________溶液吸收。 【答案】(1)蒸馏烧瓶 (2)溶液由紫红色变为无色 还原性 氧化性 5SO2+2MnO4 +2H2O=2Mn2++5SO4 +4H+ Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O 无色溶液中出现黄色浑浊 -2- (3)品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢 (4)NaOH(其他合理答案也给分) 复为红色 【解析】这是一道实验探究题,主要考查了 SO2 的制备、性质、检验和尾气处理。 很常规,学生答起来非常顺手。 10.(2010 全国新课标)(14 分)某同学在用稀硫酸与锌制取氢气的实验中, 发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题: (1)上述实验中发生反应的化学方程式有_________________________; (2)硫酸铜溶液可以加快氢气生成速率的原因是________________________; (3)实验室中现有 Na2SO4、MgSO4、Ag2SO4、K2SO4 等 4 种溶液,可与上述实 验中 CuSO4 溶液起相似作用的是_______________; (4)要加快上述实验中气体产生的速率,还可采取的措施有_____________(答两 种); (5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系 列实验。将表中所给的混合溶液分别加入到 6 个盛有过量 Zn 粒的反应瓶中, 收集产生的气体,记录获得相同体积的气体所需时间。 实验 ABCDEF混合溶液 4mol/L H2SO4/mL 饱和 CuSO4 溶液 /mL 30 0V1 0.5 V8 V2 2.5 V9 V3 5V4 V6 10 V5 20 0H2O/mL V7 V10 ①请完成此实验设计,其中:V1=______,V6=______,V9=______; ②反应一段时间后,实验 A 中的金属呈____色,实验 E 中的金属呈_____色; ③该同学最后得出的结论为:当加入少量 CuSO4 溶液时,生成氢气的速率 会大大提高。但当加入的 CuSO4 溶液超过一定量时,生成氢气的速率反而 会下降。请分析氢气生成速率下降的主要原因____________________。 【答案】1)Zn+CuSO4=ZnSO4+Cu Zn+H2SO4=ZnSO4+H2 (2)CuSO4 与 Zn 反应产生的 Cu 与 Zn 形成 Cu/Zn 微电池,加快了氢气 产生的速率 (3)Ag2SO4 (4)升高反应温度、适当增加硫酸的浓度、增加锌粒的比表面积等 (5)①30 ③当加入一定量的 CuSO4 后,生成的单质 Cu 会沉积在 Zn 的表面, 降低了 Zn 与溶液的接触面积 10 17.5 ②灰黑 暗红 【解析】这是一道无机综合题,考查原电池反应原理,影响化学反应速率的因素, 定量实验方法和分析解决实际问题的能力。体现了新课标高考重视对“过 程与方法”的考查。 (1)考生容易漏写“ Zn + CuSO4 = ZnSO4 + Cu ”。 (2)置换出的少量 Cu 与 Zn 和稀硫酸构成原电池。 (3)是(2)的延伸——Ag、Zn、稀硫酸也能构成原电池。 (4)答案有多种,只要合理均可。 (5)①着重考查学生对定量实验方法原理的理解和阅读图表获取信息 的能力。该实验目的是“进一步研究硫酸铜的量对氢气生成速率 的影响”,所以,应控制稀硫酸的量不变,故 V1=V2=V3=V4=V5=30, V6=10,V7=20,V9=17.5,V10=10。 ②考查单质 Zn 和 Cu 的颜色。 ③考查学生分析解决实际问题的能力。 11.(2010 全国新课标)[化学——选修化学与技术](15 分) 水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影 响人体健康。请回答下列问题: (1)天然水中溶解的气体主要有__________、___________; (2)天然水在净化处理过程中加入的混凝剂可以是______________(填两种物 质名称),其净水作用的原理是_________________________________ ; (3)水的净化与软化的区别______________________; (4)硬度为 1°的水是指每升水含 10mgCaO 或与之相当的物质(如 7.1mgMgO)。若某天然水中 c(Ca2+)=1.2×10—3mol/L, c(Mg2+)=6×10-4mol/L, 则此水的硬度为__________。 -(5)若(4)中的天然水中还含有 c(HCO3 )=8×10-4mol/L,现要软化 10m3 这种天 然水,则需先加入 Ca(OH)2 ______g,后加入 Na2CO3 _________g。 【答案】1)氧气(O2) 二氧化碳(CO2)(或氮气) (2)明矾、硫酸铝、硫酸铁、硫酸亚铁(填其中任何两种) 铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,它可吸附天然 水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉,达到 净化目的 (3)水的净化是用混凝剂(如明矾等)将水中胶体及悬浮物沉淀下来, 而水的软化是除去水中的钙离子和镁离子 (4)10° (5)740 1484 【解析】题干精练,设问明确。 (2)中学生对混凝剂的提法也许不熟悉,但只要理解净水原理这个问题便可迎 刃而解。 (4)以新情境给出水的硬度的概念,理解了这个概念,计算就很轻松。此水的 硬度为: (1.2103 6103 )56103 10 10 (5)注意 Mg(HCO3)2 溶液与 Ca(OH)2 反应时 OH-的双重作用——沉淀 Mg2+,中 -和 HCO3 。 ∴ m[Ca(OH)2] = [ 6×10-4 + (8×10-4) ]×104×74 = 740 g 12M[Na2CO3] = ( 1.2×10-3 + 1×10-3 – 0.8×10-3 )×104×106 = 1484 g 12.(2010 全国新课标)[化学——选修物质结构与性质](15 分) 主族元素 W、X、Y、Z 的原子序数依次增大,W 的原子最外层电子数是次外 层电子数的 3 倍。X、Y 和 Z 分属不同的周期,它们的原子序数之和是 W 原 子序数的 5 倍。在由元素 W、X、Y、Z 组成的所有可能的二组分化合物中, 由元素 W 与 Y 形成的化合物 M 的熔点最高。请回答下列问题: (1)W 元素原子的 L 层电子排布式为___________,W3 分子空间构型为 _________; (2)X 单质与水发生主要反应的化学方程式为_________________________; (3)化合物 M 的化学式为__________,其晶体结构与 NaCl 相同,而熔点高于 NaCl。M 熔点较高的原因是________。将一定量的化合物 ZX 负载在 M 上 可制得 ZX/M 催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月 桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有__________, O—C—O 的键角约为____________; (4)X、Y、Z 可形成立方晶体结构的化合物,其晶胞中 X 占据所有棱的中心,Y 位于顶角,Z 处于体心位置,则该晶体的组成为 X:Y: Z=_________________; (5)含有元素 Z 的盐的焰色反应为___________色。许多金属盐都可以发生焰色 反应,其原因是_________________________。 【答案】1)2S22P4 V 形 (2)2F2+2H2O=4HF+O2 (3)MgO (4)3∶1∶1 (5)紫 晶格能大(MgO 为 2-2 价态化合物) SP3 和 SP2 120° 激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定 波长(可见光区域)光的形式释放能量 【解析】先依据题设条件推出 W、X、Y、Z 各是什么元素,然后依据题目要求 填空。 W 的原子最外层电子数是次外层的 3 倍,可知 W 是氧(O);X、Y、 Z 分属不同周期,它们的原子序数之和为 40,在由元素 W、X、Y、Z 组成的所有可能的二组分化合物中,由元素 W 与 Y 形成的化合物 M (即 YW)的熔点最高可以推出 Y 为镁(Mg),M 为 MgO,X 为氢 (H),Z 为钾(K)。 13.(2010 全国新课标)[化学——选修有机化学基础](15 分) PC 是一种可降解的聚碳酸酯类高分子材料,由于其具有优良的耐冲击性和韧 性,因而得到了广泛的应用。以下是某研究小组开发的生产 PC 的合成路线: 已知以下信息:①A 可使溴的 CCl4 溶液褪色;②B 中有五种不同化学环境的 氢; ③C 可与 FeCl3 溶液发生显色反应;④D 不能使溴的 CCl4 溶液褪色,其核磁 共振氢谱为单峰。 请回答下列问题: (1)A 的化学名称是______________;(2)B 的结构简式为_________________; (3)C 与 D 反应生成 E 的化学方程式为_________________________________; (4)D 有多种同分异构体,其中能发生银镜反应的是_____________(写出结构简 式); (5)B 的同分异构体中含有苯环的还有__________种,其中在核磁共振氢谱中出 现两组峰,且峰面积之比为 3∶1 的是________________(写出结构简式)。 【答案】(1)丙烯 (2) (3) (4) CH3CH2CHO (5)7 【解析】这是一道传统的有机合成题,与无机推断题解法一样,先走通转化关系 (合成路线),再按要求抄写答案。 其中(4)、(5)两问设置条件书写同分异构体,实现了本题的选拔功 能。
2010 年高考全国新课标(宁夏、吉林、黑龙江)理综化学试卷 一、选择题 1.(2010 全国新课标)下列各项表达中正确的是( A.Na2O2 的电子式为 ) B.106g 的乙醇和丙醇混合液完全燃烧生成的 CO2 为 112L(标准状况) C.在氮原子中,质子数为 7 而中子数不一定为 7 D.Cl-的结构示意图为 2.(2010 新课标)分子式为 C3H6Cl2 的同分异构体共有(不考虑立体异构)( ) A.3 种 B.4 种 C.5 种 D.6 种 3.(2010 全国新课标)下列各组中的反应,属于同一反应类型的是( A.由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 ) B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 C.由氯代环己烷消去制环己烯;由丙烯加溴制 1,2-二溴丙烷 D.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇 4.(2010 全国新课标)把 500mL 有 BaCl2 和 KCl 的混合溶液分成 5 等份,取 一份加入含 amol 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含 bmol 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为( ) A.0.1(b-2a)mol/L C.10(b-a)mol/L B.10( 2a-b)mol/L D.10(b-2a)mol/L 5.(2010 全国新课标)己知:HCN(aq)与 NaOH(aq)反应的∆H=-12.1kJ/mol; HCl(aq)与 NaOH(aq)反应的∆H=-55.6kJ/mol。则 HCN 在水溶液中电离的∆H 等于 () A.-67.7 kJ/molB.-43.5 kJ/mol C.+43.5 kJ/mol D.+67.7kJ/mol 6.(2010 全国新课标)根据下图,可判断出下列离子方程式中错误的是( ) A.2Ag(s)+Cd2+(aq)==2Ag+(aq)+Cd(s) B.Co2+(aq)+Cd(s)==Co(s)+Cd2+(aq) C.2Ag+(aq)+Cd(s)==2Ag(s)+Cd2+(aq) D. 2Ag+(aq)+Co(s)==2Ag(s)+Co2+(aq) 7.(2010 全国新课标)下表中评价合理的是( )选项 化学反应及其离子方程式 评价 正确 AFe3O4 与稀硝酸反应:2Fe3O4+18H+=6Fe3++H2- +8H2O 2- BCD向碳酸镁中加入稀盐酸: CO3 +2H+==CO2+ H2O 错误,碳酸镁不应该写 成离子形式 向硫酸铵溶液中加入氢氧化钡溶 正确 液:Ba2++SO4 ==BaSO4¯ 2- FeBr2 溶液与等物质的量的 Cl2 反应: 错误,Fe2+与 Br-的化学 计量数之比应为 1:2 2Fe2++2Br-+2Cl2==2Fe3++4Cl-+Br2 二、非选题 8.(2010 全国新课标)物质 A~G 有下图所示转化关系(部分反应物、生成物 没有列出)。其中 A 为某金属矿的主要成分,经过一系列反应可得到 B 和 C。 单质 C 可与 E 的浓溶液发生反应,G 为砖红色沉淀。 请回答下列问题: (1)写出下列物质的化学式:B (2)利用电解可提纯 C 物质,在该电解反应中阳极物质是 ,电解质溶液是 、E 、G ;,阴极物质 是;(3)反应②的化学方程式是 。(4)将 0.23 mol B 和 0.11 mol 氧气放入容积为 1 L 的密闭容器中,发生反应①, 在一定温度下,反应达到平衡,得到 0.12 mol D,则反应的平衡常数 K= 若温度不变,再加入 0.50 mol 氧气后重新达到平衡,则 B 的平衡浓度 。(填 “增大”、“不变”或“减小”),氧气的转化率 (填“升高”、“不变”或“降 低”),D 的体积分数 (填“增大”、“不变”或“减小”)。 9.(2010 全国新课标) 某化学兴趣小组为探究 SO2 的性质,按下图所示装置进 行实验。 请到答 F 列问题: (1)装置 A 中盛放亚硫酸钠的仪器名称是 式为 (2)实验过程中,装置 B、C 中发生的现象分别是 ,其中发生反应的化学方程 ;、,这些现象 分别说明 SO2 具有的性质是 和;装置 B 中发生反应的离子方程式为 ;(3)装置 D 的目的是探究 SO2 与品红作用的可逆性,请写出实验操作及现象 ;(4)尾气可采用 溶液吸收。 10.(2010 全国新课标)某同学在用稀硫酸与锌制取氢气的实验中,发现加入 少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题: (1)上述实验中发生反应的化学方程式有 ;(2)硫酸铜溶液可以加快氢气生成速率的原因是 ;(3)实验室中现有 Na2SO3、MgSO4、Ag2SO4、K2SO4 等 4 中溶液,可与实验中 CuSO4 溶液起相似作用的是 (4)要加快上述实验中气体产生的速率,还可采取的措旌有 ;(答两种); (5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一 系列实验。将表中所给的混合溶液分别加入到 6 个盛有过量 Zn 粒的反应瓶中, 收集产生的气体,记录获得相同体积的气体所需时间。 实验 混合溶液 ABCDEF4mol/L H2SO4/mL 饱和 CuSO4 溶液/mL H2O/mL 30 0V1 0.5 V8 V2 2.5 V9 V3 5V4 V6 10 V5 20 0V7 V10 ①请完成此实验设计,其中:V1= ,V6= ,V9= ;②反应一段时间后,实验 A 中的金属呈 色,实验 E 中的金属呈 色; ③该同学最后得出的结论为:当加入少量 CuSO4 溶液时,生成氢气的速率会 大大提高。但当加入的 CuSO4 溶液超过一定量时,生成氢气的速率反而会下降。 请分析氢气生成速率下降的主要原因 .11.(2010 全国新课标)水是一种重要的自然资源,是人类赖以生存不可缺少 的物质,水质优劣直接影响人体健康。请回答下列问题: (1)天然水中溶解的气体主要有 、.(2)天然水在净化处理过程中加入的混凝剂可以是 (填两种物质的名称), 其净水作用的原理是 .(3)水的净化与软化的区别是 .(4)硬度为 1°的水是指每升水含 10mgCaO 或与之相当的物质(如 7.1mgMgO)。若 某天然水中 c(Ca2+)=1.2´10-3mol/L,c(Mg2+)=6´10-4mol/L,则此水的硬度为 .-(5)若(4)中的天然水还含有 c(HCO3 )=8´10-4mol/L,现要软化 10m3 这种天然水, 则需先加入 Ca(OH)2 g ,后加入 Na2CO3 g. 12.(2010 全国新课标)主族元素 W、X、Y、Z 的原子序数依次增大,W 原子 最外层电子数是次外层的 3 倍,X,Y 和 Z 分属于不同的周期,它们的原子序数 之和是 W 原子序数的 5 倍。在由元素 W、X、Y、Z 组成的所有二组分化合物中, 由元素 W、Y 形成的化合物 M 的熔点最高。请回答下列问题: (1)W 原子 L 层电子排布式为 (2)X 单质与水反应的主要化学方程式 (3)化合物 M 的化学式 其晶体结构与NaCl 相同,而熔点高于 NaCl。M 熔 点较高的原因是 。将一定是的化合物ZX 负载在 M 上可制得 ZX/M 催化剂, 用于催化碳酸二甲酯与月桂酸醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中, W3 空间构形是 ..碳原子采用的杂化方式有 .,O-C-O 的键角约 .(4) X、Y、Z 可形成立方晶体的化合物,其晶胞中 X 占有棱的中心,Y 位于 顶角,Z 位于体心位置,则该晶体的组成为 X:Y:Z= (5)含有元素 Z 的盐的焰色反应为 色,许多金属盐都可以发生焰色反应,其 原因是 ..13.(2010 全国新课标)PC 是一种可降解的聚碳酸酯类高分子材料,由于其具 有优良的耐冲击性和韧性,因而得到了广泛的应用。以下是某研究小组开发的生 产 PC 的合成路线: 已知以下信息: ①A 可使溴的 CCl4 溶液褪色; ②B 中有五种不同化学环境的氢; ③C 可与 FeCl3 溶液发生显色反应: ④D 不能使溴的 CCl4 褪色,其核磁共振氢谱为单峰。 请回答下列问题: (1)A 的化学名称是 (2)B 的结构简式为 ;;(3)C 与 D 反应生成 E 的化学方程式为 ;(4)D 有多种同分异构体,其中能发生银镜反应的是 (写出结构简式); (5)B 的同分异构体中含有苯环的还有 现丙两组峰,且峰面积之比为 3:1 的是 种,其中在核磁共振氢谱中出 (写出结构简式)。 2010 年全国统一高考化学试卷(新课标) 参考答案 (解析在后面) 一、选择题 1.C 2.B 3.D 4.D 5.C 6.A 7.B 二、非选题 8.(1)B.SO2 E.H2SO4 G.Cu2O (2)粗铜 精铜CuSO4 溶液 (3)Cu+2H2SO4(浓) DCuSO4+SO2+2H2O (4)k=23.8mol/L 减小 降低 减小 9.(1)蒸馏烧瓶 Na2SO3+H2SO4(浓)==Na2SO4+SO2+H2O (2)溶液由紫红色变为无色,无色溶液出现黄色浑浊 还原性和氧化性 -2- 5SO2+2MnO4 +2H2O==2SO4 +5Mn2++4H+ (3)品红溶液褪色后,关闭分液漏斗活塞,点燃酒精灯加热,溶液恢复红色 (4)NaOH 10.(1)Zn+CuSO4==ZnSO4+Cu Zn+H2SO4==ZnSO4+H2 (2)CuSO4 与 Zn 反应产生的铜与 Zn 形成微电池,加快了氢气产生的速度 (3)Ag2SO4 (4)升高反应温度,适当增加硫酸的浓度,增加锌粒的表面积(答两个) (5)①V1=30 V2=60 V3=17.5 ②灰黑色,暗红色 ③当加入一定量的 CuSO4 后,生成的单质铜会沉积在 Zn 的表面降低了 Zn 与溶 液接触的表面 11.(1)氧气 二氧化碳(或氮气) (2)明矾、硫酸铝、硫酸铁、硫酸亚铁(填其中任意两种) 铝盐或铁盐在水中发生 水解生成相应的氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他 带异电的胶体,使其聚沉达到净水的目的。 (3)水的净化是用混凝剂(如明矾)将水中胶体及悬浮物沉淀下来,而水的软化是除 去水中的钙离子和镁离子 (4)10° (5)740 1484 12.(1)2S22P4 V 形 (2)2F2+2H2O==4HF+O2 (3)MgO 晶格能大 SP3 和 SP2 120° (4)3:1:1 (5)紫 激发态的电子从能量高的轨道跃迁到能量低的轨道时,以一定的波长(可见 光区域)光的形式释放能量 13.(1)丙烯 (2) (3) (4)CH3CH2CHO (5)7 2010 年全国统一高考化学试卷(新课标) 参考答案与试题解析 可能用到的相对原子质量:H-1 B-11 C-12 N-14 O-16 Na-23 S -32 Cl-35.5 Ca-40 Cu-64 一、选择题 1.(2010 全国新课标)下列各项表达中正确的是( A.Na2O2 的电子式为 )B.106g 的乙醇和丙醇混合液完全燃烧生成的 CO2 为 112L(标准状况) C.在氮原子中,质子数为 7 而中子数不一定为 7 D.Cl-的结构示意图为 【答案】C 【解析】本题综合性强,考点属于化学基本概念.既考查了重要化学用语电子式、 微粒结构示意图、原子组成符号和同位素的概念,同时也考查了 Vm 的 概念、混合的法则和守恒思想。B 选项干扰性较强,它成立的前提是乙 醇和丙醇按 1∶1 的物质的量比混合。 2.(2010 全国新课标)分子式为 C3H6Cl2 的同分异构体共有(不考虑立体异构) ()A.3 种 B.4 种 C.5 种 D.6 种 【答案】B 【解析】考查同分异构体的书写。CH3CH2CH3 的氢原子环境有两种,由此可知 二氯取代发生在同一碳原子上和不同谈原子上的异构体各有 2 种,即 2+2=4 3.(2010 全国新课标)下列各组中的反应,属于同一反应类型的是( A.由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 C.由氯代环己烷消去制环己烯;由丙烯加溴制 1,2—二溴丙烷 D.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇 【答案】D )【解析】考查有机化学基本反应类型——取代、加成、氧化、消去。A 项前者为 取代反应,后者为加成反应;B 项前者为取代反应,后者为氧化反应; C 项前者为消去反应,后者为加成反应;D 项前者为酯化反应,后者为 水解反应,均属于取代反应。 4.(2010 全国新课标)把 500mL 含有 BaCl2 和 KCl 的混合溶液分成 5 等分, 取一份加入含 a mol 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含 b mol 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为 ()A. 0.1(b-2a)mol / LB. 10(2a-b)mol /LC. 10(b-a)mol / L D. 10(b-2a)mol /L 【答案】D 【解析】本题属于无机综合计算,着重考查了守恒思想(电荷守恒)和物质的量 浓度计算。一份溶液中 n(K+)=(b-2a)mol,故 c(K+)= n/V =(b-2a)/0.1 = 10(b-2a) mol·L-1。 5.(2010 全国新课标)已知:HCN(aq)与 NaOH(aq)反应的 ΔH = -12.1kJ /mol; HCl(aq)与 NaOH(aq)反应的 ΔH = -55.6kJ/ mol。则 HCN 在水溶液中电离的 H 等于( )A.-67.7 kJ /molB.-43.5kJ /molC.+43.5 kJ/ mol 【答案】C D.+67.7 kJ/ mol 【解析】考查了盖斯定律的应用和中和热的概念. 6.(2010 全国新课标)根据右图可判断下列离子方程式中错误的是( )A.2Ag(s)+Cd2+(aq)=2Ag+(aq)+Cd(s) B.Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq) C.2Ag+(aq)+Cd(s)=2Ag(s)+Cd2+(aq) D.2Ag+(aq)+Co(s)=2Ag(s)+Co2+(aq) 【答案】A 【解析】考查了原电池的概念、化学反应强弱规律和离子方程式的书写,命题角 度新。 7.(2010 全国新课标)下表中评价合理的是( )选化学反应及其离子方程式 评价 项Fe3O4 与稀硝酸反应: A正确 2Fe3O4+18H+=6Fe3++H2↑+8H2O 2- B向碳酸镁中加入稀盐酸:CO3 +2H+=CO2↑+H2O 错误,碳酸镁不应写成离 子形式 正确 向硫酸铵溶液中加入氢氧化钡溶液: CD2- Ba2++SO4 =BaSO4↓ FeBr2 溶液与等物质的量的 Cl2 反应: 错误,Fe2+与 Br—的化学 计量数之比应为 1:2 2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 【答案】B 【解析】考查离子方程式正误判定,呈现方式新颖。A 项违反化学事实,起氧化 -作用的是 NO3 而不是 H+;B 项正确;C 项中复杂离子方程式只写了一 半,错误;D 项离子方程式正确,考虑到了反应强弱规律和电子转移守 恒,评价错。 二、非选题 8.(2010 全国新课标)(14 分)物质 A~G 有下图所示转化关系(部分反应物、 生成物没有列出)。其中 A 为某金属矿的主要成分,经过一系列反应可得到 B 和 C。单质 C 可与 E 的浓溶液发生反应,G 为砖红色沉淀。 请回答下列问题: (1)写出下列物质的化学式:B_________、E________、G_________; (2)利用电解可提纯 C 物质,在该电解反应中阳极物质是_______,阴极物质是 _______,电解质溶液是___________; (3)反应②的化学方程式是 ______________________________________________; (4)将 0.23molB 和 0.11mol 氧气放入容积为 1L 的密闭容器中,发生反应①, 在一定温度下,反应达到平衡,得到 0.12molD,则反应的平衡常数 K=__________。若温度不变,再加入 0.50mol 氧气后重新达到平衡,则 B 的平衡浓度________(填“增大”、“不变”或“减小”),氧气的转化率_______ (填“升高”、“不变”或“降低”),D 的体积分数_________(填“增大”、“不 变”或“减小”). 【答案】(1)SO2 (2)粗铜 H2SO4 精铜 Cu2O CuSO4 溶液 (3) Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O (4)23.8 mol-1·L 减小 降低 减小 【解析】以无机框图推断为载体,综合考查浓硫酸的强氧化性、铜的电解精炼和 化学平衡相关知识,难度适中。 (1)根据已知条件走通转化关系图: ABCDEFG(Cu2S) SO2 Cu SO3 H2SO4 CuSO4 Cu2O 按题目要求在指定位置写出 B、E、G 的化学式。 (2)电解法精炼铜时,粗铜作阳极,精铜作阴极,电解质溶液为 CuSO4 (aq)。 (3)该反应中浓硫酸表现了酸性和强氧化性。 (4) [mol/L] SO2(g) + O2(g) SO3(g) 0起变平0.23 0.12 0.11 0.11 0.06 0.05 0.12 0.12 ∴[SO3 ]2 0.122 K 23.80mol L1 [SO2 ]2 [O2 ] 0.112 0.05 温度不变,再加入 0.50mol O2,平衡右移,重新达到平衡后,[SO2] 平减小,α(SO2)升高,但 α(O2)反而降低,由于机械作用强于 平衡移动,故 SO2 体积分数减小。 9.(2010 全国新课标)(15 分)某化学兴趣小组为探究 SO2 的性质,按下图所 示装置进行实验。 请回答下列问题: (1)装置 A 中盛放亚硫酸钠的仪器名称是__________ ,其中发生反应的化学方 程式为_______________________________________; (2)实验过程中,装置 B、C 中发生的现象分别是_________、__________,这 些现象分别说明 SO2 具有的性质是__________和__________;装置 B 中发 生反应的离子方程式为________________________________ ; (3)装置 D 的目的是探究 SO2 与品红作用的可逆性,请写出实验操作及现象 _________; (4)尾气可采用___________溶液吸收。 【答案】(1)蒸馏烧瓶 (2)溶液由紫红色变为无色 还原性 氧化性 5SO2+2MnO4 +2H2O=2Mn2++5SO4 +4H+ Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O 无色溶液中出现黄色浑浊 -2- (3)品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢 (4)NaOH(其他合理答案也给分) 复为红色 【解析】这是一道实验探究题,主要考查了 SO2 的制备、性质、检验和尾气处理。 很常规,学生答起来非常顺手。 10.(2010 全国新课标)(14 分)某同学在用稀硫酸与锌制取氢气的实验中, 发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题: (1)上述实验中发生反应的化学方程式有_________________________; (2)硫酸铜溶液可以加快氢气生成速率的原因是________________________; (3)实验室中现有 Na2SO4、MgSO4、Ag2SO4、K2SO4 等 4 种溶液,可与上述实 验中 CuSO4 溶液起相似作用的是_______________; (4)要加快上述实验中气体产生的速率,还可采取的措施有_____________(答两 种); (5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系 列实验。将表中所给的混合溶液分别加入到 6 个盛有过量 Zn 粒的反应瓶中, 收集产生的气体,记录获得相同体积的气体所需时间。 实验 ABCDEF混合溶液 4mol/L H2SO4/mL 饱和 CuSO4 溶液 /mL 30 0V1 0.5 V8 V2 2.5 V9 V3 5V4 V6 10 V5 20 0H2O/mL V7 V10 ①请完成此实验设计,其中:V1=______,V6=______,V9=______; ②反应一段时间后,实验 A 中的金属呈____色,实验 E 中的金属呈_____色; ③该同学最后得出的结论为:当加入少量 CuSO4 溶液时,生成氢气的速率 会大大提高。但当加入的 CuSO4 溶液超过一定量时,生成氢气的速率反而 会下降。请分析氢气生成速率下降的主要原因____________________。 【答案】1)Zn+CuSO4=ZnSO4+Cu Zn+H2SO4=ZnSO4+H2 (2)CuSO4 与 Zn 反应产生的 Cu 与 Zn 形成 Cu/Zn 微电池,加快了氢气 产生的速率 (3)Ag2SO4 (4)升高反应温度、适当增加硫酸的浓度、增加锌粒的比表面积等 (5)①30 ③当加入一定量的 CuSO4 后,生成的单质 Cu 会沉积在 Zn 的表面, 降低了 Zn 与溶液的接触面积 10 17.5 ②灰黑 暗红 【解析】这是一道无机综合题,考查原电池反应原理,影响化学反应速率的因素, 定量实验方法和分析解决实际问题的能力。体现了新课标高考重视对“过 程与方法”的考查。 (1)考生容易漏写“ Zn + CuSO4 = ZnSO4 + Cu ”。 (2)置换出的少量 Cu 与 Zn 和稀硫酸构成原电池。 (3)是(2)的延伸——Ag、Zn、稀硫酸也能构成原电池。 (4)答案有多种,只要合理均可。 (5)①着重考查学生对定量实验方法原理的理解和阅读图表获取信息 的能力。该实验目的是“进一步研究硫酸铜的量对氢气生成速率 的影响”,所以,应控制稀硫酸的量不变,故 V1=V2=V3=V4=V5=30, V6=10,V7=20,V9=17.5,V10=10。 ②考查单质 Zn 和 Cu 的颜色。 ③考查学生分析解决实际问题的能力。 11.(2010 全国新课标)[化学——选修化学与技术](15 分) 水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影 响人体健康。请回答下列问题: (1)天然水中溶解的气体主要有__________、___________; (2)天然水在净化处理过程中加入的混凝剂可以是______________(填两种物 质名称),其净水作用的原理是_________________________________ ; (3)水的净化与软化的区别______________________; (4)硬度为 1°的水是指每升水含 10mgCaO 或与之相当的物质(如 7.1mgMgO)。若某天然水中 c(Ca2+)=1.2×10—3mol/L, c(Mg2+)=6×10-4mol/L, 则此水的硬度为__________。 -(5)若(4)中的天然水中还含有 c(HCO3 )=8×10-4mol/L,现要软化 10m3 这种天 然水,则需先加入 Ca(OH)2 ______g,后加入 Na2CO3 _________g。 【答案】1)氧气(O2) 二氧化碳(CO2)(或氮气) (2)明矾、硫酸铝、硫酸铁、硫酸亚铁(填其中任何两种) 铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,它可吸附天然 水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉,达到 净化目的 (3)水的净化是用混凝剂(如明矾等)将水中胶体及悬浮物沉淀下来, 而水的软化是除去水中的钙离子和镁离子 (4)10° (5)740 1484 【解析】题干精练,设问明确。 (2)中学生对混凝剂的提法也许不熟悉,但只要理解净水原理这个问题便可迎 刃而解。 (4)以新情境给出水的硬度的概念,理解了这个概念,计算就很轻松。此水的 硬度为: (1.2103 6103 )56103 10 10 (5)注意 Mg(HCO3)2 溶液与 Ca(OH)2 反应时 OH-的双重作用——沉淀 Mg2+,中 -和 HCO3 。 ∴ m[Ca(OH)2] = [ 6×10-4 + (8×10-4) ]×104×74 = 740 g 12M[Na2CO3] = ( 1.2×10-3 + 1×10-3 – 0.8×10-3 )×104×106 = 1484 g 12.(2010 全国新课标)[化学——选修物质结构与性质](15 分) 主族元素 W、X、Y、Z 的原子序数依次增大,W 的原子最外层电子数是次外 层电子数的 3 倍。X、Y 和 Z 分属不同的周期,它们的原子序数之和是 W 原 子序数的 5 倍。在由元素 W、X、Y、Z 组成的所有可能的二组分化合物中, 由元素 W 与 Y 形成的化合物 M 的熔点最高。请回答下列问题: (1)W 元素原子的 L 层电子排布式为___________,W3 分子空间构型为 _________; (2)X 单质与水发生主要反应的化学方程式为_________________________; (3)化合物 M 的化学式为__________,其晶体结构与 NaCl 相同,而熔点高于 NaCl。M 熔点较高的原因是________。将一定量的化合物 ZX 负载在 M 上 可制得 ZX/M 催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月 桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有__________, O—C—O 的键角约为____________; (4)X、Y、Z 可形成立方晶体结构的化合物,其晶胞中 X 占据所有棱的中心,Y 位于顶角,Z 处于体心位置,则该晶体的组成为 X:Y: Z=_________________; (5)含有元素 Z 的盐的焰色反应为___________色。许多金属盐都可以发生焰色 反应,其原因是_________________________。 【答案】1)2S22P4 V 形 (2)2F2+2H2O=4HF+O2 (3)MgO (4)3∶1∶1 (5)紫 晶格能大(MgO 为 2-2 价态化合物) SP3 和 SP2 120° 激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定 波长(可见光区域)光的形式释放能量 【解析】先依据题设条件推出 W、X、Y、Z 各是什么元素,然后依据题目要求 填空。 W 的原子最外层电子数是次外层的 3 倍,可知 W 是氧(O);X、Y、 Z 分属不同周期,它们的原子序数之和为 40,在由元素 W、X、Y、Z 组成的所有可能的二组分化合物中,由元素 W 与 Y 形成的化合物 M (即 YW)的熔点最高可以推出 Y 为镁(Mg),M 为 MgO,X 为氢 (H),Z 为钾(K)。 13.(2010 全国新课标)[化学——选修有机化学基础](15 分) PC 是一种可降解的聚碳酸酯类高分子材料,由于其具有优良的耐冲击性和韧 性,因而得到了广泛的应用。以下是某研究小组开发的生产 PC 的合成路线: 已知以下信息:①A 可使溴的 CCl4 溶液褪色;②B 中有五种不同化学环境的 氢; ③C 可与 FeCl3 溶液发生显色反应;④D 不能使溴的 CCl4 溶液褪色,其核磁 共振氢谱为单峰。 请回答下列问题: (1)A 的化学名称是______________;(2)B 的结构简式为_________________; (3)C 与 D 反应生成 E 的化学方程式为_________________________________; (4)D 有多种同分异构体,其中能发生银镜反应的是_____________(写出结构简 式); (5)B 的同分异构体中含有苯环的还有__________种,其中在核磁共振氢谱中出 现两组峰,且峰面积之比为 3∶1 的是________________(写出结构简式)。 【答案】(1)丙烯 (2) (3) (4) CH3CH2CHO (5)7 【解析】这是一道传统的有机合成题,与无机推断题解法一样,先走通转化关系 (合成路线),再按要求抄写答案。 其中(4)、(5)两问设置条件书写同分异构体,实现了本题的选拔功 能。
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





