
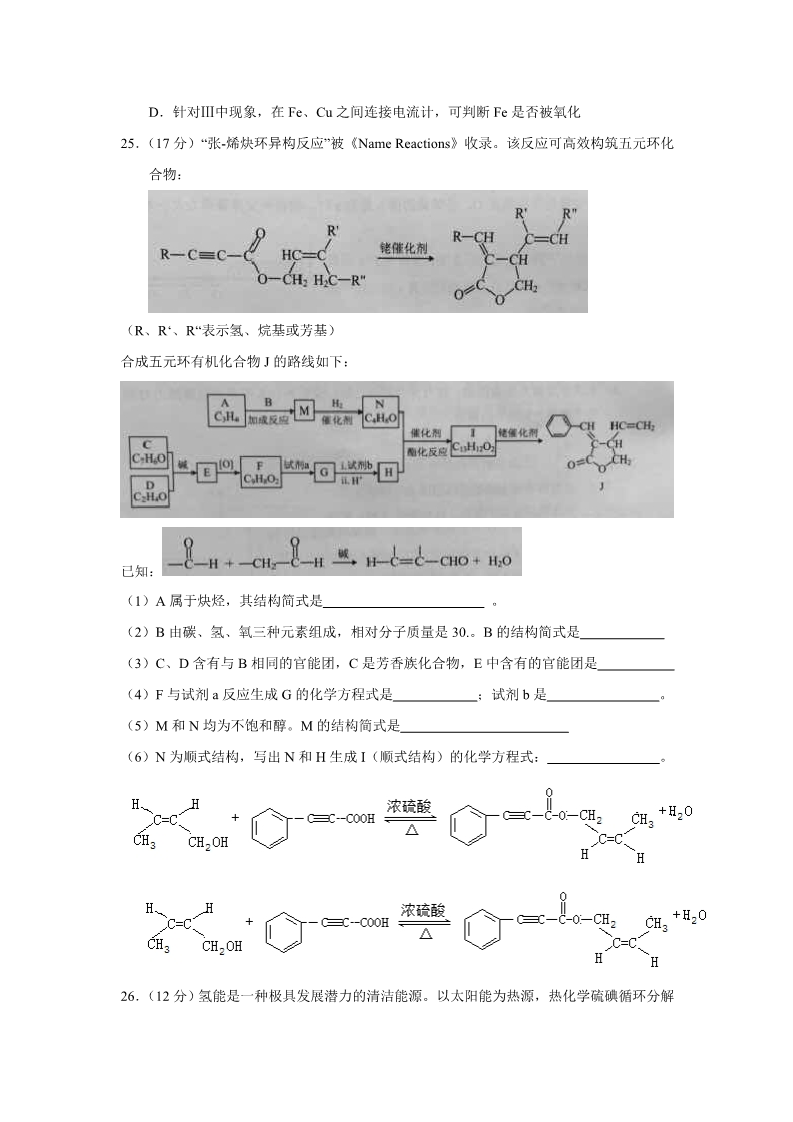
 2015 年高考北京理综化学试题及答案 6.下列我国古代的技术应用中,其工作原理不涉及化学反应的是: A 火药使用 B 粮食酿酒 C 转轮排字 D 铁的冶炼 7.下列有关性质的比较,不能用元素周期律解释的是 A.酸性;H2SO4>H3PO4 B.非金属性:Cl>Br D.热稳定性:Na2CO3>NaHCO3 C.碱性:NaOH>Mg(OH)2 8.下列关于自然界中氮循环(如右图)的说法不正确的是: A.氮元素均被氧化 B.工业合成氨属于人工固氮 C.含氮无机物和含氮有机物可相互转化 D.碳、氢、氧三种元素也参与了氮循环 9.最新报道:科学家首次用 X 射线激光技术观察到 CO 与 O 在催化剂表面形成化学键的过 程。反应过程的示意图如下: 下列说法中正确的是 A.CO 和 O 生成 CO2 是吸热反应 B.在该过程中,CO 断键形成 C 和 O C.CO 和 O 生成了具有极性共价键的 CO2 D.状态Ⅰ →状态Ⅲ表示 CO 与 O2 反应的过程 10.合成导电高分子材料 PPV 的反应: 下列说法中正确的是 A.合成 PPV 的反应为加聚反应 B.PPV 与聚苯乙烯具有相同的重复结构单元 C. 和苯乙烯互为同系物 D.通过质谱法测定 PPV 的平均相对分子质量,可得其聚合度 11.某消毒液的主要成分为 NaClO,还含有一定量的 NaOH,下列用来解释事实的方程式中 不合理的是(已知:饱和 NaClO 溶液的 pH 约为 11) A.该消毒液可用 NaOH 溶液吸收 Cl2 制备:Cl2 +2OH-=== Cl-+ ClO-+ H2O B.该消毒液的 pH 约为 12:ClO-+ H2O HClO+ OH- C.该消毒液与洁厕灵(主要成分为 HCl)混用,产生 Cl2:2H++ Cl-+ ClO-= Cl2 ↑+ H2O D.该消毒液加白醋生成 HClO,可增强漂白作用:CH3COOH+ ClO- = HClO+ CH3COO— 12.在通风橱中进行下列实验: 下列说法中不正确的是: A.Ⅰ 种气体有无色变红棕色的化学方程式为:2NO+O2=2NO2 B.Ⅱ中的现象说明 Fe 表面形成致密的氧化层,阻止 Fe 进一步反应 C.对比Ⅰ、Ⅱ中现象,说明稀 HNO3 的氧化性强于浓 HNO3 D.针对Ⅲ中现象,在 Fe、Cu 之间连接电流计,可判断 Fe 是否被氧化 25.(17 分)“张-烯炔环异构反应”被《Name Reactions》收录。该反应可高效构筑五元环化 合物: (R、R‘、R“表示氢、烷基或芳基) 合成五元环有机化合物 J 的路线如下: 已知: (1)A 属于炔烃,其结构简式是 。(2)B 由碳、氢、氧三种元素组成,相对分子质量是 30.。B 的结构简式是 (3)C、D 含有与 B 相同的官能团,C 是芳香族化合物,E 中含有的官能团是 (4)F 与试剂 a 反应生成 G 的化学方程式是 (5)M 和 N 均为不饱和醇。M 的结构简式是 ;试剂 b 是 。。(6)N 为顺式结构,写出 N 和 H 生成 I(顺式结构)的化学方程式: 26.(12 分)氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解 水是一种高效、无污染的制氢方法。其反应过程如下图所示: (1)反应Ⅰ的化学方程式是 。(2)反应Ⅰ得到的产物用 I2 进行分离。该产物的溶液在过量 I2 的存在下会分成两层——含 低浓度 I2 的 H2SO4 层和高浓度的 I2 的 HI 层。 ①根据上述事实,下列说法正确的是 a.两层溶液的密度存在差异 (选填序号)。 b.加 I2 前,H2SO4 溶液和 HI 溶液不互溶 c.I2 在 HI 溶液中比在 H2SO4 溶液中易溶 ②辨别两层溶液的方法是 。2- ③经检测,H2SO4 层中 c(H+):c(SO4 )=2.06:1。其比值大于 2 的原因是 (3)反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol 它由两步反应组成:i.H2SO4(l)=SO3(g) +H2O(g) △H=+177kJ/mol ii.SO3(g)分解。 。L(L1、L2),X 可分别代表压强或温度。 下图表示 L 一定时,ii 中 SO3(g)的平衡转 化率随 X 的变化关系。 ①X 代表的物理量是 。②判断 L1、L2 的大小关系,并简述理由: 27.(14 分) 。研究 CO2 在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。 -(1)溶于海水的 CO2 主要以 4 种无机碳形式存在,其中 HCO3 占 95%,写出 CO2 溶于水产 -生 HCO3 的方程式: 。(2)在海洋循环中,通过右图所示的途径固碳。 ①写出钙化作用的离子方程式: ②同位素示踪法证实光合作用释放出的 O2 只来自于 H2O,用 18O 标记物质的光合作用 ===(CH2O)x+x18O2+xH2O 。的化学方程式如下,将其补充完整: +(3)海水中溶解无机碳占海水总碳的 95%以上,其准确测量是研究海洋碳循环的基础,测 量溶解无机碳,可采用如下方法: ①气提、吸收 CO2,用 N2 从酸化后的海水中吹出 CO2 并用碱液吸收(装置示意图如 下),将虚线框中的装置补充完整并标出所用试剂。 ②滴定。将吸收液洗后的无机碳转化为 NaHCO3,再用 xmol/LHCl 溶液滴定,消耗 ymlHCl 溶液,海水中溶解无机碳的浓度= mol/L。 (4)利用右图所示装置从海水中提取 CO2,有利于减少环境温室气体含量。 ①结合方程式简述提取 CO2 的原理: 。②用该装置产生的物质处理 b 室排出的海水,合格后排回大海。处理至合格的方法 是。28.(15 分) 为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究 “2Fe3++2I- 2Fe2++I2”反应中 Fe3+和 Fe2+的相互转化。实验如下: (1)待实验 I 溶液颜色不再改变时,再进行实验 II,目的是使实验 I 的反应达到 。(2)iii 是 ii 的对比试验,目的是排除有 ii 中 造成的影响。 (3)i 和 ii 的颜色变化表明平衡逆向移动,Fe2+向 Fe3+转化。用化学平衡移动原理解释 原因: 。(4)根据氧化还原反应的规律,该同学推测 i 中 Fe2+向 Fe3+转化的原因:外加 Ag+使 c(I-) 降低,导致 I-的还原性弱于 Fe2+,用右图装置(a、b 均为石墨电极)进行实验验证。 ①K 闭合时,指针向右偏转,b 作 ②当指针归零(反应达到平衡)后,向 U 型管左管滴加 0.01 mol/L AgNO3 溶液, 产生的现象证实了其推测,该现象是 极。 。(5)按照(4)的原理,该同学用上图装置进行实验,证实了 ii 中 Fe2+向 Fe3+转化的原 因, ①转化原因是 。②与(4)实验对比,不同的操作是 。(6)实验 I 中,还原性:I->Fe2+;而实验 II 中,还原性:Fe2+>I-,将(3)和(4)、 (5)作对比,得出的结论是 。2015 北京理综参考答案 选择。6.C 7.D 8.A 9.C 10.D11.B 12.C 二卷。 25.参考答案: (1) CH≡C—CH3 (2)HCHO (3)碳碳双键、醛基 (4) ;NaOH 醇溶液 (5) CH3-C C-CH2OH (6) 26.参考答案: (1)SO2 + 2H2O + I2 = H2SO4 + 2HI (2)①a、c ②取上层溶液于试管中,加入盐酸酸化的氯化钡溶液,若出现白色沉淀,则上层溶液 为含低浓度 I2 的 H2SO4 溶液,若无明显现象,则上层为含高浓度 I2 的 HI 层。 2- ③碘单质可与水发生反应 I2 + H2O ⇌ HI +HIO,c(H+)增大,使溶液中 c(H+):c(SO4 )的 比值大于 2 (3)①压强 ②L2>L1 L 代表温度对 SO3 的平衡转化率的影响,反应ⅱ为吸热反应,温度升高 SO3 转化率增大 解析:考察化学反应原理和、盖斯定律、化学平衡知识。 (1)根据图案,反应 I 是 SO2 、 H2O 、 I2 的反应,SO2 + 2H2O + I2 = H2SO4 + 2HI ; (2)根据信息,含低浓度 I2 的 H2SO4 层和高浓度的 I2 的 HI 层,密度不相同,且 I2 的溶解 度不同,是液体分层原理;鉴别它们实质是鉴别 H2SO4 与 HI,可以用酸化的氯化钡溶 2- 液,也可以用酸化的硝酸银溶液;c(H+)与 c(SO4 )大于 2:1 的原因是因为 I2 与水反应 生成 HI 的缘故。 (3)根据反应特征和图形,有 2SO3(g) 2SO2(g)+O2(g),△H=550-2×177=+196kJ/mol, 是一个气体分子数增大的吸热反应,随着压强的增大,SO3(g)的平衡转化率减小,随 着温度的升高 SO3(g)的平衡转化率增大。X 为压强,L 是温度,L2>L1。 27.(14 分)参考答案: (1)CO2+H2O HCO3-+H+ (2)①Ca2++ 2HCO3-=== CaCO3↓+ CO2+H2O ②xCO2 + 2x H218O (3)① ②xy/z (4)①a 室发生阳极反应:4OH–4e-== O2+2H2O,c(OH-)下降,H2O OH-+H+平衡右 移,c(H+)增大,H+从 a 室进入 b 室,发生反应:HCO3-+H+== CO2+H2O。 ②中和法 解析:考察化学反应原理、电离知识、化学计算、电解池原理。 HCO3-+H+ ; (1)考察电离知识。CO2+H2O (2)①考察 Ca(HCO3)2 与 CaCO3 的转化:Ca2++ 2HCO3-=== CaCO3↓+ CO2+H2O ; ②考察示踪原子同位素标记和原子守恒原理:氧气从水中来。 xCO2 + 2x H218O (CH O) +x18O +xH O === 2×22(3)海水要酸化才能吹出,长进短出;形成 NaHCO3 后与 HCl 反应,根据 NaHCO3~HCl, x·y 无机碳的浓度为 mol/L. z(4)考察电解池原理,阳极:2H2O-4e- O +4H+;氢离子通过阳膜,PH 减小,进入 b === 2室与 HCO3-离子反应获得二氧化碳;从 b 室出来的海水,酸性增强,用中和法处理再 排入大海。 28.参考答案: (1)化学平衡(反应限度) (2)水,溶液中离子浓度改变 (3)i.加入 AgNO3,Ag+与 I-生成 AgI 黄色沉淀,I-浓度降低,2Fe3+ + 2I- 逆移。 2Fe2+ + I2 平衡 ii.加入 FeSO4,Fe2+浓度增大,平衡逆移。 (4)①正 ②产生黄色沉淀,指针向左偏转。 (5)①Fe2+浓度增大,还原性增强 ②当指针归零后,向 U 型管右管中滴加 0.01mol/L FeSO4 溶液。 (6)在其它条件不变时,物质的氧化性和还原性与浓度有关,浓度的改变可影响物质的氧 化还原性,导致平衡移动。 解析:考察化学平衡的实验方案设计。 (1)Fe3++2I- 2Fe2++I2;颜色不再改变,说明反应达到平衡状态; (2)iii 中加 1mL 水,是稀释,平衡逆向移动;ii 中加 1mL1mol·L-1 的 FeSO4 溶液,增大 Fe2 +浓度,平衡也逆向移动,后者影响大,以排掉水对平衡移动的影响。 (3)i 中加入硝酸银,与 I-反应,降低 I-浓度,平衡逆向移动,溶液褪色;ii 中加 1mL1mol·L -1 的 FeSO4 溶液,增大 Fe2+浓度,平衡也逆向移动,溶液颜色变浅。 (4)反应正向进行,b 极,Fe3+得到电子,为正极;当加入 AgNO3 溶液,反应逆向进行, 电流表指针偏转相反,现象是产生黄色沉淀,指针向左偏转; (5)Fe2+增大,还原性增强;当指针归零后,向 U 型管右管中滴加 0.01mol/L FeSO4 溶液。 (6)浓度的改变可影响物质的氧化性,还原性,导致平衡移动。
2015 年高考北京理综化学试题及答案 6.下列我国古代的技术应用中,其工作原理不涉及化学反应的是: A 火药使用 B 粮食酿酒 C 转轮排字 D 铁的冶炼 7.下列有关性质的比较,不能用元素周期律解释的是 A.酸性;H2SO4>H3PO4 B.非金属性:Cl>Br D.热稳定性:Na2CO3>NaHCO3 C.碱性:NaOH>Mg(OH)2 8.下列关于自然界中氮循环(如右图)的说法不正确的是: A.氮元素均被氧化 B.工业合成氨属于人工固氮 C.含氮无机物和含氮有机物可相互转化 D.碳、氢、氧三种元素也参与了氮循环 9.最新报道:科学家首次用 X 射线激光技术观察到 CO 与 O 在催化剂表面形成化学键的过 程。反应过程的示意图如下: 下列说法中正确的是 A.CO 和 O 生成 CO2 是吸热反应 B.在该过程中,CO 断键形成 C 和 O C.CO 和 O 生成了具有极性共价键的 CO2 D.状态Ⅰ →状态Ⅲ表示 CO 与 O2 反应的过程 10.合成导电高分子材料 PPV 的反应: 下列说法中正确的是 A.合成 PPV 的反应为加聚反应 B.PPV 与聚苯乙烯具有相同的重复结构单元 C. 和苯乙烯互为同系物 D.通过质谱法测定 PPV 的平均相对分子质量,可得其聚合度 11.某消毒液的主要成分为 NaClO,还含有一定量的 NaOH,下列用来解释事实的方程式中 不合理的是(已知:饱和 NaClO 溶液的 pH 约为 11) A.该消毒液可用 NaOH 溶液吸收 Cl2 制备:Cl2 +2OH-=== Cl-+ ClO-+ H2O B.该消毒液的 pH 约为 12:ClO-+ H2O HClO+ OH- C.该消毒液与洁厕灵(主要成分为 HCl)混用,产生 Cl2:2H++ Cl-+ ClO-= Cl2 ↑+ H2O D.该消毒液加白醋生成 HClO,可增强漂白作用:CH3COOH+ ClO- = HClO+ CH3COO— 12.在通风橱中进行下列实验: 下列说法中不正确的是: A.Ⅰ 种气体有无色变红棕色的化学方程式为:2NO+O2=2NO2 B.Ⅱ中的现象说明 Fe 表面形成致密的氧化层,阻止 Fe 进一步反应 C.对比Ⅰ、Ⅱ中现象,说明稀 HNO3 的氧化性强于浓 HNO3 D.针对Ⅲ中现象,在 Fe、Cu 之间连接电流计,可判断 Fe 是否被氧化 25.(17 分)“张-烯炔环异构反应”被《Name Reactions》收录。该反应可高效构筑五元环化 合物: (R、R‘、R“表示氢、烷基或芳基) 合成五元环有机化合物 J 的路线如下: 已知: (1)A 属于炔烃,其结构简式是 。(2)B 由碳、氢、氧三种元素组成,相对分子质量是 30.。B 的结构简式是 (3)C、D 含有与 B 相同的官能团,C 是芳香族化合物,E 中含有的官能团是 (4)F 与试剂 a 反应生成 G 的化学方程式是 (5)M 和 N 均为不饱和醇。M 的结构简式是 ;试剂 b 是 。。(6)N 为顺式结构,写出 N 和 H 生成 I(顺式结构)的化学方程式: 26.(12 分)氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解 水是一种高效、无污染的制氢方法。其反应过程如下图所示: (1)反应Ⅰ的化学方程式是 。(2)反应Ⅰ得到的产物用 I2 进行分离。该产物的溶液在过量 I2 的存在下会分成两层——含 低浓度 I2 的 H2SO4 层和高浓度的 I2 的 HI 层。 ①根据上述事实,下列说法正确的是 a.两层溶液的密度存在差异 (选填序号)。 b.加 I2 前,H2SO4 溶液和 HI 溶液不互溶 c.I2 在 HI 溶液中比在 H2SO4 溶液中易溶 ②辨别两层溶液的方法是 。2- ③经检测,H2SO4 层中 c(H+):c(SO4 )=2.06:1。其比值大于 2 的原因是 (3)反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol 它由两步反应组成:i.H2SO4(l)=SO3(g) +H2O(g) △H=+177kJ/mol ii.SO3(g)分解。 。L(L1、L2),X 可分别代表压强或温度。 下图表示 L 一定时,ii 中 SO3(g)的平衡转 化率随 X 的变化关系。 ①X 代表的物理量是 。②判断 L1、L2 的大小关系,并简述理由: 27.(14 分) 。研究 CO2 在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。 -(1)溶于海水的 CO2 主要以 4 种无机碳形式存在,其中 HCO3 占 95%,写出 CO2 溶于水产 -生 HCO3 的方程式: 。(2)在海洋循环中,通过右图所示的途径固碳。 ①写出钙化作用的离子方程式: ②同位素示踪法证实光合作用释放出的 O2 只来自于 H2O,用 18O 标记物质的光合作用 ===(CH2O)x+x18O2+xH2O 。的化学方程式如下,将其补充完整: +(3)海水中溶解无机碳占海水总碳的 95%以上,其准确测量是研究海洋碳循环的基础,测 量溶解无机碳,可采用如下方法: ①气提、吸收 CO2,用 N2 从酸化后的海水中吹出 CO2 并用碱液吸收(装置示意图如 下),将虚线框中的装置补充完整并标出所用试剂。 ②滴定。将吸收液洗后的无机碳转化为 NaHCO3,再用 xmol/LHCl 溶液滴定,消耗 ymlHCl 溶液,海水中溶解无机碳的浓度= mol/L。 (4)利用右图所示装置从海水中提取 CO2,有利于减少环境温室气体含量。 ①结合方程式简述提取 CO2 的原理: 。②用该装置产生的物质处理 b 室排出的海水,合格后排回大海。处理至合格的方法 是。28.(15 分) 为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究 “2Fe3++2I- 2Fe2++I2”反应中 Fe3+和 Fe2+的相互转化。实验如下: (1)待实验 I 溶液颜色不再改变时,再进行实验 II,目的是使实验 I 的反应达到 。(2)iii 是 ii 的对比试验,目的是排除有 ii 中 造成的影响。 (3)i 和 ii 的颜色变化表明平衡逆向移动,Fe2+向 Fe3+转化。用化学平衡移动原理解释 原因: 。(4)根据氧化还原反应的规律,该同学推测 i 中 Fe2+向 Fe3+转化的原因:外加 Ag+使 c(I-) 降低,导致 I-的还原性弱于 Fe2+,用右图装置(a、b 均为石墨电极)进行实验验证。 ①K 闭合时,指针向右偏转,b 作 ②当指针归零(反应达到平衡)后,向 U 型管左管滴加 0.01 mol/L AgNO3 溶液, 产生的现象证实了其推测,该现象是 极。 。(5)按照(4)的原理,该同学用上图装置进行实验,证实了 ii 中 Fe2+向 Fe3+转化的原 因, ①转化原因是 。②与(4)实验对比,不同的操作是 。(6)实验 I 中,还原性:I->Fe2+;而实验 II 中,还原性:Fe2+>I-,将(3)和(4)、 (5)作对比,得出的结论是 。2015 北京理综参考答案 选择。6.C 7.D 8.A 9.C 10.D11.B 12.C 二卷。 25.参考答案: (1) CH≡C—CH3 (2)HCHO (3)碳碳双键、醛基 (4) ;NaOH 醇溶液 (5) CH3-C C-CH2OH (6) 26.参考答案: (1)SO2 + 2H2O + I2 = H2SO4 + 2HI (2)①a、c ②取上层溶液于试管中,加入盐酸酸化的氯化钡溶液,若出现白色沉淀,则上层溶液 为含低浓度 I2 的 H2SO4 溶液,若无明显现象,则上层为含高浓度 I2 的 HI 层。 2- ③碘单质可与水发生反应 I2 + H2O ⇌ HI +HIO,c(H+)增大,使溶液中 c(H+):c(SO4 )的 比值大于 2 (3)①压强 ②L2>L1 L 代表温度对 SO3 的平衡转化率的影响,反应ⅱ为吸热反应,温度升高 SO3 转化率增大 解析:考察化学反应原理和、盖斯定律、化学平衡知识。 (1)根据图案,反应 I 是 SO2 、 H2O 、 I2 的反应,SO2 + 2H2O + I2 = H2SO4 + 2HI ; (2)根据信息,含低浓度 I2 的 H2SO4 层和高浓度的 I2 的 HI 层,密度不相同,且 I2 的溶解 度不同,是液体分层原理;鉴别它们实质是鉴别 H2SO4 与 HI,可以用酸化的氯化钡溶 2- 液,也可以用酸化的硝酸银溶液;c(H+)与 c(SO4 )大于 2:1 的原因是因为 I2 与水反应 生成 HI 的缘故。 (3)根据反应特征和图形,有 2SO3(g) 2SO2(g)+O2(g),△H=550-2×177=+196kJ/mol, 是一个气体分子数增大的吸热反应,随着压强的增大,SO3(g)的平衡转化率减小,随 着温度的升高 SO3(g)的平衡转化率增大。X 为压强,L 是温度,L2>L1。 27.(14 分)参考答案: (1)CO2+H2O HCO3-+H+ (2)①Ca2++ 2HCO3-=== CaCO3↓+ CO2+H2O ②xCO2 + 2x H218O (3)① ②xy/z (4)①a 室发生阳极反应:4OH–4e-== O2+2H2O,c(OH-)下降,H2O OH-+H+平衡右 移,c(H+)增大,H+从 a 室进入 b 室,发生反应:HCO3-+H+== CO2+H2O。 ②中和法 解析:考察化学反应原理、电离知识、化学计算、电解池原理。 HCO3-+H+ ; (1)考察电离知识。CO2+H2O (2)①考察 Ca(HCO3)2 与 CaCO3 的转化:Ca2++ 2HCO3-=== CaCO3↓+ CO2+H2O ; ②考察示踪原子同位素标记和原子守恒原理:氧气从水中来。 xCO2 + 2x H218O (CH O) +x18O +xH O === 2×22(3)海水要酸化才能吹出,长进短出;形成 NaHCO3 后与 HCl 反应,根据 NaHCO3~HCl, x·y 无机碳的浓度为 mol/L. z(4)考察电解池原理,阳极:2H2O-4e- O +4H+;氢离子通过阳膜,PH 减小,进入 b === 2室与 HCO3-离子反应获得二氧化碳;从 b 室出来的海水,酸性增强,用中和法处理再 排入大海。 28.参考答案: (1)化学平衡(反应限度) (2)水,溶液中离子浓度改变 (3)i.加入 AgNO3,Ag+与 I-生成 AgI 黄色沉淀,I-浓度降低,2Fe3+ + 2I- 逆移。 2Fe2+ + I2 平衡 ii.加入 FeSO4,Fe2+浓度增大,平衡逆移。 (4)①正 ②产生黄色沉淀,指针向左偏转。 (5)①Fe2+浓度增大,还原性增强 ②当指针归零后,向 U 型管右管中滴加 0.01mol/L FeSO4 溶液。 (6)在其它条件不变时,物质的氧化性和还原性与浓度有关,浓度的改变可影响物质的氧 化还原性,导致平衡移动。 解析:考察化学平衡的实验方案设计。 (1)Fe3++2I- 2Fe2++I2;颜色不再改变,说明反应达到平衡状态; (2)iii 中加 1mL 水,是稀释,平衡逆向移动;ii 中加 1mL1mol·L-1 的 FeSO4 溶液,增大 Fe2 +浓度,平衡也逆向移动,后者影响大,以排掉水对平衡移动的影响。 (3)i 中加入硝酸银,与 I-反应,降低 I-浓度,平衡逆向移动,溶液褪色;ii 中加 1mL1mol·L -1 的 FeSO4 溶液,增大 Fe2+浓度,平衡也逆向移动,溶液颜色变浅。 (4)反应正向进行,b 极,Fe3+得到电子,为正极;当加入 AgNO3 溶液,反应逆向进行, 电流表指针偏转相反,现象是产生黄色沉淀,指针向左偏转; (5)Fe2+增大,还原性增强;当指针归零后,向 U 型管右管中滴加 0.01mol/L FeSO4 溶液。 (6)浓度的改变可影响物质的氧化性,还原性,导致平衡移动。
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





