
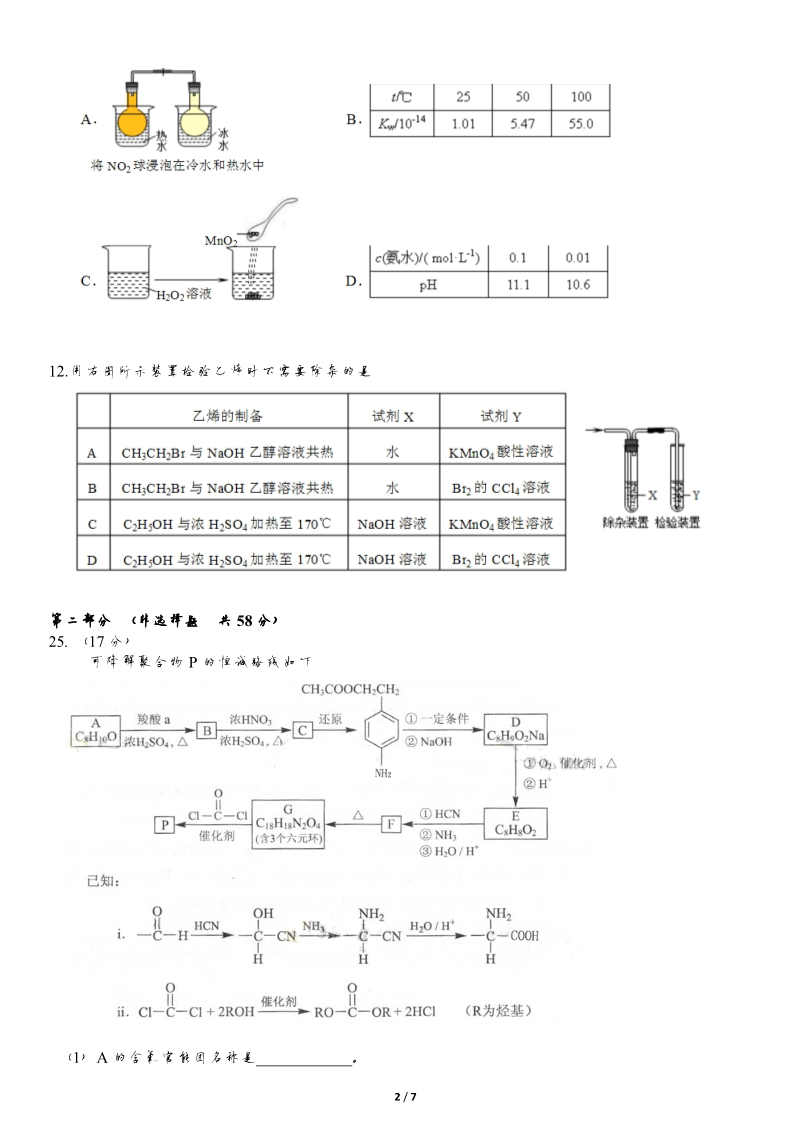
 2013 年理科综合能力测试化学部分(北京卷) 第一部分(选择,42 分) 6.下列设备工作时,将化学能转化为热能的是 7.下列金属防腐的措施中,使用外加电流的阴极保护法的是 A.水中的钢闸门连接电源的负极 C.汽水底盘喷涂高分子膜 B.金属护拦表面涂漆 D.地下钢管连接镁块 8.下列解释事实的方程式不准确的是 A.用浓盐酸检验氨:NH3+HC1=NH4C1 2- B.碳酸钠溶液显碱性:CO3 +H2O HCO-3+OH- C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ D.长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O 9.用石墨电极电解 CuCl2 溶液(见右图)。下列分析正确的是 A.a 端是直流电源的负极 B.通电使 CuCl2 发生电离 C.阳极上发生的反应:Cu2++2e-=Cu D.通电一段时间后,在阴极附近观察到黄绿色气体 10.实验:①0.1mol·L-1AgNO3 溶液和 0.1mol·L-1NaCl 溶液等体积混合得到浊液 a,过滤得到滤液 b 和白 色沉淀物 c; ② 像滤液 b 中滴加 0.1mol·L-1KI 溶液,出现浑浊; ③ 像沉淀 c 中滴加 0.1mol·L-1KI 溶液,沉淀变为黄色。 下列分析不正确的是 A. 浊液 a 中存在沉淀溶解平 B. 滤液 b 中不含有 Ag+ 衡: C. ③中颜色变化说明 AgCl 转化为 AgI D. 实验可以证明 AgI 比 AgCI 更难溶 11.下列实验事实不能用平衡移动原理解释的是 1 / 7 12.用右图所示装置检验乙烯时不需要除杂的是 第二部分 (非选择题共 58 分) 25.(17 分) 可降解聚合物 P 的恒诚路线如下 (1)A 的含氧官能团名称是____________。 2 / 7 (2)羧酸 a 的电离方程是________________。 (3)B→C 的化学方程式是_____________。 (4)化合物 D 苯环上的一氯代物有 2 中,D 的结构简式是___________。 (5)E→F 中反应①和②的反应类型分别是___________。 (6)F 的结构简式是_____________。 (7)聚合物 P 的结构简式是________________。 26.(14 分) NOx 是汽车尾气中的主要污染物之一。 (1) NOx 能形成酸雨,写出 NO2 转化为 HNO3 的化学方程式:_ (2)汽车发动机工作时会引发 N2 和 02 反应,其能量变化示意图如下: .① 写出该反应的热化学方程式: _ .②随温度升高,该反应化学平衡常数的变化趋势是_ .。 (3)在汽车尾气系统中装置催化转化器,可有效降低 NOX 的排放。 ①当尾气中空气不足时,NOX 在催化转化器中被还原成 N2 排出。写出 NO 被 CO 还原的化学方程式: _.② 当尾气中空气过量时,催化转化器中的金属氧化物吸收 NOX 生成盐。其吸收能力顺序如下: MgO 12 <2oCaO <38SrO<56BaO.原因是 收能力逐渐增强。 .,元素的金属性逐渐增强,金属氧化物对 NOX 的吸 (4) 通过NOx 传感器可监测 NOx 的含量,其工作原理示意图如下: ①Pt 电极上发生的是 反应(填“氧化”或“还原”)。 ②写出 NiO 电极的电极反应式: .27.(12 分) 用含有 A1203、SiO2 和少量 FeO·xFe2O3 的铝灰制备 A12(SO4)3·18H2O。,工艺流程如下(部分操作和条 件略): Ⅰ。向铝灰中加入过量稀 H2SO4,过滤: Ⅱ。向滤液中加入过量 KMnO4 溶液,调节溶液的 pH 约为 3; Ⅲ。加热,产生大量棕色沉淀,静置,上层溶液呈紫红色: Ⅳ。加入 MnSO4 至紫红色消失,过滤; Ⅴ。浓缩、结晶、分离,得到产品。 (1) H2S04 溶解 A1203 的离子方程式是 -(2) KMnO4 氧化 Fe2+的离子方程式补充完整: 3 / 7 (3)已知: 生成氢氧化物沉淀的 pH Al(OH)3 Fe(OH)2 Fe(OH)3 开始沉淀时 完全沉淀时 3.4 4.7 6.3 8.3 1.5 2.8 注:金属离子的起始浓度为 0.1mol·L-1 根据表中数据解释步骤Ⅱ的目的: -(4)己知:一定条件下,MnO4 可与 Mn2+反应生成 MnO2, ① 向 Ⅲ 的沉淀中加入浓 HCI 并加热,能说明沉淀中存在 MnO2 的现象是 ② Ⅳ 中加入 MnS04 的目的是 .28.(15 分) 某学生对 SO2 与漂粉精的反应进行实验探究: 操作 现象 取 4g 漂粉精固体,加入 100mL 水 过滤,测漂粉精溶液的 pH 部分固体溶解,溶液略有颜色 pH 试纸先变蓝(约为 12),后褪色 i. 液面上方出现白雾; ii. 稍后,出现浑浊,溶液变为黄绿色; iii.稍后,产生大量白色沉淀,黄绿色褪 去(1)C12 和 Ca(OH)2 制取漂粉精的化学方程是 。(2)pH 试纸颜色的变化说明漂粉精溶液具有的性质是 。(3)向水中持续通入 SO2,未观察到白雾。推测现象 i 的白雾由 HC1 小液滴形成,进行如下实验: a.用湿润的碘化钾淀粉试纸检验白雾,无变化; b.用酸化的 AgNO3 溶液检验白雾,产生白色沉淀。 ① 实验 a 目的是 ②由实验 a、b 不能判断白雾中含有 HC1,理由是 (4)现象 ii 中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和 C1-发生反应。 。。通过进一步实验确认了这种可能性,其实验方案是 。(5)将 A 瓶中混合物过滤、洗涤,得到沉淀 X ①向沉淀 X 中加入稀 HC1,无明显变化。取上层清液,加入 BaC12 溶液,产生白色沉淀。则沉淀 X 中含有的物质是 ②用离子方程式解释现象 iii 中黄绿色褪去的原因: 。。4 / 7 参考答案及解析 6、【答案】D 【解析】 A、硅太阳能电池是将太阳能直接转化为电能,故错误; B、锂离子电池将化学能直接转化为电能,故错误; C、太阳能集热器是将太阳能转变为热能,故错误; D、燃料燃烧将化学能直接转化为热能,故正确。 7、【答案】A 【解析】 A、钢闸门连接电源的负极,为电解池的阴极,被保护,属于外加电流的阴极保护法,故正确; BC、是金属表面覆盖保护层,隔绝空气,故错误 D、 镁比铁活泼,构成原电池,铁为正极,被保护,是牺牲阳极的阴极保护法,故错误。 8、【答案】C 【解析】 A、盐酸具有挥发性,挥发出的 HCl 与氨气反应生成氯化铵,冒白烟,故正确; 2- 2- B、碳酸钠是强碱弱酸盐,溶液中存在 CO3 水解平衡:CO3 +H2O=HCO3-+OH-,使溶液呈碱性, 故正确; C、钢铁发生吸氧腐蚀,铁作负极被氧化,电极反应式为 Fe-2e-=Fe2+,故错误; D、石灰水与空气中的二氧化碳反应生成碳酸钙,故正确。 9、【答案】A 【解析】 A、由溶液中离子移动方向可知,U 型管左侧电极是阴极,连接电源的负极,a 端是电源的负极, 故正确; B、通电使 CuCl2 发生电解,不是电离,故错误; C、阳极发生氧化反应,Cl-在阳极放电 2Cl–2e-=C12↑,故错误; D、Cl-发生氧化反应,在阳极放电生成 C12,故 D 错误。 10、【答案】B 【解析】 A、绝对不溶的物质没有,难溶物质在溶液中存在沉淀溶解平衡,故正确; B、溶液中存在沉淀溶解平衡,滤液中含有 Ag+,故错误; C、D 选项沉淀由白色变为黄色,说明生成 AgI,反应向更难溶的方向进行,故正确。 11、【答案】C 【解析】 A、存在平衡 2NO2=N2O4 ,升高温度平衡向生成 NO2 方向移动,故正确; B、水的电离是可逆过程,升高温度 Kw 增大,促进水的电离,故 B 正确; C、催化剂不能影响平衡移动,故 C 错误; D、弱电解质电离存在平衡,浓度越稀,电离程度越大,促进电离,但离子浓度降低,故氨水的 浓度越稀,pH 值越小,故 D 正确。 12、【答案】B 【解析】 A、B 选项乙烯中的杂质为乙醇,乙醇可使 KMnO4 褪色,故必须用水除去。乙醇不能使 Br2 的 CCl4 溶液褪色,故不需出去。 C、D选项乙烯中杂质为乙醇、SO2 和 CO2。其中乙醇、SO2 均可使 KMnO4 褪色,故用氢氧化 钠溶液除去;尽管乙醇不能使 Br2 的 CCl4 溶液褪色,但 SO2 在有 H2O(g)存在的情况下能使 Br2 的 CCl4 溶液褪色,故用氢氧化钠溶液除去。故 ACD 错误,B 正确。 5 / 7 25.(17 分) (1)羟基 (5)加成反应、取代反应 (6) (7) 【解析】 28+2-10 A 不饱和度为 =4,结合 C 的还原产物可知,A 中含有一个苯环, 26 / 7 26(14 分) 【答案】 (1)3NO2+2H2O=2HNO3+NO; (2)①、N2(g)+O2(g)=2NO(g) △H=+183KJ/mol; ②、增大; (3)①、 2NO 2CO 催化剂 N2 2CO2 ②、由 Mg、Ca、Sr、Ba 的质子数可知,它们均处 于第ⅡA 族,同一主族自上而下,原 子半径增大; (4)①、还原; 【解析】 ②、NO+O2-2e-=NO2; (1)NO2 与 H2O 反应生成 HNO3 与 NO; (2)①、△H=945kJ/mol+498kJ/mol-2×630KJ/mol=+183KJ/mol; 升高温度,平衡向正反应移动,化学平衡常数增大; ②、该反应正反应是吸热反应, (3)①、NO 被 CO 还原 N2,CO 被氧化为 CO2; ②、由 Mg、Ca、Sr、Ba 的质子数可知,它 们均处于第ⅡA 族,同一主族自上而下,原 子半径增大,金属性增强; (4)①、由工作原理示意图可知,O2 在 Pt 电极发生还原反应生成 O2-; NO 在 NiO 电极发生氧化反应生成 NO2。 ②、在 O2-参加反应下, 27(12 分) 【答案】 (1)Al2O3+6H+=2Al3++3H2O (2)5、8H+、5、4H2O; (3)将 Fe2+氧化为 Fe3+,调节 pH 值使铁完全沉淀; -(4)①、生成有黄绿色气体; 【解析】 ②、加入 MnSO4,除去过量的 MnO4 。 (1)氧化铝与硫酸反应生成硫酸铝与水; (2)反应中 MnO4-→Mn2+,Fe2+→Fe3+, MnO4-系数为 1,根据电子转移守恒可知, Fe2+系数为 1(72) 32 =5,由元素守恒可知, Fe3+系数为 5,由电荷守恒可知, 由 H+ 参加反应,其系数为 8,根 -据元素守恒可知,有 H2O 生成,其系数为 4,方程式配平为 MnO4 +5 Fe2++8H+=Mn2++5Fe3++4H2O; (3)滤液中含有 Fe2+,由表中数据可知,Fe(OH)2 开始沉淀的 pH 大于 Al(OH)3 完全沉淀的 pH 值,而 Fe(OH)3 完全沉淀的 pH 值小于 Al(OH)3 开始沉淀的 pH 值,pH 值约为 3 时,Al3+、Fe2+ 不能沉淀,步骤Ⅱ是将 Fe2+氧化为 Fe3+,调节 pH 值使铁完全沉淀; (4)①、MnO2 能将 HCl 氧化为 Cl2,若有黄绿色气体生成说明沉淀中存在 MnO2; 的上层液呈紫红色,MnO4-过量,加入 MnSO4,除去过量的 MnO4-。 ②、Ⅲ 28.(15 分) (1)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O (2)碱性、漂白性 (3) ①检验白雾中是否含有Cl2,排除 Cl2 干扰 ②白雾中混有SO2,SO2 可与酸化的 AgNO3 反应 产生白色沉淀 (4)向漂白精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色 2- (5) ①CaSO4 ②SO2+Cl2+2H2O=SO4 +2Cl-+4H+ 7 / 7
2013 年理科综合能力测试化学部分(北京卷) 第一部分(选择,42 分) 6.下列设备工作时,将化学能转化为热能的是 7.下列金属防腐的措施中,使用外加电流的阴极保护法的是 A.水中的钢闸门连接电源的负极 C.汽水底盘喷涂高分子膜 B.金属护拦表面涂漆 D.地下钢管连接镁块 8.下列解释事实的方程式不准确的是 A.用浓盐酸检验氨:NH3+HC1=NH4C1 2- B.碳酸钠溶液显碱性:CO3 +H2O HCO-3+OH- C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ D.长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O 9.用石墨电极电解 CuCl2 溶液(见右图)。下列分析正确的是 A.a 端是直流电源的负极 B.通电使 CuCl2 发生电离 C.阳极上发生的反应:Cu2++2e-=Cu D.通电一段时间后,在阴极附近观察到黄绿色气体 10.实验:①0.1mol·L-1AgNO3 溶液和 0.1mol·L-1NaCl 溶液等体积混合得到浊液 a,过滤得到滤液 b 和白 色沉淀物 c; ② 像滤液 b 中滴加 0.1mol·L-1KI 溶液,出现浑浊; ③ 像沉淀 c 中滴加 0.1mol·L-1KI 溶液,沉淀变为黄色。 下列分析不正确的是 A. 浊液 a 中存在沉淀溶解平 B. 滤液 b 中不含有 Ag+ 衡: C. ③中颜色变化说明 AgCl 转化为 AgI D. 实验可以证明 AgI 比 AgCI 更难溶 11.下列实验事实不能用平衡移动原理解释的是 1 / 7 12.用右图所示装置检验乙烯时不需要除杂的是 第二部分 (非选择题共 58 分) 25.(17 分) 可降解聚合物 P 的恒诚路线如下 (1)A 的含氧官能团名称是____________。 2 / 7 (2)羧酸 a 的电离方程是________________。 (3)B→C 的化学方程式是_____________。 (4)化合物 D 苯环上的一氯代物有 2 中,D 的结构简式是___________。 (5)E→F 中反应①和②的反应类型分别是___________。 (6)F 的结构简式是_____________。 (7)聚合物 P 的结构简式是________________。 26.(14 分) NOx 是汽车尾气中的主要污染物之一。 (1) NOx 能形成酸雨,写出 NO2 转化为 HNO3 的化学方程式:_ (2)汽车发动机工作时会引发 N2 和 02 反应,其能量变化示意图如下: .① 写出该反应的热化学方程式: _ .②随温度升高,该反应化学平衡常数的变化趋势是_ .。 (3)在汽车尾气系统中装置催化转化器,可有效降低 NOX 的排放。 ①当尾气中空气不足时,NOX 在催化转化器中被还原成 N2 排出。写出 NO 被 CO 还原的化学方程式: _.② 当尾气中空气过量时,催化转化器中的金属氧化物吸收 NOX 生成盐。其吸收能力顺序如下: MgO 12 <2oCaO <38SrO<56BaO.原因是 收能力逐渐增强。 .,元素的金属性逐渐增强,金属氧化物对 NOX 的吸 (4) 通过NOx 传感器可监测 NOx 的含量,其工作原理示意图如下: ①Pt 电极上发生的是 反应(填“氧化”或“还原”)。 ②写出 NiO 电极的电极反应式: .27.(12 分) 用含有 A1203、SiO2 和少量 FeO·xFe2O3 的铝灰制备 A12(SO4)3·18H2O。,工艺流程如下(部分操作和条 件略): Ⅰ。向铝灰中加入过量稀 H2SO4,过滤: Ⅱ。向滤液中加入过量 KMnO4 溶液,调节溶液的 pH 约为 3; Ⅲ。加热,产生大量棕色沉淀,静置,上层溶液呈紫红色: Ⅳ。加入 MnSO4 至紫红色消失,过滤; Ⅴ。浓缩、结晶、分离,得到产品。 (1) H2S04 溶解 A1203 的离子方程式是 -(2) KMnO4 氧化 Fe2+的离子方程式补充完整: 3 / 7 (3)已知: 生成氢氧化物沉淀的 pH Al(OH)3 Fe(OH)2 Fe(OH)3 开始沉淀时 完全沉淀时 3.4 4.7 6.3 8.3 1.5 2.8 注:金属离子的起始浓度为 0.1mol·L-1 根据表中数据解释步骤Ⅱ的目的: -(4)己知:一定条件下,MnO4 可与 Mn2+反应生成 MnO2, ① 向 Ⅲ 的沉淀中加入浓 HCI 并加热,能说明沉淀中存在 MnO2 的现象是 ② Ⅳ 中加入 MnS04 的目的是 .28.(15 分) 某学生对 SO2 与漂粉精的反应进行实验探究: 操作 现象 取 4g 漂粉精固体,加入 100mL 水 过滤,测漂粉精溶液的 pH 部分固体溶解,溶液略有颜色 pH 试纸先变蓝(约为 12),后褪色 i. 液面上方出现白雾; ii. 稍后,出现浑浊,溶液变为黄绿色; iii.稍后,产生大量白色沉淀,黄绿色褪 去(1)C12 和 Ca(OH)2 制取漂粉精的化学方程是 。(2)pH 试纸颜色的变化说明漂粉精溶液具有的性质是 。(3)向水中持续通入 SO2,未观察到白雾。推测现象 i 的白雾由 HC1 小液滴形成,进行如下实验: a.用湿润的碘化钾淀粉试纸检验白雾,无变化; b.用酸化的 AgNO3 溶液检验白雾,产生白色沉淀。 ① 实验 a 目的是 ②由实验 a、b 不能判断白雾中含有 HC1,理由是 (4)现象 ii 中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和 C1-发生反应。 。。通过进一步实验确认了这种可能性,其实验方案是 。(5)将 A 瓶中混合物过滤、洗涤,得到沉淀 X ①向沉淀 X 中加入稀 HC1,无明显变化。取上层清液,加入 BaC12 溶液,产生白色沉淀。则沉淀 X 中含有的物质是 ②用离子方程式解释现象 iii 中黄绿色褪去的原因: 。。4 / 7 参考答案及解析 6、【答案】D 【解析】 A、硅太阳能电池是将太阳能直接转化为电能,故错误; B、锂离子电池将化学能直接转化为电能,故错误; C、太阳能集热器是将太阳能转变为热能,故错误; D、燃料燃烧将化学能直接转化为热能,故正确。 7、【答案】A 【解析】 A、钢闸门连接电源的负极,为电解池的阴极,被保护,属于外加电流的阴极保护法,故正确; BC、是金属表面覆盖保护层,隔绝空气,故错误 D、 镁比铁活泼,构成原电池,铁为正极,被保护,是牺牲阳极的阴极保护法,故错误。 8、【答案】C 【解析】 A、盐酸具有挥发性,挥发出的 HCl 与氨气反应生成氯化铵,冒白烟,故正确; 2- 2- B、碳酸钠是强碱弱酸盐,溶液中存在 CO3 水解平衡:CO3 +H2O=HCO3-+OH-,使溶液呈碱性, 故正确; C、钢铁发生吸氧腐蚀,铁作负极被氧化,电极反应式为 Fe-2e-=Fe2+,故错误; D、石灰水与空气中的二氧化碳反应生成碳酸钙,故正确。 9、【答案】A 【解析】 A、由溶液中离子移动方向可知,U 型管左侧电极是阴极,连接电源的负极,a 端是电源的负极, 故正确; B、通电使 CuCl2 发生电解,不是电离,故错误; C、阳极发生氧化反应,Cl-在阳极放电 2Cl–2e-=C12↑,故错误; D、Cl-发生氧化反应,在阳极放电生成 C12,故 D 错误。 10、【答案】B 【解析】 A、绝对不溶的物质没有,难溶物质在溶液中存在沉淀溶解平衡,故正确; B、溶液中存在沉淀溶解平衡,滤液中含有 Ag+,故错误; C、D 选项沉淀由白色变为黄色,说明生成 AgI,反应向更难溶的方向进行,故正确。 11、【答案】C 【解析】 A、存在平衡 2NO2=N2O4 ,升高温度平衡向生成 NO2 方向移动,故正确; B、水的电离是可逆过程,升高温度 Kw 增大,促进水的电离,故 B 正确; C、催化剂不能影响平衡移动,故 C 错误; D、弱电解质电离存在平衡,浓度越稀,电离程度越大,促进电离,但离子浓度降低,故氨水的 浓度越稀,pH 值越小,故 D 正确。 12、【答案】B 【解析】 A、B 选项乙烯中的杂质为乙醇,乙醇可使 KMnO4 褪色,故必须用水除去。乙醇不能使 Br2 的 CCl4 溶液褪色,故不需出去。 C、D选项乙烯中杂质为乙醇、SO2 和 CO2。其中乙醇、SO2 均可使 KMnO4 褪色,故用氢氧化 钠溶液除去;尽管乙醇不能使 Br2 的 CCl4 溶液褪色,但 SO2 在有 H2O(g)存在的情况下能使 Br2 的 CCl4 溶液褪色,故用氢氧化钠溶液除去。故 ACD 错误,B 正确。 5 / 7 25.(17 分) (1)羟基 (5)加成反应、取代反应 (6) (7) 【解析】 28+2-10 A 不饱和度为 =4,结合 C 的还原产物可知,A 中含有一个苯环, 26 / 7 26(14 分) 【答案】 (1)3NO2+2H2O=2HNO3+NO; (2)①、N2(g)+O2(g)=2NO(g) △H=+183KJ/mol; ②、增大; (3)①、 2NO 2CO 催化剂 N2 2CO2 ②、由 Mg、Ca、Sr、Ba 的质子数可知,它们均处 于第ⅡA 族,同一主族自上而下,原 子半径增大; (4)①、还原; 【解析】 ②、NO+O2-2e-=NO2; (1)NO2 与 H2O 反应生成 HNO3 与 NO; (2)①、△H=945kJ/mol+498kJ/mol-2×630KJ/mol=+183KJ/mol; 升高温度,平衡向正反应移动,化学平衡常数增大; ②、该反应正反应是吸热反应, (3)①、NO 被 CO 还原 N2,CO 被氧化为 CO2; ②、由 Mg、Ca、Sr、Ba 的质子数可知,它 们均处于第ⅡA 族,同一主族自上而下,原 子半径增大,金属性增强; (4)①、由工作原理示意图可知,O2 在 Pt 电极发生还原反应生成 O2-; NO 在 NiO 电极发生氧化反应生成 NO2。 ②、在 O2-参加反应下, 27(12 分) 【答案】 (1)Al2O3+6H+=2Al3++3H2O (2)5、8H+、5、4H2O; (3)将 Fe2+氧化为 Fe3+,调节 pH 值使铁完全沉淀; -(4)①、生成有黄绿色气体; 【解析】 ②、加入 MnSO4,除去过量的 MnO4 。 (1)氧化铝与硫酸反应生成硫酸铝与水; (2)反应中 MnO4-→Mn2+,Fe2+→Fe3+, MnO4-系数为 1,根据电子转移守恒可知, Fe2+系数为 1(72) 32 =5,由元素守恒可知, Fe3+系数为 5,由电荷守恒可知, 由 H+ 参加反应,其系数为 8,根 -据元素守恒可知,有 H2O 生成,其系数为 4,方程式配平为 MnO4 +5 Fe2++8H+=Mn2++5Fe3++4H2O; (3)滤液中含有 Fe2+,由表中数据可知,Fe(OH)2 开始沉淀的 pH 大于 Al(OH)3 完全沉淀的 pH 值,而 Fe(OH)3 完全沉淀的 pH 值小于 Al(OH)3 开始沉淀的 pH 值,pH 值约为 3 时,Al3+、Fe2+ 不能沉淀,步骤Ⅱ是将 Fe2+氧化为 Fe3+,调节 pH 值使铁完全沉淀; (4)①、MnO2 能将 HCl 氧化为 Cl2,若有黄绿色气体生成说明沉淀中存在 MnO2; 的上层液呈紫红色,MnO4-过量,加入 MnSO4,除去过量的 MnO4-。 ②、Ⅲ 28.(15 分) (1)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O (2)碱性、漂白性 (3) ①检验白雾中是否含有Cl2,排除 Cl2 干扰 ②白雾中混有SO2,SO2 可与酸化的 AgNO3 反应 产生白色沉淀 (4)向漂白精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色 2- (5) ①CaSO4 ②SO2+Cl2+2H2O=SO4 +2Cl-+4H+ 7 / 7
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





