
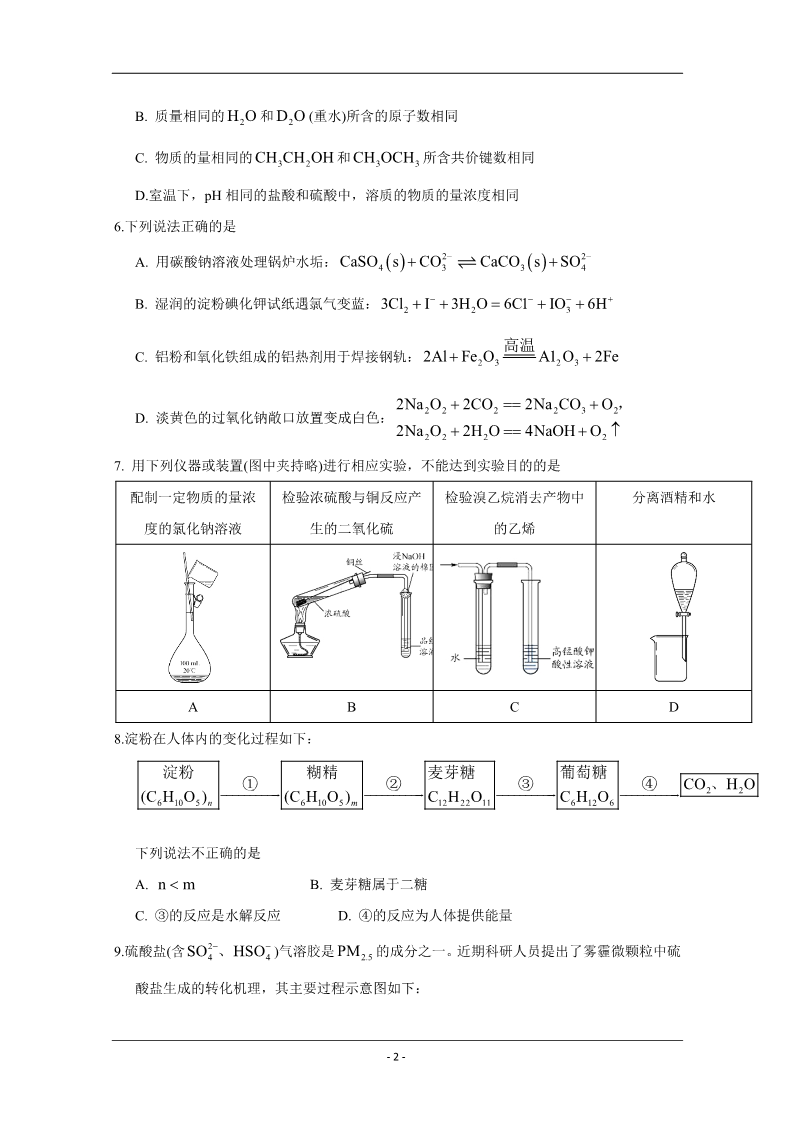
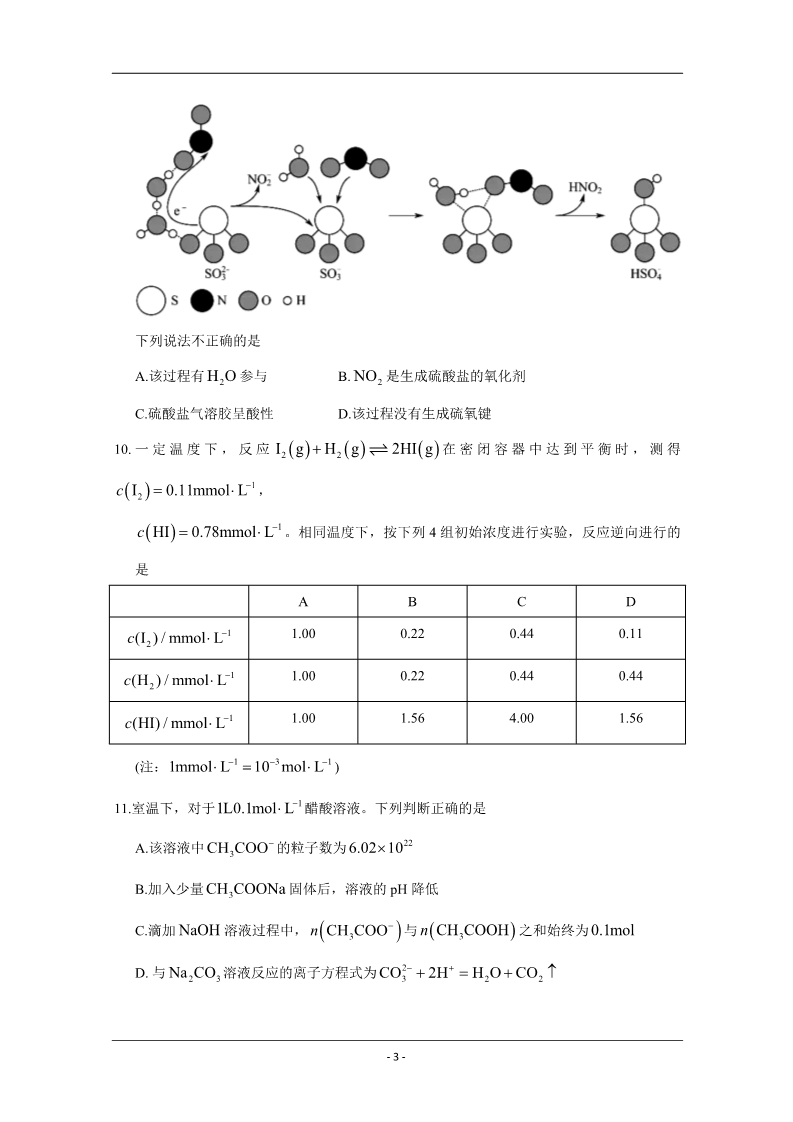
 绝密★启用前 2020年北京市普通高中学业水平等级性考试 化学本试卷共 9 页,100 分。考试时长 90 分钟。考生务必将答案答在答题卡上,在试卷上作 答无效。考试结束后,将本试卷和答题卡一并交回。 可能用到的相对原子质量:H1 C12N14 O16 第一部分 本部分共 14 题,每题 3 分,共 42 分。在每题列出的四个选项中,选出最符合题目要求 的一项。 1. 近年来,我国航空航天事业成果显著。下列成果所涉及的材料为金属材料的是 A. “天宫二号”航天器使用的质量轻强度高的材料——钛合金 B. “北斗三号”导航卫星使用的太阳能电池材料——砷化镓 C. “长征五号”运载火箭使用的高效燃料——液氢 D. “C919”飞机身使用的复合材料——碳纤维和环氧树脂 2. 下列物质的应用中,利用了氧化还原反应的是 A. 用石灰乳脱除烟气中的SO2 B. 用明矾[KAl SO12H2O] 处理污水 4 2 C. 用盐酸去除铁锈(主要成分 Fe2O3 xH2O )D. 用 84 消毒液(有效成分 NaClO )杀灭细菌 3.水与下列物质反应时,水表现出氧化性的是 A. Na B. Cl2 C. NO2 D. Na2O 4.已知: 33 As (砷)与 P 为同族元素。下列说法不正确的是 H A. As 原子核外最外层有 5 个电子 B. AsH3 的电子式是 H:As : H C. 热稳定性: AsH3 PH3 5.下列说法正确的是 D. 非金属性: As Cl A. 同温同压下, O2 和 CO2 的密度相同 – 1 – B. 质量相同的 H2O 和D2O (重水)所含的原子数相同 CH3OCH3 所含共价键数相同 C. 物质的量相同的 CH3CH2OH 和D.室温下,pH 相同的盐酸和硫酸中,溶质的物质的量浓度相同 6.下列说法正确的是 A. 用碳酸钠溶液处理锅炉水垢: CaSO s CO2 CaCO sSO2 4 3 34B. 湿润的淀粉碘化钾试纸遇氯气变蓝:3Cl2 I 3H2O 6C1 IO3 6H 高温 C. 铝粉和氧化铁组成的铝热剂用于焊接钢轨: 2Al Fe2O3 A12 O3 2Fe 2Na2O2 2CO2 2Na2CO3 O2, 2Na2O2 2H2O 4NaOH O2 D. 淡黄色的过氧化钠敞口放置变成白色: 7. 用下列仪器或装置(图中夹持略)进行相应实验,不能达到实验目的的是 配制一定物质的量浓 度的氯化钠溶液 检验浓硫酸与铜反应产 生的二氧化硫 检验溴乙烷消去产物中 的乙烯 分离酒精和水 ABCD8.淀粉在人体内的变化过程如下: 淀粉 糊精 (C6H10O5 )m 麦芽糖 葡萄糖 C6H12O6 ①②③④CO2、H2O (C6H10O5 )n C12H22O11 下列说法不正确的是 A. n m B. 麦芽糖属于二糖 D. ④的反应为人体提供能量 C. ③的反应是水解反应 9.硫酸盐(含SO24、HSO4 )气溶胶是 PM2.5 的成分之一。近期科研人员提出了雾霾微颗粒中硫 酸盐生成的转化机理,其主要过程示意图如下: – 2 – 下列说法不正确的是 A.该过程有 H2O 参与 B. NO2 是生成硫酸盐的氧化剂 D.该过程没有生成硫氧键 C.硫酸盐气溶胶呈酸性 10. 一 定 温 度 下 , 反 应I g H g 2HI g 在 密 闭 容 器 中 达 到 平 衡 时 , 测 得 2 2 c I 0.11mmolL1 , 2c HI 0.78mmolL1 。相同温度下,按下列 4 组初始浓度进行实验,反应逆向进行的 是ABCDc(I2 ) / mmolL1 c(H2 ) / mmolL1 c(HI) / mmolL1 1.00 0.22 0.44 0.11 1.00 1.00 0.22 1.56 0.44 4.00 0.44 1.56 (注:1mmolL1 103 molL1 )11.室温下,对于1L0.1molL1 醋酸溶液。下列判断正确的是 A.该溶液中 CH3COO 的粒子数为 6.021022 B.加入少量 CH3COONa 固体后,溶液的 pH 降低 C.滴加 NaOH 溶液过程中, n CH COO 与n CH COOH之和始终为 0.1mol 33D. 与 Na2CO3 溶液反应的离子方程式为 CO32 2H H2O CO2 – 3 – 12.依据图示关系,下列说法不正确的是 A.石墨燃烧是放热反应 B.1molC (石墨)和1molCO 分别在足量 燃烧,全部转化为 CO2 ,前者放热多 O2 中 C. C(石墨) CO g 2CO g 2 H H1 H2 D.化学反应的 H ,只与反应体系的始态和终态有关,与反应途径无关 13.高分子M广泛用于牙膏、牙科粘合剂等口腔护理产品,合成路线如下: 下列说法不正确的是 A.试剂 a 是甲醇 B.化合物 B 不存在顺反异构体 C.化合物 C 的核磁共振氢谱有一组峰 D.合成M的聚合反应是缩聚反应 14.某同学进行如下实验: 实验步骤 实验现象 I试纸颜色变化:黄色→蓝色(pH≈10) →黄色 将NH4Cl固体加入试管中,并将湿润的 pH 试纸置 →红色(pH≈2);试管中部有白色固体附着 试纸颜色变化:黄色→橙黄色(pH≈5) 于试管口,试管口略向下倾斜,对试管底部进行加热 II 将饱和 NH4Cl溶液滴在 pH 试纸上 下列说法不正确的是 A.根据Ⅰ中试纸变蓝,说明 NH4Cl发生了分解反应 B.根据Ⅰ中试纸颜色变化,说明氨气比氯化氢气体扩散速率快 C. Ⅰ中试纸变成红色,是由于 NH4Cl水解造成的 D.根据试管中部有白色固体附着,说明不宜用加热 NH4Cl的方法制备 NH3 – 4 – 第二部分 本部分共 5 题,共 58 分。 15.(10 分) H2O2 是一种重要的化学品,其合成方法不断发展。 (1)早期制备方法 O2 加热 盐酸 除杂 减压蒸馏 Ba(NO3 )2 BaOBaO2 滤液 H2O2 III III IV V①Ⅰ为分解反应,产物除 BaO、O2 外,还有一种红棕色气体。该反应的化学方程式是 。②Ⅱ为可逆反应,促进该反应正向进行的措施是 ③Ⅲ中生成 H2O2 ,反应的化学方程式是 。。④减压能够降低蒸馏温度,从 H2O2 的化学性质角度说明Ⅴ中采用减压蒸馏的原因: 。(2)电化学制备方法 已知反应 2H2O2 2H2O O2 能自发进行,反向不能自发进行,通过电解可以实现由 H2O 和 O2 为原料制备 H2O2 ,下图为制备装置示意图。 ①a 极的电极反应式是 。。②下列说法正确的是 A.该装置可以实现电能转化为化学能 B.电极 b 连接电源负极 C.该方法相较于早期制备方法具有原料廉价,对环境友好等优点。 – 5 – 16.(12 分) 奥昔布宁是具有解痉和抗胆碱作用的药物。其合成路线如下: 已知: i. ii. (1)A 是芳香族化合物,A 分子中含氧官能团是 。(2)B→C 的反应类型是 (3)E 的结构简式是 。。(4)J→K 的化学方程式是 。(5)已知:G、L 和奥昔布宁的沸点均高于 200℃,G 和 L 发生反应合成奥昔布宁时,通过在 70℃左右蒸出 (填物质名称)来促进反应。 (6)奥昔布宁的结构简式是 17.(12 分) 用如下方法回收废旧 CPU 中的单质 Au(金),Ag 和 Cu。 。已知:①浓硝酸不能单独将 Au 溶解。 ②HAuCl4 H AuCl4 (1)酸溶后经 操作,将混合物分离。 – 6 – (2)浓、稀 HNO3 均可作酸溶试剂。溶解等量的 Cu 消耗 HNO3 的物质的量不同,写出消耗 HNO3 物质的量少的反应的化学方程式: 。(3) HNO3 NaCl 与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。 ①将溶金反应的化学方程式补充完整: Au NaCl HNO3 HAuCl4 + NaNO3 ②关于溶金的下列说法正确的是 。A.用到了 HNO3 的氧化性 B.王水中浓盐酸的主要作用是增强溶液的酸性 C.用浓盐酸与 NaNO3 也可使 Au 溶解 (4)若用 Zn 粉将溶液中的1molHAuCl4 完全还原,则参加反应的 Zn 的物质的量是 mol。 (5)用适当浓度的盐酸、NaCl 溶液、氨水与铁粉,可按照如下方法从酸溶后的溶液中回收 Cu 和 Ag(图中标注的试剂和物质均不同)。 试剂 1 是 18.(12 分) ,试剂 2 是 。MnO2 是重要化工原料,由软锰矿制备 MnO2 的一种工艺流程如下: 资料:①软锰矿的主要成分为 MnO2 ,主要杂质有 Al2O3 和 SiO2 ②金属离子沉淀的 pH Al3 Mn2 Fe3 Fe2 开始沉淀时 完全沉淀时 1.5 2.8 3.4 4.7 5.8 7.8 6.3 8.3 – 7 – ③该工艺条件下, MnO2 与 H2SO4 不反应。 (1)溶出 ①溶出前,软锰矿需研磨。目的是 。②溶出时,Fe 的氧化过程及得到 Mn2 的主要途径如图所示。 i. Ⅱ是从软锰矿中溶出 Mn2 的主要反应,反应的离子方程式是 。ii.若 Fe2 全部来自于反应 Fe 2H Fe2 H2 ,完全溶出 Mn2 所需 Fe 与 MnO2 的物 质的量比值为 2。而实际比值(0.9)小于 2,原因是 (2)纯化 。已知: MnO2 的氧化性与溶液 pH 有关。纯化时先加入 MnO2 ,后加入 NH3 H2O ,调溶 液 pH≈5,说明试剂加入顺序及调节 pH 的原因: (3)电解 。Mn2 纯化液经电解得 MnO2 。生成 MnO2 的电极反应式是 (4)产品纯度测定 。向 ag 产品中依次加入足量 bg Na2C2O4 和足量稀 H2SO4 ,加热至充分反应,再用 cmolL1KMnO4 溶液滴定剩余 Na2C2O4 至终点,消耗 KMnO4 溶液的体积为 dL。(已知: MnO2 及 MnO4 均被还原为 Mn2 。相对分子质量: MnO2 86.94; Na2C2O4 134.0)产品 纯度为 (用质量分数表示)。 19.(12 分) 探究 Na2SO3 固体的热分解产物: 资料:① 4Na2SO3 Na2S 3Na2SO4 。②Na2S能与 S 反应生成 Na2Sx , Na2Sx 与酸反应生成 S 和 H2S。 ③BaS 易溶于水。 隔绝空气条件下,加热无水 Na2SO3 固体得到黄色固体 A,过程中未检测到气体生成。黄 – 8 – 色固体 A 加水得到浊液,放置得无色溶液 B。 (1)检验分解产物 Na2S 取少量溶液 B,向其中滴加 CuSO4 溶液,产生黑色沉淀,证实有S2 。反应的离子方程式 是。(2)检验分解产物 Na2SO4 取少量溶液 B,滴加 BaCl2 溶液,产生白色沉淀,加入盐酸,沉淀增多(经检验该沉淀含 S),同时产生有臭鸡蛋气味的气体( H2S),由于沉淀增多对检验造成干扰,另取少量溶液 B,加入足量盐酸,离心沉降(固液分离)后, (填操作和现象), 可证实分解产物中含有SO24 (3)探究(2)中 S 的来源 。来源 1:固体 A 中有未分解的 Na2SO3 ,在酸性条件下与 Na2S反应生成 S。 来源 2:溶液 B 中有 Na2Sx ,加酸反应生成 S。 针对来源 1 进行如下实验: ①实验可证实来源 1 不成立。实验证据是 ②不能用盐酸代替硫酸的原因是 ③写出来源 2 产生 S 的反应的离子方程式: (4)实验证明 Na2SO3 ,固体热分解有 Na2S 分析产物中 S 产生的合理性: 。。。、Na2SO4 和 S 产生。运用氧化还原反应规律 。- 9 –
绝密★启用前 2020年北京市普通高中学业水平等级性考试 化学本试卷共 9 页,100 分。考试时长 90 分钟。考生务必将答案答在答题卡上,在试卷上作 答无效。考试结束后,将本试卷和答题卡一并交回。 可能用到的相对原子质量:H1 C12N14 O16 第一部分 本部分共 14 题,每题 3 分,共 42 分。在每题列出的四个选项中,选出最符合题目要求 的一项。 1. 近年来,我国航空航天事业成果显著。下列成果所涉及的材料为金属材料的是 A. “天宫二号”航天器使用的质量轻强度高的材料——钛合金 B. “北斗三号”导航卫星使用的太阳能电池材料——砷化镓 C. “长征五号”运载火箭使用的高效燃料——液氢 D. “C919”飞机身使用的复合材料——碳纤维和环氧树脂 2. 下列物质的应用中,利用了氧化还原反应的是 A. 用石灰乳脱除烟气中的SO2 B. 用明矾[KAl SO12H2O] 处理污水 4 2 C. 用盐酸去除铁锈(主要成分 Fe2O3 xH2O )D. 用 84 消毒液(有效成分 NaClO )杀灭细菌 3.水与下列物质反应时,水表现出氧化性的是 A. Na B. Cl2 C. NO2 D. Na2O 4.已知: 33 As (砷)与 P 为同族元素。下列说法不正确的是 H A. As 原子核外最外层有 5 个电子 B. AsH3 的电子式是 H:As : H C. 热稳定性: AsH3 PH3 5.下列说法正确的是 D. 非金属性: As Cl A. 同温同压下, O2 和 CO2 的密度相同 – 1 – B. 质量相同的 H2O 和D2O (重水)所含的原子数相同 CH3OCH3 所含共价键数相同 C. 物质的量相同的 CH3CH2OH 和D.室温下,pH 相同的盐酸和硫酸中,溶质的物质的量浓度相同 6.下列说法正确的是 A. 用碳酸钠溶液处理锅炉水垢: CaSO s CO2 CaCO sSO2 4 3 34B. 湿润的淀粉碘化钾试纸遇氯气变蓝:3Cl2 I 3H2O 6C1 IO3 6H 高温 C. 铝粉和氧化铁组成的铝热剂用于焊接钢轨: 2Al Fe2O3 A12 O3 2Fe 2Na2O2 2CO2 2Na2CO3 O2, 2Na2O2 2H2O 4NaOH O2 D. 淡黄色的过氧化钠敞口放置变成白色: 7. 用下列仪器或装置(图中夹持略)进行相应实验,不能达到实验目的的是 配制一定物质的量浓 度的氯化钠溶液 检验浓硫酸与铜反应产 生的二氧化硫 检验溴乙烷消去产物中 的乙烯 分离酒精和水 ABCD8.淀粉在人体内的变化过程如下: 淀粉 糊精 (C6H10O5 )m 麦芽糖 葡萄糖 C6H12O6 ①②③④CO2、H2O (C6H10O5 )n C12H22O11 下列说法不正确的是 A. n m B. 麦芽糖属于二糖 D. ④的反应为人体提供能量 C. ③的反应是水解反应 9.硫酸盐(含SO24、HSO4 )气溶胶是 PM2.5 的成分之一。近期科研人员提出了雾霾微颗粒中硫 酸盐生成的转化机理,其主要过程示意图如下: – 2 – 下列说法不正确的是 A.该过程有 H2O 参与 B. NO2 是生成硫酸盐的氧化剂 D.该过程没有生成硫氧键 C.硫酸盐气溶胶呈酸性 10. 一 定 温 度 下 , 反 应I g H g 2HI g 在 密 闭 容 器 中 达 到 平 衡 时 , 测 得 2 2 c I 0.11mmolL1 , 2c HI 0.78mmolL1 。相同温度下,按下列 4 组初始浓度进行实验,反应逆向进行的 是ABCDc(I2 ) / mmolL1 c(H2 ) / mmolL1 c(HI) / mmolL1 1.00 0.22 0.44 0.11 1.00 1.00 0.22 1.56 0.44 4.00 0.44 1.56 (注:1mmolL1 103 molL1 )11.室温下,对于1L0.1molL1 醋酸溶液。下列判断正确的是 A.该溶液中 CH3COO 的粒子数为 6.021022 B.加入少量 CH3COONa 固体后,溶液的 pH 降低 C.滴加 NaOH 溶液过程中, n CH COO 与n CH COOH之和始终为 0.1mol 33D. 与 Na2CO3 溶液反应的离子方程式为 CO32 2H H2O CO2 – 3 – 12.依据图示关系,下列说法不正确的是 A.石墨燃烧是放热反应 B.1molC (石墨)和1molCO 分别在足量 燃烧,全部转化为 CO2 ,前者放热多 O2 中 C. C(石墨) CO g 2CO g 2 H H1 H2 D.化学反应的 H ,只与反应体系的始态和终态有关,与反应途径无关 13.高分子M广泛用于牙膏、牙科粘合剂等口腔护理产品,合成路线如下: 下列说法不正确的是 A.试剂 a 是甲醇 B.化合物 B 不存在顺反异构体 C.化合物 C 的核磁共振氢谱有一组峰 D.合成M的聚合反应是缩聚反应 14.某同学进行如下实验: 实验步骤 实验现象 I试纸颜色变化:黄色→蓝色(pH≈10) →黄色 将NH4Cl固体加入试管中,并将湿润的 pH 试纸置 →红色(pH≈2);试管中部有白色固体附着 试纸颜色变化:黄色→橙黄色(pH≈5) 于试管口,试管口略向下倾斜,对试管底部进行加热 II 将饱和 NH4Cl溶液滴在 pH 试纸上 下列说法不正确的是 A.根据Ⅰ中试纸变蓝,说明 NH4Cl发生了分解反应 B.根据Ⅰ中试纸颜色变化,说明氨气比氯化氢气体扩散速率快 C. Ⅰ中试纸变成红色,是由于 NH4Cl水解造成的 D.根据试管中部有白色固体附着,说明不宜用加热 NH4Cl的方法制备 NH3 – 4 – 第二部分 本部分共 5 题,共 58 分。 15.(10 分) H2O2 是一种重要的化学品,其合成方法不断发展。 (1)早期制备方法 O2 加热 盐酸 除杂 减压蒸馏 Ba(NO3 )2 BaOBaO2 滤液 H2O2 III III IV V①Ⅰ为分解反应,产物除 BaO、O2 外,还有一种红棕色气体。该反应的化学方程式是 。②Ⅱ为可逆反应,促进该反应正向进行的措施是 ③Ⅲ中生成 H2O2 ,反应的化学方程式是 。。④减压能够降低蒸馏温度,从 H2O2 的化学性质角度说明Ⅴ中采用减压蒸馏的原因: 。(2)电化学制备方法 已知反应 2H2O2 2H2O O2 能自发进行,反向不能自发进行,通过电解可以实现由 H2O 和 O2 为原料制备 H2O2 ,下图为制备装置示意图。 ①a 极的电极反应式是 。。②下列说法正确的是 A.该装置可以实现电能转化为化学能 B.电极 b 连接电源负极 C.该方法相较于早期制备方法具有原料廉价,对环境友好等优点。 – 5 – 16.(12 分) 奥昔布宁是具有解痉和抗胆碱作用的药物。其合成路线如下: 已知: i. ii. (1)A 是芳香族化合物,A 分子中含氧官能团是 。(2)B→C 的反应类型是 (3)E 的结构简式是 。。(4)J→K 的化学方程式是 。(5)已知:G、L 和奥昔布宁的沸点均高于 200℃,G 和 L 发生反应合成奥昔布宁时,通过在 70℃左右蒸出 (填物质名称)来促进反应。 (6)奥昔布宁的结构简式是 17.(12 分) 用如下方法回收废旧 CPU 中的单质 Au(金),Ag 和 Cu。 。已知:①浓硝酸不能单独将 Au 溶解。 ②HAuCl4 H AuCl4 (1)酸溶后经 操作,将混合物分离。 – 6 – (2)浓、稀 HNO3 均可作酸溶试剂。溶解等量的 Cu 消耗 HNO3 的物质的量不同,写出消耗 HNO3 物质的量少的反应的化学方程式: 。(3) HNO3 NaCl 与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。 ①将溶金反应的化学方程式补充完整: Au NaCl HNO3 HAuCl4 + NaNO3 ②关于溶金的下列说法正确的是 。A.用到了 HNO3 的氧化性 B.王水中浓盐酸的主要作用是增强溶液的酸性 C.用浓盐酸与 NaNO3 也可使 Au 溶解 (4)若用 Zn 粉将溶液中的1molHAuCl4 完全还原,则参加反应的 Zn 的物质的量是 mol。 (5)用适当浓度的盐酸、NaCl 溶液、氨水与铁粉,可按照如下方法从酸溶后的溶液中回收 Cu 和 Ag(图中标注的试剂和物质均不同)。 试剂 1 是 18.(12 分) ,试剂 2 是 。MnO2 是重要化工原料,由软锰矿制备 MnO2 的一种工艺流程如下: 资料:①软锰矿的主要成分为 MnO2 ,主要杂质有 Al2O3 和 SiO2 ②金属离子沉淀的 pH Al3 Mn2 Fe3 Fe2 开始沉淀时 完全沉淀时 1.5 2.8 3.4 4.7 5.8 7.8 6.3 8.3 – 7 – ③该工艺条件下, MnO2 与 H2SO4 不反应。 (1)溶出 ①溶出前,软锰矿需研磨。目的是 。②溶出时,Fe 的氧化过程及得到 Mn2 的主要途径如图所示。 i. Ⅱ是从软锰矿中溶出 Mn2 的主要反应,反应的离子方程式是 。ii.若 Fe2 全部来自于反应 Fe 2H Fe2 H2 ,完全溶出 Mn2 所需 Fe 与 MnO2 的物 质的量比值为 2。而实际比值(0.9)小于 2,原因是 (2)纯化 。已知: MnO2 的氧化性与溶液 pH 有关。纯化时先加入 MnO2 ,后加入 NH3 H2O ,调溶 液 pH≈5,说明试剂加入顺序及调节 pH 的原因: (3)电解 。Mn2 纯化液经电解得 MnO2 。生成 MnO2 的电极反应式是 (4)产品纯度测定 。向 ag 产品中依次加入足量 bg Na2C2O4 和足量稀 H2SO4 ,加热至充分反应,再用 cmolL1KMnO4 溶液滴定剩余 Na2C2O4 至终点,消耗 KMnO4 溶液的体积为 dL。(已知: MnO2 及 MnO4 均被还原为 Mn2 。相对分子质量: MnO2 86.94; Na2C2O4 134.0)产品 纯度为 (用质量分数表示)。 19.(12 分) 探究 Na2SO3 固体的热分解产物: 资料:① 4Na2SO3 Na2S 3Na2SO4 。②Na2S能与 S 反应生成 Na2Sx , Na2Sx 与酸反应生成 S 和 H2S。 ③BaS 易溶于水。 隔绝空气条件下,加热无水 Na2SO3 固体得到黄色固体 A,过程中未检测到气体生成。黄 – 8 – 色固体 A 加水得到浊液,放置得无色溶液 B。 (1)检验分解产物 Na2S 取少量溶液 B,向其中滴加 CuSO4 溶液,产生黑色沉淀,证实有S2 。反应的离子方程式 是。(2)检验分解产物 Na2SO4 取少量溶液 B,滴加 BaCl2 溶液,产生白色沉淀,加入盐酸,沉淀增多(经检验该沉淀含 S),同时产生有臭鸡蛋气味的气体( H2S),由于沉淀增多对检验造成干扰,另取少量溶液 B,加入足量盐酸,离心沉降(固液分离)后, (填操作和现象), 可证实分解产物中含有SO24 (3)探究(2)中 S 的来源 。来源 1:固体 A 中有未分解的 Na2SO3 ,在酸性条件下与 Na2S反应生成 S。 来源 2:溶液 B 中有 Na2Sx ,加酸反应生成 S。 针对来源 1 进行如下实验: ①实验可证实来源 1 不成立。实验证据是 ②不能用盐酸代替硫酸的原因是 ③写出来源 2 产生 S 的反应的离子方程式: (4)实验证明 Na2SO3 ,固体热分解有 Na2S 分析产物中 S 产生的合理性: 。。。、Na2SO4 和 S 产生。运用氧化还原反应规律 。- 9 –
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





