
 2020 年全国统一高考化学试卷(新课标Ⅲ) 一、选择题:本题共 7 小题,每小题 6 分,共 42 分。在每小题给出的四个选项中,只有一 项是符合题目要求的. 1.(6 分)宋代《千里江山图)描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿 色来自孔雀石颜料(主要成分 为 Cu(OH)2•CuCO3),青色来自蓝铜矿颜料(主要成分为 Cu(OH)2•2CuCO3)。 下列说法错误的是( ) A.保存《千里江山图》需控制温度和湿度 B.孔雀石、蓝铜矿颜料不易被空气氧化 C.孔雀石、蓝铜矿颜料耐酸耐碱 D.Cu(OH2)•CuCO3 中铜的质量分数高于 Cu(OH2)•2CuCO3 2.(6 分)金丝桃苷是从中药材中提取的一种具有抗病毒作用的黄酮类化合物,结构式如 图:下列关于金丝桃苷的叙述,错误的是( ) A.可与氢气发生加成反应 C.能与乙酸发生酯化反应 B.分子含 21 个碳原子 D.不能与金属钠反应 3.(6 分)NA 是阿伏加德罗常数的值。下列说法正确的是( ) A.22.4L(标准状况)氮气中含有 7NA 个中子 B.1mol 重水比 1mol 水多 NA 个质子 C.12g 石墨烯和 12g 金刚石均含有 NA 个碳原子 D.1L 1mol•L﹣1 NaCl 溶液含有 28NA 个电子 4.(6 分)喷泉实验装置如图所示。应用下列各组气体﹣﹣溶液,能出现喷泉现象的是( ) 气体 溶液 A. 稀盐酸 H2S 第 1 页(共 27 页) B. C. D. HCl NO 稀氨水 稀 H2SO4 饱和 NaHCO3 溶液 CO2 A.A B.B C.C D.D 5.(6 分)对于下列实验,能正确描述其反应的离子方程式是( ) A.用 Na2SO3 溶液吸收少量 Cl2:3SO32﹣+Cl2+H2O═2HSO3﹣+2Cl﹣+SO4 B.向 CaCl2 溶液中通入 CO2:Ca2++H2O+CO2═CaCO3↓+2H+ 2﹣ C.向 H2O2 溶液中滴加少量 FeCl3:2Fe3++H2O2═O2↑+2H++2Fe2+ +D.同浓度同体积 NH4HSO4 溶液与 NaOH 溶液混合:NH4 +OH﹣═NH3•H2O 6.(6 分)一种高性能的碱性硼化钒(VB2 )﹣﹣空气电池如图所示,其中在 VB2 电极发 生反应:VB2+16OH﹣﹣11e﹣═VO43﹣+2B(OH)4﹣+4H2O 该电池工作时,下列说法错 误的是( ) A.负载通过 0.04mol 电子时,有 0.224L (标准状况)O2 参与反应 B.正极区溶液的 pH 降低、负极区溶液的 pH 升高 第 2 页(共 27 页) 3﹣ C.电池总反应为 4VB2+11O2+20OH﹣+6H2O═8B(OH)4﹣+4VO4 D.电流由复合碳电极经负载、VB2 电极、KOH 溶液回到复合碳电极 7.(6 分)W、X、Y、Z 为原子序数依次增大的短周期元素,四种元素的核外电子总数满 足 X+Y=W+Z;化合物 XW3 与 WZ 相遇会产生白烟。下列叙述正确的是( ) A.非金属性:W>X>Y>Z B.原子半径:Z>Y>X>W C.元素 X 的含氧酸均为强酸 D.Y 的氧化物水化物为强碱 二、非选择题:共 58 分。第 8~10 题为必考题,每个试题考生都必须作答。第 11~12 为 选考题,考生根据要求作答。(一)必考题:共 43 分。 8.(14 分)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如 图装置(部分装置省略)制备 KClO3 和 NaClO,探究其氧化还原性质。 回答下列问题: (1)盛放 MnO2 粉末的仪器名称是 ,a 中的试剂为 。 (2)b 中采用的加热方式是 。c 中化学反应的离子方程式是 ,采用冰水 浴冷却的目的是 。 ,可选用试剂 (3)d 的作用是 (填标号)。 A.Na2S B.NaCl C.Ca(OH)2 D.H2SO4 (4)反应结束后,取出 b 中试管,经冷却结晶, 晶体。 , ,干燥,得到 KClO3 第 3 页(共 27 页) (5)取少量 KClO3 和 NaClO 溶液分别置于 1 号和 2 号试管中,滴加中性 KI 溶液。1 号 试管溶液颜色不变。2 号试管溶液变为棕色,加入 CCl4 振荡,静置后 CCl4 层显 色。可知该条件下 KClO3 的氧化能力 NaClO(填“大于”或“小于”)。 9.(15 分)某油脂厂废弃的油脂加氢镍催化剂主要含金属 Ni、Al、Fe 及其氧化物,还有 少量其他不溶性物质。采用如图工艺流程回收其中的镍制备硫酸镍晶体(NiSO4•7H2O ) :溶液中金属离子开始沉淀和完全沉淀的 pH 如下表所示: Ni2+ Al3+ Fe3+ Fe2+ 金属离子 开始沉淀时(c=0.01 mol•L﹣1)的 pH 沉淀完全时(c=1.0×10﹣5mol•L﹣1)的 pH 回答下列问题: 7.2 8.7 3.7 4.7 2.2 3.2 7.5 9.0 (1)“碱浸”中 NaOH 的两个作用分别是 。为回收金属,用稀硫酸将“滤液① 。 ”调为中性,生成沉淀。写出该反应的离子方程式 (2)“滤液②”中含有的金属离子是 (3)“转化”中可替代 H2O2 的物质是 。 。若工艺流程改为先“调 pH”后“转化” ,即 ,“滤液③”中可能含有的杂质离子为 。 (4)利用上述表格数据,计算 Ni(OH)2 的 Ksp= (列出计算式)。如果“转 化”后的溶液中 Ni2+浓度为 1.0mol•L﹣1,则“调 pH”应控制的 pH 范围是 。 (5)硫酸镍在强碱溶液中用 NaClO 氧化,可沉淀出能用作镍镉电池正极材料的 NiOOH. 写出该反应的离子方程式 。 (6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是 。 10.(14 分)二氧化碳催化加氢合成乙烯是综合利用 CO2 的热点研究领域。回答下列问题: (1)CO2 催化加氢生成乙烯和水的反应中,产物的物质的量之比 n(C2H4):n(H2O)= 第 4 页(共 27 页) 。当反应达到平衡时,若增大压强,则 n(C2H4) (填“变大”“变小”或“不 变”)。 (2)理论计算表明。原料初始组成 n(CO2):n(H2)=1:3,在体系压强为 0.1MPa, 反应达到平衡时,四种组分的物质的量分数 x 随温度 T 的变化如图所示。图中,表示 C2H4 、CO2 变化的曲线分别是 、 。 CO2 催化加氢合成 C2H4 反应的△H 0 (填“大于”或“小于”)。 ﹣(3)根据图中点 A(440K,0.39),计算该温度时反应的平衡常数 Kp= (MPa) 3(列出计算式。以分压表示,分压=总压×物质的量分数)。 (4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成 C3H6、C3H8、C4H8 等低碳 烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当 。 (二)选考题:共 15 分。请考生从 2 道化学题中任选一题作答。如果多做,则按所做的第 一题计分。[化学–选修 3:物质结构与性质](15 分) 11.(15 分)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料 。回答下列问题: (1)H、B、N 中,原子半径最大的是 元素 的相似。 。根据对角线规则,B 的一些化学性质与 (2)NH3BH3 分子中,N﹣B 化学键称为 键,其电子对由 提供。氨硼烷 在催化剂作用下水解释放氢气: +3NH3BH3+6H2O═3NH4 +B3O63﹣+9H2 第 5 页(共 27 页) B3O63﹣的结构为 .在该反应中,B 原子的杂化轨道类型由 变 为 。 (3)NH3BH3 分子中,与 N 原子相连的 H 呈正电性(Hδ+),与 B 原子相连的 H 呈负 电性(Hδ﹣),电负性大小顺序是 写分子式),其熔点比 NH3BH3 。与 NH3BH3 原子总数相等的等电子体是 ( (填“高”或“低”),原因是在 NH3BH3 分子 之间,存在 作用,也称“双氢键”。 (4)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为 apm、bpm、 cpm,α=β=γ=90°.氨硼烷的 2×2×2 超晶胞结构如图所示。氨硼烷晶体的密度 ρ= g•cm﹣3(列出计算式,设 NA 为阿伏加德罗常数的值)。 [化学–选修 5:有机化学基础](15 分) 12.苯基环丁烯酮( PCBO)是一种十分活泼的反应物,可利用它的开环 反应合成一系列多官能团化合物。近期我国科学家报道用 PCBO 与醛或酮发生[4+2]环加 成反应,合成了具有生物活性的多官能团化合物(E),部分合成路线如图: 第 6 页(共 27 页) 已知如下信息: 回答下列问题: (1)A 的化学名称是 (2)B 的结构简式为 。 。 (3)由 C 生成 D 所用的试剂和反应条件为 易发生脱羧反应,生成分子式为 C8H8O2 的副产物,该副产物的结构简式为 (4)写出化合物 E 中含氧官能团的名称 ;E 中手性碳(注:连有四个不同的原 子或基团的碳)的个数为 。 (5)M 为 C 的一种同分异构体。已知:1mol M 与饱和碳酸氢钠溶液充分反应能放出 2mol 二氧化碳;M 与酸性高锰酸钾溶液反应生成对苯二甲酸。M 的结构简式为 。 ;该步反应中,若反应温度过高,C 。 (6)对于 ,选用不同的取代基 R’,在催化剂作用下与 PCBO 发生的[4+2] 反应进行深入研究,R’对产率的影响见下表: R’ ﹣CH3 91 ﹣C2H5 ﹣CH2CH2C6H5 产率/% 80 63 请找出规律,并解释原因 。 第 7 页(共 27 页) 2020 年全国统一高考化学试卷(新课标Ⅲ) 参考答案与试题解析 一、选择题:本题共 7 小题,每小题 6 分,共 42 分。在每小题给出的四个选项中,只有一 项是符合题目要求的. 1.(6 分)宋代《千里江山图)描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿 色来自孔雀石颜料(主要成分 为 Cu(OH)2•CuCO3),青色来自蓝铜矿颜料(主要成分为 Cu(OH)2•2CuCO3)。 下列说法错误的是( ) A.保存《千里江山图》需控制温度和湿度 B.孔雀石、蓝铜矿颜料不易被空气氧化 C.孔雀石、蓝铜矿颜料耐酸耐碱 D.Cu(OH2)•CuCO3 中铜的质量分数高于 Cu(OH2)•2CuCO3 【分析】A.Cu(OH) •CuCO3 和 Cu(OH) •2CuCO3 均不稳定,受热易分解,纤维素 22或蛋白质均能水解; B.Cu(OH) •CuCO3 和 Cu(OH) •2CuCO3 中除 O 元素外,C、H、Cu 均为最高价; 22C.Cu(OH)2•CuCO3 和 Cu(OH)2•2CuCO3 均能与酸反应,不与碱反应; D.通过计算判断比较铜的质量分数大小。 【解答】解:A.Cu(OH) •CuCO3 和 Cu(OH) •2CuCO3 均不稳定,受热易分解,纤 22维素或蛋白质均能水解,长期在潮湿环境中易腐烂变质,则保存《千里江山图》需控制 温度和湿度,故 A 正确; B.Cu(OH)2•CuCO3 和 Cu(OH)2•2CuCO3 中除 O 元素外,C、H、Cu 均为最高价, 无还原性,不能被空气中氧气氧化,则孔雀石、蓝铜矿颜料不易被空气氧化,故 B 正确; C.Cu(OH)2•CuCO3 和 Cu(OH)2•2CuCO3 均能与酸反应,不与碱反应,则孔雀石、 蓝铜矿颜料耐碱不耐酸,故 C 错误; D.Cu(OH2)•CuCO3 中铜的质量分数为 ,Cu(OH2)•2CuCO3 中铜的质 量分数为 ,则 Cu(OH2)•CuCO3 中铜的质量分数高于 Cu(OH2)•2CuCO3 ,故 D 正确; 故选:C。 第 8 页(共 27 页) 【点评】本题以《千里江山图》为载体,考查物质的组成、结构和性质的关系,涉及元 素质量分数的计算和盐的通性,基础考查,难度中等。 2.(6 分)金丝桃苷是从中药材中提取的一种具有抗病毒作用的黄酮类化合物,结构式如 图:下列关于金丝桃苷的叙述,错误的是( ) A.可与氢气发生加成反应 C.能与乙酸发生酯化反应 B.分子含 21 个碳原子 D.不能与金属钠反应 【分析】A、分子中含有碳碳双键、碳氧双键和苯环; B、由图可知金丝桃苷的分子式 C21H20O12; C、分子中含有羟基,能发生酯化反应; D、分子结构可知结构中含有羟基; 【解答】解:A、分子中含有碳碳双键、碳氧双键和苯环,可以发生加成反应,故 A 正 确; B、由图可知金丝桃苷的分子式 C21H20O12,则分子含 21 个碳原子,故 B 正确; C、分子中含有羟基,能发生酯化反应,即能与乙酸发生酯化反应,故 C 正确; D、分子结构可知结构中含有羟基,能与金属钠反应产生氢气,故 D 错误; 故选:D。 【点评】本题考查有机物结构和性质,侧重考查酚、烯烃、醇、醚和酮的性质,明确官 能团及其性质关系是解本题关键,题目难度不大。 3.(6 分)NA 是阿伏加德罗常数的值。下列说法正确的是( ) A.22.4L(标准状况)氮气中含有 7NA 个中子 B.1mol 重水比 1mol 水多 NA 个质子 C.12g 石墨烯和 12g 金刚石均含有 NA 个碳原子 D.1L 1mol•L﹣1 NaCl 溶液含有 28NA 个电子 【分析】A.一个氮气分子有 14 个中子; 第 9 页(共 27 页) B.重水和水的质子数相等; C.跟据 n= 计算物质的量,再比较微粒数; D.溶剂也要考虑。 【解答】解:A.氮气是双原子分子,一个氮气分子有 14 个中子,22.4L (标准状况) 氮气中含有 14NA 个中子,故 A 错误; B.重水(D2O)和水(H2O)的质子数都是 10,1mol 重水比 1mol 水都是 10NA 个质子, 故 B 错误; C.12g 石墨烯 n(C60)= =mol,含有个碳原子物质的量 n(c)= mol× 60=1mol,含有 NA 个碳原子,12g 金刚石(C)的物质的量 n= 含有 NA 个碳原子,故 C 正确; ==1mol, D.1L 1mol•L﹣1 NaCl 溶质含有 28NA 个电子,溶剂水也要考虑,故 D 错误; 故选:C。 【点评】本题考查阿伏伽德罗常数的计算,是高频考点,要熟练掌握计算公式,和公式 的使用条件,D 选项容易思维定式出现错误。 4.(6 分)喷泉实验装置如图所示。应用下列各组气体﹣﹣溶液,能出现喷泉现象的是( ) 气体 H2S HCl NO 溶液 A. B. C. D. 稀盐酸 稀氨水 稀 H2SO4 饱和 NaHCO3 CO2 溶液 第 10 页(共 27 页) A.A B.B C.C D.D 【分析】在烧瓶中充满干燥气体,而胶头滴管及烧杯中分别盛有液体,若形成喷泉,则 气体极易溶于液体或气体极易与液体反应,以此来解答。 【解答】解:A、H2S 在稀盐酸中溶解度小,且与稀盐酸不反应,不能出现喷泉,故 A 错误; B.HCl 气体极易溶于稀氨水,且氯化氢气体与氨水反应生成氯化铵,产生压强差,形成 喷泉,故 B 正确; C、一氧化氮不溶于稀 H2SO4,也不与稀 H2SO4 反应,不能出现喷泉,故 C 错误; D、二氧化碳不溶于饱和碳酸氢钠,也不与饱和碳酸氢钠反应,不能出现喷泉,故 D 错 误; 故选:B。 【点评】本题考查实验装置综合,为高频考点,把握喷泉实验的原理为解答的关键,侧 重物质性质及实验能力的考查,注意气体极易溶于液体或气体极易与液体反应可形成喷 泉,题目难度不大。 5.(6 分)对于下列实验,能正确描述其反应的离子方程式是( ) 2﹣ A.用 Na2SO3 溶液吸收少量 Cl2:3SO32﹣+Cl2+H2O═2HSO3﹣+2Cl﹣+SO4 B.向 CaCl2 溶液中通入 CO2:Ca2++H2O+CO2═CaCO3↓+2H+ C.向 H2O2 溶液中滴加少量 FeCl3:2Fe3++H2O2═O2↑+2H++2Fe2+ +D.同浓度同体积 NH4HSO4 溶液与 NaOH 溶液混合:NH4 +OH﹣═NH3•H2O 【分析】A.符合电荷守恒,物料守恒,强制弱规律, B.向 CaCl2 溶液中通入 CO2 不反应; C.不符合客观事实,氧气氧化二价铁离子; 第 11 页(共 27 页) D.不符合客观事实,氢氧根优先于氢离子反应。 2【解答】解:A.用 Na2SO3 溶液吸收少量 Cl2:3SO32﹣+Cl2+H2O═2HSO3﹣+2Cl﹣+SO4 ﹣,符合电荷守恒,物料守恒,强制弱规律,故 A 正确; B.弱酸不能制强酸,向 CaCl2 溶液中通入 CO2 不反应,故 B 错误; C.向 H2O2 溶液中滴加少量 FeCl3,FeCl3 做催化剂,促进双氧水的分解,氧气的氧化性 大于三价铁离子,弱氧化剂不能制强氧化剂,故 C 错误; D.不符合客观事实,氢氧根优先与酸性更强的氢离子反应,正确的离子方程式:H++OH ﹣═H2O,故 D 错误; 故选:A。 【点评】本题考查了化学反应原理,离子方程式的书写,离子方程式的正误判断,重点 考查反应发生的可能性,掌握强制弱的原理,难度中等。 6.(6 分)一种高性能的碱性硼化钒(VB2 )﹣﹣空气电池如图所示,其中在 VB2 电极发 生反应:VB2+16OH﹣﹣11e﹣═VO43﹣+2B(OH)4﹣+4H2O 该电池工作时,下列说法错 误的是( ) A.负载通过 0.04mol 电子时,有 0.224L (标准状况)O2 参与反应 B.正极区溶液的 pH 降低、负极区溶液的 pH 升高 3﹣ C.电池总反应为 4VB2+11O2+20OH﹣+6H2O═8B(OH)4﹣+4VO4 D.电流由复合碳电极经负载、VB2 电极、KOH 溶液回到复合碳电极 【分析】A、正极氧气得电子生成氢氧根离子; B、根据负极 VB2+16OH﹣﹣11e﹣═VO43﹣+2B(OH)4﹣+4H2O 消耗氢氧根离子,正极 O2+4e﹣+2H2O=4OH﹣分析解答; C、负极:VB2+16OH﹣﹣11e﹣═VO43﹣+2B(OH)﹣+4H2O,正极:O2+4e﹣+2H2O=4OH 4第 12 页(共 27 页) ﹣,根据得失电子守恒求总的电极反应式; D、原电池中电流由正极经过外电路向负极,由此分析解答。 【解答】解:A、正极氧气得电子生成氢氧根离子,电极反应式为:O2+4e﹣+2H2O=4OH ﹣,由电极反应式可知,消耗 1mol 氧气转移 4mol 电子,则负载通过 0.04mol 电子时, 有 0.224L (标准状况)O2 参与反应,故 A 正确; B、根据负极 VB2+16OH﹣﹣11e﹣═VO43﹣+2B(OH)4﹣+4H2O 消耗氢氧根离子,正极 O2+4e﹣+2H2O=4OH﹣,则正极区溶液的 pH 升高、负极区溶液的 pH 降低,故 B 错误; C、负极:VB2+16OH﹣﹣11e﹣═VO43﹣+2B(OH)﹣+4H2O…①,正极:O2+4e﹣+2H2O 4=4OH﹣…②,根据得失电子守恒,即 4①+11②得:4VB2+11O2+20OH﹣+6H2O═8B( OH)4﹣+4VO43﹣,故 C 正确; D、原电池中电流由正极经过外电路向负极,则电流由复合碳电极经负载、VB2 电极、KOH 溶液回到复合碳电极,故 D 正确; 故选:B。 【点评】本题考查原电池及其电解池的工作原理,题目难度中等,本题注意把握电极反 应式的书写,利用电子守恒计算。 7.(6 分)W、X、Y、Z 为原子序数依次增大的短周期元素,四种元素的核外电子总数满 足 X+Y=W+Z;化合物 XW3 与 WZ 相遇会产生白烟。下列叙述正确的是( ) A.非金属性:W>X>Y>Z B.原子半径:Z>Y>X>W C.元素 X 的含氧酸均为强酸 D.Y 的氧化物水化物为强碱 【分析】原子序数依次增大的短周期元素,化合物 XW3 与 WZ 相遇会产生白烟,先假设 是氨气和氯化氢,再结合四种元素的核外电子总数满足 X+Y=W+Z,推导出 W、X、Y、 Z 分别是 H、N、Na、Cl,据此答题。 【解答】解:A.根据最高价氧化物对应水化物的酸性强弱,非金属性 Cl>N>H>Na, 故 A 错误; B.同周期元素从左向右原子半径依次减小,同主族元素自上而下原子半径依次增大,原 子半径:Na>Cl>N>H,故 B 错误; C.元素 X 的含氧酸有硝酸和亚硝酸,亚硝酸是弱酸,故 C 错误; 第 13 页(共 27 页) D.Y 的氧化物水化物为氢氧化钠,氢氧化钠是强碱,故 D 正确; 故选:D。 【点评】本题以推断的形式考查了元素周期律、元素周期表,是高频考点,要熟练掌握 周期表的结构,要熟悉常见元素化合物的性质,正确推断出元素后才能做题。 二、非选择题:共 58 分。第 8~10 题为必考题,每个试题考生都必须作答。第 11~12 为 选考题,考生根据要求作答。(一)必考题:共 43 分。 8.(14 分)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如 图装置(部分装置省略)制备 KClO3 和 NaClO,探究其氧化还原性质。 回答下列问题: (1)盛放 MnO2 粉末的仪器名称是 圆底烧瓶 ,a 中的试剂为 饱和食盐水 。 (2)b 中采用的加热方式是 水浴加热 。c 中化学反应的离子方程式是 Cl2+2OH﹣ ClO﹣+Cl﹣+H2O ,采用冰水浴冷却的目的是 避免生成 NaClO3 。 (3)d 的作用是 吸收多余的氯气,防止污染大气 ,可选用试剂 AC (填标号)。 A.Na2S B.NaCl C.Ca(OH)2 D.H2SO4 (4)反应结束后,取出 b 中试管,经冷却结晶, 过滤 , 少量的冷水洗涤 ,干燥 ,得到 KClO3 晶体。 (5)取少量 KClO3 和 NaClO 溶液分别置于 1 号和 2 号试管中,滴加中性 KI 溶液。1 号 试管溶液颜色不变。2 号试管溶液变为棕色,加入 CCl4 振荡,静置后 CCl4 层显 紫 色 。可知该条件下 KClO3 的氧化能力 小于 NaClO(填“大于”或“小于”)。 【分析】实验目的制备 KClO3 和 NaClO,并探究其氧化还原性质; 实验原理:3Cl2+6KOH KClO3+5KCl+3H2O ,第 14 页(共 27 页) Cl2+2NaOH NaClO+NaCl+3H2O; 实验装置:最左侧为制取氯气装置,a 为除杂装置,杂质为挥发的氯化氢和水,后面还要 通入溶液,没有必要除水,所以 a 中用饱和食盐水除氯化氢, 装置 b 用来制取 KClO3,装置 c 用来制取 NaClO,装置 d 用来吸收多余的氯气,防止污 染大气, (1)根据形状和用途判断,盛放 MnO2 粉末的仪器名称是圆底烧瓶,a 为除杂装置,杂 质为挥发的氯化氢和水,所以 a 中用饱和食盐水除氯化氢; (2)根据装置图看出 b 中采用的加热方式是水浴加热;c 中化学反应:Cl2+2NaOH NaClO+NaCl+H2O 改离子方程式,氢氧化钠与氯气反应有多种情况,温度高时 生成 NaClO3 采用冰水浴冷却的目的是提高产品的纯度; (3)d 为尾气处理装置,作用是装置 d 用来吸收多余的氯气,防止污染大气,可选用试 剂可以和氯气反应的物质 Na2S 和 Ca(OH)2; (4)b 试管中的溶质主要是 KClO3,KCl,KClO3 的溶解度受温度影响大,冷却结晶, 析出 KClO3 晶体,经过过滤得到 KClO3 晶体,表面还有 KCl 杂质,通过冷水洗涤减少 KClO3 的损失; (5)取少量 KClO3 和 NaClO 溶液分别置于 1 号和 2 号试管中,滴加中性 KI 溶液,1 号 试管溶液颜色不变,说明 KClO3 没有和 KI 溶液反应,2 号试管溶液变为棕色,说明 NaClO 和 KI 溶液反应生成了碘单质,加入 CCl4 振荡,碘单质易溶解于 CCl4 中,静置后 CCl4 层显紫色。可知该条件下 KClO3 的氧化能力比 NaClO 差。 【解答】解:(1)根据形状和用途判断,盛放 MnO2 粉末的仪器名称是圆底烧瓶,a 为 除杂装置,杂质为挥发的氯化氢和水,后面还要通入溶液,没有必要除水,所以 a 中用 饱和食盐水除氯化氢,a 中的试剂为饱和食盐水; 故答案为:圆底烧瓶;饱和食盐水; (2)根据装置图看出 b 中采用的加热方式是水浴加热;c 中化学反应:Cl2+2NaOH NaClO+NaCl+H2O,改离子方程式:Cl2+2OH﹣ ClO﹣+Cl﹣+H2O,氢氧 化钠与氯气反应有多种情况,温度高时生成 NaClO3.采用冰水浴冷却的目的是提高产品 的纯度; 故答案为:水浴加热;Cl2+2OH﹣ ClO﹣+Cl﹣+H2O;避免生成 NaClO3; 第 15 页(共 27 页) (3)d 为尾气处理装置,作用是装置 d 用来吸收多余的氯气,防止污染大气,可选用试 剂为可以和氯气反应的物质 Na2S 和 Ca(OH)2; 故答案为:吸收多余的氯气,防止污染大气;AC; (4)b 试管中的溶质主要是 KClO3,KCl,KClO3 的溶解度受温度影响大,冷却结晶, 析出 KClO3 晶体,经过过滤得到 KClO3 晶体,表面还有 KCl 杂质,通过冷水洗涤减少 KClO3 的损失; 故答案为:过滤;少量的冷水洗涤; (5)取少量 KClO3 和 NaClO 溶液分别置于 1 号和 2 号试管中,滴加中性 KI 溶液,1 号 试管溶液颜色不变,说明 KClO3 没有和 KI 溶液反应,2 号试管溶液变为棕色,说明 NaClO 和 KI 溶液反应生成了碘单质,加入 CCl4 振荡,碘单质易溶解于 CCl4 中,静置后 CCl4 层显紫色。可知该条件下 KClO3 的氧化能力比 NaClO 差; 故答案为:紫;小于。 【点评】本题是制备实验,以制备 KClO3 和 NaClO,探究其氧化还原性质,考查学生实 验素养和分析问题的能力,难度中等,要有扎实的实验功底和化学学科素养。 9.(15 分)某油脂厂废弃的油脂加氢镍催化剂主要含金属 Ni、Al、Fe 及其氧化物,还有 少量其他不溶性物质。采用如图工艺流程回收其中的镍制备硫酸镍晶体(NiSO4•7H2O ) :溶液中金属离子开始沉淀和完全沉淀的 pH 如下表所示: Ni2+ Al3+ Fe3+ Fe2+ 金属离子 开始沉淀时(c=0.01 mol•L﹣1)的 pH 沉淀完全时(c=1.0×10﹣5mol•L﹣1)的 pH 7.2 8.7 3.7 4.7 2.2 3.2 7.5 9.0 回答下列问题: (1)“碱浸”中 NaOH 的两个作用分别是 除去油脂、溶解铝及其氧化物 。为回收金 ﹣属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式 AlO2 第 16 页(共 27 页) +H++H2O=Al(OH)3↓或[Al(OH)4]﹣+H+=Al(OH)3↓+H2O 。 (2)“滤液②”中含有的金属离子是 Ni2+、Fe2+、Fe3+ 。 (3)“转化”中可替代 H2O2 的物质是 O2 或空气 。若工艺流程改为先“调 pH”后“ 转化”,即 ,“滤液③”中可能含有的杂质离子 为 Fe3+ 。 (4)利用上述表格数据,计算 Ni(OH) 的 Ksp= c(Ni2+)c2(OH﹣)=1.0×10﹣5mol 2•L﹣1×1×10﹣5.3mol/L×1×10﹣5.3mol/L=1×10﹣15.6(mol•L﹣1)3 (列出计算式)。 如果“转化”后的溶液中 Ni2+浓度为 1.0mol•L﹣1,则“调 pH”应控制的 pH 范围是 3.2 ~6.2 。 (5)硫酸镍在强碱溶液中用 NaClO 氧化,可沉淀出能用作镍镉电池正极材料的 NiOOH. 写出该反应的离子方程式 2Ni2++ClOˉ+4OHˉ=2NiOOH↓+Clˉ+H2O 。 (6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是 提高镍的回收率 。 【分析】由工艺流程分析可得,向废镍催化剂中加入 NaOH 溶液进行碱浸,可除去油脂, 并发生反应 2Al+2NaOH+2H2O=2NaAlO2+3H2↑、Al2O3+2NaOH=2NaAlO2+H2O 将 Al 及其氧化物溶解,得到的滤液①含有 NaAlO2,滤饼①为 Ni、Fe 及其氧化物和少量其他 不溶性杂质,加稀 H2SO4 酸浸后得到含有 Ni2+、Fe2+、Fe3+的滤液②,Fe2+经 H2O2 氧化 为 Fe3+后,加入 NaOH 调节 pH 使 Fe3+转化为 Fe(OH)3 沉淀除去,再控制 pH 浓缩结 晶得到硫酸镍的晶体,据此分析解答问题。 【解答】解:(1)根据分析可知,向废镍催化剂中加入 NaOH 溶液进行碱浸,可除去油 脂,并将 Al 及其氧化物溶解,滤液①中含有 NaAlO2(或 Na[Al(OH)4]),加入稀硫 酸可发生反应 AlO2﹣+H++H2O=Al(OH)↓或[Al(OH)]﹣+H+=Al(OH)↓+H2O; 343故答案为:除去油脂、溶解铝及其氧化物;AlO2﹣+H++H2O=Al(OH)3↓或[Al(OH) 4]﹣+H+=Al(OH)3↓+H2O; (2)加入稀硫酸酸浸,Ni、Fe 及其氧化物溶解,所以“滤液②”中含有的金属离子是 Ni2+ 、Fe2+、Fe3+, 故答案为:Ni2+、Fe2+、Fe3+; (3)“转化”中 H2O2 的作用是将 Fe2+氧化为 Fe3+,不能引入杂质,可用 O2 或空气替 第 17 页(共 27 页) 代;若将工艺流程改为先“调 pH”后“转化”,会使调 pH 过滤后的溶液中含有 Fe2+、 则滤液③中可能含有转化生成的 Fe3+; 故答案为:O2 或空气;Fe3+; (4)由上述表格可知,Ni2+完全沉淀时的 pH=8.7,此时 c(Ni2+)=1.0×10﹣5mol•L﹣ 1,c(H+)=1.0×10﹣8.7mol•L﹣1,则 c(OH﹣)= ==1×10﹣ 5.3mol/L,则 Ni(OH)2 的 Ksp=c(Ni2+)c2(OH﹣)=1.0×10﹣5mol•L﹣1×1×10﹣ 5.3mol/L×1×10﹣5.3mol/L=1×10﹣15.6(mol•L﹣1)3.如果“转化”后的溶液中 Ni2+浓 度为 1.0mol•L﹣1,为避免镍离子沉淀,Ksp=c(Ni2+)c2(OH﹣),c2(OH﹣)= 3=1×10﹣15.6(mol•L﹣1) ,此时 c(OH﹣)=1×10﹣7.8mol•L﹣1,则 c(H+) =1.0×10﹣6.2mol•L﹣1,即 pH=6.2;Fe3+完全沉淀的 pH 为 3.2,因此“调节 pH”应控 制的 pH 范围是 3.2~6.2; 故答案为:c(Ni2+)c2(OH﹣)=1.0×10﹣5mol•L﹣1×1×10﹣5.3mol/L×1×10﹣5.3mol/L =1×10﹣15.6;3.2~6.2; (5)由题干信息,硫酸镍在强碱中被 NaClO 氧化得到 NiOOH 沉淀,即反应中 Ni2+被氧 化为 NiOOH 沉淀,ClOˉ被还原为 Clˉ,则根据氧化还原得失电子守恒可得离子方程式 为 2Ni2++ClOˉ+4OHˉ=2NiOOH↓+Clˉ+H2O; 故答案为:2Ni2++ClOˉ+4OHˉ=2NiOOH↓+Clˉ+H2O; (6)分离出硫酸镍晶体后的母液中还含有 Ni2+,可将其收集、循环使用,从而提高镍的 回收率; 故答案为:提高镍的回收率。 【点评】本题以化学工艺流程为背景,考查物质的分离提纯,离子反应、氧化还原反应、 沉淀平衡常数的计算等知识点,是近年高考的热点题型,属于学科内综合题,考查分析 问题能力、提取利用题目信息能力,计算能力、表达能力等,难度中等,注意(4)中 Ni2+ 开始沉淀的 pH 不能直接利用表中数据,要通过计算获得。 10.(14 分)二氧化碳催化加氢合成乙烯是综合利用 CO2 的热点研究领域。回答下列问题: (1)CO2 催化加氢生成乙烯和水的反应中,产物的物质的量之比 n(C2H4):n(H2O)= 1:4 。当反应达到平衡时,若增大压强,则 n(C2H4) 变大 (填“变大”“变小” 或“不变”)。 第 18 页(共 27 页) (2)理论计算表明。原料初始组成 n(CO2):n(H2)=1:3,在体系压强为 0.1MPa, 反应达到平衡时,四种组分的物质的量分数 x 随温度 T 的变化如图所示。图中,表示 C2H4 、CO2 变化的曲线分别是 d 、 c 。 CO2 催化加氢合成 C2H4 反应的△H 小于 0 ( 填“大于”或“小于”)。 ( 3 ) 根 据 图 中 点A ( 440K , 0.39 ) , 计 算 该 温 度 时 反 应 的 平 衡 常 数Kp = (MPa)﹣3(列出计算式。以分压表示,分压=总压×物质的量分数 )。 (4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成 C3H6、C3H8、C4H8 等低碳 烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当 选择合适的催化 剂 。 【分析】(1)根据质量守恒定律配平化学方程式,可以确定产物的物质的量之比。根据 可逆反应的特点分析增大压强对化学平衡的影响; (2)原料初始组成 n(CO2):n(H2)=1:3,根据方程式,生成物乙烯与水物质的量 之比为 1:4,从图中找到关键数据确定代表各组分的曲线; 根据图中代表各组分的曲线随温度变化的趋势,确定该反应是放热反应还是吸热反应; (3)原料初始组成 n(CO2):n(H2)=1:3,在体系压强为 0.1Mpa 建立平衡,由 A 点坐标可知,该温度下,氢气和水的物质的量分数均为 0.39,生成物乙烯与水物质的量 之比为 1:4,求出乙烯、二氧化碳的物质的量分数,结合化学平衡常数公式计算; (4)根据催化剂对化反应速率的影响和对主反应的选择性,工业上通常要选择合适的催 化剂以提高化学反应速率、减少副反应的发生。 【解答】解:(1)CO2 催化加氢生成乙烯和水,该反应的化学方程式可表示为 第 19 页(共 27 页) 2CO2+6H2⇌CH2=CH2+4H2O, 则该反应中产物的物质的量之比 n(C2H4):n(H2O)=1:4; 由于该反应是气体分子数减少的反应,当反应达到平衡状态时,若增大压强,则化学平 衡向正反应方向移动,n(C2H4)变大, 故答案为:1:4;变大; (2)由题中信息可知,两反应物初始投料之比等于化学计量数之比;由图中曲线的起点 坐标可知,c 和 a 所表示的物质的物质的量分数之比为 1:3、d 和 b 表示的物质的物质的 量分数之比为 1:4,则结合化学计量数之比可以判断,表示乙烯变化的曲线是 d,表示 二氧化碳变化曲线的是 c; 由图中曲线的变化趋势可知,升高温度,乙烯的物质的量分数减小,则化学平衡向逆反 应方向移动,则该反应为放热反应,△H 小于 0, 故答案为:d;c;小于; (3)原料初始组成 n(CO2):n(H2)=1:3,在体系压强为 0.1Mpa 建立平衡,由 A 点坐标可知,该温度下,氢气和水的物质的量分数均为 0.39,则乙烯的物质的量分数为 水的四分之一,即乙烯的物质的量分数为 之一,即二氧化碳的物质的量分数为 ,二氧化碳的物质的量分数为氢气的三分 ,Kp ===(MPa)﹣3 ,故答案为: ;(4)工业上通常通过选择合适催化剂,以加快化学反应速率,同时还可以提高目标产品 的选择性,减少副反应的发生。因此,一定温度和压强下,为了提高反应速率和乙烯的 选择性,应当选择合适的催化剂, 故答案为:选择合适的催化剂。 【点评】本题考查化学平衡相关知识,侧重考查学生分析能力、识图能力和计算能力, 确定图中曲线所代表的化学物质是难点,其关键在于明确物质的量的分数之比等于各组 分的物质的量之比,也等于化学计量数之比(在初始投料之比等于化学计量数之比的前 提下,否则不成立),此题难度较大。 第 20 页(共 27 页) (二)选考题:共 15 分。请考生从 2 道化学题中任选一题作答。如果多做,则按所做的第 一题计分。[化学–选修 3:物质结构与性质](15 分) 11.(15 分)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料 。回答下列问题: (1)H、B、N 中,原子半径最大的是 B 。根据对角线规则,B 的一些化学性质与元 素 Si 的相似。 (2)NH3BH3 分子中,N﹣B 化学键称为 配位 键,其电子对由 N 提供。氨硼烷在 催化剂作用下水解释放氢气: +3NH3BH3+6H2O═3NH4 +B3O63﹣+9H2 B3O63﹣的结构为 为 sp2 。 .在该反应中,B 原子的杂化轨道类型由 sp3 变 (3)NH3BH3 分子中,与 N 原子相连的 H 呈正电性(Hδ+),与 B 原子相连的 H 呈负 电性(Hδ﹣),电负性大小顺序是 N>H>B 。与 NH3BH3 原子总数相等的等电子体 是 CH3CH3 (写分子式),其熔点比 NH3BH3 低 (填“高”或“低”),原因是 在 NH3BH3 分子之间,存在 Hδ+与 Hδ﹣的静电引力 作用,也称“双氢键”。 (4)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为 apm、bpm、 cpm,α=β=γ=90°.氨硼烷的 2×2×2 超晶胞结构如图所示。氨硼烷晶体的密度 ρ= g•cm﹣3(列出计算式,设 NA 为阿伏加德罗常数的值)。 【分析】根据元素在周期表中的位置比较和判断元素的相关性质;根据中心原子的价层 电子对数确定其杂化轨道的类型;运用等量代换的方法寻找等电子体;根据电负性对化 第 21 页(共 27 页) 合价的影响比较不同元素的电负性;根据晶胞的质量和体积求晶体的密度。 【解答】解:(1)在所有元素中,H 原子的半径是最小的,同一周期从左到右,原子半 径依次减小,所以,H、B、N 中原子半径最大是 B.B 与 Si 在元素周期表中处于对角线 的位置,根据对角线规则,B 的一些化学性质与 Si 元素相似。 故答案为:B;Si。 (2)B 原子最外层有 3 个电子,其与 3 个 H 原子形成共价键后,其价层电子对只有 3 对 ,还有一个空轨道;在 NH3 中,N 原子有一对孤对电子,故在 NH3BH3 分子中,N﹣B 键为配位键,其电子对由 N 原子提供。NH3BH3 分子中,B 原子的价层电子对数为 4,故 其杂化方式为 sp3.NH3BH3 在催化剂的作用下水解生成氢气和 B3O63﹣,由图中信息可 知,B3O63﹣中每个 B 原子只形成 3 个σ键,其中的 B 原子的杂化方式为 sp2,因此,B 原子的杂化轨道类型由 sp3 变为 sp2。 故答案为:配位、N、sp3、sp2。 (3)NH3BH3 分子中,与 N 原子相连的 H 呈正电性,说明 N 的电负性大于 H;与 B 原 子相连的 H 呈负电性,说明 H 的电负性大于 B,因此 3 种元素电负性由大到小的顺序为 N>H>B.NH3BH3 分子中有 8 个原子,其价电子总数为 14,N 和 B 的价电子数的平均 值为 4,依据等量代换的原则,可以找到其等电子体为 CH3CH3.由于 NH3BH3 分子属于 极性分子,而 CH3CH3 属于非极性分子,两者相对分子质量接近,但是极性分子的分子 间作用力较大,故 CH3CH3 熔点比 NH3BH3 低。NH3BH3 分子间存在“双氢键”,类比 氢键的形成原理,说明其分子间存在 Hδ+与 Hδ﹣的静电引力。 故答案为:N>H>B、CH3CH3、低、Hδ+与 Hδ﹣的静电引力。 (4)在氨硼烷的 2×2×2 的超晶胞结构中,共有 16 个氨硼烷分子,晶胞的长、宽、高 分别为 2apm、2bpm、2cpm,若将其平均分为 8 份可以得到 8 个小长方体,则平均每个 小长方体中占有 2 个氨硼烷分子,小长方体的长、宽、高分别为 apm、bpm、cpm,则小 长方体的质量为 ,小长方体的体积为 abc×10﹣30cm﹣3,因此,氨硼烷晶体的密 度为 。故答案为: 。第 22 页(共 27 页) 【点评】本题最后有关晶体密度的计算是难点,要求考生能读懂题意,通过观察晶胞结 构,确定超晶胞结构中的分子数,并能合理分成 8 份,从而简化计算。 [化学–选修 5:有机化学基础](15 分) 12.苯基环丁烯酮( PCBO)是一种十分活泼的反应物,可利用它的开环 反应合成一系列多官能团化合物。近期我国科学家报道用 PCBO 与醛或酮发生[4+2]环加 成反应,合成了具有生物活性的多官能团化合物(E),部分合成路线如图: 已知如下信息: 回答下列问题: (1)A 的化学名称是 2﹣羟基苯甲醛 。 (2)B 的结构简式为 。 (3)由 C 生成 D 所用的试剂和反应条件为 乙醇、浓硫酸/加热 ;该步反应中,若反 应温度过高,C 易发生脱羧反应,生成分子式为 C8H8O2 的副产物,该副产物的结构简式 为 。 第 23 页(共 27 页) (4)写出化合物 E 中含氧官能团的名称 羟基、酯基 ;E 中手性碳(注:连有四个不 同的原子或基团的碳)的个数为 2 。 (5)M 为 C 的一种同分异构体。已知:1mol M 与饱和碳酸氢钠溶液充分反应能放出 2mol 二氧化碳;M 与酸性高锰酸钾溶液反应生成对苯二甲酸。M 的结构简式为 。 (6)对于 ,选用不同的取代基 R’,在催化剂作用下与 PCBO 发生的[4+2] 反应进行深入研究,R’对产率的影响见下表: R’ ﹣CH3 ﹣C2H5 ﹣CH2CH2C6H5 产率/% 91 80 63 请找出规律,并解释原因 随着 R′体积增大,产率降低;原因是 R′体积增大,位阻 增大 。 【分析】根据合成路线分析可知,A( )与 CH3CHO 在 NaOH 的水溶液 中 发 生 题 给 的 已 知 反 应 , 生 成B ( ) , B 与 KMnO4 反 应 , 被 氧 化 后 再 酸 化 得 到C ( 第 24 页(共 27 页) ),C 再与 CH3CH2OH 在浓 H2SO4 加热条件下,发生酯化反 应得 D( ),D 再与苯基环丁烯酮( PCBO) 反应得到 E( ),据此分析。 【解答】解:(1)A 的结构简式为: ,醛基所连的碳为“1”号碳,羟 基相连的碳为“2”号碳,所以名称为 2﹣羟基苯甲醛(或水杨醛), 故答案为:2﹣羟基苯甲醛(或水杨醛); (2)根据上述分析可知,B 的结构简式为: ,故答案为: ;(3)C( )与 CH3CH2OH 在浓 H2SO4 加热的条件下,发生酸 脱羟基醇脱氢的酯化反应得到 D( ),即所用试剂为乙醇、 第 25 页(共 27 页) 浓硫酸,反应条件为加热;在该步反应中,若反应温度过高,根据副产物的分子式 C8H8O2 可知,C( )发生脱羧反应生成 ,故答案为:乙醇、浓硫酸/加热; (4)化合物 E 的结构简式为: ,分子中的含氧官能团为 : 羟 基 和 酯 基 , E 中 手 性 碳 原 子 共 有 位 置 为 的2 个 手 性 碳 , 如 图 所 示 : ,故答案为:羟基、酯基;2; (5)M 为 C( )的一种同分异构体,1molM 与饱和 NaHCO3 溶液反应能放出 2molCO2,则 M 中含有两个羧基(﹣COOH),M 又与酸性高锰酸钾溶 液生成对二苯甲酸,所以 M 分子苯环上只有两个取代基且处于对位,则 M 的结构简式 为: ,故答案为: ;第 26 页(共 27 页) (6)由表格数据分析可得到规律,随着取代基 R′体积的增大,产物的产率降低,出现 此规律的原因可能是因为 R′体积增大,从而位阻增大,导致产率降低, 故答案为:随着 R′体积增大,产率降低;原因是 R′体积增大,位阻增大。 【点评】本题考查学生对有机化学基础的理解和掌握,题目难度中等,掌握有机的命名、反 应条件、官能团名称、手性碳、同分异构等,明确由手性碳及同分异构的书写是解题关键。 同时考查了阅读题目获取新信息的能力,需要学生具备扎实的基础与综合运用知识、信息分 析解决问题能力。 第 27 页(共 27 页)
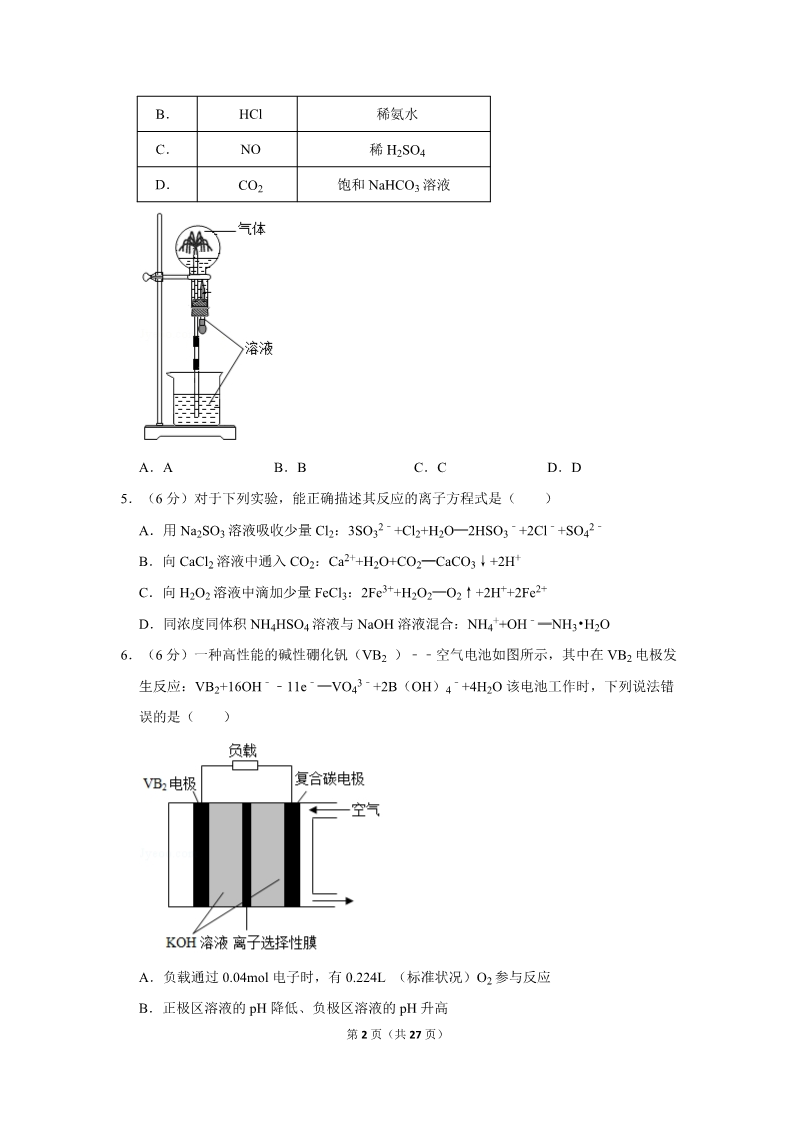
2020 年全国统一高考化学试卷(新课标Ⅲ) 一、选择题:本题共 7 小题,每小题 6 分,共 42 分。在每小题给出的四个选项中,只有一 项是符合题目要求的. 1.(6 分)宋代《千里江山图)描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿 色来自孔雀石颜料(主要成分 为 Cu(OH)2•CuCO3),青色来自蓝铜矿颜料(主要成分为 Cu(OH)2•2CuCO3)。 下列说法错误的是( ) A.保存《千里江山图》需控制温度和湿度 B.孔雀石、蓝铜矿颜料不易被空气氧化 C.孔雀石、蓝铜矿颜料耐酸耐碱 D.Cu(OH2)•CuCO3 中铜的质量分数高于 Cu(OH2)•2CuCO3 2.(6 分)金丝桃苷是从中药材中提取的一种具有抗病毒作用的黄酮类化合物,结构式如 图:下列关于金丝桃苷的叙述,错误的是( ) A.可与氢气发生加成反应 C.能与乙酸发生酯化反应 B.分子含 21 个碳原子 D.不能与金属钠反应 3.(6 分)NA 是阿伏加德罗常数的值。下列说法正确的是( ) A.22.4L(标准状况)氮气中含有 7NA 个中子 B.1mol 重水比 1mol 水多 NA 个质子 C.12g 石墨烯和 12g 金刚石均含有 NA 个碳原子 D.1L 1mol•L﹣1 NaCl 溶液含有 28NA 个电子 4.(6 分)喷泉实验装置如图所示。应用下列各组气体﹣﹣溶液,能出现喷泉现象的是( ) 气体 溶液 A. 稀盐酸 H2S 第 1 页(共 27 页) B. C. D. HCl NO 稀氨水 稀 H2SO4 饱和 NaHCO3 溶液 CO2 A.A B.B C.C D.D 5.(6 分)对于下列实验,能正确描述其反应的离子方程式是( ) A.用 Na2SO3 溶液吸收少量 Cl2:3SO32﹣+Cl2+H2O═2HSO3﹣+2Cl﹣+SO4 B.向 CaCl2 溶液中通入 CO2:Ca2++H2O+CO2═CaCO3↓+2H+ 2﹣ C.向 H2O2 溶液中滴加少量 FeCl3:2Fe3++H2O2═O2↑+2H++2Fe2+ +D.同浓度同体积 NH4HSO4 溶液与 NaOH 溶液混合:NH4 +OH﹣═NH3•H2O 6.(6 分)一种高性能的碱性硼化钒(VB2 )﹣﹣空气电池如图所示,其中在 VB2 电极发 生反应:VB2+16OH﹣﹣11e﹣═VO43﹣+2B(OH)4﹣+4H2O 该电池工作时,下列说法错 误的是( ) A.负载通过 0.04mol 电子时,有 0.224L (标准状况)O2 参与反应 B.正极区溶液的 pH 降低、负极区溶液的 pH 升高 第 2 页(共 27 页) 3﹣ C.电池总反应为 4VB2+11O2+20OH﹣+6H2O═8B(OH)4﹣+4VO4 D.电流由复合碳电极经负载、VB2 电极、KOH 溶液回到复合碳电极 7.(6 分)W、X、Y、Z 为原子序数依次增大的短周期元素,四种元素的核外电子总数满 足 X+Y=W+Z;化合物 XW3 与 WZ 相遇会产生白烟。下列叙述正确的是( ) A.非金属性:W>X>Y>Z B.原子半径:Z>Y>X>W C.元素 X 的含氧酸均为强酸 D.Y 的氧化物水化物为强碱 二、非选择题:共 58 分。第 8~10 题为必考题,每个试题考生都必须作答。第 11~12 为 选考题,考生根据要求作答。(一)必考题:共 43 分。 8.(14 分)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如 图装置(部分装置省略)制备 KClO3 和 NaClO,探究其氧化还原性质。 回答下列问题: (1)盛放 MnO2 粉末的仪器名称是 ,a 中的试剂为 。 (2)b 中采用的加热方式是 。c 中化学反应的离子方程式是 ,采用冰水 浴冷却的目的是 。 ,可选用试剂 (3)d 的作用是 (填标号)。 A.Na2S B.NaCl C.Ca(OH)2 D.H2SO4 (4)反应结束后,取出 b 中试管,经冷却结晶, 晶体。 , ,干燥,得到 KClO3 第 3 页(共 27 页) (5)取少量 KClO3 和 NaClO 溶液分别置于 1 号和 2 号试管中,滴加中性 KI 溶液。1 号 试管溶液颜色不变。2 号试管溶液变为棕色,加入 CCl4 振荡,静置后 CCl4 层显 色。可知该条件下 KClO3 的氧化能力 NaClO(填“大于”或“小于”)。 9.(15 分)某油脂厂废弃的油脂加氢镍催化剂主要含金属 Ni、Al、Fe 及其氧化物,还有 少量其他不溶性物质。采用如图工艺流程回收其中的镍制备硫酸镍晶体(NiSO4•7H2O ) :溶液中金属离子开始沉淀和完全沉淀的 pH 如下表所示: Ni2+ Al3+ Fe3+ Fe2+ 金属离子 开始沉淀时(c=0.01 mol•L﹣1)的 pH 沉淀完全时(c=1.0×10﹣5mol•L﹣1)的 pH 回答下列问题: 7.2 8.7 3.7 4.7 2.2 3.2 7.5 9.0 (1)“碱浸”中 NaOH 的两个作用分别是 。为回收金属,用稀硫酸将“滤液① 。 ”调为中性,生成沉淀。写出该反应的离子方程式 (2)“滤液②”中含有的金属离子是 (3)“转化”中可替代 H2O2 的物质是 。 。若工艺流程改为先“调 pH”后“转化” ,即 ,“滤液③”中可能含有的杂质离子为 。 (4)利用上述表格数据,计算 Ni(OH)2 的 Ksp= (列出计算式)。如果“转 化”后的溶液中 Ni2+浓度为 1.0mol•L﹣1,则“调 pH”应控制的 pH 范围是 。 (5)硫酸镍在强碱溶液中用 NaClO 氧化,可沉淀出能用作镍镉电池正极材料的 NiOOH. 写出该反应的离子方程式 。 (6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是 。 10.(14 分)二氧化碳催化加氢合成乙烯是综合利用 CO2 的热点研究领域。回答下列问题: (1)CO2 催化加氢生成乙烯和水的反应中,产物的物质的量之比 n(C2H4):n(H2O)= 第 4 页(共 27 页) 。当反应达到平衡时,若增大压强,则 n(C2H4) (填“变大”“变小”或“不 变”)。 (2)理论计算表明。原料初始组成 n(CO2):n(H2)=1:3,在体系压强为 0.1MPa, 反应达到平衡时,四种组分的物质的量分数 x 随温度 T 的变化如图所示。图中,表示 C2H4 、CO2 变化的曲线分别是 、 。 CO2 催化加氢合成 C2H4 反应的△H 0 (填“大于”或“小于”)。 ﹣(3)根据图中点 A(440K,0.39),计算该温度时反应的平衡常数 Kp= (MPa) 3(列出计算式。以分压表示,分压=总压×物质的量分数)。 (4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成 C3H6、C3H8、C4H8 等低碳 烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当 。 (二)选考题:共 15 分。请考生从 2 道化学题中任选一题作答。如果多做,则按所做的第 一题计分。[化学–选修 3:物质结构与性质](15 分) 11.(15 分)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料 。回答下列问题: (1)H、B、N 中,原子半径最大的是 元素 的相似。 。根据对角线规则,B 的一些化学性质与 (2)NH3BH3 分子中,N﹣B 化学键称为 键,其电子对由 提供。氨硼烷 在催化剂作用下水解释放氢气: +3NH3BH3+6H2O═3NH4 +B3O63﹣+9H2 第 5 页(共 27 页) B3O63﹣的结构为 .在该反应中,B 原子的杂化轨道类型由 变 为 。 (3)NH3BH3 分子中,与 N 原子相连的 H 呈正电性(Hδ+),与 B 原子相连的 H 呈负 电性(Hδ﹣),电负性大小顺序是 写分子式),其熔点比 NH3BH3 。与 NH3BH3 原子总数相等的等电子体是 ( (填“高”或“低”),原因是在 NH3BH3 分子 之间,存在 作用,也称“双氢键”。 (4)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为 apm、bpm、 cpm,α=β=γ=90°.氨硼烷的 2×2×2 超晶胞结构如图所示。氨硼烷晶体的密度 ρ= g•cm﹣3(列出计算式,设 NA 为阿伏加德罗常数的值)。 [化学–选修 5:有机化学基础](15 分) 12.苯基环丁烯酮( PCBO)是一种十分活泼的反应物,可利用它的开环 反应合成一系列多官能团化合物。近期我国科学家报道用 PCBO 与醛或酮发生[4+2]环加 成反应,合成了具有生物活性的多官能团化合物(E),部分合成路线如图: 第 6 页(共 27 页) 已知如下信息: 回答下列问题: (1)A 的化学名称是 (2)B 的结构简式为 。 。 (3)由 C 生成 D 所用的试剂和反应条件为 易发生脱羧反应,生成分子式为 C8H8O2 的副产物,该副产物的结构简式为 (4)写出化合物 E 中含氧官能团的名称 ;E 中手性碳(注:连有四个不同的原 子或基团的碳)的个数为 。 (5)M 为 C 的一种同分异构体。已知:1mol M 与饱和碳酸氢钠溶液充分反应能放出 2mol 二氧化碳;M 与酸性高锰酸钾溶液反应生成对苯二甲酸。M 的结构简式为 。 ;该步反应中,若反应温度过高,C 。 (6)对于 ,选用不同的取代基 R’,在催化剂作用下与 PCBO 发生的[4+2] 反应进行深入研究,R’对产率的影响见下表: R’ ﹣CH3 91 ﹣C2H5 ﹣CH2CH2C6H5 产率/% 80 63 请找出规律,并解释原因 。 第 7 页(共 27 页) 2020 年全国统一高考化学试卷(新课标Ⅲ) 参考答案与试题解析 一、选择题:本题共 7 小题,每小题 6 分,共 42 分。在每小题给出的四个选项中,只有一 项是符合题目要求的. 1.(6 分)宋代《千里江山图)描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿 色来自孔雀石颜料(主要成分 为 Cu(OH)2•CuCO3),青色来自蓝铜矿颜料(主要成分为 Cu(OH)2•2CuCO3)。 下列说法错误的是( ) A.保存《千里江山图》需控制温度和湿度 B.孔雀石、蓝铜矿颜料不易被空气氧化 C.孔雀石、蓝铜矿颜料耐酸耐碱 D.Cu(OH2)•CuCO3 中铜的质量分数高于 Cu(OH2)•2CuCO3 【分析】A.Cu(OH) •CuCO3 和 Cu(OH) •2CuCO3 均不稳定,受热易分解,纤维素 22或蛋白质均能水解; B.Cu(OH) •CuCO3 和 Cu(OH) •2CuCO3 中除 O 元素外,C、H、Cu 均为最高价; 22C.Cu(OH)2•CuCO3 和 Cu(OH)2•2CuCO3 均能与酸反应,不与碱反应; D.通过计算判断比较铜的质量分数大小。 【解答】解:A.Cu(OH) •CuCO3 和 Cu(OH) •2CuCO3 均不稳定,受热易分解,纤 22维素或蛋白质均能水解,长期在潮湿环境中易腐烂变质,则保存《千里江山图》需控制 温度和湿度,故 A 正确; B.Cu(OH)2•CuCO3 和 Cu(OH)2•2CuCO3 中除 O 元素外,C、H、Cu 均为最高价, 无还原性,不能被空气中氧气氧化,则孔雀石、蓝铜矿颜料不易被空气氧化,故 B 正确; C.Cu(OH)2•CuCO3 和 Cu(OH)2•2CuCO3 均能与酸反应,不与碱反应,则孔雀石、 蓝铜矿颜料耐碱不耐酸,故 C 错误; D.Cu(OH2)•CuCO3 中铜的质量分数为 ,Cu(OH2)•2CuCO3 中铜的质 量分数为 ,则 Cu(OH2)•CuCO3 中铜的质量分数高于 Cu(OH2)•2CuCO3 ,故 D 正确; 故选:C。 第 8 页(共 27 页) 【点评】本题以《千里江山图》为载体,考查物质的组成、结构和性质的关系,涉及元 素质量分数的计算和盐的通性,基础考查,难度中等。 2.(6 分)金丝桃苷是从中药材中提取的一种具有抗病毒作用的黄酮类化合物,结构式如 图:下列关于金丝桃苷的叙述,错误的是( ) A.可与氢气发生加成反应 C.能与乙酸发生酯化反应 B.分子含 21 个碳原子 D.不能与金属钠反应 【分析】A、分子中含有碳碳双键、碳氧双键和苯环; B、由图可知金丝桃苷的分子式 C21H20O12; C、分子中含有羟基,能发生酯化反应; D、分子结构可知结构中含有羟基; 【解答】解:A、分子中含有碳碳双键、碳氧双键和苯环,可以发生加成反应,故 A 正 确; B、由图可知金丝桃苷的分子式 C21H20O12,则分子含 21 个碳原子,故 B 正确; C、分子中含有羟基,能发生酯化反应,即能与乙酸发生酯化反应,故 C 正确; D、分子结构可知结构中含有羟基,能与金属钠反应产生氢气,故 D 错误; 故选:D。 【点评】本题考查有机物结构和性质,侧重考查酚、烯烃、醇、醚和酮的性质,明确官 能团及其性质关系是解本题关键,题目难度不大。 3.(6 分)NA 是阿伏加德罗常数的值。下列说法正确的是( ) A.22.4L(标准状况)氮气中含有 7NA 个中子 B.1mol 重水比 1mol 水多 NA 个质子 C.12g 石墨烯和 12g 金刚石均含有 NA 个碳原子 D.1L 1mol•L﹣1 NaCl 溶液含有 28NA 个电子 【分析】A.一个氮气分子有 14 个中子; 第 9 页(共 27 页) B.重水和水的质子数相等; C.跟据 n= 计算物质的量,再比较微粒数; D.溶剂也要考虑。 【解答】解:A.氮气是双原子分子,一个氮气分子有 14 个中子,22.4L (标准状况) 氮气中含有 14NA 个中子,故 A 错误; B.重水(D2O)和水(H2O)的质子数都是 10,1mol 重水比 1mol 水都是 10NA 个质子, 故 B 错误; C.12g 石墨烯 n(C60)= =mol,含有个碳原子物质的量 n(c)= mol× 60=1mol,含有 NA 个碳原子,12g 金刚石(C)的物质的量 n= 含有 NA 个碳原子,故 C 正确; ==1mol, D.1L 1mol•L﹣1 NaCl 溶质含有 28NA 个电子,溶剂水也要考虑,故 D 错误; 故选:C。 【点评】本题考查阿伏伽德罗常数的计算,是高频考点,要熟练掌握计算公式,和公式 的使用条件,D 选项容易思维定式出现错误。 4.(6 分)喷泉实验装置如图所示。应用下列各组气体﹣﹣溶液,能出现喷泉现象的是( ) 气体 H2S HCl NO 溶液 A. B. C. D. 稀盐酸 稀氨水 稀 H2SO4 饱和 NaHCO3 CO2 溶液 第 10 页(共 27 页) A.A B.B C.C D.D 【分析】在烧瓶中充满干燥气体,而胶头滴管及烧杯中分别盛有液体,若形成喷泉,则 气体极易溶于液体或气体极易与液体反应,以此来解答。 【解答】解:A、H2S 在稀盐酸中溶解度小,且与稀盐酸不反应,不能出现喷泉,故 A 错误; B.HCl 气体极易溶于稀氨水,且氯化氢气体与氨水反应生成氯化铵,产生压强差,形成 喷泉,故 B 正确; C、一氧化氮不溶于稀 H2SO4,也不与稀 H2SO4 反应,不能出现喷泉,故 C 错误; D、二氧化碳不溶于饱和碳酸氢钠,也不与饱和碳酸氢钠反应,不能出现喷泉,故 D 错 误; 故选:B。 【点评】本题考查实验装置综合,为高频考点,把握喷泉实验的原理为解答的关键,侧 重物质性质及实验能力的考查,注意气体极易溶于液体或气体极易与液体反应可形成喷 泉,题目难度不大。 5.(6 分)对于下列实验,能正确描述其反应的离子方程式是( ) 2﹣ A.用 Na2SO3 溶液吸收少量 Cl2:3SO32﹣+Cl2+H2O═2HSO3﹣+2Cl﹣+SO4 B.向 CaCl2 溶液中通入 CO2:Ca2++H2O+CO2═CaCO3↓+2H+ C.向 H2O2 溶液中滴加少量 FeCl3:2Fe3++H2O2═O2↑+2H++2Fe2+ +D.同浓度同体积 NH4HSO4 溶液与 NaOH 溶液混合:NH4 +OH﹣═NH3•H2O 【分析】A.符合电荷守恒,物料守恒,强制弱规律, B.向 CaCl2 溶液中通入 CO2 不反应; C.不符合客观事实,氧气氧化二价铁离子; 第 11 页(共 27 页) D.不符合客观事实,氢氧根优先于氢离子反应。 2【解答】解:A.用 Na2SO3 溶液吸收少量 Cl2:3SO32﹣+Cl2+H2O═2HSO3﹣+2Cl﹣+SO4 ﹣,符合电荷守恒,物料守恒,强制弱规律,故 A 正确; B.弱酸不能制强酸,向 CaCl2 溶液中通入 CO2 不反应,故 B 错误; C.向 H2O2 溶液中滴加少量 FeCl3,FeCl3 做催化剂,促进双氧水的分解,氧气的氧化性 大于三价铁离子,弱氧化剂不能制强氧化剂,故 C 错误; D.不符合客观事实,氢氧根优先与酸性更强的氢离子反应,正确的离子方程式:H++OH ﹣═H2O,故 D 错误; 故选:A。 【点评】本题考查了化学反应原理,离子方程式的书写,离子方程式的正误判断,重点 考查反应发生的可能性,掌握强制弱的原理,难度中等。 6.(6 分)一种高性能的碱性硼化钒(VB2 )﹣﹣空气电池如图所示,其中在 VB2 电极发 生反应:VB2+16OH﹣﹣11e﹣═VO43﹣+2B(OH)4﹣+4H2O 该电池工作时,下列说法错 误的是( ) A.负载通过 0.04mol 电子时,有 0.224L (标准状况)O2 参与反应 B.正极区溶液的 pH 降低、负极区溶液的 pH 升高 3﹣ C.电池总反应为 4VB2+11O2+20OH﹣+6H2O═8B(OH)4﹣+4VO4 D.电流由复合碳电极经负载、VB2 电极、KOH 溶液回到复合碳电极 【分析】A、正极氧气得电子生成氢氧根离子; B、根据负极 VB2+16OH﹣﹣11e﹣═VO43﹣+2B(OH)4﹣+4H2O 消耗氢氧根离子,正极 O2+4e﹣+2H2O=4OH﹣分析解答; C、负极:VB2+16OH﹣﹣11e﹣═VO43﹣+2B(OH)﹣+4H2O,正极:O2+4e﹣+2H2O=4OH 4第 12 页(共 27 页) ﹣,根据得失电子守恒求总的电极反应式; D、原电池中电流由正极经过外电路向负极,由此分析解答。 【解答】解:A、正极氧气得电子生成氢氧根离子,电极反应式为:O2+4e﹣+2H2O=4OH ﹣,由电极反应式可知,消耗 1mol 氧气转移 4mol 电子,则负载通过 0.04mol 电子时, 有 0.224L (标准状况)O2 参与反应,故 A 正确; B、根据负极 VB2+16OH﹣﹣11e﹣═VO43﹣+2B(OH)4﹣+4H2O 消耗氢氧根离子,正极 O2+4e﹣+2H2O=4OH﹣,则正极区溶液的 pH 升高、负极区溶液的 pH 降低,故 B 错误; C、负极:VB2+16OH﹣﹣11e﹣═VO43﹣+2B(OH)﹣+4H2O…①,正极:O2+4e﹣+2H2O 4=4OH﹣…②,根据得失电子守恒,即 4①+11②得:4VB2+11O2+20OH﹣+6H2O═8B( OH)4﹣+4VO43﹣,故 C 正确; D、原电池中电流由正极经过外电路向负极,则电流由复合碳电极经负载、VB2 电极、KOH 溶液回到复合碳电极,故 D 正确; 故选:B。 【点评】本题考查原电池及其电解池的工作原理,题目难度中等,本题注意把握电极反 应式的书写,利用电子守恒计算。 7.(6 分)W、X、Y、Z 为原子序数依次增大的短周期元素,四种元素的核外电子总数满 足 X+Y=W+Z;化合物 XW3 与 WZ 相遇会产生白烟。下列叙述正确的是( ) A.非金属性:W>X>Y>Z B.原子半径:Z>Y>X>W C.元素 X 的含氧酸均为强酸 D.Y 的氧化物水化物为强碱 【分析】原子序数依次增大的短周期元素,化合物 XW3 与 WZ 相遇会产生白烟,先假设 是氨气和氯化氢,再结合四种元素的核外电子总数满足 X+Y=W+Z,推导出 W、X、Y、 Z 分别是 H、N、Na、Cl,据此答题。 【解答】解:A.根据最高价氧化物对应水化物的酸性强弱,非金属性 Cl>N>H>Na, 故 A 错误; B.同周期元素从左向右原子半径依次减小,同主族元素自上而下原子半径依次增大,原 子半径:Na>Cl>N>H,故 B 错误; C.元素 X 的含氧酸有硝酸和亚硝酸,亚硝酸是弱酸,故 C 错误; 第 13 页(共 27 页) D.Y 的氧化物水化物为氢氧化钠,氢氧化钠是强碱,故 D 正确; 故选:D。 【点评】本题以推断的形式考查了元素周期律、元素周期表,是高频考点,要熟练掌握 周期表的结构,要熟悉常见元素化合物的性质,正确推断出元素后才能做题。 二、非选择题:共 58 分。第 8~10 题为必考题,每个试题考生都必须作答。第 11~12 为 选考题,考生根据要求作答。(一)必考题:共 43 分。 8.(14 分)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如 图装置(部分装置省略)制备 KClO3 和 NaClO,探究其氧化还原性质。 回答下列问题: (1)盛放 MnO2 粉末的仪器名称是 圆底烧瓶 ,a 中的试剂为 饱和食盐水 。 (2)b 中采用的加热方式是 水浴加热 。c 中化学反应的离子方程式是 Cl2+2OH﹣ ClO﹣+Cl﹣+H2O ,采用冰水浴冷却的目的是 避免生成 NaClO3 。 (3)d 的作用是 吸收多余的氯气,防止污染大气 ,可选用试剂 AC (填标号)。 A.Na2S B.NaCl C.Ca(OH)2 D.H2SO4 (4)反应结束后,取出 b 中试管,经冷却结晶, 过滤 , 少量的冷水洗涤 ,干燥 ,得到 KClO3 晶体。 (5)取少量 KClO3 和 NaClO 溶液分别置于 1 号和 2 号试管中,滴加中性 KI 溶液。1 号 试管溶液颜色不变。2 号试管溶液变为棕色,加入 CCl4 振荡,静置后 CCl4 层显 紫 色 。可知该条件下 KClO3 的氧化能力 小于 NaClO(填“大于”或“小于”)。 【分析】实验目的制备 KClO3 和 NaClO,并探究其氧化还原性质; 实验原理:3Cl2+6KOH KClO3+5KCl+3H2O ,第 14 页(共 27 页) Cl2+2NaOH NaClO+NaCl+3H2O; 实验装置:最左侧为制取氯气装置,a 为除杂装置,杂质为挥发的氯化氢和水,后面还要 通入溶液,没有必要除水,所以 a 中用饱和食盐水除氯化氢, 装置 b 用来制取 KClO3,装置 c 用来制取 NaClO,装置 d 用来吸收多余的氯气,防止污 染大气, (1)根据形状和用途判断,盛放 MnO2 粉末的仪器名称是圆底烧瓶,a 为除杂装置,杂 质为挥发的氯化氢和水,所以 a 中用饱和食盐水除氯化氢; (2)根据装置图看出 b 中采用的加热方式是水浴加热;c 中化学反应:Cl2+2NaOH NaClO+NaCl+H2O 改离子方程式,氢氧化钠与氯气反应有多种情况,温度高时 生成 NaClO3 采用冰水浴冷却的目的是提高产品的纯度; (3)d 为尾气处理装置,作用是装置 d 用来吸收多余的氯气,防止污染大气,可选用试 剂可以和氯气反应的物质 Na2S 和 Ca(OH)2; (4)b 试管中的溶质主要是 KClO3,KCl,KClO3 的溶解度受温度影响大,冷却结晶, 析出 KClO3 晶体,经过过滤得到 KClO3 晶体,表面还有 KCl 杂质,通过冷水洗涤减少 KClO3 的损失; (5)取少量 KClO3 和 NaClO 溶液分别置于 1 号和 2 号试管中,滴加中性 KI 溶液,1 号 试管溶液颜色不变,说明 KClO3 没有和 KI 溶液反应,2 号试管溶液变为棕色,说明 NaClO 和 KI 溶液反应生成了碘单质,加入 CCl4 振荡,碘单质易溶解于 CCl4 中,静置后 CCl4 层显紫色。可知该条件下 KClO3 的氧化能力比 NaClO 差。 【解答】解:(1)根据形状和用途判断,盛放 MnO2 粉末的仪器名称是圆底烧瓶,a 为 除杂装置,杂质为挥发的氯化氢和水,后面还要通入溶液,没有必要除水,所以 a 中用 饱和食盐水除氯化氢,a 中的试剂为饱和食盐水; 故答案为:圆底烧瓶;饱和食盐水; (2)根据装置图看出 b 中采用的加热方式是水浴加热;c 中化学反应:Cl2+2NaOH NaClO+NaCl+H2O,改离子方程式:Cl2+2OH﹣ ClO﹣+Cl﹣+H2O,氢氧 化钠与氯气反应有多种情况,温度高时生成 NaClO3.采用冰水浴冷却的目的是提高产品 的纯度; 故答案为:水浴加热;Cl2+2OH﹣ ClO﹣+Cl﹣+H2O;避免生成 NaClO3; 第 15 页(共 27 页) (3)d 为尾气处理装置,作用是装置 d 用来吸收多余的氯气,防止污染大气,可选用试 剂为可以和氯气反应的物质 Na2S 和 Ca(OH)2; 故答案为:吸收多余的氯气,防止污染大气;AC; (4)b 试管中的溶质主要是 KClO3,KCl,KClO3 的溶解度受温度影响大,冷却结晶, 析出 KClO3 晶体,经过过滤得到 KClO3 晶体,表面还有 KCl 杂质,通过冷水洗涤减少 KClO3 的损失; 故答案为:过滤;少量的冷水洗涤; (5)取少量 KClO3 和 NaClO 溶液分别置于 1 号和 2 号试管中,滴加中性 KI 溶液,1 号 试管溶液颜色不变,说明 KClO3 没有和 KI 溶液反应,2 号试管溶液变为棕色,说明 NaClO 和 KI 溶液反应生成了碘单质,加入 CCl4 振荡,碘单质易溶解于 CCl4 中,静置后 CCl4 层显紫色。可知该条件下 KClO3 的氧化能力比 NaClO 差; 故答案为:紫;小于。 【点评】本题是制备实验,以制备 KClO3 和 NaClO,探究其氧化还原性质,考查学生实 验素养和分析问题的能力,难度中等,要有扎实的实验功底和化学学科素养。 9.(15 分)某油脂厂废弃的油脂加氢镍催化剂主要含金属 Ni、Al、Fe 及其氧化物,还有 少量其他不溶性物质。采用如图工艺流程回收其中的镍制备硫酸镍晶体(NiSO4•7H2O ) :溶液中金属离子开始沉淀和完全沉淀的 pH 如下表所示: Ni2+ Al3+ Fe3+ Fe2+ 金属离子 开始沉淀时(c=0.01 mol•L﹣1)的 pH 沉淀完全时(c=1.0×10﹣5mol•L﹣1)的 pH 7.2 8.7 3.7 4.7 2.2 3.2 7.5 9.0 回答下列问题: (1)“碱浸”中 NaOH 的两个作用分别是 除去油脂、溶解铝及其氧化物 。为回收金 ﹣属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式 AlO2 第 16 页(共 27 页) +H++H2O=Al(OH)3↓或[Al(OH)4]﹣+H+=Al(OH)3↓+H2O 。 (2)“滤液②”中含有的金属离子是 Ni2+、Fe2+、Fe3+ 。 (3)“转化”中可替代 H2O2 的物质是 O2 或空气 。若工艺流程改为先“调 pH”后“ 转化”,即 ,“滤液③”中可能含有的杂质离子 为 Fe3+ 。 (4)利用上述表格数据,计算 Ni(OH) 的 Ksp= c(Ni2+)c2(OH﹣)=1.0×10﹣5mol 2•L﹣1×1×10﹣5.3mol/L×1×10﹣5.3mol/L=1×10﹣15.6(mol•L﹣1)3 (列出计算式)。 如果“转化”后的溶液中 Ni2+浓度为 1.0mol•L﹣1,则“调 pH”应控制的 pH 范围是 3.2 ~6.2 。 (5)硫酸镍在强碱溶液中用 NaClO 氧化,可沉淀出能用作镍镉电池正极材料的 NiOOH. 写出该反应的离子方程式 2Ni2++ClOˉ+4OHˉ=2NiOOH↓+Clˉ+H2O 。 (6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是 提高镍的回收率 。 【分析】由工艺流程分析可得,向废镍催化剂中加入 NaOH 溶液进行碱浸,可除去油脂, 并发生反应 2Al+2NaOH+2H2O=2NaAlO2+3H2↑、Al2O3+2NaOH=2NaAlO2+H2O 将 Al 及其氧化物溶解,得到的滤液①含有 NaAlO2,滤饼①为 Ni、Fe 及其氧化物和少量其他 不溶性杂质,加稀 H2SO4 酸浸后得到含有 Ni2+、Fe2+、Fe3+的滤液②,Fe2+经 H2O2 氧化 为 Fe3+后,加入 NaOH 调节 pH 使 Fe3+转化为 Fe(OH)3 沉淀除去,再控制 pH 浓缩结 晶得到硫酸镍的晶体,据此分析解答问题。 【解答】解:(1)根据分析可知,向废镍催化剂中加入 NaOH 溶液进行碱浸,可除去油 脂,并将 Al 及其氧化物溶解,滤液①中含有 NaAlO2(或 Na[Al(OH)4]),加入稀硫 酸可发生反应 AlO2﹣+H++H2O=Al(OH)↓或[Al(OH)]﹣+H+=Al(OH)↓+H2O; 343故答案为:除去油脂、溶解铝及其氧化物;AlO2﹣+H++H2O=Al(OH)3↓或[Al(OH) 4]﹣+H+=Al(OH)3↓+H2O; (2)加入稀硫酸酸浸,Ni、Fe 及其氧化物溶解,所以“滤液②”中含有的金属离子是 Ni2+ 、Fe2+、Fe3+, 故答案为:Ni2+、Fe2+、Fe3+; (3)“转化”中 H2O2 的作用是将 Fe2+氧化为 Fe3+,不能引入杂质,可用 O2 或空气替 第 17 页(共 27 页) 代;若将工艺流程改为先“调 pH”后“转化”,会使调 pH 过滤后的溶液中含有 Fe2+、 则滤液③中可能含有转化生成的 Fe3+; 故答案为:O2 或空气;Fe3+; (4)由上述表格可知,Ni2+完全沉淀时的 pH=8.7,此时 c(Ni2+)=1.0×10﹣5mol•L﹣ 1,c(H+)=1.0×10﹣8.7mol•L﹣1,则 c(OH﹣)= ==1×10﹣ 5.3mol/L,则 Ni(OH)2 的 Ksp=c(Ni2+)c2(OH﹣)=1.0×10﹣5mol•L﹣1×1×10﹣ 5.3mol/L×1×10﹣5.3mol/L=1×10﹣15.6(mol•L﹣1)3.如果“转化”后的溶液中 Ni2+浓 度为 1.0mol•L﹣1,为避免镍离子沉淀,Ksp=c(Ni2+)c2(OH﹣),c2(OH﹣)= 3=1×10﹣15.6(mol•L﹣1) ,此时 c(OH﹣)=1×10﹣7.8mol•L﹣1,则 c(H+) =1.0×10﹣6.2mol•L﹣1,即 pH=6.2;Fe3+完全沉淀的 pH 为 3.2,因此“调节 pH”应控 制的 pH 范围是 3.2~6.2; 故答案为:c(Ni2+)c2(OH﹣)=1.0×10﹣5mol•L﹣1×1×10﹣5.3mol/L×1×10﹣5.3mol/L =1×10﹣15.6;3.2~6.2; (5)由题干信息,硫酸镍在强碱中被 NaClO 氧化得到 NiOOH 沉淀,即反应中 Ni2+被氧 化为 NiOOH 沉淀,ClOˉ被还原为 Clˉ,则根据氧化还原得失电子守恒可得离子方程式 为 2Ni2++ClOˉ+4OHˉ=2NiOOH↓+Clˉ+H2O; 故答案为:2Ni2++ClOˉ+4OHˉ=2NiOOH↓+Clˉ+H2O; (6)分离出硫酸镍晶体后的母液中还含有 Ni2+,可将其收集、循环使用,从而提高镍的 回收率; 故答案为:提高镍的回收率。 【点评】本题以化学工艺流程为背景,考查物质的分离提纯,离子反应、氧化还原反应、 沉淀平衡常数的计算等知识点,是近年高考的热点题型,属于学科内综合题,考查分析 问题能力、提取利用题目信息能力,计算能力、表达能力等,难度中等,注意(4)中 Ni2+ 开始沉淀的 pH 不能直接利用表中数据,要通过计算获得。 10.(14 分)二氧化碳催化加氢合成乙烯是综合利用 CO2 的热点研究领域。回答下列问题: (1)CO2 催化加氢生成乙烯和水的反应中,产物的物质的量之比 n(C2H4):n(H2O)= 1:4 。当反应达到平衡时,若增大压强,则 n(C2H4) 变大 (填“变大”“变小” 或“不变”)。 第 18 页(共 27 页) (2)理论计算表明。原料初始组成 n(CO2):n(H2)=1:3,在体系压强为 0.1MPa, 反应达到平衡时,四种组分的物质的量分数 x 随温度 T 的变化如图所示。图中,表示 C2H4 、CO2 变化的曲线分别是 d 、 c 。 CO2 催化加氢合成 C2H4 反应的△H 小于 0 ( 填“大于”或“小于”)。 ( 3 ) 根 据 图 中 点A ( 440K , 0.39 ) , 计 算 该 温 度 时 反 应 的 平 衡 常 数Kp = (MPa)﹣3(列出计算式。以分压表示,分压=总压×物质的量分数 )。 (4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成 C3H6、C3H8、C4H8 等低碳 烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当 选择合适的催化 剂 。 【分析】(1)根据质量守恒定律配平化学方程式,可以确定产物的物质的量之比。根据 可逆反应的特点分析增大压强对化学平衡的影响; (2)原料初始组成 n(CO2):n(H2)=1:3,根据方程式,生成物乙烯与水物质的量 之比为 1:4,从图中找到关键数据确定代表各组分的曲线; 根据图中代表各组分的曲线随温度变化的趋势,确定该反应是放热反应还是吸热反应; (3)原料初始组成 n(CO2):n(H2)=1:3,在体系压强为 0.1Mpa 建立平衡,由 A 点坐标可知,该温度下,氢气和水的物质的量分数均为 0.39,生成物乙烯与水物质的量 之比为 1:4,求出乙烯、二氧化碳的物质的量分数,结合化学平衡常数公式计算; (4)根据催化剂对化反应速率的影响和对主反应的选择性,工业上通常要选择合适的催 化剂以提高化学反应速率、减少副反应的发生。 【解答】解:(1)CO2 催化加氢生成乙烯和水,该反应的化学方程式可表示为 第 19 页(共 27 页) 2CO2+6H2⇌CH2=CH2+4H2O, 则该反应中产物的物质的量之比 n(C2H4):n(H2O)=1:4; 由于该反应是气体分子数减少的反应,当反应达到平衡状态时,若增大压强,则化学平 衡向正反应方向移动,n(C2H4)变大, 故答案为:1:4;变大; (2)由题中信息可知,两反应物初始投料之比等于化学计量数之比;由图中曲线的起点 坐标可知,c 和 a 所表示的物质的物质的量分数之比为 1:3、d 和 b 表示的物质的物质的 量分数之比为 1:4,则结合化学计量数之比可以判断,表示乙烯变化的曲线是 d,表示 二氧化碳变化曲线的是 c; 由图中曲线的变化趋势可知,升高温度,乙烯的物质的量分数减小,则化学平衡向逆反 应方向移动,则该反应为放热反应,△H 小于 0, 故答案为:d;c;小于; (3)原料初始组成 n(CO2):n(H2)=1:3,在体系压强为 0.1Mpa 建立平衡,由 A 点坐标可知,该温度下,氢气和水的物质的量分数均为 0.39,则乙烯的物质的量分数为 水的四分之一,即乙烯的物质的量分数为 之一,即二氧化碳的物质的量分数为 ,二氧化碳的物质的量分数为氢气的三分 ,Kp ===(MPa)﹣3 ,故答案为: ;(4)工业上通常通过选择合适催化剂,以加快化学反应速率,同时还可以提高目标产品 的选择性,减少副反应的发生。因此,一定温度和压强下,为了提高反应速率和乙烯的 选择性,应当选择合适的催化剂, 故答案为:选择合适的催化剂。 【点评】本题考查化学平衡相关知识,侧重考查学生分析能力、识图能力和计算能力, 确定图中曲线所代表的化学物质是难点,其关键在于明确物质的量的分数之比等于各组 分的物质的量之比,也等于化学计量数之比(在初始投料之比等于化学计量数之比的前 提下,否则不成立),此题难度较大。 第 20 页(共 27 页) (二)选考题:共 15 分。请考生从 2 道化学题中任选一题作答。如果多做,则按所做的第 一题计分。[化学–选修 3:物质结构与性质](15 分) 11.(15 分)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料 。回答下列问题: (1)H、B、N 中,原子半径最大的是 B 。根据对角线规则,B 的一些化学性质与元 素 Si 的相似。 (2)NH3BH3 分子中,N﹣B 化学键称为 配位 键,其电子对由 N 提供。氨硼烷在 催化剂作用下水解释放氢气: +3NH3BH3+6H2O═3NH4 +B3O63﹣+9H2 B3O63﹣的结构为 为 sp2 。 .在该反应中,B 原子的杂化轨道类型由 sp3 变 (3)NH3BH3 分子中,与 N 原子相连的 H 呈正电性(Hδ+),与 B 原子相连的 H 呈负 电性(Hδ﹣),电负性大小顺序是 N>H>B 。与 NH3BH3 原子总数相等的等电子体 是 CH3CH3 (写分子式),其熔点比 NH3BH3 低 (填“高”或“低”),原因是 在 NH3BH3 分子之间,存在 Hδ+与 Hδ﹣的静电引力 作用,也称“双氢键”。 (4)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为 apm、bpm、 cpm,α=β=γ=90°.氨硼烷的 2×2×2 超晶胞结构如图所示。氨硼烷晶体的密度 ρ= g•cm﹣3(列出计算式,设 NA 为阿伏加德罗常数的值)。 【分析】根据元素在周期表中的位置比较和判断元素的相关性质;根据中心原子的价层 电子对数确定其杂化轨道的类型;运用等量代换的方法寻找等电子体;根据电负性对化 第 21 页(共 27 页) 合价的影响比较不同元素的电负性;根据晶胞的质量和体积求晶体的密度。 【解答】解:(1)在所有元素中,H 原子的半径是最小的,同一周期从左到右,原子半 径依次减小,所以,H、B、N 中原子半径最大是 B.B 与 Si 在元素周期表中处于对角线 的位置,根据对角线规则,B 的一些化学性质与 Si 元素相似。 故答案为:B;Si。 (2)B 原子最外层有 3 个电子,其与 3 个 H 原子形成共价键后,其价层电子对只有 3 对 ,还有一个空轨道;在 NH3 中,N 原子有一对孤对电子,故在 NH3BH3 分子中,N﹣B 键为配位键,其电子对由 N 原子提供。NH3BH3 分子中,B 原子的价层电子对数为 4,故 其杂化方式为 sp3.NH3BH3 在催化剂的作用下水解生成氢气和 B3O63﹣,由图中信息可 知,B3O63﹣中每个 B 原子只形成 3 个σ键,其中的 B 原子的杂化方式为 sp2,因此,B 原子的杂化轨道类型由 sp3 变为 sp2。 故答案为:配位、N、sp3、sp2。 (3)NH3BH3 分子中,与 N 原子相连的 H 呈正电性,说明 N 的电负性大于 H;与 B 原 子相连的 H 呈负电性,说明 H 的电负性大于 B,因此 3 种元素电负性由大到小的顺序为 N>H>B.NH3BH3 分子中有 8 个原子,其价电子总数为 14,N 和 B 的价电子数的平均 值为 4,依据等量代换的原则,可以找到其等电子体为 CH3CH3.由于 NH3BH3 分子属于 极性分子,而 CH3CH3 属于非极性分子,两者相对分子质量接近,但是极性分子的分子 间作用力较大,故 CH3CH3 熔点比 NH3BH3 低。NH3BH3 分子间存在“双氢键”,类比 氢键的形成原理,说明其分子间存在 Hδ+与 Hδ﹣的静电引力。 故答案为:N>H>B、CH3CH3、低、Hδ+与 Hδ﹣的静电引力。 (4)在氨硼烷的 2×2×2 的超晶胞结构中,共有 16 个氨硼烷分子,晶胞的长、宽、高 分别为 2apm、2bpm、2cpm,若将其平均分为 8 份可以得到 8 个小长方体,则平均每个 小长方体中占有 2 个氨硼烷分子,小长方体的长、宽、高分别为 apm、bpm、cpm,则小 长方体的质量为 ,小长方体的体积为 abc×10﹣30cm﹣3,因此,氨硼烷晶体的密 度为 。故答案为: 。第 22 页(共 27 页) 【点评】本题最后有关晶体密度的计算是难点,要求考生能读懂题意,通过观察晶胞结 构,确定超晶胞结构中的分子数,并能合理分成 8 份,从而简化计算。 [化学–选修 5:有机化学基础](15 分) 12.苯基环丁烯酮( PCBO)是一种十分活泼的反应物,可利用它的开环 反应合成一系列多官能团化合物。近期我国科学家报道用 PCBO 与醛或酮发生[4+2]环加 成反应,合成了具有生物活性的多官能团化合物(E),部分合成路线如图: 已知如下信息: 回答下列问题: (1)A 的化学名称是 2﹣羟基苯甲醛 。 (2)B 的结构简式为 。 (3)由 C 生成 D 所用的试剂和反应条件为 乙醇、浓硫酸/加热 ;该步反应中,若反 应温度过高,C 易发生脱羧反应,生成分子式为 C8H8O2 的副产物,该副产物的结构简式 为 。 第 23 页(共 27 页) (4)写出化合物 E 中含氧官能团的名称 羟基、酯基 ;E 中手性碳(注:连有四个不 同的原子或基团的碳)的个数为 2 。 (5)M 为 C 的一种同分异构体。已知:1mol M 与饱和碳酸氢钠溶液充分反应能放出 2mol 二氧化碳;M 与酸性高锰酸钾溶液反应生成对苯二甲酸。M 的结构简式为 。 (6)对于 ,选用不同的取代基 R’,在催化剂作用下与 PCBO 发生的[4+2] 反应进行深入研究,R’对产率的影响见下表: R’ ﹣CH3 ﹣C2H5 ﹣CH2CH2C6H5 产率/% 91 80 63 请找出规律,并解释原因 随着 R′体积增大,产率降低;原因是 R′体积增大,位阻 增大 。 【分析】根据合成路线分析可知,A( )与 CH3CHO 在 NaOH 的水溶液 中 发 生 题 给 的 已 知 反 应 , 生 成B ( ) , B 与 KMnO4 反 应 , 被 氧 化 后 再 酸 化 得 到C ( 第 24 页(共 27 页) ),C 再与 CH3CH2OH 在浓 H2SO4 加热条件下,发生酯化反 应得 D( ),D 再与苯基环丁烯酮( PCBO) 反应得到 E( ),据此分析。 【解答】解:(1)A 的结构简式为: ,醛基所连的碳为“1”号碳,羟 基相连的碳为“2”号碳,所以名称为 2﹣羟基苯甲醛(或水杨醛), 故答案为:2﹣羟基苯甲醛(或水杨醛); (2)根据上述分析可知,B 的结构简式为: ,故答案为: ;(3)C( )与 CH3CH2OH 在浓 H2SO4 加热的条件下,发生酸 脱羟基醇脱氢的酯化反应得到 D( ),即所用试剂为乙醇、 第 25 页(共 27 页) 浓硫酸,反应条件为加热;在该步反应中,若反应温度过高,根据副产物的分子式 C8H8O2 可知,C( )发生脱羧反应生成 ,故答案为:乙醇、浓硫酸/加热; (4)化合物 E 的结构简式为: ,分子中的含氧官能团为 : 羟 基 和 酯 基 , E 中 手 性 碳 原 子 共 有 位 置 为 的2 个 手 性 碳 , 如 图 所 示 : ,故答案为:羟基、酯基;2; (5)M 为 C( )的一种同分异构体,1molM 与饱和 NaHCO3 溶液反应能放出 2molCO2,则 M 中含有两个羧基(﹣COOH),M 又与酸性高锰酸钾溶 液生成对二苯甲酸,所以 M 分子苯环上只有两个取代基且处于对位,则 M 的结构简式 为: ,故答案为: ;第 26 页(共 27 页) (6)由表格数据分析可得到规律,随着取代基 R′体积的增大,产物的产率降低,出现 此规律的原因可能是因为 R′体积增大,从而位阻增大,导致产率降低, 故答案为:随着 R′体积增大,产率降低;原因是 R′体积增大,位阻增大。 【点评】本题考查学生对有机化学基础的理解和掌握,题目难度中等,掌握有机的命名、反 应条件、官能团名称、手性碳、同分异构等,明确由手性碳及同分异构的书写是解题关键。 同时考查了阅读题目获取新信息的能力,需要学生具备扎实的基础与综合运用知识、信息分 析解决问题能力。 第 27 页(共 27 页)
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





