
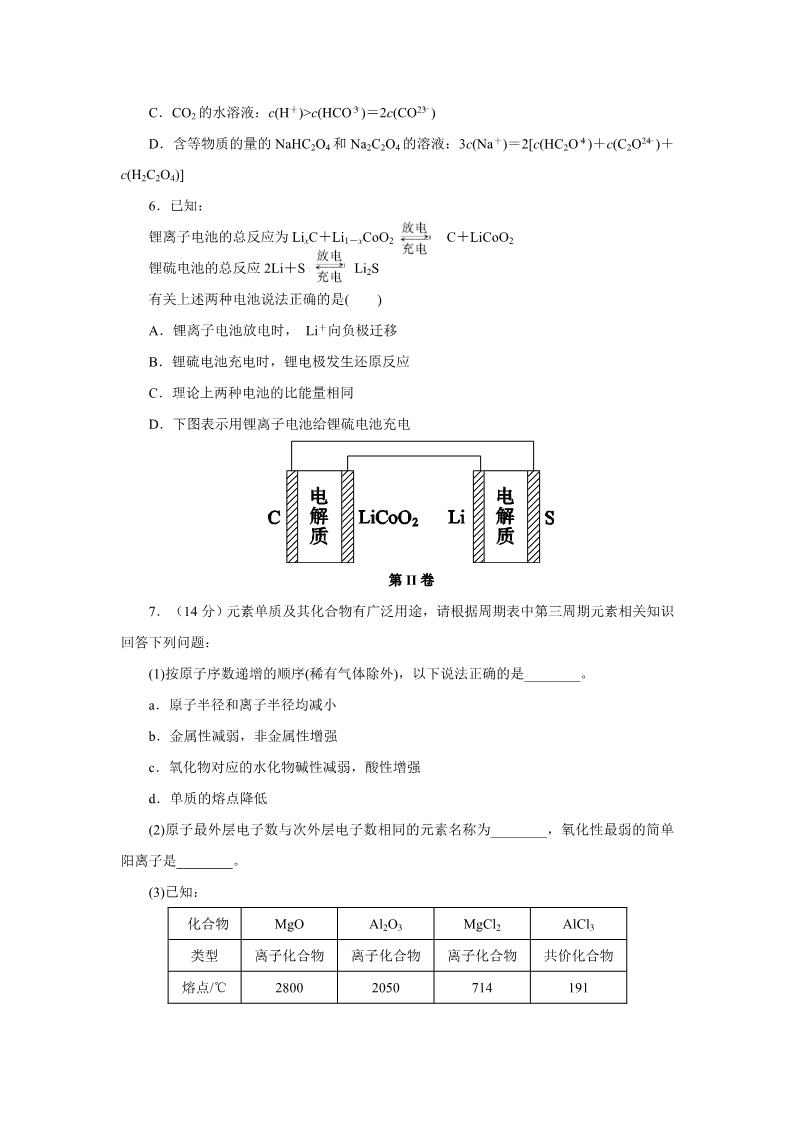
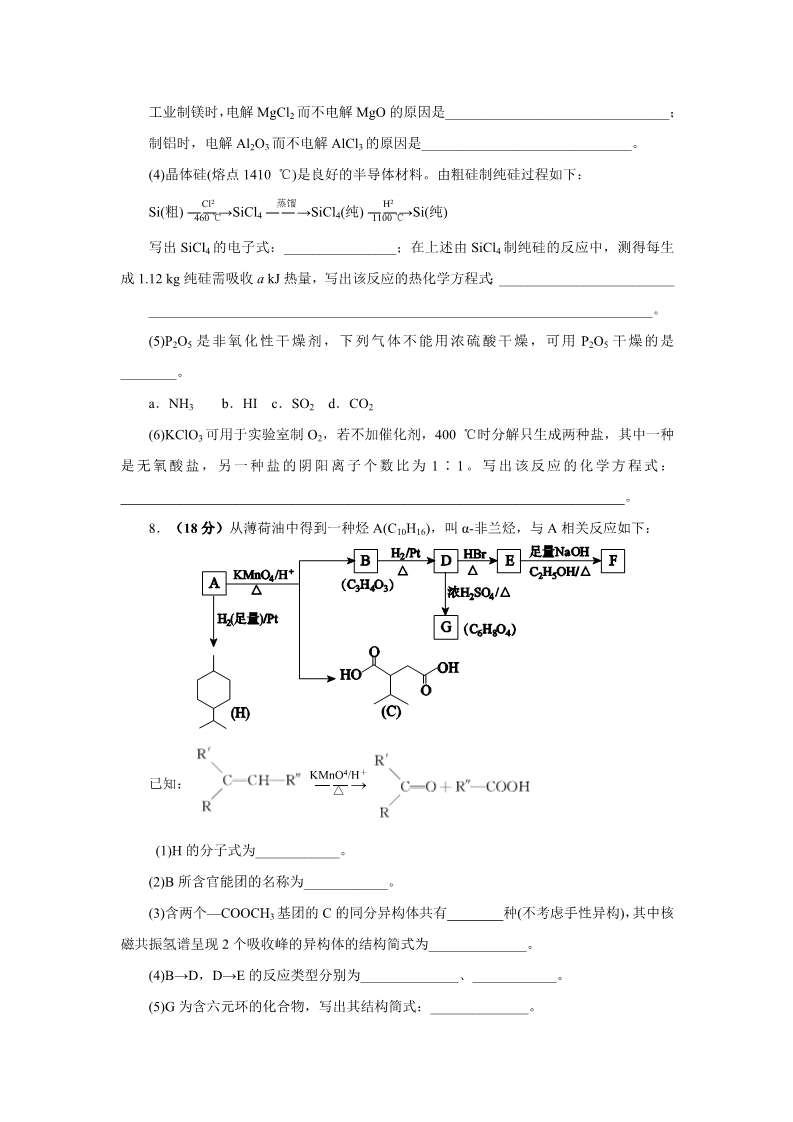
 2014 年天津高考理综化学试题含答案 WORD 一、单项选择题 1.化学与生产、生活息息相关,下列叙述错误的是( ) A.铁表面镀锌可增强其抗腐蚀性 B.用聚乙烯塑料代替聚乳酸塑料可减少白色污染 C.大量燃烧化石燃料是造成雾霾天气的一种重要因素 D.含重金属离子的电镀废液不能随意排放 2.实验室制备下列气体时,所用方法正确的是( ) A.制氧气时,用 Na2O2 或 H2O2 作反应物可选择相同的气体发生装置 B.制氯气时,用饱和 NaHCO3 溶液和浓硫酸净化气体 C.制乙烯时,用排水法或向上排空气法收集气体 D.制二氧化氮时,用水或 NaOH 溶液吸收尾气 3.运用相关化学知识进行判断,下列结论错误的是( ) A.某吸热反应能自发进行,因此该反应是熵增反应 B.NH4F 水溶液中含有 HF,因此 NH4F 溶液不能存放于玻璃试剂瓶中 C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成 H2 的速率 4.对下图两种化合物的结构或性质描述正确的是( ) A.不是同分异构体 B.分子中共平面的碳原子数相同 C.均能与溴水反应 D.可用红外光谱区分,但不能用核磁共振氢谱区分 5.下列有关电解质溶液中粒子浓度关系正确的是( ) -A.pH=1 的 NaHSO4 溶液:c(H+)=c(SO24 )+c(OH-) B.含有 AgCl 和 AgI 固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) -C.CO2 的水溶液:c(H+)>c(HCO-3 )=2c(CO23 )D.含等物质的量的 NaHC2O4 和 Na2C2O4 的溶液:3c(Na+)=2[c(HC2O-4 )+c(C2O24 )+ -c(H2C2O4)] 6.已知: 锂离子电池的总反应为 LixC+Li1-xCoO2 C+LiCoO2 锂硫电池的总反应 2Li+S Li2S 有关上述两种电池说法正确的是( ) A.锂离子电池放电时, Li+向负极迁移 B.锂硫电池充电时,锂电极发生还原反应 C.理论上两种电池的比能量相同 D.下图表示用锂离子电池给锂硫电池充电 第 II 卷 7.(14 分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识 回答下列问题: (1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。 a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强 c.氧化物对应的水化物碱性减弱,酸性增强 d.单质的熔点降低 (2)原子最外层电子数与次外层电子数相同的元素名称为________,氧化性最弱的简单 阳离子是________。 (3)已知: 化合物 类型 MgO 离子化合物 2800 Al2O3 离子化合物 2050 MgCl2 离子化合物 714 AlCl3 共价化合物 191 熔点/℃ 工业制镁时,电解 MgCl2 而不电解 MgO 的原因是________________________________; 制铝时,电解 Al2O3 而不电解 AlCl3 的原因是______________________________。 (4)晶体硅(熔点 1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下: Cl2 H2 馏蒸SiCl 4 ――→ Si(粗) SiCl (纯) Si(纯) ――→ ――→ 4460 ℃ 1100 ℃ 写出 SiCl4 的电子式:________________;在上述由 SiCl4 制纯硅的反应中,测得每生 成 1.12 kg 纯硅需吸收 a kJ 热量,写出该反应的热化学方程式:_________________________ ________________________________________________________________________。 (5)P2O5 是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用 P2O5 干燥的是 ________。 a.NH3 b.HI c.SO2 d.CO2 (6)KClO3 可用于实验室制 O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种 是 无 氧 酸 盐 , 另 一 种 盐 的 阴 阳 离 子 个 数 比 为1 ∶ 1 。 写 出 该 反 应 的 化 学 方 程 式 : ________________________________________________________________________。 8.(18 分)从薄荷油中得到一种烃 A(C10H16),叫 α-非兰烃,与 A 相关反应如下: KMnO4/H+ ――△ → 已知: (1)H 的分子式为____________。 (2)B 所含官能团的名称为____________。 (3)含两个—COOCH3 基团的 C 的同分异构体共有________种(不考虑手性异构),其中核 磁共振氢谱呈现 2 个吸收峰的异构体的结构简式为______________。 (4)B→D,D→E 的反应类型分别为______________、____________。 (5)G 为含六元环的化合物,写出其结构简式:______________。 (6)F 在一定条件下发生聚合反应可得到一种高吸水性树脂,该树脂名称为___________。 (7)写出 E→F 的化学反应方程式:_________________________。 (8)A 的结构简式为____________,A 与等物质的量的 Br2 进行加成反应的产物共有 ________种(不考虑立体异构)。 9.(18 分)Na2S2O3 是重要的化工原料,易溶于水,在中性或碱性环境中稳定。 Ⅰ.制备 Na2S2O3·5H2O △===== 反应原理:Na SO (aq)+S(s) Na S O (aq) 2 23 23实验步骤: ①称取 15 g Na2SO3 加入圆底烧瓶中,再加入 80 mL 蒸馏水。另取 5 g 研细的硫粉,用 3 mL 乙醇润湿,加入上述溶液中。 ②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸 60 min。 ③趁热过滤,将滤液水浴加热浓缩,冷却析出 Na2S2O3·5H2O,经过滤、洗涤、干燥, 得到产品。 回答问题: (1)硫粉在反应前用乙醇润湿的目的是__________________________。 (2)仪器 a 的名称是________,其作用是____________________。 (3)产品中除了有未反应的 Na2SO3 外,最可能存在的无机杂质是______________。检验 是否存在该杂质的方法是____________________________。 (4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因: ________________________________________________________________________ ________________________________________________________________________。 Ⅱ.测定产品纯度 准确称取 W g 产品,用适量蒸馏水溶解,以淀粉作指示剂,用 0.100 0 mol·L-1 碘的标 准溶液滴定。 --反应原理为 2S2O23 +I2===S4O26 +2I- (5)滴定至终点时,溶液颜色的变化:________________________________。 (6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为__________mL。产品 的纯度为(设 Na2S2O3·5H2O 相对分子质量为 M)______________。 Ⅲ.Na2S2O3 的应用 -(7)Na2S2O3 还原性较强,在溶液中易被 Cl2 氧化成 SO24 ,常用作脱氯剂,该反应的离子 方程式为____________________________________________。 10 . 合 成 氨 是 人 类 科 学 技 术 上 的 一 项 重 大 突 破 , 其 反 应 原 理 为N2(g) + 3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下: (1)天然气中的 H2S 杂质常用氨水吸收,产物为 NH4HS。一定条件下向 NH4HS 溶液中 通 入 空 气 , 得 到 单 质 硫 并 使 吸 收 液 再 生 , 写 出 再 生 反 应 的 化 学 方 程 式 : ________________________________________________________________________。 (2)步骤Ⅱ中制氢气的原理如下: ①CH4(g)+H2O(g) ②CO(g)+H2O(g) CO(g)+3H2(g) CO2(g)+H2(g) ΔH=+206.4 kJ·mol-1 ΔH=-41.2 kJ·mol-1 对于反应①,一定可以提高平衡体系中 H2 的百分含量,又能加快反应速率的措施是 ____________。 a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强 利用反应②,将 CO 进一步转化,可提高 H2 的产量。若 1 mol CO 和 H2 的混合气体(CO 的体积分数为 20%)与 H2O 反应,得到 1.18 mol CO、CO2 和 H2 的混合气体,则 CO 的转化 率为____________。 (3)图(a)表示 500 ℃、60.0 MPa 条件下,原料气投料比与平衡时 NH3 体积分数的关系。 根据图中 a 点数据计算 N2 的平衡体积分数:____________。 (4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内, 从通入原料气开始,随温度不断升高,NH3 物质的量变化的曲线示意图。 (a) (b) (5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。 简述本流程中提高合成氨原料总转化率的方法: ________________________________________________________________________。 2014 年天津高考理综化学试题含答案 WORD 一、单项选择题 1.化学与生产、生活息息相关,下列叙述错误的是( ) A.铁表面镀锌可增强其抗腐蚀性 B.用聚乙烯塑料代替聚乳酸塑料可减少白色污染 C.大量燃烧化石燃料是造成雾霾天气的一种重要因素 D.含重金属离子的电镀废液不能随意排放 【答案】B 【解析】A、锌的化学性质活泼,铁表面镀锌,铁被保护,A 项正确 B、;聚乳酸塑料 易降解,而聚乙烯塑料难降解,是产生白色污染的主要污染物,B 项错误;C、化石燃料燃 烧时生成大量的二氧化碳,同时生成一氧化碳、二氧化硫等有害气体,还能产生大量的粉 尘等有害颗粒物,故大量燃烧化石燃料是造成雾霾天气的一种重要因素,C 项正确;D、含 重金属离子的电镀废液随意排放会造成水体污染,D 项正确。 2.实验室制备下列气体时,所用方法正确的是( ) A.制氧气时,用 Na2O2 或 H2O2 作反应物可选择相同的气体发生装置 B.制氯气时,用饱和 NaHCO3 溶液和浓硫酸净化气体 C.制乙烯时,用排水法或向上排空气法收集气体 D.制二氧化氮时,用水或 NaOH 溶液吸收尾气 【答案】A 【解析】A、用 Na2O2 和水反应制取氧气,与用在 MnO2 催化下分解 H2O2 制取氧气的 发生装置相同,A 项正确;B、饱和 NaHCO3 溶液显碱性,能与氯气反应,B 项错误;C、 相同条件下,乙烯的密度与空气的密度相差不大,故不能用排空气法收集乙烯,C 项错误; D、NO2 与水发生反应 3NO2+H2O===2HNO3+NO,产生的 NO 仍是有毒气体,故不能用 水吸收含 NO2 的尾气,D 项错误。 3.运用相关化学知识进行判断,下列结论错误的是( ) A.某吸热反应能自发进行,因此该反应是熵增反应 B.NH4F 水溶液中含有 HF,因此 NH4F 溶液不能存放于玻璃试剂瓶中 C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成 H2 的速率 【答案】D 【解析】A、当 ΔH-TΔS<0 时,反应能自发进行,吸热反应的 ΔH>0,吸热反应能 自发,说明 ΔS>0,A 项正确;B、NH4F 溶液中 F-水解生成 HF,HF 能与玻璃中的 SiO2 发生反应 4HF+SiO2===SiF4↑+2H2O,故 NH4F 溶液不能存放在玻璃试剂瓶中,B 项正确; C、可燃冰需在低温高压下形成,所以可燃冰可存在于海底,C 项正确;D、常温下,浓硫 酸使铁发生钝化,D 项错误。 4.对下图两种化合物的结构或性质描述正确的是( ) A.不是同分异构体 B.分子中共平面的碳原子数相同 C.均能与溴水反应 D.可用红外光谱区分,但不能用核磁共振氢谱区分 【答案】C 【解析】A、两种有机物的分子式均为 C10H14O,但结构不同,故二者互为同分异构体, A 项错误;B、第一种有机物分子中含有苯环,而第二种有机物分子中不含苯环,显然前者 分子中共面的碳原子比后者分子中共面碳原子多,B 项错误;C、第一种有机物分子中含有 酚羟基,能与浓溴水发生取代反应,第二种有机物分子中含有碳碳双键,能与溴水发生加 成反应,C 项正确;D、两种有机物分子中的氢原子的化学环境不尽相同,故可用核磁共振 氢谱区分,D 项错误。 5.下列有关电解质溶液中粒子浓度关系正确的是( ) -A.pH=1 的 NaHSO4 溶液:c(H+)=c(SO24 )+c(OH-) B.含有 AgCl 和 AgI 固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) -C.CO2 的水溶液:c(H+)>c(HCO-3 )=2c(CO23 )D.含等物质的量的 NaHC2O4 和 Na2C2O4 的溶液:3c(Na+)=2[c(HC2O-4 )+c(C2O24 )+ -c(H2C2O4)] 【答案】A 【解析】A、由溶液中的电荷守恒得:c(Na+)+c(H+)=2c(SO24 )+c(OH-),又因 ---NaHSO4 溶液中 c(Na+)=c(SO24 ),所以 c(H+)=c(SO24 )+c(OH-),A 项正确;B、因 Ksp(AgCl)>Ksp(AgI),所以含有 AgCl 和 AgI 固体的悬浊液中 c(Cl-)>c(I-),B 项错误;C、 CO2 的水溶液中存在电离平衡:H2CO3 H++HCO-3 、HCO-3 H++CO2-3 ,因第一 步电离的程度远大于第二步电离的程度,故溶液中 c(HCO-3 )远大于 2c(CO23-),C 项错误; D、根据物料守恒得:2c(Na+)=3[c(HC2O-4 )+c(C2O2-4 )+c(H2C2O4)],故 D 项错误。 6.已知: 锂离子电池的总反应为 LixC+Li1-xCoO2 锂硫电池的总反应 2Li+S Li2S C+LiCoO2 有关上述两种电池说法正确的是( ) A.锂离子电池放电时, Li+向负极迁移 B.锂硫电池充电时,锂电极发生还原反应 C.理论上两种电池的比能量相同 D.下图表示用锂离子电池给锂硫电池充电 【答案】B 【解析】A、电池工作时,阳离子(Li+)向正极迁移,A 项错误;B、锂硫电池充电时, 锂电极上发生 Li+得电子生成 Li 的还原反应,B 项正确;C、两种电池负极材料不同,故 理论上两种电池的比能量不相同,C 项错误;D、根据电池总反应知,生成碳的反应是氧化 反应,因此碳电极作电池的负极,而锂硫电池中单质锂作电池的负极,给电池充电时,电 池负极应接电源负极,即锂硫电池的锂电极应与锂离子电池的碳电极相连,D 项错误。 第 II 卷 7.(14 分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识 回答下列问题: (1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。 a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强 c.氧化物对应的水化物碱性减弱,酸性增强 d.单质的熔点降低 (2)原子最外层电子数与次外层电子数相同的元素名称为________,氧化性最弱的简单 阳离子是________。 (3)已知: 化合物 类型 MgO 离子化合物 2800 Al2O3 离子化合物 2050 MgCl2 离子化合物 714 AlCl3 共价化合物 191 熔点/℃ 工业制镁时,电解 MgCl2 而不电解 MgO 的原因是________________________________; 制铝时,电解 Al2O3 而不电解 AlCl3 的原因是______________________________。 (4)晶体硅(熔点 1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下: Cl2 H2 馏蒸SiCl 4 ――→ Si(粗) SiCl (纯) Si(纯) ――→ ――→ 4460 ℃ 1100 ℃ 写出 SiCl4 的电子式:________________;在上述由 SiCl4 制纯硅的反应中,测得每生 成 1.12 kg 纯硅需吸收 a kJ 热量,写出该反应的热化学方程式:_________________________ ________________________________________________________________________。 (5)P2O5 是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用 P2O5 干燥的是 ________。 a.NH3 b.HI c.SO2 d.CO2 (6)KClO3 可用于实验室制 O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种 是 无 氧 酸 盐 , 另 一 种 盐 的 阴 阳 离 子 个 数 比 为1 ∶ 1 。 写 出 该 反 应 的 化 学 方 程 式 : ________________________________________________________________________。 【答案】(14 分) (1)b (2)氩 Na+(或钠离子) (3)MgO 的熔点高,熔融时耗费更多能源,增加生产成本 态难导电 AlCl3 是共价化合物,熔融 1100 ℃ (4) SiCl (g)+2H (g) Si(s)+4HCl(g) ΔH=+0.025a kJ·mol-1 ===== 42(5)b 400 ℃ 3 ===== (6)4KClO KCl+3KClO 4【解析】(1)除稀有气体外,第三周期元素随原子序数的递增原子半径逐渐减小,而离 子半径不一定减小,如 r(Na+)<r(Cl-),a 错误;同一周期的主族元素随原子序数的递增, 金属性减弱,非金属性增强,b 正确;同周期主族元素从左至右,最高价氧化物对应的水化 物碱性减弱,酸性增强,c 错误;单质的熔点不一定降低,如 Na 的熔点低于 Mg、Al 等的 熔点,d 错误。(2)第三周期元素的原子核外有三个电子层,次外层电子数为 8,故该元素原 子最外层的电子数也为 8,该元素为氩;简单离子的氧化性越弱,对应单质的还原性越强, 元素的金属性越强,第三周期中金属性最强的元素是 Na,因此 Na+的氧化性最弱。(3)由题 给数据表知,MgO 的熔点比 MgCl2 的熔点高,MgO 熔融时耗费更多能源,增加成本;AlCl3 是共价化合物,熔融态时不电离,难导电,故冶炼铝不能用电解 AlCl3 的方法。(4)SiCl4 属 于共价化合物,其电子式为 ;由 SiCl4 制纯硅的化学方程式为 SiCl4(l)+2H2(g) 1100 ℃ ===== Si(s)+4HCl(g),生成 1.12 kg 即 40 mol 纯硅吸收 a kJ 热量,则生成 1 mol 纯硅需吸 收 0.025a kJ 热量。(5)NH3 是碱性气体,既不能用浓硫酸干燥,也不能用 P2O5 干燥;HI 是 具有还原性的酸性气体,可用 P2O5 干燥,但不能用浓硫酸干燥;SO2、CO2 既能用浓硫酸 干燥,又能用 P2O5 干燥,综上分析,正确答案为 b。(6)KClO3(Cl 的化合价为+5 价)受热 分解生成的无氧酸盐是 KCl,另一含氧酸盐中氯元素的化合价必须比+5 价高,可能为+6 价或+7 价,若为+6 价,形成的盐中阴阳离子个数比不可能为 1∶1,只能是+7 价,故该 含氧酸盐为 KClO4,据此可写出该反应的化学方程式。 8.(18 分)从薄荷油中得到一种烃 A(C10H16),叫 α-非兰烃,与 A 相关反应如下: KMnO4/H+ ――△ → 已知: (1)H 的分子式为____________。 (2)B 所含官能团的名称为____________。 (3)含两个—COOCH3 基团的 C 的同分异构体共有________种(不考虑手性异构),其中核 磁共振氢谱呈现 2 个吸收峰的异构体的结构简式为______________。 (4)B→D,D→E 的反应类型分别为______________、____________。 (5)G 为含六元环的化合物,写出其结构简式:______________。 (6)F 在一定条件下发生聚合反应可得到一种高吸水性树脂,该树脂名称为___________。 (7)写出 E→F 的化学反应方程式:_________________________。 (8)A 的结构简式为____________,A 与等物质的量的 Br2 进行加成反应的产物共有 ________种(不考虑立体异构)。 【答案】(18 分) (1)C10H20 (2)羰基、羧基 (3)4 CH3OOCCCH3COOCH3CH3 (4)加成反应(或还原反应) 取代反应 (5) (6)聚丙烯酸钠 C2H5OH (7) (8) +2NaOH CH ===CHCOONa+NaBr+2H O ――→ 2 2 △ 3【解析】由 A―→H 的转化加氢,有机物分子的碳链骨架没有变化,可知 A 分子中含 有一个六元环,结合 A 的分子式 C10H16 可知还应含有两个不饱和度,再根据题中信息以及 C 的 结 构 简 式 、 B 的 分 子 式 可 推 出A 的 结 构 简 式 为 ,B―→D 加氢,属于加成反应,则 D 为乳酸 , 则B 的 结 构 简 式 为 ,由 E―→F 的条件“氢氧化钠的醇溶液加热”,应为卤代烃的消去,逆推可知 D―→E 发生取代反应,溴 原 子 取 代 了 乳 酸 分 子 中 的 羟 基 , 则E、 F 的 结 构 简 式 分 别 为 和。(3) 两 个 —COOCH3 基 团 在 端 点 , 故 可 写 出 其 满 足 条 件 的 同 分 异 构 体 有 : 、、和共四种,其中具有较强的对称性,只有两种化学环境的氢原子。(8)A 为共轭 烯烃,与等物质的量的 Br2 发生加成反应,有两种 1、2 加成产物,一种 1、4 加成产物, 共 3 种。 9.(18 分)Na2S2O3 是重要的化工原料,易溶于水,在中性或碱性环境中稳定。 Ⅰ.制备 Na2S2O3·5H2O △===== 反应原理:Na SO (aq)+S(s) Na S O (aq) 2 23 23实验步骤: ①称取 15 g Na2SO3 加入圆底烧瓶中,再加入 80 mL 蒸馏水。另取 5 g 研细的硫粉,用 3 mL 乙醇润湿,加入上述溶液中。 ②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸 60 min。 ③趁热过滤,将滤液水浴加热浓缩,冷却析出 Na2S2O3·5H2O,经过滤、洗涤、干燥, 得到产品。 回答问题: (1)硫粉在反应前用乙醇润湿的目的是__________________________。 (2)仪器 a 的名称是________,其作用是____________________。 (3)产品中除了有未反应的 Na2SO3 外,最可能存在的无机杂质是______________。检验 是否存在该杂质的方法是____________________________。 (4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因: ________________________________________________________________________ ________________________________________________________________________。 Ⅱ.测定产品纯度 准确称取 W g 产品,用适量蒸馏水溶解,以淀粉作指示剂,用 0.100 0 mol·L-1 碘的标 准溶液滴定。 --反应原理为 2S2O23 +I2===S4O26 +2I- (5)滴定至终点时,溶液颜色的变化:________________________________。 (6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为__________mL。产品 的纯度为(设 Na2S2O3·5H2O 相对分子质量为 M)______________。 Ⅲ.Na2S2O3 的应用 -(7)Na2S2O3 还原性较强,在溶液中易被 Cl2 氧化成 SO24 ,常用作脱氯剂,该反应的离子 方程式为____________________________________________。 【答案】(18 分) (1)使硫粉易于分散到溶液中 (2)冷凝管 冷凝回流 (3)Na2SO4 取少量产品溶于过量盐酸,过滤,向滤液中加 BaCl2 溶液,若有白色沉淀, 则产品中含有 Na2SO4 -(4)S2O23 +2H+===S↓+SO2↑+H2O (5)由无色变蓝色 3.620 × 10-3M (6)18.10 ×100% W--(7)S2O23 +4Cl2+5H2O===2SO24 +8Cl-+10H+ 【解析】(1)硫粉难溶于水,微溶于乙醇,故硫粉用乙醇润湿后易扩散到溶液中。(2)装 置中仪器 a 是冷凝管,起冷凝回流汽化的反应物的作用。(3)因反应物 Na2SO3 易被空气中的 氧气氧化成 Na2SO4,故可能存在的无机杂质是 Na2SO4;检验产品中是否含有 Na2SO4,即 检验 SO 24 是否存在,需要防止 SO 2-3 的干扰,故不能用具有强氧化性的硝酸酸化,而应用 -盐酸酸化,过滤除去不溶物,再向滤液中滴加氯化钡溶液。(4)产品发黄,说明产品中含有 硫杂质,这是由于在酸性环境中 Na2S2O3 不稳定,发生歧化反应:2H++S2O2-3 ===S↓+SO2↑ +H2O 所致。(5)滴定终点时,过量的单质碘使无色的淀粉溶液变蓝,可指示滴定终点。(6) 起始读数为 0.00 mL,终点读数为 18.10 mL,所以消耗碘的标准溶液的体积为 18.10 mL- 0.00 mL=18.10 mL;根据 2Na2S2O3·5H2O~2S2O23-~I2,得 n(Na2S2O3·5H2O) =2n(I2)= --3- 3 2×0.100 0 mol·L 1×18.10×10 L= 3.620×10 mol , 则 产 品 的 纯 度 3.620 × 10-3 mol × M g/mol W g 3.620 × 10-3M --×100%= ×100%。(7)S2O 23 被 Cl2 氧化成 SO24 ,W--Cl2 被还原为 Cl-,首先根据化合价升降总数相等写出 S2O23 +4Cl2→2SO24 +8Cl-,然后 --根据原子守恒和电荷守恒写出 S2O23 +4Cl2+5H2O===2SO24 +8Cl-+10OH-。 10 . 合 成 氨 是 人 类 科 学 技 术 上 的 一 项 重 大 突 破 , 其 反 应 原 理 为N2(g) + 3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下: (1)天然气中的 H2S 杂质常用氨水吸收,产物为 NH4HS。一定条件下向 NH4HS 溶液中 通 入 空 气 , 得 到 单 质 硫 并 使 吸 收 液 再 生 , 写 出 再 生 反 应 的 化 学 方 程 式 : ________________________________________________________________________。 (2)步骤Ⅱ中制氢气的原理如下: ①CH4(g)+H2O(g) ②CO(g)+H2O(g) CO(g)+3H2(g) CO2(g)+H2(g) ΔH=+206.4 kJ·mol-1 ΔH=-41.2 kJ·mol-1 对于反应①,一定可以提高平衡体系中 H2 的百分含量,又能加快反应速率的措施是 ____________。 a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强 利用反应②,将 CO 进一步转化,可提高 H2 的产量。若 1 mol CO 和 H2 的混合气体(CO 的体积分数为 20%)与 H2O 反应,得到 1.18 mol CO、CO2 和 H2 的混合气体,则 CO 的转化 率为____________。 (3)图(a)表示 500 ℃、60.0 MPa 条件下,原料气投料比与平衡时 NH3 体积分数的关系。 根据图中 a 点数据计算 N2 的平衡体积分数:____________。 (4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内, 从通入原料气开始,随温度不断升高,NH3 物质的量变化的曲线示意图。 (a) (b) (5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。 简述本流程中提高合成氨原料总转化率的方法: ________________________________________________________________________。 【答案】 (1)2NH4HS+O 一定条件2NH ·H O+2S↓ 2 ===== 32(2)a 90% (3)14.5% (4) (5)Ⅳ 对原料气加压;分离液氨后,未反应的 N2、H2 循环使用 【解析】(1)由题意可知为空气中的 O2 将负二价硫氧化为硫单质,根据电子守恒将方程 式配平即可。(2)反应①为气体物质的量增大的吸热反应,降低压强使平衡右移,但反应速 率减小,d 错;催化剂不能改变反应限度,即不能改变 H2 的百分含量,c 错;增大水蒸气 浓度虽可使反应速率增大以及平衡右移,但产物 H2 的百分含量却减小,b 错;升高温度反 应速率增大,且平衡正向移动,H2 的百分含量增大,a 对。CO 与 H2 的混合气体与水蒸气 的反应中,反应体系中的气体的物质的量不变,而 1 molCO 与 H2 的混合气体参加反应生成 1.18 mol 混合气,说明有 0.18 mol水蒸气参加反应,则根据方程式②可知参加反应的 CO 0.18 mol 也为 0.18 mol,则其转化率为 ×100%=90%。 1 mol × 20% (3)由图中看出当 N2 与 H2 物质的量比为 1∶3 时,NH3 的平衡体积分数最大,为 42%。 设平衡时转化的 N2 的物质的量为 x mol,由三段式: N2+3H2 2NH3 0起始(mol): 转化(mol): 13x3x 2x 平衡(mol): 1-x 3- 3x 2x 2x ×100%=42%,则 x=0.59 ( - )+( -)+ 3x 2x 1×3( - ) x1则平衡时 N2 的体积分数为 ×100%=14.5%。(4)作图时要注 ( - )+( -)+ 3x 2x 1×3意开始时 NH3 物质的量不断增多,是因为反应正向进行(反应未达平衡),达到一定程度后 反应达到平衡而此时温度继续升高,平衡逆向移动,NH3 的物质的量减小。(5)热交换器可 以使需要加热的物质得到加热,还可以使需要冷却的物质得到冷却,能充分利用能量。合 成氨反应为气体物质的量减小的反应,加压利于反应正向进行;此外,循环利用可反复利 用原料,提高原料利用率。
2014 年天津高考理综化学试题含答案 WORD 一、单项选择题 1.化学与生产、生活息息相关,下列叙述错误的是( ) A.铁表面镀锌可增强其抗腐蚀性 B.用聚乙烯塑料代替聚乳酸塑料可减少白色污染 C.大量燃烧化石燃料是造成雾霾天气的一种重要因素 D.含重金属离子的电镀废液不能随意排放 2.实验室制备下列气体时,所用方法正确的是( ) A.制氧气时,用 Na2O2 或 H2O2 作反应物可选择相同的气体发生装置 B.制氯气时,用饱和 NaHCO3 溶液和浓硫酸净化气体 C.制乙烯时,用排水法或向上排空气法收集气体 D.制二氧化氮时,用水或 NaOH 溶液吸收尾气 3.运用相关化学知识进行判断,下列结论错误的是( ) A.某吸热反应能自发进行,因此该反应是熵增反应 B.NH4F 水溶液中含有 HF,因此 NH4F 溶液不能存放于玻璃试剂瓶中 C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成 H2 的速率 4.对下图两种化合物的结构或性质描述正确的是( ) A.不是同分异构体 B.分子中共平面的碳原子数相同 C.均能与溴水反应 D.可用红外光谱区分,但不能用核磁共振氢谱区分 5.下列有关电解质溶液中粒子浓度关系正确的是( ) -A.pH=1 的 NaHSO4 溶液:c(H+)=c(SO24 )+c(OH-) B.含有 AgCl 和 AgI 固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) -C.CO2 的水溶液:c(H+)>c(HCO-3 )=2c(CO23 )D.含等物质的量的 NaHC2O4 和 Na2C2O4 的溶液:3c(Na+)=2[c(HC2O-4 )+c(C2O24 )+ -c(H2C2O4)] 6.已知: 锂离子电池的总反应为 LixC+Li1-xCoO2 C+LiCoO2 锂硫电池的总反应 2Li+S Li2S 有关上述两种电池说法正确的是( ) A.锂离子电池放电时, Li+向负极迁移 B.锂硫电池充电时,锂电极发生还原反应 C.理论上两种电池的比能量相同 D.下图表示用锂离子电池给锂硫电池充电 第 II 卷 7.(14 分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识 回答下列问题: (1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。 a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强 c.氧化物对应的水化物碱性减弱,酸性增强 d.单质的熔点降低 (2)原子最外层电子数与次外层电子数相同的元素名称为________,氧化性最弱的简单 阳离子是________。 (3)已知: 化合物 类型 MgO 离子化合物 2800 Al2O3 离子化合物 2050 MgCl2 离子化合物 714 AlCl3 共价化合物 191 熔点/℃ 工业制镁时,电解 MgCl2 而不电解 MgO 的原因是________________________________; 制铝时,电解 Al2O3 而不电解 AlCl3 的原因是______________________________。 (4)晶体硅(熔点 1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下: Cl2 H2 馏蒸SiCl 4 ――→ Si(粗) SiCl (纯) Si(纯) ――→ ――→ 4460 ℃ 1100 ℃ 写出 SiCl4 的电子式:________________;在上述由 SiCl4 制纯硅的反应中,测得每生 成 1.12 kg 纯硅需吸收 a kJ 热量,写出该反应的热化学方程式:_________________________ ________________________________________________________________________。 (5)P2O5 是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用 P2O5 干燥的是 ________。 a.NH3 b.HI c.SO2 d.CO2 (6)KClO3 可用于实验室制 O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种 是 无 氧 酸 盐 , 另 一 种 盐 的 阴 阳 离 子 个 数 比 为1 ∶ 1 。 写 出 该 反 应 的 化 学 方 程 式 : ________________________________________________________________________。 8.(18 分)从薄荷油中得到一种烃 A(C10H16),叫 α-非兰烃,与 A 相关反应如下: KMnO4/H+ ――△ → 已知: (1)H 的分子式为____________。 (2)B 所含官能团的名称为____________。 (3)含两个—COOCH3 基团的 C 的同分异构体共有________种(不考虑手性异构),其中核 磁共振氢谱呈现 2 个吸收峰的异构体的结构简式为______________。 (4)B→D,D→E 的反应类型分别为______________、____________。 (5)G 为含六元环的化合物,写出其结构简式:______________。 (6)F 在一定条件下发生聚合反应可得到一种高吸水性树脂,该树脂名称为___________。 (7)写出 E→F 的化学反应方程式:_________________________。 (8)A 的结构简式为____________,A 与等物质的量的 Br2 进行加成反应的产物共有 ________种(不考虑立体异构)。 9.(18 分)Na2S2O3 是重要的化工原料,易溶于水,在中性或碱性环境中稳定。 Ⅰ.制备 Na2S2O3·5H2O △===== 反应原理:Na SO (aq)+S(s) Na S O (aq) 2 23 23实验步骤: ①称取 15 g Na2SO3 加入圆底烧瓶中,再加入 80 mL 蒸馏水。另取 5 g 研细的硫粉,用 3 mL 乙醇润湿,加入上述溶液中。 ②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸 60 min。 ③趁热过滤,将滤液水浴加热浓缩,冷却析出 Na2S2O3·5H2O,经过滤、洗涤、干燥, 得到产品。 回答问题: (1)硫粉在反应前用乙醇润湿的目的是__________________________。 (2)仪器 a 的名称是________,其作用是____________________。 (3)产品中除了有未反应的 Na2SO3 外,最可能存在的无机杂质是______________。检验 是否存在该杂质的方法是____________________________。 (4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因: ________________________________________________________________________ ________________________________________________________________________。 Ⅱ.测定产品纯度 准确称取 W g 产品,用适量蒸馏水溶解,以淀粉作指示剂,用 0.100 0 mol·L-1 碘的标 准溶液滴定。 --反应原理为 2S2O23 +I2===S4O26 +2I- (5)滴定至终点时,溶液颜色的变化:________________________________。 (6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为__________mL。产品 的纯度为(设 Na2S2O3·5H2O 相对分子质量为 M)______________。 Ⅲ.Na2S2O3 的应用 -(7)Na2S2O3 还原性较强,在溶液中易被 Cl2 氧化成 SO24 ,常用作脱氯剂,该反应的离子 方程式为____________________________________________。 10 . 合 成 氨 是 人 类 科 学 技 术 上 的 一 项 重 大 突 破 , 其 反 应 原 理 为N2(g) + 3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下: (1)天然气中的 H2S 杂质常用氨水吸收,产物为 NH4HS。一定条件下向 NH4HS 溶液中 通 入 空 气 , 得 到 单 质 硫 并 使 吸 收 液 再 生 , 写 出 再 生 反 应 的 化 学 方 程 式 : ________________________________________________________________________。 (2)步骤Ⅱ中制氢气的原理如下: ①CH4(g)+H2O(g) ②CO(g)+H2O(g) CO(g)+3H2(g) CO2(g)+H2(g) ΔH=+206.4 kJ·mol-1 ΔH=-41.2 kJ·mol-1 对于反应①,一定可以提高平衡体系中 H2 的百分含量,又能加快反应速率的措施是 ____________。 a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强 利用反应②,将 CO 进一步转化,可提高 H2 的产量。若 1 mol CO 和 H2 的混合气体(CO 的体积分数为 20%)与 H2O 反应,得到 1.18 mol CO、CO2 和 H2 的混合气体,则 CO 的转化 率为____________。 (3)图(a)表示 500 ℃、60.0 MPa 条件下,原料气投料比与平衡时 NH3 体积分数的关系。 根据图中 a 点数据计算 N2 的平衡体积分数:____________。 (4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内, 从通入原料气开始,随温度不断升高,NH3 物质的量变化的曲线示意图。 (a) (b) (5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。 简述本流程中提高合成氨原料总转化率的方法: ________________________________________________________________________。 2014 年天津高考理综化学试题含答案 WORD 一、单项选择题 1.化学与生产、生活息息相关,下列叙述错误的是( ) A.铁表面镀锌可增强其抗腐蚀性 B.用聚乙烯塑料代替聚乳酸塑料可减少白色污染 C.大量燃烧化石燃料是造成雾霾天气的一种重要因素 D.含重金属离子的电镀废液不能随意排放 【答案】B 【解析】A、锌的化学性质活泼,铁表面镀锌,铁被保护,A 项正确 B、;聚乳酸塑料 易降解,而聚乙烯塑料难降解,是产生白色污染的主要污染物,B 项错误;C、化石燃料燃 烧时生成大量的二氧化碳,同时生成一氧化碳、二氧化硫等有害气体,还能产生大量的粉 尘等有害颗粒物,故大量燃烧化石燃料是造成雾霾天气的一种重要因素,C 项正确;D、含 重金属离子的电镀废液随意排放会造成水体污染,D 项正确。 2.实验室制备下列气体时,所用方法正确的是( ) A.制氧气时,用 Na2O2 或 H2O2 作反应物可选择相同的气体发生装置 B.制氯气时,用饱和 NaHCO3 溶液和浓硫酸净化气体 C.制乙烯时,用排水法或向上排空气法收集气体 D.制二氧化氮时,用水或 NaOH 溶液吸收尾气 【答案】A 【解析】A、用 Na2O2 和水反应制取氧气,与用在 MnO2 催化下分解 H2O2 制取氧气的 发生装置相同,A 项正确;B、饱和 NaHCO3 溶液显碱性,能与氯气反应,B 项错误;C、 相同条件下,乙烯的密度与空气的密度相差不大,故不能用排空气法收集乙烯,C 项错误; D、NO2 与水发生反应 3NO2+H2O===2HNO3+NO,产生的 NO 仍是有毒气体,故不能用 水吸收含 NO2 的尾气,D 项错误。 3.运用相关化学知识进行判断,下列结论错误的是( ) A.某吸热反应能自发进行,因此该反应是熵增反应 B.NH4F 水溶液中含有 HF,因此 NH4F 溶液不能存放于玻璃试剂瓶中 C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成 H2 的速率 【答案】D 【解析】A、当 ΔH-TΔS<0 时,反应能自发进行,吸热反应的 ΔH>0,吸热反应能 自发,说明 ΔS>0,A 项正确;B、NH4F 溶液中 F-水解生成 HF,HF 能与玻璃中的 SiO2 发生反应 4HF+SiO2===SiF4↑+2H2O,故 NH4F 溶液不能存放在玻璃试剂瓶中,B 项正确; C、可燃冰需在低温高压下形成,所以可燃冰可存在于海底,C 项正确;D、常温下,浓硫 酸使铁发生钝化,D 项错误。 4.对下图两种化合物的结构或性质描述正确的是( ) A.不是同分异构体 B.分子中共平面的碳原子数相同 C.均能与溴水反应 D.可用红外光谱区分,但不能用核磁共振氢谱区分 【答案】C 【解析】A、两种有机物的分子式均为 C10H14O,但结构不同,故二者互为同分异构体, A 项错误;B、第一种有机物分子中含有苯环,而第二种有机物分子中不含苯环,显然前者 分子中共面的碳原子比后者分子中共面碳原子多,B 项错误;C、第一种有机物分子中含有 酚羟基,能与浓溴水发生取代反应,第二种有机物分子中含有碳碳双键,能与溴水发生加 成反应,C 项正确;D、两种有机物分子中的氢原子的化学环境不尽相同,故可用核磁共振 氢谱区分,D 项错误。 5.下列有关电解质溶液中粒子浓度关系正确的是( ) -A.pH=1 的 NaHSO4 溶液:c(H+)=c(SO24 )+c(OH-) B.含有 AgCl 和 AgI 固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) -C.CO2 的水溶液:c(H+)>c(HCO-3 )=2c(CO23 )D.含等物质的量的 NaHC2O4 和 Na2C2O4 的溶液:3c(Na+)=2[c(HC2O-4 )+c(C2O24 )+ -c(H2C2O4)] 【答案】A 【解析】A、由溶液中的电荷守恒得:c(Na+)+c(H+)=2c(SO24 )+c(OH-),又因 ---NaHSO4 溶液中 c(Na+)=c(SO24 ),所以 c(H+)=c(SO24 )+c(OH-),A 项正确;B、因 Ksp(AgCl)>Ksp(AgI),所以含有 AgCl 和 AgI 固体的悬浊液中 c(Cl-)>c(I-),B 项错误;C、 CO2 的水溶液中存在电离平衡:H2CO3 H++HCO-3 、HCO-3 H++CO2-3 ,因第一 步电离的程度远大于第二步电离的程度,故溶液中 c(HCO-3 )远大于 2c(CO23-),C 项错误; D、根据物料守恒得:2c(Na+)=3[c(HC2O-4 )+c(C2O2-4 )+c(H2C2O4)],故 D 项错误。 6.已知: 锂离子电池的总反应为 LixC+Li1-xCoO2 锂硫电池的总反应 2Li+S Li2S C+LiCoO2 有关上述两种电池说法正确的是( ) A.锂离子电池放电时, Li+向负极迁移 B.锂硫电池充电时,锂电极发生还原反应 C.理论上两种电池的比能量相同 D.下图表示用锂离子电池给锂硫电池充电 【答案】B 【解析】A、电池工作时,阳离子(Li+)向正极迁移,A 项错误;B、锂硫电池充电时, 锂电极上发生 Li+得电子生成 Li 的还原反应,B 项正确;C、两种电池负极材料不同,故 理论上两种电池的比能量不相同,C 项错误;D、根据电池总反应知,生成碳的反应是氧化 反应,因此碳电极作电池的负极,而锂硫电池中单质锂作电池的负极,给电池充电时,电 池负极应接电源负极,即锂硫电池的锂电极应与锂离子电池的碳电极相连,D 项错误。 第 II 卷 7.(14 分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识 回答下列问题: (1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。 a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强 c.氧化物对应的水化物碱性减弱,酸性增强 d.单质的熔点降低 (2)原子最外层电子数与次外层电子数相同的元素名称为________,氧化性最弱的简单 阳离子是________。 (3)已知: 化合物 类型 MgO 离子化合物 2800 Al2O3 离子化合物 2050 MgCl2 离子化合物 714 AlCl3 共价化合物 191 熔点/℃ 工业制镁时,电解 MgCl2 而不电解 MgO 的原因是________________________________; 制铝时,电解 Al2O3 而不电解 AlCl3 的原因是______________________________。 (4)晶体硅(熔点 1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下: Cl2 H2 馏蒸SiCl 4 ――→ Si(粗) SiCl (纯) Si(纯) ――→ ――→ 4460 ℃ 1100 ℃ 写出 SiCl4 的电子式:________________;在上述由 SiCl4 制纯硅的反应中,测得每生 成 1.12 kg 纯硅需吸收 a kJ 热量,写出该反应的热化学方程式:_________________________ ________________________________________________________________________。 (5)P2O5 是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用 P2O5 干燥的是 ________。 a.NH3 b.HI c.SO2 d.CO2 (6)KClO3 可用于实验室制 O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种 是 无 氧 酸 盐 , 另 一 种 盐 的 阴 阳 离 子 个 数 比 为1 ∶ 1 。 写 出 该 反 应 的 化 学 方 程 式 : ________________________________________________________________________。 【答案】(14 分) (1)b (2)氩 Na+(或钠离子) (3)MgO 的熔点高,熔融时耗费更多能源,增加生产成本 态难导电 AlCl3 是共价化合物,熔融 1100 ℃ (4) SiCl (g)+2H (g) Si(s)+4HCl(g) ΔH=+0.025a kJ·mol-1 ===== 42(5)b 400 ℃ 3 ===== (6)4KClO KCl+3KClO 4【解析】(1)除稀有气体外,第三周期元素随原子序数的递增原子半径逐渐减小,而离 子半径不一定减小,如 r(Na+)<r(Cl-),a 错误;同一周期的主族元素随原子序数的递增, 金属性减弱,非金属性增强,b 正确;同周期主族元素从左至右,最高价氧化物对应的水化 物碱性减弱,酸性增强,c 错误;单质的熔点不一定降低,如 Na 的熔点低于 Mg、Al 等的 熔点,d 错误。(2)第三周期元素的原子核外有三个电子层,次外层电子数为 8,故该元素原 子最外层的电子数也为 8,该元素为氩;简单离子的氧化性越弱,对应单质的还原性越强, 元素的金属性越强,第三周期中金属性最强的元素是 Na,因此 Na+的氧化性最弱。(3)由题 给数据表知,MgO 的熔点比 MgCl2 的熔点高,MgO 熔融时耗费更多能源,增加成本;AlCl3 是共价化合物,熔融态时不电离,难导电,故冶炼铝不能用电解 AlCl3 的方法。(4)SiCl4 属 于共价化合物,其电子式为 ;由 SiCl4 制纯硅的化学方程式为 SiCl4(l)+2H2(g) 1100 ℃ ===== Si(s)+4HCl(g),生成 1.12 kg 即 40 mol 纯硅吸收 a kJ 热量,则生成 1 mol 纯硅需吸 收 0.025a kJ 热量。(5)NH3 是碱性气体,既不能用浓硫酸干燥,也不能用 P2O5 干燥;HI 是 具有还原性的酸性气体,可用 P2O5 干燥,但不能用浓硫酸干燥;SO2、CO2 既能用浓硫酸 干燥,又能用 P2O5 干燥,综上分析,正确答案为 b。(6)KClO3(Cl 的化合价为+5 价)受热 分解生成的无氧酸盐是 KCl,另一含氧酸盐中氯元素的化合价必须比+5 价高,可能为+6 价或+7 价,若为+6 价,形成的盐中阴阳离子个数比不可能为 1∶1,只能是+7 价,故该 含氧酸盐为 KClO4,据此可写出该反应的化学方程式。 8.(18 分)从薄荷油中得到一种烃 A(C10H16),叫 α-非兰烃,与 A 相关反应如下: KMnO4/H+ ――△ → 已知: (1)H 的分子式为____________。 (2)B 所含官能团的名称为____________。 (3)含两个—COOCH3 基团的 C 的同分异构体共有________种(不考虑手性异构),其中核 磁共振氢谱呈现 2 个吸收峰的异构体的结构简式为______________。 (4)B→D,D→E 的反应类型分别为______________、____________。 (5)G 为含六元环的化合物,写出其结构简式:______________。 (6)F 在一定条件下发生聚合反应可得到一种高吸水性树脂,该树脂名称为___________。 (7)写出 E→F 的化学反应方程式:_________________________。 (8)A 的结构简式为____________,A 与等物质的量的 Br2 进行加成反应的产物共有 ________种(不考虑立体异构)。 【答案】(18 分) (1)C10H20 (2)羰基、羧基 (3)4 CH3OOCCCH3COOCH3CH3 (4)加成反应(或还原反应) 取代反应 (5) (6)聚丙烯酸钠 C2H5OH (7) (8) +2NaOH CH ===CHCOONa+NaBr+2H O ――→ 2 2 △ 3【解析】由 A―→H 的转化加氢,有机物分子的碳链骨架没有变化,可知 A 分子中含 有一个六元环,结合 A 的分子式 C10H16 可知还应含有两个不饱和度,再根据题中信息以及 C 的 结 构 简 式 、 B 的 分 子 式 可 推 出A 的 结 构 简 式 为 ,B―→D 加氢,属于加成反应,则 D 为乳酸 , 则B 的 结 构 简 式 为 ,由 E―→F 的条件“氢氧化钠的醇溶液加热”,应为卤代烃的消去,逆推可知 D―→E 发生取代反应,溴 原 子 取 代 了 乳 酸 分 子 中 的 羟 基 , 则E、 F 的 结 构 简 式 分 别 为 和。(3) 两 个 —COOCH3 基 团 在 端 点 , 故 可 写 出 其 满 足 条 件 的 同 分 异 构 体 有 : 、、和共四种,其中具有较强的对称性,只有两种化学环境的氢原子。(8)A 为共轭 烯烃,与等物质的量的 Br2 发生加成反应,有两种 1、2 加成产物,一种 1、4 加成产物, 共 3 种。 9.(18 分)Na2S2O3 是重要的化工原料,易溶于水,在中性或碱性环境中稳定。 Ⅰ.制备 Na2S2O3·5H2O △===== 反应原理:Na SO (aq)+S(s) Na S O (aq) 2 23 23实验步骤: ①称取 15 g Na2SO3 加入圆底烧瓶中,再加入 80 mL 蒸馏水。另取 5 g 研细的硫粉,用 3 mL 乙醇润湿,加入上述溶液中。 ②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸 60 min。 ③趁热过滤,将滤液水浴加热浓缩,冷却析出 Na2S2O3·5H2O,经过滤、洗涤、干燥, 得到产品。 回答问题: (1)硫粉在反应前用乙醇润湿的目的是__________________________。 (2)仪器 a 的名称是________,其作用是____________________。 (3)产品中除了有未反应的 Na2SO3 外,最可能存在的无机杂质是______________。检验 是否存在该杂质的方法是____________________________。 (4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因: ________________________________________________________________________ ________________________________________________________________________。 Ⅱ.测定产品纯度 准确称取 W g 产品,用适量蒸馏水溶解,以淀粉作指示剂,用 0.100 0 mol·L-1 碘的标 准溶液滴定。 --反应原理为 2S2O23 +I2===S4O26 +2I- (5)滴定至终点时,溶液颜色的变化:________________________________。 (6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为__________mL。产品 的纯度为(设 Na2S2O3·5H2O 相对分子质量为 M)______________。 Ⅲ.Na2S2O3 的应用 -(7)Na2S2O3 还原性较强,在溶液中易被 Cl2 氧化成 SO24 ,常用作脱氯剂,该反应的离子 方程式为____________________________________________。 【答案】(18 分) (1)使硫粉易于分散到溶液中 (2)冷凝管 冷凝回流 (3)Na2SO4 取少量产品溶于过量盐酸,过滤,向滤液中加 BaCl2 溶液,若有白色沉淀, 则产品中含有 Na2SO4 -(4)S2O23 +2H+===S↓+SO2↑+H2O (5)由无色变蓝色 3.620 × 10-3M (6)18.10 ×100% W--(7)S2O23 +4Cl2+5H2O===2SO24 +8Cl-+10H+ 【解析】(1)硫粉难溶于水,微溶于乙醇,故硫粉用乙醇润湿后易扩散到溶液中。(2)装 置中仪器 a 是冷凝管,起冷凝回流汽化的反应物的作用。(3)因反应物 Na2SO3 易被空气中的 氧气氧化成 Na2SO4,故可能存在的无机杂质是 Na2SO4;检验产品中是否含有 Na2SO4,即 检验 SO 24 是否存在,需要防止 SO 2-3 的干扰,故不能用具有强氧化性的硝酸酸化,而应用 -盐酸酸化,过滤除去不溶物,再向滤液中滴加氯化钡溶液。(4)产品发黄,说明产品中含有 硫杂质,这是由于在酸性环境中 Na2S2O3 不稳定,发生歧化反应:2H++S2O2-3 ===S↓+SO2↑ +H2O 所致。(5)滴定终点时,过量的单质碘使无色的淀粉溶液变蓝,可指示滴定终点。(6) 起始读数为 0.00 mL,终点读数为 18.10 mL,所以消耗碘的标准溶液的体积为 18.10 mL- 0.00 mL=18.10 mL;根据 2Na2S2O3·5H2O~2S2O23-~I2,得 n(Na2S2O3·5H2O) =2n(I2)= --3- 3 2×0.100 0 mol·L 1×18.10×10 L= 3.620×10 mol , 则 产 品 的 纯 度 3.620 × 10-3 mol × M g/mol W g 3.620 × 10-3M --×100%= ×100%。(7)S2O 23 被 Cl2 氧化成 SO24 ,W--Cl2 被还原为 Cl-,首先根据化合价升降总数相等写出 S2O23 +4Cl2→2SO24 +8Cl-,然后 --根据原子守恒和电荷守恒写出 S2O23 +4Cl2+5H2O===2SO24 +8Cl-+10OH-。 10 . 合 成 氨 是 人 类 科 学 技 术 上 的 一 项 重 大 突 破 , 其 反 应 原 理 为N2(g) + 3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下: (1)天然气中的 H2S 杂质常用氨水吸收,产物为 NH4HS。一定条件下向 NH4HS 溶液中 通 入 空 气 , 得 到 单 质 硫 并 使 吸 收 液 再 生 , 写 出 再 生 反 应 的 化 学 方 程 式 : ________________________________________________________________________。 (2)步骤Ⅱ中制氢气的原理如下: ①CH4(g)+H2O(g) ②CO(g)+H2O(g) CO(g)+3H2(g) CO2(g)+H2(g) ΔH=+206.4 kJ·mol-1 ΔH=-41.2 kJ·mol-1 对于反应①,一定可以提高平衡体系中 H2 的百分含量,又能加快反应速率的措施是 ____________。 a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强 利用反应②,将 CO 进一步转化,可提高 H2 的产量。若 1 mol CO 和 H2 的混合气体(CO 的体积分数为 20%)与 H2O 反应,得到 1.18 mol CO、CO2 和 H2 的混合气体,则 CO 的转化 率为____________。 (3)图(a)表示 500 ℃、60.0 MPa 条件下,原料气投料比与平衡时 NH3 体积分数的关系。 根据图中 a 点数据计算 N2 的平衡体积分数:____________。 (4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内, 从通入原料气开始,随温度不断升高,NH3 物质的量变化的曲线示意图。 (a) (b) (5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。 简述本流程中提高合成氨原料总转化率的方法: ________________________________________________________________________。 【答案】 (1)2NH4HS+O 一定条件2NH ·H O+2S↓ 2 ===== 32(2)a 90% (3)14.5% (4) (5)Ⅳ 对原料气加压;分离液氨后,未反应的 N2、H2 循环使用 【解析】(1)由题意可知为空气中的 O2 将负二价硫氧化为硫单质,根据电子守恒将方程 式配平即可。(2)反应①为气体物质的量增大的吸热反应,降低压强使平衡右移,但反应速 率减小,d 错;催化剂不能改变反应限度,即不能改变 H2 的百分含量,c 错;增大水蒸气 浓度虽可使反应速率增大以及平衡右移,但产物 H2 的百分含量却减小,b 错;升高温度反 应速率增大,且平衡正向移动,H2 的百分含量增大,a 对。CO 与 H2 的混合气体与水蒸气 的反应中,反应体系中的气体的物质的量不变,而 1 molCO 与 H2 的混合气体参加反应生成 1.18 mol 混合气,说明有 0.18 mol水蒸气参加反应,则根据方程式②可知参加反应的 CO 0.18 mol 也为 0.18 mol,则其转化率为 ×100%=90%。 1 mol × 20% (3)由图中看出当 N2 与 H2 物质的量比为 1∶3 时,NH3 的平衡体积分数最大,为 42%。 设平衡时转化的 N2 的物质的量为 x mol,由三段式: N2+3H2 2NH3 0起始(mol): 转化(mol): 13x3x 2x 平衡(mol): 1-x 3- 3x 2x 2x ×100%=42%,则 x=0.59 ( - )+( -)+ 3x 2x 1×3( - ) x1则平衡时 N2 的体积分数为 ×100%=14.5%。(4)作图时要注 ( - )+( -)+ 3x 2x 1×3意开始时 NH3 物质的量不断增多,是因为反应正向进行(反应未达平衡),达到一定程度后 反应达到平衡而此时温度继续升高,平衡逆向移动,NH3 的物质的量减小。(5)热交换器可 以使需要加热的物质得到加热,还可以使需要冷却的物质得到冷却,能充分利用能量。合 成氨反应为气体物质的量减小的反应,加压利于反应正向进行;此外,循环利用可反复利 用原料,提高原料利用率。
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





