
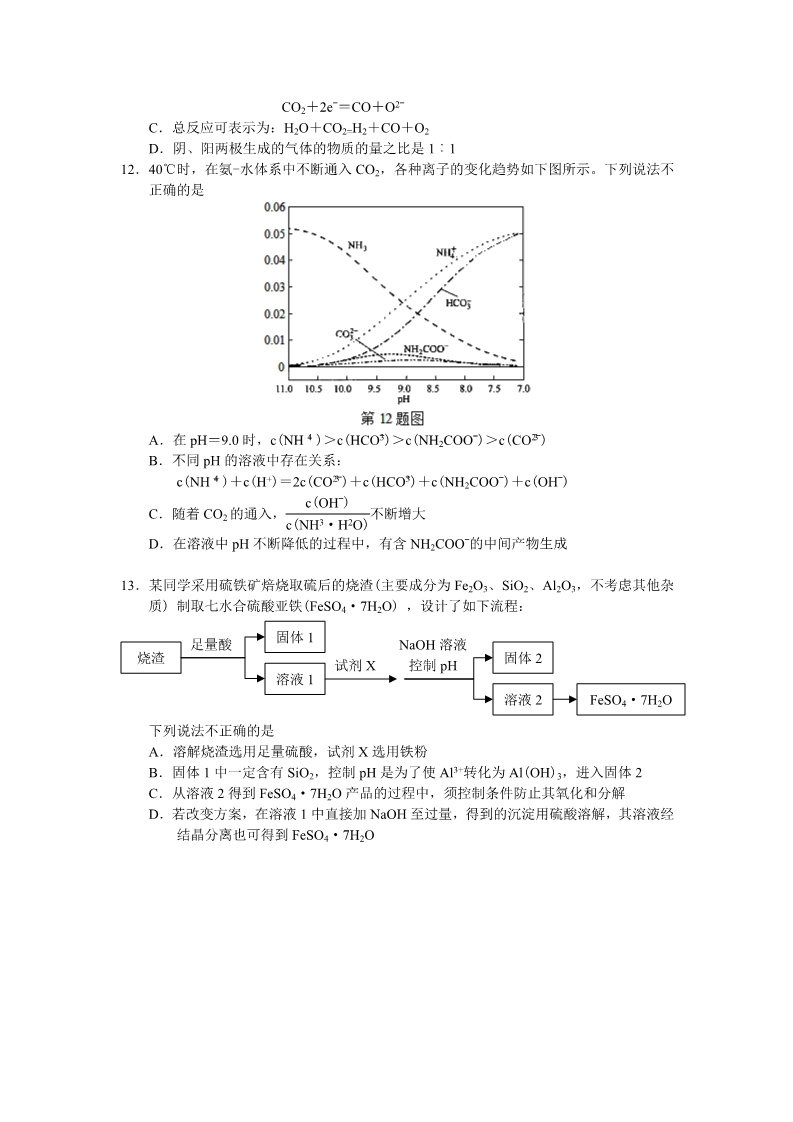
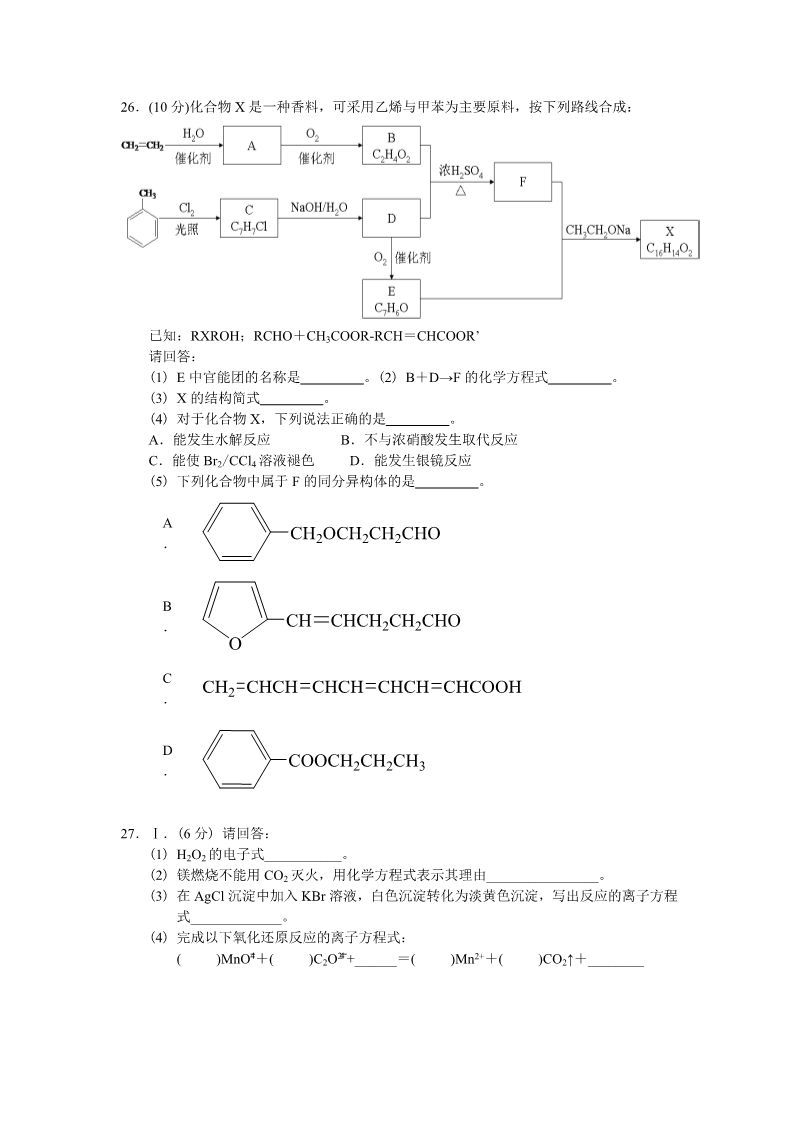
 2015 年普通高等学校招生全国统一考试 浙江卷·理科综合·化学部分 7.下列说法不正确的是 A.液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动 性B.常压下,0℃时冰的密度比水的密度小,水在 4℃时密度最大,这些都与分子间的氢 键有关 C.石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 D.燃料的脱硫脱氮、SO2 的回收利用和 NOx 的催化转化都是减少酸雨产生的措施 8.下列说法正确的是 A.为测定新制氯水的 pH,用玻璃棒蘸取液体滴在 pH 试纸上,与标准比色卡对照即可 B.做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸。如果在沸腾前发现忘记加沸 石,应立即停止加热,冷却后补加 C.在未知溶液中滴加 BaCl2 溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知 24 23 ˉˉ溶液中存在 SO 或 SO D.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、 干燥的方法 9.右下表为元素周期表的一部分,其中 X、Y、Z、W 为短周期元素,W 元素的核电荷数 为 X 元素的 2 倍。下列说法正确的是 XA.X、W、Z 元素的原子半径及它们的气态氢化物的热稳定性均依次 YZTW递增 B.Y、Z、W 元素在自然界中均不能以游离态存在,它们的最高价氧 化物的水化物的酸性依次递增 第 9 题表 C.YX2 晶体熔化、液态 WX3 气化均需克服分子间作用力 D.根据元素周期律,可以推测 T 元素的单质具有半导体特性,T2X3 具有氧化性和还原 性10.下列说法不正确的是 A.己烷有 4 种同分异构体,它们的熔点、沸点各不相同 B.在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属 于取代反应 C.油脂皂化反应得到高级脂肪酸盐与甘油 —[ D.聚合物( 2—]n )可由单体 CH3CH=CH2 和 CH2=CH2 加聚制得 2— —— 2CH CH CHCH |3 CH 11 .在 固 态 金 属 氧 化 物 电 解 池 中 ,高 温 共 电 解 H2O-CO2 混合气体制备 H2 和 CO 是一种新的能 源利用方式,基本原理如图所示。下列说法不 正确的是 A.X 是电源的负极 B.阴极的反应式是:H2O+2eˉ=H2+O2ˉ CO2+2eˉ=CO+O2ˉ C.总反应可表示为:H2O+CO2=H2+CO+O2 D.阴、阳两极生成的气体的物质的量之比是 1︰1 12.40℃时,在氨-水体系中不断通入 CO2,各种离子的变化趋势如下图所示。下列说法不 正确的是 +4 323 ˉˉA.在 pH=9.0 时,c(NH )>c(HCO )>c(NH2COOˉ)>c(CO ) B.不同 pH 的溶液中存在关系: +4 23 3+ˉˉc(NH )+c(H )=2c(CO )+c(HCO )+c(NH2COOˉ)+c(OHˉ) ( ) c OHˉ C.随着 CO2 的通入, 不断增大 32( · ) c NHH O D.在溶液中 pH 不断降低的过程中,有含 NH2COOˉ的中间产物生成 13.某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为 Fe2O3、SiO2、Al2O3,不考虑其他杂 质) 制取七水合硫酸亚铁(FeSO4·7H2O) ,设计了如下流程: 固体 1 足量酸 NaOH 溶液 控制 pH 烧渣 固体 2 溶液 2 试剂 X 溶液 1 FeSO4·7H2O 下列说法不正确的是 A.溶解烧渣选用足量硫酸,试剂 X 选用铁粉 B.固体 1 中一定含有 SiO2,控制 pH 是为了使 Al3+转化为 Al(OH)3,进入固体 2 C.从溶液 2 得到 FeSO4·7H2O 产品的过程中,须控制条件防止其氧化和分解 D.若改变方案,在溶液 1 中直接加 NaOH 至过量,得到的沉淀用硫酸溶解,其溶液经 结晶分离也可得到 FeSO4·7H2O 26.(10 分)化合物 X 是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成: 已知:RXROH;RCHO+CH3COOR-RCH=CHCOOR’ 请回答: (1) E 中官能团的名称是 (3) X 的结构简式 。(2) B+D→F 的化学方程式 。。(4) 对于化合物 X,下列说法正确的是 。A.能发生水解反应 B.不与浓硝酸发生取代反应 D.能发生银镜反应 C.能使 Br2/CCl4 溶液褪色 (5) 下列化合物中属于 F 的同分异构体的是 。ACH2OCH2CH2CHO .BCH CHCH2CH2CHO .OCCH2 CHCH CHCH CHCH CHCOOH COOCH2CH2CH3 .D.27.Ⅰ.(6 分) 请回答: (1) H2O2 的电子式___________。 (2) 镁燃烧不能用 CO2 灭火,用化学方程式表示其理由________________。 (3) 在 AgCl 沉淀中加入 KBr 溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程 式_____________。 (4) 完成以下氧化还原反应的离子方程式: 424 )Mn2++( )CO2↑+________ ˉˉ()MnO +( )C2O +______=( Ⅱ.(12 分) 化合物甲和 NaAlH4 都是重要的还原剂。一定条件下金属钠和 H2 反应生成 甲。甲与水反应可产生 H2,甲与 AlCl3 反应可得到 NaAlH4。将 4.80g 甲加热至完全分 解,得到金属钠和 2.24 L(已折算成标准状况) 的 H2。 请推测并回答: (1) 甲的化学式__________。 (2) 甲与 AlCl3 反应得到 NaAlH4 的化学方程式__________。 (3) NaAlH4 与水发生氧化还原反应的化学方程式__________。 (4)甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为 Fe2O3)脱锈过程 发生的化学方程式___________。 (5) 某同学认为:用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓硫 酸干燥,再与金属钠反应,得到固体物质即为纯净的甲;取该固体物质与水反应, 若能产生 H2,即可证明得到的甲一定是纯净的。 判断该同学设想的制备和验纯方法的合理性并说明理由___________。 28.(15 分)乙苯催化脱氢制苯乙烯反应: (1)已知: 化学键 键能/kJ·molˉ1 C-H C-C C=C H-H 412 348 612 436 计算上述反应的△H=________ kJ·mol-1。 (2)维持体系总压强 p 恒定,在温度 T 时,物质的量为 n、体积为 V 的乙苯蒸汽发生 催化脱氢反应。已知乙苯的平衡转化率为 α,则在该温度下反应的平衡常数 K= ____________(用 α 等符号表示)。 (3)工业上,通常在乙苯蒸汽中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比 为 1︰9),控制反应温度 600℃,并保持体系总压为常压的条件下进行反应。在不 同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了 H2 以外的产物中苯乙烯的物质的量分数)示意图如下: ①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实___________。 ②控制反应温度为 600℃的理由是____________。 (3)某研究机构用 CO2 代替水蒸气开发了绿色化学合成工艺—-乙苯-二氧化碳耦合催 化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生 产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2 +C=2CO。新工艺的特点有_________(填编号)。 ①CO2 与 H2 反应,使乙苯脱氢反应的化学平衡右移 ②不用高温水蒸气,可降低能量消耗 ③有利于减少积炭 ④有利用 CO2 资源利用 29.(15 分)某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。 实验(一) 碘含量的测定 取 0.0100 mol·Lˉ1 的 AgNO3 标准溶液装入滴定管,取 100.00 mL 海带浸取原液至滴定 池,用电势滴定法测定碘含量。测的的电动势(E)反映溶液中 c(Iˉ)的变化,部分数据如 下表: V(AgNO3)/mL 15.00 19.00 19.80 19.98 20.00 20.02 21.00 23.00 25.00 E/mV 实验(二) -225 -200 -150 -100 50.0 碘的制取 175 275 300 325 另制海带浸取原液,甲、乙两种实验方案如下: 已知:3I2+6NaOH=5NaI+NaIO3+3H2O 请回答: (1) 实验(一) 中的仪器名称:仪器 A (2) ①根据表中数据绘制滴定曲线: , 仪器 B 。②该次滴定终点时用去 AgNO3 溶液的体积为 量为 %。 mL,计算得海带中碘的百分含 (3) ①分液漏斗使用前须检漏,检漏方法为 ②步骤 X 中,萃取后分液漏斗内观察到的现象是 ③下列有关步骤 Y 的说法,正确的是 A.应控制 NaOH 溶液的浓度和体积 B.将碘转化呈离子进入水层 。。。C.主要是除去海带浸取原液中的有机杂质 D.NaOH 溶液可以由乙醇代替 ④实验(二) 中操作 Z 的名称是 。。(4) 方案甲中采用蒸馏不合理,理由是 2015 年普通高等学校招生全国统一考试 浙江卷·理科综合·化学部分 总体感受:考完试的时候,多个学生反应化学非常简单。我拿到试卷认真做了一遍,感觉 最近 3 年题型越来越接近全国卷,应该是“改邪归正”了。记得以前我跟学生们开玩笑, 浙江卷化学考个 30-40 分的,拿全国卷随便考 60-70 分。选择题 13 题是很失败的一道题,26 题紧跟考纲,恰到好处。27 题再次回到去年 7 月份培训时任雪明教研员说的电子式、方程 式配平方面,后面的 NaAlH4 在多套模拟题出现,学生一般不会觉得陌生,28 题求反应热, 可能有些学生方法错误,但答案最终是正确的,29 题分液漏斗的检漏应该很麻烦,有旋塞 与玻璃塞,应该要检验 2 个地方,标准答案写的过于简略。本套试卷重点强调知识,对能 力考查方面弱化了,所以学生觉得简单,试卷亮点也很难找出。 7.下列说法不正确的是 A.液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动 性B.常压下,0℃时冰的密度比水的密度小,水在 4℃时密度最大,这些都与分子间的氢 键有关 C.石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 D.燃料的脱硫脱氮、SO2 的回收利用和 NOx 的催化转化都是减少酸雨产生的措施 答案:C 纳米银离子的聚集属于物理变化,其他说法是正确的。 8.下列说法正确的是 A.为测定新制氯水的 pH,用玻璃棒蘸取液体滴在 pH 试纸上,与标准比色卡对照即可 B.做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸。如果在沸腾前发现忘记加沸 石,应立即停止加热,冷却后补加 C.在未知溶液中滴加 BaCl2 溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知 24 23 ˉˉ溶液中存在 SO 或 SO D.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、 干燥的方法 答案:B A.氯水有漂白性。C答案无法排除银离子的干扰。D混有少量硝酸钾的氯化钠,应采用蒸 发结晶的方法,反过来混有氯化钠的硝酸钾应采用蒸发浓缩,冷却结晶的方法。 9.右下表为元素周期表的一部分,其中 X、Y、Z、W 为短周期元素,W 元素的核电荷数 为 X 元素的 2 倍。下列说法正确的是 XA.X、W、Z 元素的原子半径及它们的气态氢化物的热稳定性均依次 YZTW递增 B.Y、Z、W 元素在自然界中均不能以游离态存在,它们的最高价氧 化物的水化物的酸性依次递增 第 9 题表 C.YX2 晶体熔化、液态 WX3 气化均需克服分子间作用力 D.根据元素周期律,可以推测 T 元素的单质具有半导体特性,T2X3 具有氧化性和还原 性答案:D X:O Y:Si Z:P W:S A 答案 X、W、Z 非金属性依次减弱,所以氢化物稳 定性依次减弱。 B 答案硫可以单质存在 10.下列说法不正确的是 C 二氧化硅晶体熔化破坏共价键 A.己烷有 4 种同分异构体,它们的熔点、沸点各不相同 B.在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属 于取代反应 C.油脂皂化反应得到高级脂肪酸盐与甘油 —[ D.聚合物( 2—]n )可由单体 CH3CH=CH2 和 CH2=CH2 加聚制得 2— —— 2CH CH CHCH |3 CH 答案:A 己烷有 5 种同分异构体,结构不同,熔沸点不同。 其他说法都正确 11.在固态金属氧化物电解池中, 高温共电解 H2O-CO2 混合气体制备 H2 和 CO 是 一种新的能源利用方式,基本原理如图所示。下 列说法不正确的是 A.X 是电源的负极 B.阴极的反应式是:H2O+2eˉ=H2+O2ˉ CO2+2eˉ=CO+O2ˉ C.总反应可表示为:H2O+CO2=H2+CO+O2 D.阴、阳两极生成的气体的物质的量之比是 1︰1 答案:D 考察熔融盐原电池,很明显 D 答案气体物质的量之比为 2:1 12.40℃时,在氨-水体系中不断通入 CO2,各种离子的变化趋势如下图所示。下列说法不 正确的是 +4 323 ˉˉA.在 pH=9.0 时,c(NH )>c(HCO )>c(NH2COOˉ)>c(CO ) B.不同 pH 的溶液中存在关系: +4 23 3+ˉˉc(NH )+c(H )=2c(CO )+c(HCO )+c(NH2COOˉ)+c(OHˉ) ( ) c OHˉ C.随着 CO2 的通入, 不断增大 32( · ) c NHH O D.在溶液中 pH 不断降低的过程中,有含 NH2COOˉ的中间产物生成 答案:C ( ) c OHˉ A 答案从图可以看出,B 答案是电荷守恒,C 答案 =Kb/c(NH +4 ) ,由于 c(NH 32( · ) c NHH O ( ) c OHˉ +4 )逐渐增大,所以 逐渐减小。 32( · ) c NHH O 13.某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为 Fe2O3、SiO2、Al2O3,不考虑其他杂 质) 制取七水合硫酸亚铁(FeSO4·7H2O) ,设计了如下流程: 固体 1 足量酸 NaOH 溶液 控制 pH 烧渣 固体 2 溶液 2 试剂 X 溶液 1 FeSO4·7H2O 下列说法不正确的是 A.溶解烧渣选用足量硫酸,试剂 X 选用铁粉 B.固体 1 中一定含有 SiO2,控制 pH 是为了使 Al3+转化为 Al(OH)3,进入固体 2 C.从溶液 2 得到 FeSO4·7H2O 产品的过程中,须控制条件防止其氧化和分解 D.若改变方案,在溶液 1 中直接加 NaOH 至过量,得到的沉淀用硫酸溶解,其溶液经 结晶分离也可得到 FeSO4·7H2O 答案:D 明显溶液中有硫酸铁。 26.(10 分)化合物 X 是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成: 已知:RXROH;RCHO+CH3COOR-RCH=CHCOOR’ 请回答: (1) E 中官能团的名称是 (3) X 的结构简式 。(2) B+D→F 的化学方程式 。。(4) 对于化合物 X,下列说法正确的是 。A.能发生水解反应 B.不与浓硝酸发生取代反应 D.能发生银镜反应 C.能使 Br2/CCl4 溶液褪色 (5) 下列化合物中属于 F 的同分异构体的是 。ACH2OCH2CH2CHO .BCH CHCH2CH2CHO .OCCH2 CHCH CHCH CHCH CHCOOH COOCH2CH2CH3 .D.答案:此题很多学生能拿满分 27.Ⅰ.(6 分) 请回答: (1) H2O2 的电子式___________。 (2) 镁燃烧不能用 CO2 灭火,用化学方程式表示其理由________________。 (3) 在 AgCl 沉淀中加入 KBr 溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程 式_____________。 (4) 完成以下氧化还原反应的离子方程式: 424 )Mn2++( )CO2↑+________ ˉˉ()MnO +( )C2O +______=( Ⅱ.(12 分) 化合物甲和 NaAlH4 都是重要的还原剂。一定条件下金属钠和 H2 反应生成 甲。甲与水反应可产生 H2,甲与 AlCl3 反应可得到 NaAlH4。将 4.80g 甲加热至完全分 解,得到金属钠和 2.24 L(已折算成标准状况) 的 H2。 请推测并回答: (1) 甲的化学式__________。 (2) 甲与 AlCl3 反应得到 NaAlH4 的化学方程式__________。 (3) NaAlH4 与水发生氧化还原反应的化学方程式__________。 (4)甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为 Fe2O3)脱锈过程 发生的化学方程式___________。 (5) 某同学认为:用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓硫 酸干燥,再与金属钠反应,得到固体物质即为纯净的甲;取该固体物质与水反应, 若能产生 H2,即可证明得到的甲一定是纯净的。 判断该同学设想的制备和验纯方法的合理性并说明理由___________。 答案:27-II 中的第(4)问,因为是脱锈过程,所以得到的是铁,另一个是 NaOH 28.(15 分)乙苯催化脱氢制苯乙烯反应: (1)已知: 化学键 键能/kJ·molˉ1 C-H C-C C=C H-H 412 348 612 436 计算上述反应的△H=________ kJ·mol-1。 (2)维持体系总压强 p 恒定,在温度 T 时,物质的量为 n、体积为 V 的乙苯蒸汽发生 催化脱氢反应。已知乙苯的平衡转化率为 α,则在该温度下反应的平衡常数 K= ____________(用 α 等符号表示)。 (3)工业上,通常在乙苯蒸汽中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比 为 1︰9),控制反应温度 600℃,并保持体系总压为常压的条件下进行反应。在不 同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了 H2 以外的产物中苯乙烯的物质的量分数)示意图如下: ①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实___________。 ②控制反应温度为 600℃的理由是____________。 (3)某研究机构用 CO2 代替水蒸气开发了绿色化学合成工艺—-乙苯-二氧化碳耦合催 化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生 产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2 +C=2CO。新工艺的特点有_________(填编号)。 ①CO2 与 H2 反应,使乙苯脱氢反应的化学平衡右移 ②不用高温水蒸气,可降低能量消耗 ③有利于减少积炭 ④有利用 CO2 资源利用 答案: (1)△H=5×412+348-612-3×412-436=124 kJ/mol(把苯环看做一个整体,因为左右都有 这个结构,可以抵消) (2 恒 T,P 下,V 与 n 成 正比。根据三段式,后来体积为V(1+α),代入平衡常数计算公式 计算即可。 29.(15 分)某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。 实验(一) 碘含量的测定 取 0.0100 mol·Lˉ1 的 AgNO3 标准溶液装入滴定管,取 100.00 mL 海带浸取原液至滴定 池,用电势滴定法测定碘含量。测的的电动势(E)反映溶液中 c(Iˉ)的变化,部分数据如 下表: V(AgNO3)/mL 15.00 19.00 19.80 19.98 20.00 20.02 21.00 23.00 25.00 E/mV 实验(二) -225 -200 -150 -100 50.0 碘的制取 175 275 300 325 另制海带浸取原液,甲、乙两种实验方案如下: 已知:3I2+6NaOH=5NaI+NaIO3+3H2O 请回答: (1) 实验(一) 中的仪器名称:仪器 A (2) ①根据表中数据绘制滴定曲线: , 仪器 B 。②该次滴定终点时用去 AgNO3 溶液的体积为 量为 %。 mL,计算得海带中碘的百分含 (3) ①分液漏斗使用前须检漏,检漏方法为 ②步骤 X 中,萃取后分液漏斗内观察到的现象是 ③下列有关步骤 Y 的说法,正确的是 A.应控制 NaOH 溶液的浓度和体积 B.将碘转化呈离子进入水层 。。。C.主要是除去海带浸取原液中的有机杂质 D.NaOH 溶液可以由乙醇代替 ④实验(二) 中操作 Z 的名称是 。。(4) 方案甲中采用蒸馏不合理,理由是 答案: 分液漏斗因为有旋塞与玻璃塞,应该检验两个地方:关闭分液漏斗的旋塞,向分液 漏斗中注入少量水,观察旋塞周围是否渗水,如不渗水,再将旋塞旋转 180 度,如不渗水, 证明旋塞部位不漏液良好(这也是酸式滴定管的检漏方法)。塞好上口瓶塞,用食指摁住瓶塞, 另一只手扶住旋塞处,把分液漏斗倒立过来,观察瓶塞处是否渗水,如不渗水,将分液漏斗 正立后并将瓶塞旋转 180 度塞紧,如不渗水,证明瓶塞部位不漏水(这也是容量瓶的检漏方 法) 注:容量瓶 滴定管分液漏斗使用前均需要检漏。(3)③ AB c 答案有机杂质在步骤 X 就已经分开。④操作 Z 只能填过滤,如果写萃取,又回到前面步骤中去了。
2015 年普通高等学校招生全国统一考试 浙江卷·理科综合·化学部分 7.下列说法不正确的是 A.液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动 性B.常压下,0℃时冰的密度比水的密度小,水在 4℃时密度最大,这些都与分子间的氢 键有关 C.石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 D.燃料的脱硫脱氮、SO2 的回收利用和 NOx 的催化转化都是减少酸雨产生的措施 8.下列说法正确的是 A.为测定新制氯水的 pH,用玻璃棒蘸取液体滴在 pH 试纸上,与标准比色卡对照即可 B.做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸。如果在沸腾前发现忘记加沸 石,应立即停止加热,冷却后补加 C.在未知溶液中滴加 BaCl2 溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知 24 23 ˉˉ溶液中存在 SO 或 SO D.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、 干燥的方法 9.右下表为元素周期表的一部分,其中 X、Y、Z、W 为短周期元素,W 元素的核电荷数 为 X 元素的 2 倍。下列说法正确的是 XA.X、W、Z 元素的原子半径及它们的气态氢化物的热稳定性均依次 YZTW递增 B.Y、Z、W 元素在自然界中均不能以游离态存在,它们的最高价氧 化物的水化物的酸性依次递增 第 9 题表 C.YX2 晶体熔化、液态 WX3 气化均需克服分子间作用力 D.根据元素周期律,可以推测 T 元素的单质具有半导体特性,T2X3 具有氧化性和还原 性10.下列说法不正确的是 A.己烷有 4 种同分异构体,它们的熔点、沸点各不相同 B.在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属 于取代反应 C.油脂皂化反应得到高级脂肪酸盐与甘油 —[ D.聚合物( 2—]n )可由单体 CH3CH=CH2 和 CH2=CH2 加聚制得 2— —— 2CH CH CHCH |3 CH 11 .在 固 态 金 属 氧 化 物 电 解 池 中 ,高 温 共 电 解 H2O-CO2 混合气体制备 H2 和 CO 是一种新的能 源利用方式,基本原理如图所示。下列说法不 正确的是 A.X 是电源的负极 B.阴极的反应式是:H2O+2eˉ=H2+O2ˉ CO2+2eˉ=CO+O2ˉ C.总反应可表示为:H2O+CO2=H2+CO+O2 D.阴、阳两极生成的气体的物质的量之比是 1︰1 12.40℃时,在氨-水体系中不断通入 CO2,各种离子的变化趋势如下图所示。下列说法不 正确的是 +4 323 ˉˉA.在 pH=9.0 时,c(NH )>c(HCO )>c(NH2COOˉ)>c(CO ) B.不同 pH 的溶液中存在关系: +4 23 3+ˉˉc(NH )+c(H )=2c(CO )+c(HCO )+c(NH2COOˉ)+c(OHˉ) ( ) c OHˉ C.随着 CO2 的通入, 不断增大 32( · ) c NHH O D.在溶液中 pH 不断降低的过程中,有含 NH2COOˉ的中间产物生成 13.某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为 Fe2O3、SiO2、Al2O3,不考虑其他杂 质) 制取七水合硫酸亚铁(FeSO4·7H2O) ,设计了如下流程: 固体 1 足量酸 NaOH 溶液 控制 pH 烧渣 固体 2 溶液 2 试剂 X 溶液 1 FeSO4·7H2O 下列说法不正确的是 A.溶解烧渣选用足量硫酸,试剂 X 选用铁粉 B.固体 1 中一定含有 SiO2,控制 pH 是为了使 Al3+转化为 Al(OH)3,进入固体 2 C.从溶液 2 得到 FeSO4·7H2O 产品的过程中,须控制条件防止其氧化和分解 D.若改变方案,在溶液 1 中直接加 NaOH 至过量,得到的沉淀用硫酸溶解,其溶液经 结晶分离也可得到 FeSO4·7H2O 26.(10 分)化合物 X 是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成: 已知:RXROH;RCHO+CH3COOR-RCH=CHCOOR’ 请回答: (1) E 中官能团的名称是 (3) X 的结构简式 。(2) B+D→F 的化学方程式 。。(4) 对于化合物 X,下列说法正确的是 。A.能发生水解反应 B.不与浓硝酸发生取代反应 D.能发生银镜反应 C.能使 Br2/CCl4 溶液褪色 (5) 下列化合物中属于 F 的同分异构体的是 。ACH2OCH2CH2CHO .BCH CHCH2CH2CHO .OCCH2 CHCH CHCH CHCH CHCOOH COOCH2CH2CH3 .D.27.Ⅰ.(6 分) 请回答: (1) H2O2 的电子式___________。 (2) 镁燃烧不能用 CO2 灭火,用化学方程式表示其理由________________。 (3) 在 AgCl 沉淀中加入 KBr 溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程 式_____________。 (4) 完成以下氧化还原反应的离子方程式: 424 )Mn2++( )CO2↑+________ ˉˉ()MnO +( )C2O +______=( Ⅱ.(12 分) 化合物甲和 NaAlH4 都是重要的还原剂。一定条件下金属钠和 H2 反应生成 甲。甲与水反应可产生 H2,甲与 AlCl3 反应可得到 NaAlH4。将 4.80g 甲加热至完全分 解,得到金属钠和 2.24 L(已折算成标准状况) 的 H2。 请推测并回答: (1) 甲的化学式__________。 (2) 甲与 AlCl3 反应得到 NaAlH4 的化学方程式__________。 (3) NaAlH4 与水发生氧化还原反应的化学方程式__________。 (4)甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为 Fe2O3)脱锈过程 发生的化学方程式___________。 (5) 某同学认为:用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓硫 酸干燥,再与金属钠反应,得到固体物质即为纯净的甲;取该固体物质与水反应, 若能产生 H2,即可证明得到的甲一定是纯净的。 判断该同学设想的制备和验纯方法的合理性并说明理由___________。 28.(15 分)乙苯催化脱氢制苯乙烯反应: (1)已知: 化学键 键能/kJ·molˉ1 C-H C-C C=C H-H 412 348 612 436 计算上述反应的△H=________ kJ·mol-1。 (2)维持体系总压强 p 恒定,在温度 T 时,物质的量为 n、体积为 V 的乙苯蒸汽发生 催化脱氢反应。已知乙苯的平衡转化率为 α,则在该温度下反应的平衡常数 K= ____________(用 α 等符号表示)。 (3)工业上,通常在乙苯蒸汽中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比 为 1︰9),控制反应温度 600℃,并保持体系总压为常压的条件下进行反应。在不 同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了 H2 以外的产物中苯乙烯的物质的量分数)示意图如下: ①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实___________。 ②控制反应温度为 600℃的理由是____________。 (3)某研究机构用 CO2 代替水蒸气开发了绿色化学合成工艺—-乙苯-二氧化碳耦合催 化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生 产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2 +C=2CO。新工艺的特点有_________(填编号)。 ①CO2 与 H2 反应,使乙苯脱氢反应的化学平衡右移 ②不用高温水蒸气,可降低能量消耗 ③有利于减少积炭 ④有利用 CO2 资源利用 29.(15 分)某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。 实验(一) 碘含量的测定 取 0.0100 mol·Lˉ1 的 AgNO3 标准溶液装入滴定管,取 100.00 mL 海带浸取原液至滴定 池,用电势滴定法测定碘含量。测的的电动势(E)反映溶液中 c(Iˉ)的变化,部分数据如 下表: V(AgNO3)/mL 15.00 19.00 19.80 19.98 20.00 20.02 21.00 23.00 25.00 E/mV 实验(二) -225 -200 -150 -100 50.0 碘的制取 175 275 300 325 另制海带浸取原液,甲、乙两种实验方案如下: 已知:3I2+6NaOH=5NaI+NaIO3+3H2O 请回答: (1) 实验(一) 中的仪器名称:仪器 A (2) ①根据表中数据绘制滴定曲线: , 仪器 B 。②该次滴定终点时用去 AgNO3 溶液的体积为 量为 %。 mL,计算得海带中碘的百分含 (3) ①分液漏斗使用前须检漏,检漏方法为 ②步骤 X 中,萃取后分液漏斗内观察到的现象是 ③下列有关步骤 Y 的说法,正确的是 A.应控制 NaOH 溶液的浓度和体积 B.将碘转化呈离子进入水层 。。。C.主要是除去海带浸取原液中的有机杂质 D.NaOH 溶液可以由乙醇代替 ④实验(二) 中操作 Z 的名称是 。。(4) 方案甲中采用蒸馏不合理,理由是 2015 年普通高等学校招生全国统一考试 浙江卷·理科综合·化学部分 总体感受:考完试的时候,多个学生反应化学非常简单。我拿到试卷认真做了一遍,感觉 最近 3 年题型越来越接近全国卷,应该是“改邪归正”了。记得以前我跟学生们开玩笑, 浙江卷化学考个 30-40 分的,拿全国卷随便考 60-70 分。选择题 13 题是很失败的一道题,26 题紧跟考纲,恰到好处。27 题再次回到去年 7 月份培训时任雪明教研员说的电子式、方程 式配平方面,后面的 NaAlH4 在多套模拟题出现,学生一般不会觉得陌生,28 题求反应热, 可能有些学生方法错误,但答案最终是正确的,29 题分液漏斗的检漏应该很麻烦,有旋塞 与玻璃塞,应该要检验 2 个地方,标准答案写的过于简略。本套试卷重点强调知识,对能 力考查方面弱化了,所以学生觉得简单,试卷亮点也很难找出。 7.下列说法不正确的是 A.液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动 性B.常压下,0℃时冰的密度比水的密度小,水在 4℃时密度最大,这些都与分子间的氢 键有关 C.石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 D.燃料的脱硫脱氮、SO2 的回收利用和 NOx 的催化转化都是减少酸雨产生的措施 答案:C 纳米银离子的聚集属于物理变化,其他说法是正确的。 8.下列说法正确的是 A.为测定新制氯水的 pH,用玻璃棒蘸取液体滴在 pH 试纸上,与标准比色卡对照即可 B.做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸。如果在沸腾前发现忘记加沸 石,应立即停止加热,冷却后补加 C.在未知溶液中滴加 BaCl2 溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知 24 23 ˉˉ溶液中存在 SO 或 SO D.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、 干燥的方法 答案:B A.氯水有漂白性。C答案无法排除银离子的干扰。D混有少量硝酸钾的氯化钠,应采用蒸 发结晶的方法,反过来混有氯化钠的硝酸钾应采用蒸发浓缩,冷却结晶的方法。 9.右下表为元素周期表的一部分,其中 X、Y、Z、W 为短周期元素,W 元素的核电荷数 为 X 元素的 2 倍。下列说法正确的是 XA.X、W、Z 元素的原子半径及它们的气态氢化物的热稳定性均依次 YZTW递增 B.Y、Z、W 元素在自然界中均不能以游离态存在,它们的最高价氧 化物的水化物的酸性依次递增 第 9 题表 C.YX2 晶体熔化、液态 WX3 气化均需克服分子间作用力 D.根据元素周期律,可以推测 T 元素的单质具有半导体特性,T2X3 具有氧化性和还原 性答案:D X:O Y:Si Z:P W:S A 答案 X、W、Z 非金属性依次减弱,所以氢化物稳 定性依次减弱。 B 答案硫可以单质存在 10.下列说法不正确的是 C 二氧化硅晶体熔化破坏共价键 A.己烷有 4 种同分异构体,它们的熔点、沸点各不相同 B.在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属 于取代反应 C.油脂皂化反应得到高级脂肪酸盐与甘油 —[ D.聚合物( 2—]n )可由单体 CH3CH=CH2 和 CH2=CH2 加聚制得 2— —— 2CH CH CHCH |3 CH 答案:A 己烷有 5 种同分异构体,结构不同,熔沸点不同。 其他说法都正确 11.在固态金属氧化物电解池中, 高温共电解 H2O-CO2 混合气体制备 H2 和 CO 是 一种新的能源利用方式,基本原理如图所示。下 列说法不正确的是 A.X 是电源的负极 B.阴极的反应式是:H2O+2eˉ=H2+O2ˉ CO2+2eˉ=CO+O2ˉ C.总反应可表示为:H2O+CO2=H2+CO+O2 D.阴、阳两极生成的气体的物质的量之比是 1︰1 答案:D 考察熔融盐原电池,很明显 D 答案气体物质的量之比为 2:1 12.40℃时,在氨-水体系中不断通入 CO2,各种离子的变化趋势如下图所示。下列说法不 正确的是 +4 323 ˉˉA.在 pH=9.0 时,c(NH )>c(HCO )>c(NH2COOˉ)>c(CO ) B.不同 pH 的溶液中存在关系: +4 23 3+ˉˉc(NH )+c(H )=2c(CO )+c(HCO )+c(NH2COOˉ)+c(OHˉ) ( ) c OHˉ C.随着 CO2 的通入, 不断增大 32( · ) c NHH O D.在溶液中 pH 不断降低的过程中,有含 NH2COOˉ的中间产物生成 答案:C ( ) c OHˉ A 答案从图可以看出,B 答案是电荷守恒,C 答案 =Kb/c(NH +4 ) ,由于 c(NH 32( · ) c NHH O ( ) c OHˉ +4 )逐渐增大,所以 逐渐减小。 32( · ) c NHH O 13.某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为 Fe2O3、SiO2、Al2O3,不考虑其他杂 质) 制取七水合硫酸亚铁(FeSO4·7H2O) ,设计了如下流程: 固体 1 足量酸 NaOH 溶液 控制 pH 烧渣 固体 2 溶液 2 试剂 X 溶液 1 FeSO4·7H2O 下列说法不正确的是 A.溶解烧渣选用足量硫酸,试剂 X 选用铁粉 B.固体 1 中一定含有 SiO2,控制 pH 是为了使 Al3+转化为 Al(OH)3,进入固体 2 C.从溶液 2 得到 FeSO4·7H2O 产品的过程中,须控制条件防止其氧化和分解 D.若改变方案,在溶液 1 中直接加 NaOH 至过量,得到的沉淀用硫酸溶解,其溶液经 结晶分离也可得到 FeSO4·7H2O 答案:D 明显溶液中有硫酸铁。 26.(10 分)化合物 X 是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成: 已知:RXROH;RCHO+CH3COOR-RCH=CHCOOR’ 请回答: (1) E 中官能团的名称是 (3) X 的结构简式 。(2) B+D→F 的化学方程式 。。(4) 对于化合物 X,下列说法正确的是 。A.能发生水解反应 B.不与浓硝酸发生取代反应 D.能发生银镜反应 C.能使 Br2/CCl4 溶液褪色 (5) 下列化合物中属于 F 的同分异构体的是 。ACH2OCH2CH2CHO .BCH CHCH2CH2CHO .OCCH2 CHCH CHCH CHCH CHCOOH COOCH2CH2CH3 .D.答案:此题很多学生能拿满分 27.Ⅰ.(6 分) 请回答: (1) H2O2 的电子式___________。 (2) 镁燃烧不能用 CO2 灭火,用化学方程式表示其理由________________。 (3) 在 AgCl 沉淀中加入 KBr 溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程 式_____________。 (4) 完成以下氧化还原反应的离子方程式: 424 )Mn2++( )CO2↑+________ ˉˉ()MnO +( )C2O +______=( Ⅱ.(12 分) 化合物甲和 NaAlH4 都是重要的还原剂。一定条件下金属钠和 H2 反应生成 甲。甲与水反应可产生 H2,甲与 AlCl3 反应可得到 NaAlH4。将 4.80g 甲加热至完全分 解,得到金属钠和 2.24 L(已折算成标准状况) 的 H2。 请推测并回答: (1) 甲的化学式__________。 (2) 甲与 AlCl3 反应得到 NaAlH4 的化学方程式__________。 (3) NaAlH4 与水发生氧化还原反应的化学方程式__________。 (4)甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为 Fe2O3)脱锈过程 发生的化学方程式___________。 (5) 某同学认为:用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓硫 酸干燥,再与金属钠反应,得到固体物质即为纯净的甲;取该固体物质与水反应, 若能产生 H2,即可证明得到的甲一定是纯净的。 判断该同学设想的制备和验纯方法的合理性并说明理由___________。 答案:27-II 中的第(4)问,因为是脱锈过程,所以得到的是铁,另一个是 NaOH 28.(15 分)乙苯催化脱氢制苯乙烯反应: (1)已知: 化学键 键能/kJ·molˉ1 C-H C-C C=C H-H 412 348 612 436 计算上述反应的△H=________ kJ·mol-1。 (2)维持体系总压强 p 恒定,在温度 T 时,物质的量为 n、体积为 V 的乙苯蒸汽发生 催化脱氢反应。已知乙苯的平衡转化率为 α,则在该温度下反应的平衡常数 K= ____________(用 α 等符号表示)。 (3)工业上,通常在乙苯蒸汽中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比 为 1︰9),控制反应温度 600℃,并保持体系总压为常压的条件下进行反应。在不 同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了 H2 以外的产物中苯乙烯的物质的量分数)示意图如下: ①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实___________。 ②控制反应温度为 600℃的理由是____________。 (3)某研究机构用 CO2 代替水蒸气开发了绿色化学合成工艺—-乙苯-二氧化碳耦合催 化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生 产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2 +C=2CO。新工艺的特点有_________(填编号)。 ①CO2 与 H2 反应,使乙苯脱氢反应的化学平衡右移 ②不用高温水蒸气,可降低能量消耗 ③有利于减少积炭 ④有利用 CO2 资源利用 答案: (1)△H=5×412+348-612-3×412-436=124 kJ/mol(把苯环看做一个整体,因为左右都有 这个结构,可以抵消) (2 恒 T,P 下,V 与 n 成 正比。根据三段式,后来体积为V(1+α),代入平衡常数计算公式 计算即可。 29.(15 分)某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。 实验(一) 碘含量的测定 取 0.0100 mol·Lˉ1 的 AgNO3 标准溶液装入滴定管,取 100.00 mL 海带浸取原液至滴定 池,用电势滴定法测定碘含量。测的的电动势(E)反映溶液中 c(Iˉ)的变化,部分数据如 下表: V(AgNO3)/mL 15.00 19.00 19.80 19.98 20.00 20.02 21.00 23.00 25.00 E/mV 实验(二) -225 -200 -150 -100 50.0 碘的制取 175 275 300 325 另制海带浸取原液,甲、乙两种实验方案如下: 已知:3I2+6NaOH=5NaI+NaIO3+3H2O 请回答: (1) 实验(一) 中的仪器名称:仪器 A (2) ①根据表中数据绘制滴定曲线: , 仪器 B 。②该次滴定终点时用去 AgNO3 溶液的体积为 量为 %。 mL,计算得海带中碘的百分含 (3) ①分液漏斗使用前须检漏,检漏方法为 ②步骤 X 中,萃取后分液漏斗内观察到的现象是 ③下列有关步骤 Y 的说法,正确的是 A.应控制 NaOH 溶液的浓度和体积 B.将碘转化呈离子进入水层 。。。C.主要是除去海带浸取原液中的有机杂质 D.NaOH 溶液可以由乙醇代替 ④实验(二) 中操作 Z 的名称是 。。(4) 方案甲中采用蒸馏不合理,理由是 答案: 分液漏斗因为有旋塞与玻璃塞,应该检验两个地方:关闭分液漏斗的旋塞,向分液 漏斗中注入少量水,观察旋塞周围是否渗水,如不渗水,再将旋塞旋转 180 度,如不渗水, 证明旋塞部位不漏液良好(这也是酸式滴定管的检漏方法)。塞好上口瓶塞,用食指摁住瓶塞, 另一只手扶住旋塞处,把分液漏斗倒立过来,观察瓶塞处是否渗水,如不渗水,将分液漏斗 正立后并将瓶塞旋转 180 度塞紧,如不渗水,证明瓶塞部位不漏水(这也是容量瓶的检漏方 法) 注:容量瓶 滴定管分液漏斗使用前均需要检漏。(3)③ AB c 答案有机杂质在步骤 X 就已经分开。④操作 Z 只能填过滤,如果写萃取,又回到前面步骤中去了。
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





