
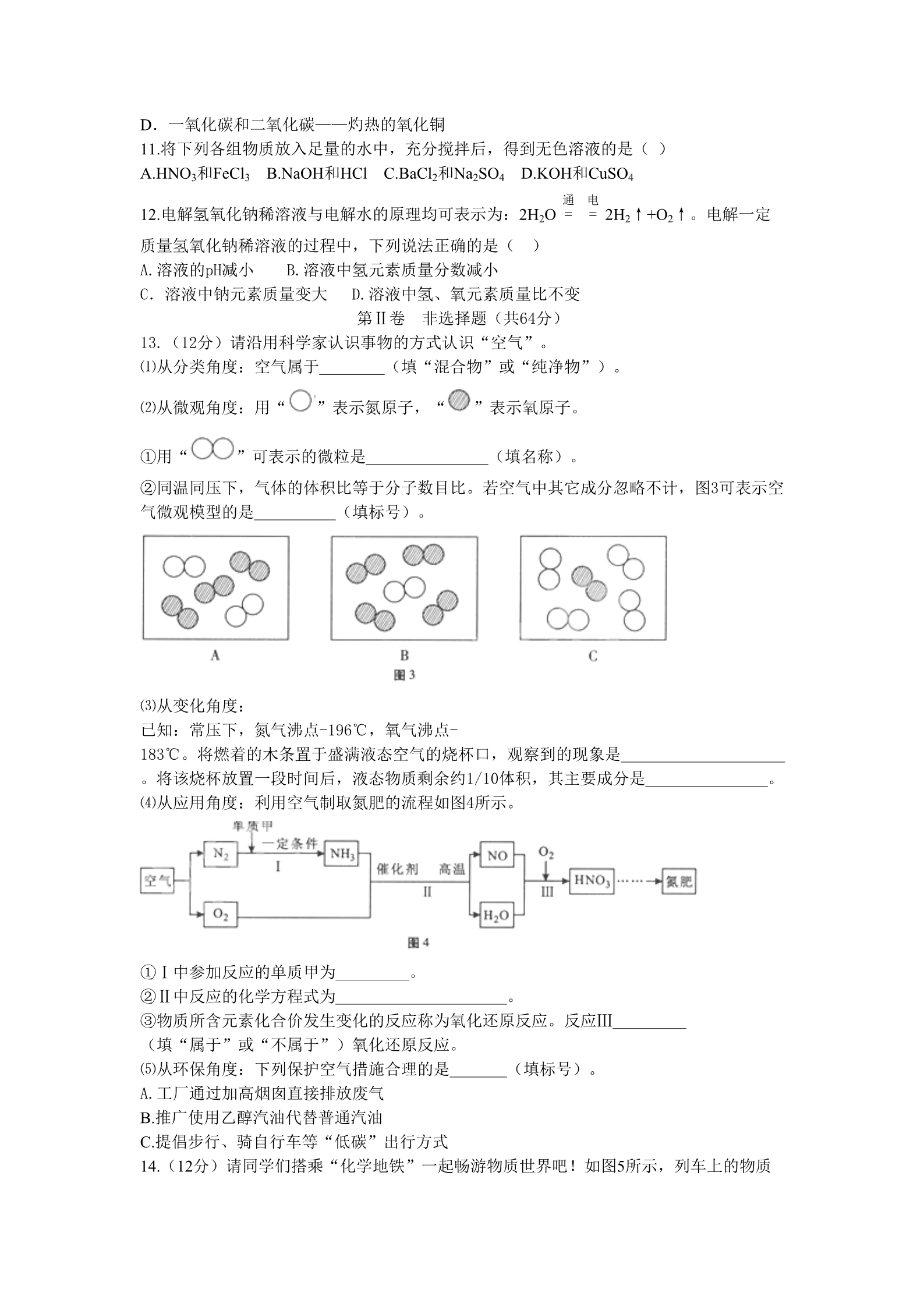

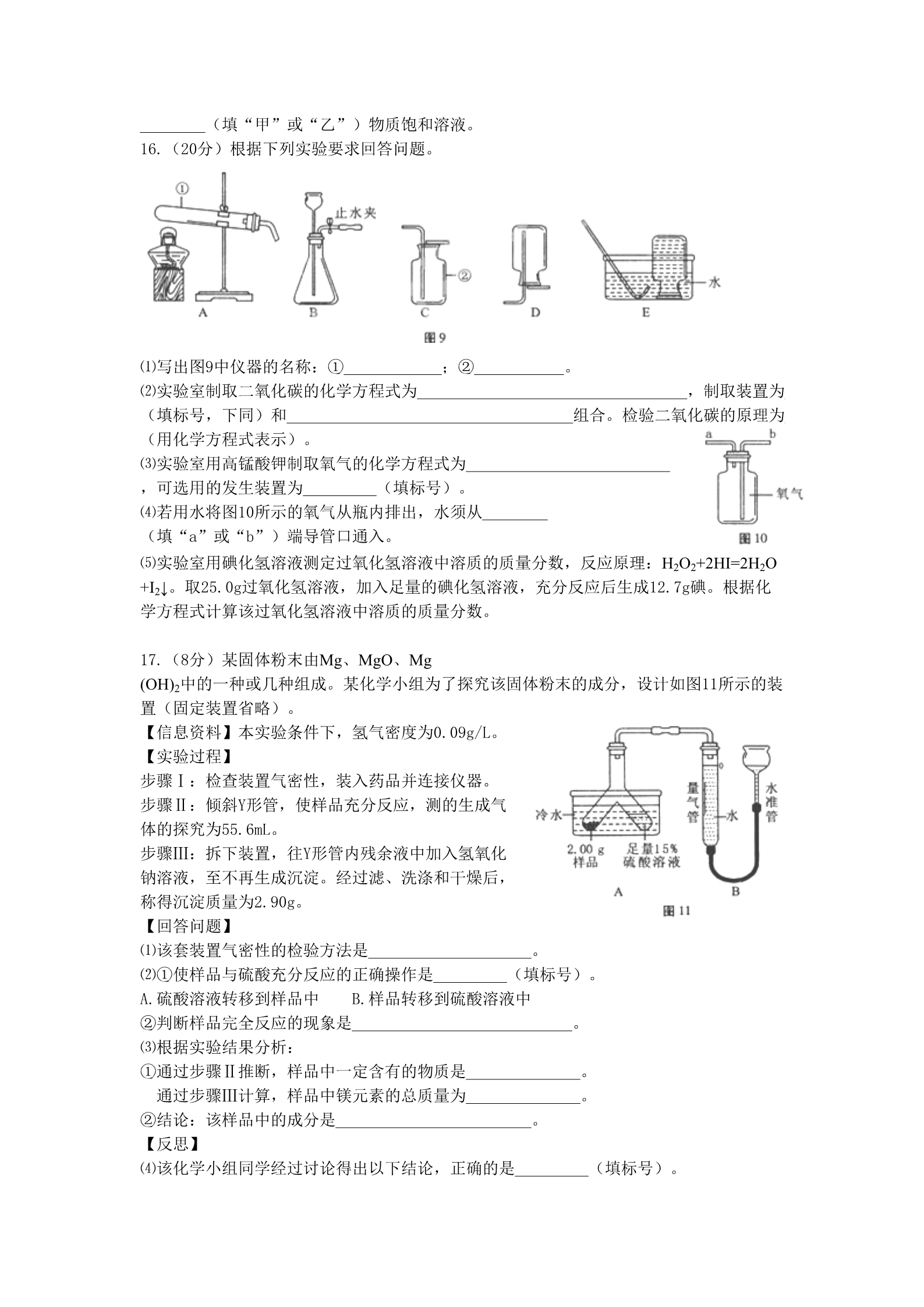

2016年福州市初中毕业会考、高级中等学校招生考试化学试卷 (全卷17小题;满分100分,考试时间60分钟) 可能用到的相对分子质量:H-1 C-12 O-16 Na-23 Mg-24 S-32 I-127 第Ⅰ卷 选择题(每小题3分,共36分) 第Ⅰ卷包括12小题,每题3,共36分。每题只有一个选项符合题意 1.下列生活用品所含的主要材料,属于有机合成材料的是( ) A.塑料水杯 B.纯棉毛巾 C.羊毛围巾 D.蚕丝被芯 2.人体缺钙易引发的病症是( ) A.贫血 B.夜盲症 C.骨质疏松 D.甲状腺肿大 3.下列与金属相关的说法正确的是( )A.生铁和钢性能完全相同 B.炼铁过程只发生物理变化 C.常温下所以金属均为固态 D.铁在潮湿的空气中易生锈 4.下列关于“酒精温度计遇冷读数下降”的微观解释正确的是( ) A.分子停止运动 B.分子体积缩小 C.分子间间隔减小 D.分子种类发生了变化 5.下列化学用语与含义相符的是( ) A.Fe3O4——氧化铁 B.2N——2个氮元素 C.H+——1个氢离子 D.Cl2——2个氯原子 6.图1是钠元素在元素周期表中的信息和钠原子结构示意图。下列说法错误的是( ) A.钠的原子序数为11 B.钠原子核外有3个电子层 C.钠的相对原子质量为22.989 D.化学反应中,钠原子易得电子 7.实验室配制一定质量分数的稀硫酸并用其除铁锈,部分操作如图2所示,其中正确的是( )8.以下实验能比较出铜和银的金属活动性强弱的是( ) A.测定两金属的密度 B.铜片放入硝酸银溶液中 C.将两种金属相互刻画 D.铜片、银片分别放入稀硫酸中 9.下列物质的用途主要利用其化学性质的是( ) A.铜丝作导线 B.干冰用于人工降雨 C.天然气作燃料 D.金刚石用于切割玻璃 10.下列鉴别物质所用的方法或试剂,错误的是( ) A.硬水和软水——观察颜色 B.氯化钾和氯化铵——氢氧化钠 C.合成纤维和羊毛纤维——点燃闻气味 D.一氧化碳和二氧化碳——灼热的氧化铜 11.将下列各组物质放入足量的水中,充分搅拌后,得到无色溶液的是( ) A.HNO3和FeCl3 B.NaOH和HCl C.BaCl2和Na2SO4 D.KOH和CuSO4 通电12.电解氢氧化钠稀溶液与电解水的原理均可表示为:2H2O = =2H2↑+O2↑。电解一定 质量氢氧化钠稀溶液的过程中,下列说法正确的是( A.溶液的pH减小 B.溶液中氢元素质量分数减小 )C.溶液中钠元素质量变大 D.溶液中氢、氧元素质量比不变 第Ⅱ卷 非选择题(共64分) 13.(12分)请沿用科学家认识事物的方式认识“空气”。 ⑴从分类角度:空气属于 (填“混合物”或“纯净物”)。 ⑵从微观角度:用“ ”表示氮原子,“ ”表示氧原子。 ①用“ ”可表示的微粒是 (填名称)。 ②同温同压下,气体的体积比等于分子数目比。若空气中其它成分忽略不计,图3可表示空 气微观模型的是 (填标号)。 ⑶从变化角度: 已知:常压下,氮气沸点-196℃,氧气沸点- 183℃。将燃着的木条置于盛满液态空气的烧杯口,观察到的现象是 。将该烧杯放置一段时间后,液态物质剩余约1/10体积,其主要成分是 ⑷从应用角度:利用空气制取氮肥的流程如图4所示。 。①Ⅰ中参加反应的单质甲为 ②Ⅱ中反应的化学方程式为 。。③物质所含元素化合价发生变化的反应称为氧化还原反应。反应Ⅲ (填“属于”或“不属于”)氧化还原反应。 ⑸从环保角度:下列保护空气措施合理的是 A.工厂通过加高烟囱直接排放废气 (填标号)。 B.推广使用乙醇汽油代替普通汽油 C.提倡步行、骑自行车等“低碳”出行方式 14.(12分)请同学们搭乘“化学地铁”一起畅游物质世界吧!如图5所示,列车上的物质 可与各站的对应物质发生一步进行的反应, 方可驶向下一站。“2— 5号站”各站的对应物质属于不同类别的纯净 物。 ⑴若列车上的物质为“碳酸钠溶液”。 ①列车途经“1号站”时,若指示剂为紫色石 蕊溶液,溶液变 色。 ②列车途经“2号站”时,若氧化物为二氧化 碳,二氧化碳与碳酸钠溶液反应生成碳酸氢 钠(NaHCO3)的化学方程式为 。③列车途经“3号站”时,反应的化学方程式为 (写一个)。 ⑵“碳酸钠溶液”列车抵达“4号站”时,将列车上的物质更换为“稀盐酸”后出发。 ①与“碳酸钠溶液”和“稀盐酸”都能反应的“4号站”的对应物质为 (填一种)。②“稀盐酸”列车途经“5号站”时,反应的化学方程式为 (写一个)。 ③“稀盐酸”列车途经“1、2、3号站”时,原“碳酸钠溶液”列车途经某站的对应物质必 须更换为 (写一种物质),“稀盐酸”列车方能走完。 15(12分)Ⅰ质量守恒定律的发现对化学的发展做出了重要贡献。 ⑴通过称量下列各组试剂在密闭容器内混合前后的总质量,能验证质量守恒定律的是 (填标号)。 A.蔗糖和水 B.氯化钠溶液和硝酸钾溶液 C.铁和氯化铜溶液 ⑵在氧气中点燃红磷的实验过程,固体变化如图6所示。 ①从燃烧条件分析,固体质量在t1前没有发生变化的原因是 。②该反应的化学方程式为 ③参加反应的氧气质量为 。g。 ⑶某反应的微观示意图如图7所示: ①该反应所属的基本反应类型为 。②参加反应的甲物质和生成的丙物质分子数目比为 。Ⅱ甲和乙两种固态物质的饱和溶液中溶质质量分数与温度 的关系如图8所示。 ⑴甲和乙两种物质的溶解度随温度的升高而 (填“增大”或“减小”)。 ⑵下列对P点的含义叙述正确的是 (填标号)。 A.t1℃时,甲和乙两种物质的溶解度相等 B.t1℃时,甲和乙两种物质溶液的溶质质量分数相等 C.t1℃时,甲和乙两种物质的饱和溶液中溶质的质量相等 ⑶25g乙物质完全溶于100g水中所需的最低温度是 ℃。 ⑷t2℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是 (填“甲”或“乙”)物质饱和溶液。 16.(20分)根据下列实验要求回答问题。 ⑴写出图9中仪器的名称:① ⑵实验室制取二氧化碳的化学方程式为 (填标号,下同)和 ;② 。,制取装置为 组合。检验二氧化碳的原理为 (用化学方程式表示)。 ⑶实验室用高锰酸钾制取氧气的化学方程式为 ,可选用的发生装置为 (填标号)。 ⑷若用水将图10所示的氧气从瓶内排出,水须从 (填“a”或“b”)端导管口通入。 ⑸实验室用碘化氢溶液测定过氧化氢溶液中溶质的质量分数,反应原理:H2O2+2HI=2H2O +I2↓。取25.0g过氧化氢溶液,加入足量的碘化氢溶液,充分反应后生成12.7g碘。根据化 学方程式计算该过氧化氢溶液中溶质的质量分数。 17.(8分)某固体粉末由Mg、MgO、Mg (OH)2中的一种或几种组成。某化学小组为了探究该固体粉末的成分,设计如图11所示的装 置(固定装置省略)。 【信息资料】本实验条件下,氢气密度为0.09g/L。 【实验过程】 步骤Ⅰ:检查装置气密性,装入药品并连接仪器。 步骤Ⅱ:倾斜Y形管,使样品充分反应,测的生成气 体的探究为55.6mL。 步骤Ⅲ:拆下装置,往Y形管内残余液中加入氢氧化 钠溶液,至不再生成沉淀。经过滤、洗涤和干燥后, 称得沉淀质量为2.90g。 【回答问题】 ⑴该套装置气密性的检验方法是 。⑵①使样品与硫酸充分反应的正确操作是 (填标号)。 A.硫酸溶液转移到样品中 B.样品转移到硫酸溶液中 ②判断样品完全反应的现象是 ⑶根据实验结果分析: 。①通过步骤Ⅱ推断,样品中一定含有的物质是 通过步骤Ⅲ计算,样品中镁元素的总质量为 ②结论:该样品中的成分是 【反思】 。。。⑷该化学小组同学经过讨论得出以下结论,正确的是 (填标号)。 A.利用该实验方案,能计算出样品中各物质的质量 B.实验前可通过样品的质量估算硫酸溶液的质量,确保样品完全反应 C.仅称量步骤Ⅱ中Y形管内药品减轻的质量,即能计算出样品中各物质的质量 2016年福州市初中毕业会考、高级中等学校招生考试 化学试卷参考答案 第Ⅰ卷 选择题(每小题3分,共36分) 1.A 2.C 3.D 4.C 5.C 6.D 7.B 8.B 9.C 10.A 11.B 12.B 第Ⅱ卷 非选择题(共64分) 13.(12分)⑴混合物 ⑵①氮分子 ②C ⑶燃着的木条熄灭 液氧 ⑷①H2 ②4NH3+5O2 4NO+6H2O ③属于 ⑸BC 14.(12分)⑴①蓝 ②Na2CO3+H2O+CO2==2NaHCO3 ③Na2CO3+Ca(OH)2==CaCO3↓+2NaOH ⑵①AgNO3 ②Fe+2HCl==FeCl2+H2↑ ③CuO 15.(12分)Ⅰ⑴C ⑵①温度未达到红磷的着火点 ②4P + 5O2 点燃 2P2O5 ③8.0 ⑶①置换反应 ②1:2 Ⅱ⑴增大 ⑵A 16.(20分)⑴试管 集气瓶 ⑵CaCO3+2HCl==CaCl2+H2O+CO2↑ B C CO2 +Ca(OH)2 ==CaCO3↓+ H2O ⑶2KMnO4 △ K2MnO4 + MnO2 + O2↑ A ⑷b ⑸6.8% 17.(8分)⑴把水准管下移一段距离,使水准管和量气管中的水形成一定的液面差,如果 一段时间后液面差保持不变,则说明装置不漏气;反之,则表示装置漏气。 ⑵①A ②Y形管中的固体全部消失 ⑶①Mg 1.20 ②Mg、MgO和Mg (OH)2 ⑷AB
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





