
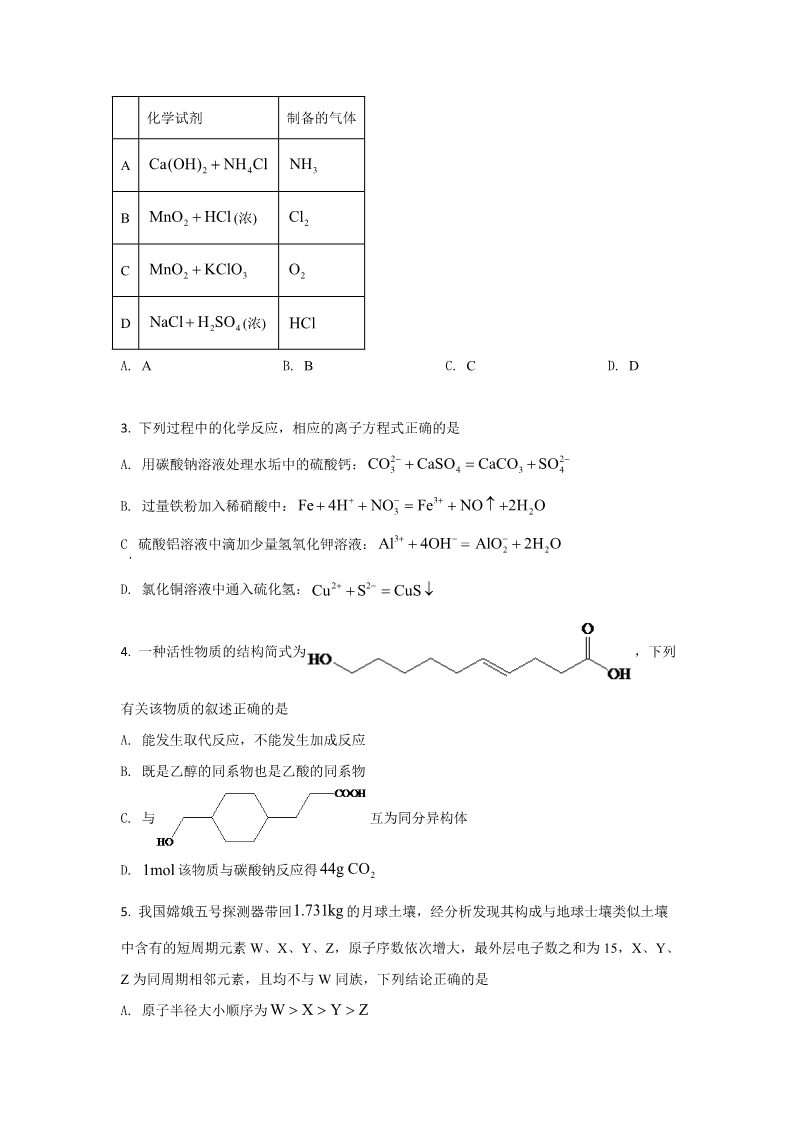
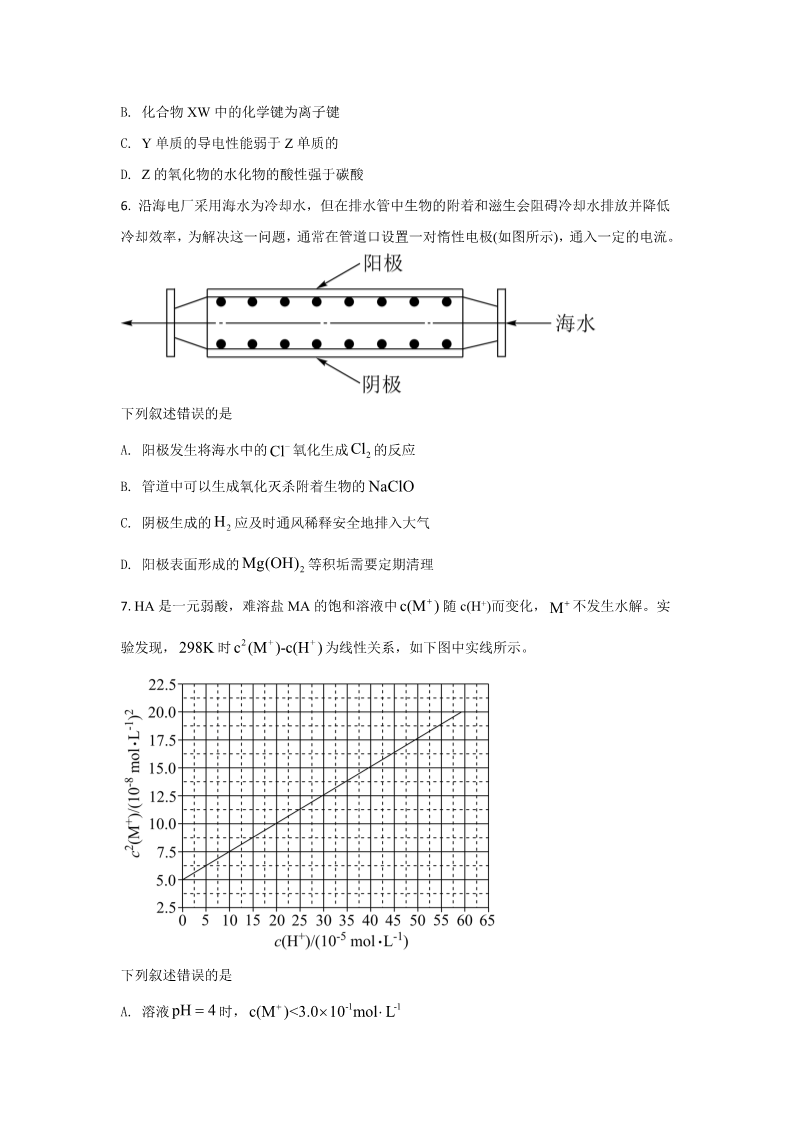
 2021 年普通高等学校招生全国统一考试(全国乙卷) 化 学 注意事项: 1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上,并将自己的姓名、 准考证号、座位号填写在本试卷上。 2.回答选择题时,选出每小题答案后,用 2B 铅笔把答题卡上对应题目的答案标 号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案标号,涂写在本试卷上 无效。 3.作答非选择题时,将答案书写在答题卡上,书写在本试卷上无效。 4.考试结束后,将本试卷和答题卡一并交回。 可能用到的相对原子质量:H 1C 12N 14O 16Na 23Al 27Cl35.5 Fe56 一、选择题 1. 我国提出争取在 2030 年前实现碳达峰,2060 年实现碳中和,这对于改善环境,实现绿色 CO 发展至关重要。碳中和是指 直接有效的是 2 的排放总量和减少总量相当。下列措施中能促进碳中和最 A. B. C. 将重质油裂解为轻质油作为燃料 大规模开采可燃冰作为清洁燃料 通过清洁煤技术减少煤燃烧污染 CO D. 2. 研发催化剂将 2 还原为甲醇 在实验室采用如图装置制备气体,合理的是 化学试剂 制备的气体 Ca(OH)2 NH4Cl NH3 ABCDMnO HCl Cl2 O2 (浓) 2MnO2 KClO3 NaCl H2SO 4 (浓) HCl A. A B. B C. C D. D 3. 下列过程中的化学反应,相应的离子方程式正确的是 CO2 CaSO CaCO SO2 A. 用碳酸钠溶液处理水垢中的硫酸钙: 3434Fe 4H NO Fe3 NO 2H O B. 过量铁粉加入稀硝酸中: 32Al3 4OH AlO 2H O C 硫酸铝溶液中滴加少量氢氧化钾溶液: 222 2 D. 氯化铜溶液中通入硫化氢: Cu S CuS 4. 一种活性物质的结构简式为 ,下列 有关该物质的叙述正确的是 A. 能发生取代反应,不能发生加成反应 B. 既是乙醇的同系物也是乙酸的同系物 C. 与 互为同分异构体 44g CO 该物质与碳酸钠反应得 D. 1mol 21.731kg 5. 我国嫦娥五号探测器带回 的月球土壤,经分析发现其构成与地球士壤类似土壤 中含有的短周期元素 W、X、Y、Z,原子序数依次增大,最外层电子数之和为 15,X、Y、 Z 为同周期相邻元素,且均不与 W 同族,下列结论正确的是 W X Y Z A. 原子半径大小顺序为 B. 化合物 XW 中的化学键为离子键 C. Y 单质的导电性能弱于 Z 单质的 D. Z 的氧化物的水化物的酸性强于碳酸 6. 沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低 冷却效率,为解决这一问题,通常在管道口设置一对惰性电极(如图所示),通入一定的电流。 下列叙述错误的是 Cl 氧化生成 2 的反应 A. 阳极发生将海水中的 Cl B. 管道中可以生成氧化灭杀附着生物的 NaClO HC. 阴极生成的 2 应及时通风稀释安全地排入大气 Mg(OH) D. 阳极表面形成的 2 等积垢需要定期清理 随 c(H+)而变化, 不发生水解。实 7. HA 是一元弱酸,难溶盐 MA 的饱和溶液中 c(M ) M2++验发现, 时为线性关系,如下图中实线所示。 298K c (M )-c(H ) 下列叙述错误的是 -1 -1 pH 4 A. 溶液 时, c(M )<3.010 molL K (MA)=5.010-8 B. MA 的溶度积度积 sp ++–pH=7 C. 溶液 时, c(M )+c(H )=c(A)+c(OH ) K (HA) 2.010-4 D. HA 的电离常数 a三、非选择题:共 174 分。第 22~32 为必考题,每个试题考生都必须作答。第 33~38 题为选考题,考生根据要求作答。 TiO SiO 、Al OMgO 、 、 2 3 8. 磁选后的炼铁高钛炉渣,主要成分有 、以及少量的 CaO 22Fe2O 3 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。 pH 该工艺条件下,有关金属离子开始沉淀和沉淀完全的 金属离子 见下表 Mg2 Fe3 2.2 Ca2 12.4 13.8 Al3 pH 开始沉淀的 3.5 4.7 9.5 c=1.0105 molL1 pH 沉淀完全 的3.2 11.1 回答下列问题: Fe O 3 转化为相应 2TiO SiO 、Al OMgO 、 、 2 3 (1)“焙烧”中, 2 几乎不发生反应, 、CaO 2Al O NH Al SO 的硫酸盐,写出 3 转化为 4 2 的化学方程式_______。 24pH pH 至 11.6,依次析出的 (2)“水浸”后“滤液”的 约为 2.0,在“分步沉淀”时用氨水逐步调节 金属离子是_______。 (3)“母液①”中 2+ 浓度为_______ -1 。Mg molL (4)“水浸渣”在 160℃“酸溶”最适合的酸是_______。“酸溶渣”的成分是_______、_______。 2 TiO xH O (5)“酸溶”后,将溶液适当稀释并加热, 程式是_______。 水解析出 沉淀,该反应的离子方 TiO 22(6)将“母液①”和“母液②”混合,吸收尾气,经处理得_______,循环利用。 9. 氧化石墨烯具有稳定的网状结构,在能源、材料等领域有着重要的应用前景,通过氧化 剥离石墨制备氧化石墨烯的一种方法如下(转置如图所示): H SO NaNO Ⅰ.将浓 、3 、石墨粉末在 c 中混合,置于冰水浴中,剧烈搅拌下,分批缓慢 4 粉末,塞好瓶口。 Ⅱ.转至油浴中,35℃搅拌 1 小时,缓慢滴加一定量的蒸馏水。升温至 98℃并保持 1 小时。 24KMnO 加入 H O Ⅲ.转移至大烧杯中,静置冷却至室温。加入大量蒸馏水,而后滴加 2 至悬浊液由紫色 2变为土黄色。 Ⅳ.离心分离,稀盐酸洗涤沉淀。 Ⅴ.蒸馏水洗涤沉淀。 Ⅵ.冷冻干燥,得到土黄色的氧化石墨烯。 回答下列问题: (1)装置图中,仪器 a、c 的名称分别是_______、_______,仪器 b 的进水口是_______(填字 母)。 KMnO (2)步骤Ⅰ中,需分批缓慢加入 4 粉末并使用冰水浴,原因是_______。 (3)步骤Ⅱ中的加热方式采用油浴,不使用热水浴,原因是_______。 H O (4)步骤Ⅲ中, 2 的作用是_______(以离子方程式表示)。 2SO2 (5)步骤Ⅳ中,洗涤是否完成,可通过检测洗出液中是否存在 _______。 来判断。检测的方法是 4试纸检测来判断 是否洗净,其理由是_______。 pH (6)步骤Ⅴ可用 10. Cl 一氯化碘(ICl)是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合 成中的碘化剂。回答下列问题: (1)历史上海藻提碘中得到一种红棕色液体,由于性质相似,Liebig 误认为是 ICl,从而错过 了一种新元素的发现,该元素是_______。 BaPtCl BaCl Cl 和(2)氯铂酸钡( 6 )固体加热时部分分解为 、2 ,376.8℃时平衡常数 6 ,抽真空后,通过一支管通入 碘蒸气(然后将支管封闭),在 376.8℃,碘蒸气初始压强为 20.0kPa 。376.8℃平衡时,测得 Pt 2K′p 1.0104 Pa2 BaPtCl ,在一硬质玻璃烧瓶中加入过量 p = 2ICl(g) Cl (g) I (g) 烧瓶中压强为32.5kPa ,则 _______kPa ,反应 的平衡常数 ICl 22K=_______(列出计算式即可)。 K(3)McMorris 测定和计算了在 136~180℃范围内下列反应的平衡常数 2NO(g)+2ICl(g) 2NOCl(g)+I2 (g) Kp1 。p2NOCl(g) 2NO(g)+Cl2 (g) Kp2 11lgK ~ lgK ~ p2 得到 和均为线性关系,如下图所示: p1 TTCl ①由图可知,NOCl 分解为 NO 和 反应的 _______0(填“大于”或“小于”) ΔH 2KKp2 表示):该反应的 2ICl(g) Cl (g) I (g) ②反应 的 K=_______(用 、p1 22_______0(填“大于”或“小于”),写出推理过程_______。 ΔH (4)Kistiakowsky 曾研究了 NOCl 光化学分解反应,在一定频率(v)光的照射下机理为: NOCl hv NOCl NOCl NOCl 2NO Cl2 其中 hv 表示一个光子能量, NOCl*表示 NOCl 的激发态。可知,分解 1mol 的 NOCl 需要 吸收_______mol 光子。 Cr 是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。 11. 过渡金属元素铬 回答下列问题: (1)对于基态 Cr 原子,下列叙述正确的是_______(填标号)。 A.轨道处于半充满时体系总能量低,核外电子排布应 51为[Ar]3d 4s B.4s 电子能量较高,总是在比 3s 电子离核更远的地方运动 C.电负性比钾高,原子对键合电子的吸引力比钾大 (2)三价铬离子能形成多种配位化合物。 2 中提供电子对形成配位 Cr NH H OCl 3 3 2 2键的原子是_______,中心离子的配位数为_______。 2 中配体分子 以及分子 NH H O 、PH 3 的空间结构和相应的 (3) Cr NH H OCl 3 3 2 322键角如图所示。 PH NH PH H O 3 的_______,原因是_______, 的 23 中 P 的杂化类型是_______。 3 的沸点比 NH 键角小于 3 的,分析原因_______。 AlCr AlCr 2 具有 (4)在金属材料中添加 2 颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。 r体心四方结构,如图所示,处于顶角位置的是_______原子。设 Cr 和 Al 原子半径分别为 Cr r和Al ,则金属原子空间占有率为_______%(列出计算表达式)。 12. 卤沙唑仑 W 是一种抗失眠药物,在医药工业中的一种合成方法如下: 已知:(ⅰ) (ⅱ) 回答下列问题: (1)A 的化学名称是_______。 (2)写出反应③的化学方程式_______。 (3)D 具有的官能团名称是_______。(不考虑苯环) (4)反应④中,Y 的结构简式为_______。 的(5)反应⑤ 反应类型是_______。 (6)C 的同分异构体中,含有苯环并能发生银镜反应的化合物共有种_______种。 (7)写出 W 的结构简式_______。
2021 年普通高等学校招生全国统一考试(全国乙卷) 化 学 注意事项: 1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上,并将自己的姓名、 准考证号、座位号填写在本试卷上。 2.回答选择题时,选出每小题答案后,用 2B 铅笔把答题卡上对应题目的答案标 号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案标号,涂写在本试卷上 无效。 3.作答非选择题时,将答案书写在答题卡上,书写在本试卷上无效。 4.考试结束后,将本试卷和答题卡一并交回。 可能用到的相对原子质量:H 1C 12N 14O 16Na 23Al 27Cl35.5 Fe56 一、选择题 1. 我国提出争取在 2030 年前实现碳达峰,2060 年实现碳中和,这对于改善环境,实现绿色 CO 发展至关重要。碳中和是指 直接有效的是 2 的排放总量和减少总量相当。下列措施中能促进碳中和最 A. B. C. 将重质油裂解为轻质油作为燃料 大规模开采可燃冰作为清洁燃料 通过清洁煤技术减少煤燃烧污染 CO D. 2. 研发催化剂将 2 还原为甲醇 在实验室采用如图装置制备气体,合理的是 化学试剂 制备的气体 Ca(OH)2 NH4Cl NH3 ABCDMnO HCl Cl2 O2 (浓) 2MnO2 KClO3 NaCl H2SO 4 (浓) HCl A. A B. B C. C D. D 3. 下列过程中的化学反应,相应的离子方程式正确的是 CO2 CaSO CaCO SO2 A. 用碳酸钠溶液处理水垢中的硫酸钙: 3434Fe 4H NO Fe3 NO 2H O B. 过量铁粉加入稀硝酸中: 32Al3 4OH AlO 2H O C 硫酸铝溶液中滴加少量氢氧化钾溶液: 222 2 D. 氯化铜溶液中通入硫化氢: Cu S CuS 4. 一种活性物质的结构简式为 ,下列 有关该物质的叙述正确的是 A. 能发生取代反应,不能发生加成反应 B. 既是乙醇的同系物也是乙酸的同系物 C. 与 互为同分异构体 44g CO 该物质与碳酸钠反应得 D. 1mol 21.731kg 5. 我国嫦娥五号探测器带回 的月球土壤,经分析发现其构成与地球士壤类似土壤 中含有的短周期元素 W、X、Y、Z,原子序数依次增大,最外层电子数之和为 15,X、Y、 Z 为同周期相邻元素,且均不与 W 同族,下列结论正确的是 W X Y Z A. 原子半径大小顺序为 B. 化合物 XW 中的化学键为离子键 C. Y 单质的导电性能弱于 Z 单质的 D. Z 的氧化物的水化物的酸性强于碳酸 6. 沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低 冷却效率,为解决这一问题,通常在管道口设置一对惰性电极(如图所示),通入一定的电流。 下列叙述错误的是 Cl 氧化生成 2 的反应 A. 阳极发生将海水中的 Cl B. 管道中可以生成氧化灭杀附着生物的 NaClO HC. 阴极生成的 2 应及时通风稀释安全地排入大气 Mg(OH) D. 阳极表面形成的 2 等积垢需要定期清理 随 c(H+)而变化, 不发生水解。实 7. HA 是一元弱酸,难溶盐 MA 的饱和溶液中 c(M ) M2++验发现, 时为线性关系,如下图中实线所示。 298K c (M )-c(H ) 下列叙述错误的是 -1 -1 pH 4 A. 溶液 时, c(M )<3.010 molL K (MA)=5.010-8 B. MA 的溶度积度积 sp ++–pH=7 C. 溶液 时, c(M )+c(H )=c(A)+c(OH ) K (HA) 2.010-4 D. HA 的电离常数 a三、非选择题:共 174 分。第 22~32 为必考题,每个试题考生都必须作答。第 33~38 题为选考题,考生根据要求作答。 TiO SiO 、Al OMgO 、 、 2 3 8. 磁选后的炼铁高钛炉渣,主要成分有 、以及少量的 CaO 22Fe2O 3 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。 pH 该工艺条件下,有关金属离子开始沉淀和沉淀完全的 金属离子 见下表 Mg2 Fe3 2.2 Ca2 12.4 13.8 Al3 pH 开始沉淀的 3.5 4.7 9.5 c=1.0105 molL1 pH 沉淀完全 的3.2 11.1 回答下列问题: Fe O 3 转化为相应 2TiO SiO 、Al OMgO 、 、 2 3 (1)“焙烧”中, 2 几乎不发生反应, 、CaO 2Al O NH Al SO 的硫酸盐,写出 3 转化为 4 2 的化学方程式_______。 24pH pH 至 11.6,依次析出的 (2)“水浸”后“滤液”的 约为 2.0,在“分步沉淀”时用氨水逐步调节 金属离子是_______。 (3)“母液①”中 2+ 浓度为_______ -1 。Mg molL (4)“水浸渣”在 160℃“酸溶”最适合的酸是_______。“酸溶渣”的成分是_______、_______。 2 TiO xH O (5)“酸溶”后,将溶液适当稀释并加热, 程式是_______。 水解析出 沉淀,该反应的离子方 TiO 22(6)将“母液①”和“母液②”混合,吸收尾气,经处理得_______,循环利用。 9. 氧化石墨烯具有稳定的网状结构,在能源、材料等领域有着重要的应用前景,通过氧化 剥离石墨制备氧化石墨烯的一种方法如下(转置如图所示): H SO NaNO Ⅰ.将浓 、3 、石墨粉末在 c 中混合,置于冰水浴中,剧烈搅拌下,分批缓慢 4 粉末,塞好瓶口。 Ⅱ.转至油浴中,35℃搅拌 1 小时,缓慢滴加一定量的蒸馏水。升温至 98℃并保持 1 小时。 24KMnO 加入 H O Ⅲ.转移至大烧杯中,静置冷却至室温。加入大量蒸馏水,而后滴加 2 至悬浊液由紫色 2变为土黄色。 Ⅳ.离心分离,稀盐酸洗涤沉淀。 Ⅴ.蒸馏水洗涤沉淀。 Ⅵ.冷冻干燥,得到土黄色的氧化石墨烯。 回答下列问题: (1)装置图中,仪器 a、c 的名称分别是_______、_______,仪器 b 的进水口是_______(填字 母)。 KMnO (2)步骤Ⅰ中,需分批缓慢加入 4 粉末并使用冰水浴,原因是_______。 (3)步骤Ⅱ中的加热方式采用油浴,不使用热水浴,原因是_______。 H O (4)步骤Ⅲ中, 2 的作用是_______(以离子方程式表示)。 2SO2 (5)步骤Ⅳ中,洗涤是否完成,可通过检测洗出液中是否存在 _______。 来判断。检测的方法是 4试纸检测来判断 是否洗净,其理由是_______。 pH (6)步骤Ⅴ可用 10. Cl 一氯化碘(ICl)是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合 成中的碘化剂。回答下列问题: (1)历史上海藻提碘中得到一种红棕色液体,由于性质相似,Liebig 误认为是 ICl,从而错过 了一种新元素的发现,该元素是_______。 BaPtCl BaCl Cl 和(2)氯铂酸钡( 6 )固体加热时部分分解为 、2 ,376.8℃时平衡常数 6 ,抽真空后,通过一支管通入 碘蒸气(然后将支管封闭),在 376.8℃,碘蒸气初始压强为 20.0kPa 。376.8℃平衡时,测得 Pt 2K′p 1.0104 Pa2 BaPtCl ,在一硬质玻璃烧瓶中加入过量 p = 2ICl(g) Cl (g) I (g) 烧瓶中压强为32.5kPa ,则 _______kPa ,反应 的平衡常数 ICl 22K=_______(列出计算式即可)。 K(3)McMorris 测定和计算了在 136~180℃范围内下列反应的平衡常数 2NO(g)+2ICl(g) 2NOCl(g)+I2 (g) Kp1 。p2NOCl(g) 2NO(g)+Cl2 (g) Kp2 11lgK ~ lgK ~ p2 得到 和均为线性关系,如下图所示: p1 TTCl ①由图可知,NOCl 分解为 NO 和 反应的 _______0(填“大于”或“小于”) ΔH 2KKp2 表示):该反应的 2ICl(g) Cl (g) I (g) ②反应 的 K=_______(用 、p1 22_______0(填“大于”或“小于”),写出推理过程_______。 ΔH (4)Kistiakowsky 曾研究了 NOCl 光化学分解反应,在一定频率(v)光的照射下机理为: NOCl hv NOCl NOCl NOCl 2NO Cl2 其中 hv 表示一个光子能量, NOCl*表示 NOCl 的激发态。可知,分解 1mol 的 NOCl 需要 吸收_______mol 光子。 Cr 是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。 11. 过渡金属元素铬 回答下列问题: (1)对于基态 Cr 原子,下列叙述正确的是_______(填标号)。 A.轨道处于半充满时体系总能量低,核外电子排布应 51为[Ar]3d 4s B.4s 电子能量较高,总是在比 3s 电子离核更远的地方运动 C.电负性比钾高,原子对键合电子的吸引力比钾大 (2)三价铬离子能形成多种配位化合物。 2 中提供电子对形成配位 Cr NH H OCl 3 3 2 2键的原子是_______,中心离子的配位数为_______。 2 中配体分子 以及分子 NH H O 、PH 3 的空间结构和相应的 (3) Cr NH H OCl 3 3 2 322键角如图所示。 PH NH PH H O 3 的_______,原因是_______, 的 23 中 P 的杂化类型是_______。 3 的沸点比 NH 键角小于 3 的,分析原因_______。 AlCr AlCr 2 具有 (4)在金属材料中添加 2 颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。 r体心四方结构,如图所示,处于顶角位置的是_______原子。设 Cr 和 Al 原子半径分别为 Cr r和Al ,则金属原子空间占有率为_______%(列出计算表达式)。 12. 卤沙唑仑 W 是一种抗失眠药物,在医药工业中的一种合成方法如下: 已知:(ⅰ) (ⅱ) 回答下列问题: (1)A 的化学名称是_______。 (2)写出反应③的化学方程式_______。 (3)D 具有的官能团名称是_______。(不考虑苯环) (4)反应④中,Y 的结构简式为_______。 的(5)反应⑤ 反应类型是_______。 (6)C 的同分异构体中,含有苯环并能发生银镜反应的化合物共有种_______种。 (7)写出 W 的结构简式_______。
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





