

 2014 年全国统一高考化学试卷(新课标Ⅰ) 一、选择题(本题共 7 小题,每小题 6 分,共 42 分) 1.(6 分)下列化合物中同分异构体数目最少的是( ) A.戊烷 B.戊醇 C.戊烯 D.乙酸乙酯 2.(6 分)化学与社会、生活密切相关,对下列现象或事实的解释正确的是( ) 选项 现象或事实 用热的烧碱溶液洗去油污 漂白粉在空气中久置变质 解释 ABNa2CO3 可直接和油污反应 漂白粉中的 CaCl2 与空气中的 CO2 反应生成 CaCO3 C施肥时,草木灰(有效成分为 K2CO3)不 K2CO3 与 NH4Cl 反应生成氨气 能与 NH4Cl 混合使用 会降低肥效 FeCl3 能从含有 Cu2+的溶液中置 DFeCl3 溶液可用于铜质印刷线路板制作 换出铜 A.A B.B C.C D.D 3.(6 分)已知分解 1mol H2O2 放出热量 98kJ,在含少量 I﹣的溶液中,H2O2 分 解的机理为: H2O2+I﹣→H2O+IO﹣ 慢H2O2+IO﹣→H2O+O2+I﹣ 快下列有关该反应的说法正确的是( ) A.反应速率与 I﹣的浓度有关 B.IO﹣也是该反应的催化剂 C.反应活化能等于 98kJ•mol﹣1 D.v(H2O2)=v(H2O)=v(O2) 4.(6 分)X,Y,Z 均为短周期元素,X,Y 处于同一周期,X,Z 的最低价离 子分别为 X2﹣和 Z﹣,Y+和 Z﹣具有相同的电子层结构。下列说法正确的是( )A.原子最外层电子数:X>Y>Z C.离子半径:X2﹣>Y+>Z﹣ B.单质沸点:X>Y>Z D.原子序数:X>Y>Z 第 1 页(共 35 页) 5.(6 分)溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误 的是( ) A.溴酸银的溶解是放热过程 B.温度升高时溴酸银溶解速度加快 C.60℃时溴酸银的 Ksp 约等于 6×10﹣4 D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 6.(6 分)下列有关仪器使用方法或实验操作正确的是( ) A.洗净的锥形瓶和容量瓶可以放进烘箱烘干 B.酸式滴定管装标准溶液前,必须先用该溶液润洗 C.酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差 D.用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体 7.(6 分)利用如图所示装置进行下列实验,能得出相应实验结论是( ) 选项 ①②③实验结论 ANa2S 稀硫酸 AgNO3 与 AgCl Ksp(AgCl)>Ksp(Ag2S) 的浊液 BC浓硫酸 蔗糖 溴水 浓硫酸具有脱水性、氧化性 Na2SO3 稀盐酸 Ba(NO3)2 溶 SO2 与可溶性钡盐均可生成 白色沉淀 液DNa2CO3 浓硝酸 Na2SiO3 溶液 酸性:硝酸>碳酸>硅酸 A.A B.B C.C D.D 第 2 页(共 35 页) 三、非选择题:包括必考题和选考题两部分(一)必考题(共 58 分) 8.(13 分)乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验 室制备乙酸异戊酯的反应、装置示意图和有关数据如图 1、2 及表格: 图 1 图 2 图 3 密度/(g•cm﹣3) 相对分子质量 沸点/℃ 水中溶解性 88 60 0.8123 1.0492 0.8670 131 118 142 异戊醇 乙酸 微溶 溶130 乙酸异戊酯 实验步骤: 难溶 在 A 中加入 4.4g 异戊醇、6.0g 乙酸、数滴浓硫酸和 2~3 片碎瓷片,开始缓慢加 热 A,回流 50min,反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和 碳酸氢钠溶液和水洗涤;分出的产物加入少量无水 MgSO4 固体,静置片刻, 过滤除去 MgSO4 固体,进行蒸馏纯化,收集 140﹣143℃馏分,得乙酸异戊酯 第 3 页(共 35 页) 3.9g. 回答下列问题: (1)仪器 B 的名称是 ; (2)在洗涤操作中,第一次水洗的主要目的是 是 ; ,第二次水洗的主要目的 (3)在洗涤、分液操作中,应充分振荡、然后静置,待分层后 ) (填标号 a.直接将乙酸异戊酯从分液漏斗的上口倒出 b.直接将乙酸异戊酯从分液漏斗的下口放出 c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出 d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出 (4)本实验中加入过量乙酸的目的是 (5)实验中加入少量无水 MgSO4 的目的是 (6)在蒸馏操作中,仪器选择及安装都正确的是(如图 3) (7)本实验的产率是 (填标号) a.30% b.40% c.60% d.90% (8)在进行蒸馏操作时,若从 130℃便开始收集馏分,会使实验的产率偏 (填“高”或“低”),其原因是 . ; ; (填标号) 9.(15 分)次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答 下列问题: (1)H3PO2 是一元中强酸,写出其电离方程式 (2)H3PO2 及 NaH2PO2 均可将溶液中的 Ag+还原为银,从而可用于化学镀银。 ①H3PO2 中,P 元素的化合价为 ; ②利用 H3PO2 进行化学镀银反应中,氧化剂与还原剂的物质的量之比为 4:1, ; 则氧化产物为 (填化学式); ③NaH2PO2 为 (填“正盐”或“酸式盐”),其溶液显 (填“弱酸性” 、“中性”或“弱碱性”); (3)H3PO2 的工业制法是:将白磷(P4)与 Ba(OH)2 溶液反应生成 PH3 气体 和 Ba(H2PO2),后者再与 H2SO4 反应,写出白磷与 Ba(OH) 溶液反应的 22第 4 页(共 35 页) 化学方程式 ; (4)H3PO2 也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和 阴膜分别只允许阳离子、阴离子通过): ①写出阳极的电极反应式 ; ②分析产品室可得到 H3PO2 的原因 ; ③早期采用“三室电渗析法”制备 H3PO2,将“四室电渗析法”中阳极室的稀硫酸用 H3PO2 稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室 与产品室,其缺点是产品中混有 杂质,该杂质产生的原因是 。 10.(15 分)乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水 合法生产,回答下列问题: (1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H), 再水解生成乙醇,写出相应反应的化学方程式 ; (2)已知: 甲醇脱水反应 2CH3OH(g)═CH3OCH3(g)+H2O(g)△H1=﹣23.9kJ•mol﹣1 甲醇制烯烃反应 2CH3OH(g)═C2H4(g)+2H2O(g)△H2=﹣29.1kJ•mol﹣1 乙醇异构化反应 C2H5OH(g)═CH3OCH3(g)△H3=+50.7kJ•mol﹣1 则乙烯气相直接水合反应 C2H4 (g)+H2O(g)═C2H5OH(g)的△H= kJ•mol﹣1,与间接水合法相比,气相直接水合法的优点是 (3)如图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中 =1:1) ; :第 5 页(共 35 页) ①列式计算乙烯水合制乙醇反应在图中 A 点的平衡常数 Kp= 压代替平衡浓度计算,分压=总压×物质的量分数); (用平衡分 ; ②图中压强(P1,P2,P3,P4)大小顺序为 ,理由是 ③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度 290℃ ,压强 6.9MPa, =0.6:1,乙烯的转化率为 5%,若要进一步提 :高乙烯转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有 、 。 【化学-选修 2:化学与技术】 11.(15 分)磷矿石主要以磷酸钙[Ca3(PO4)2•H2O]和磷灰石[Ca5F(PO4)3, Ca5(OH)(PO4) ]等形式存在,图(a)为目前国际上磷矿石利用的大致情 3况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸,图(b)是热法磷酸 生产过程中由磷灰石制单质磷的流程: 第 6 页(共 35 页) 部分物质的相关性质如下: 熔点/℃ 沸点/℃ 280.5 备注 44 白磷 PH3 ﹣133.8 ﹣90 ﹣87.8 ﹣86 难溶于水、有还原性 易水解 SiF4 回答下列问题: (1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的 % ;(2)以磷矿石为原料,湿法磷酸过程中 Ca5F(PO4)3 反应化学方程式为: .现有 1t 折合含有 P2O5 约 30%的磷灰石,最多可制得到 85%的商品磷酸 t. (3)如图(b)所示,热法磷酸生产过程的第一步是将 SiO2、过量焦炭与磷灰 石混合,高温反应生成白磷.炉渣的主要成分是 (填化学式).冷凝 塔 1 的主要沉积物是 (4)尾气中主要含有 入纯碱溶液,可除去 填化学式) ,冷凝塔 2 的主要沉积物是 . ,还含有少量的 PH3、H2S 和 HF 等.将尾气先通 ;再通入次氯酸钠溶液,可除去 .(均 (5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是 . 【化学-选修 3:物质结构与性质】 12.早期发现的一种天然二十面体准晶颗粒由 Al、Cu、Fe 三种金属元素组成, 回答下列问题: (1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体、准晶体和非晶体. (2)基态 Fe 原子有 硫氰化钾检验 Fe3+,形成的配合物的颜色为 (3)新制备的 Cu(OH) 可将乙醛(CH3CHO)氧化成乙酸,而自身还原成 Cu2O 个未成对电子,Fe3+的电子排布式为 ,可用 . 2,乙醛中碳原子的杂化轨道类型为 数目为 ;1mol 乙醛分子中含有的 σ 键的 .Cu2O 为 ,乙酸的沸点明显高于乙醛,其主要原因是 第 7 页(共 35 页) 半导体材料,在其立方晶胞内部有 4 个氧原子,其余氧原子位于面心和顶点, 则该晶胞中有 个铜原子. (4)Al 单质为面心立方晶体,其晶胞参数 a=0.405nm,晶胞中铝原子的配位数 g•cm﹣3(不必计算出结果). 为 ,列式表示 Al 单质的密度 【化学-选修 5:有机化学基础】 13.席夫碱类化合物 G 在催化、药物、新材料等方面有广泛应用。合成 G 的一 种路线如下: 已知以下信息: ①②1molB 经上述反应可生成 2molC,且 C 不能发生银镜反应。 ③D 属于单取代芳香烃,其相对分子质量为 106。 ④核磁共振氢谱显示 F 苯环上有两种化学环境的氢。 ⑤回答下列问题: (1)由 A 生成 B 的化学方程式为 ,反应类型为 ; (2)E 的化学名称是 (3)G 的结构简式为 ,由 D 生成 E 的化学方程式为 ; ; (4)F 的同分异构体中含有苯环的还有 种(不考虑立体异构),其中核 磁共振氢谱中有 4 组峰,且面积比为 6:2:2:1 的是 ,(写出其中 的一种的结构简式)。 (5)由苯和化合物 C 经如下步骤可合成 N﹣异丙基苯胺。 第 8 页(共 35 页) 反应条件 1 所选择的试剂为 结构简式为 。 ;反应条件 2 所选择的试剂为 ;I 的 第 9 页(共 35 页) 2014 年全国统一高考化学试卷(新课标Ⅰ) 参考答案与试题解析 一、选择题(本题共 7 小题,每小题 6 分,共 42 分) 1.(6 分)下列化合物中同分异构体数目最少的是( ) A.戊烷 B.戊醇 C.戊烯 D.乙酸乙酯 【考点】I4:同分异构现象和同分异构体.菁优网版权所有 【专题】531:同系物和同分异构体. 【分析】戊烷只存在碳链异构,戊醇和戊烯存在碳链异构、位置异构,乙酸乙酯 存在碳链异构、官能团异构、位置异构. 【解答】解:戊烷只存在碳链异构,同分异构体为 3 种,而戊醇和戊烯存在碳链 异构、位置异构,乙酸乙酯存在碳链异构、官能团异构、位置异构,异构类 型越多,同分异构体的数目越多,因此戊醇、戊烯和乙酸乙酯的同分异构体 的数目均大于 3 种, 故选:A。 【点评】本题主要考查了同分异构体数目的判断,可通过同分异构体的类型进行 简单判断,难度不大. 2.(6 分)化学与社会、生活密切相关,对下列现象或事实的解释正确的是( ) 选项 现象或事实 解释 A用热的烧碱溶液洗去油污 Na2CO3 可直接和油污反 应B漂白粉在空气中久置变质 漂白粉中的 CaCl2 与空气 中的 CO2 反 应生成 CaCO3 第 10 页(共 35 页) C施肥时,草木灰(有效成分为 K2CO3) K2CO3 与 NH4Cl 反应生成 不能 氨气会降低 肥效 与 NH4Cl 混合使用 FeCl3 溶液可用于铜质印刷线路板制作 FeCl3 能从含有 Cu2+的溶 D液中置换出铜 A.A B.B C.C D.D 【考点】FH:硅和二氧化硅;GF:钠的重要化合物;GL:两性氧化物和两性氢 氧化物;IC:乙烯的用途.菁优网版权所有 【分析】A.依据盐类水解的性质及油脂水解的性质解答; B.漂白粉漂白原理为次氯酸钙与二氧化碳、水反应生成碳酸钙和次氯酸; C.依据盐类水解的性质解答; D.氯化铁能够与铜反应生成氯化亚铁和氯化铜. 【解答】解:A.油脂在碱性环境下水解生成可溶性物质,碳酸钠为强碱弱酸盐 水解显碱性,升高温度促进盐类水解,所以用热的纯碱溶液洗去油污,碳酸 钠与油脂不直接反应,故 A 错误; B.漂白粉漂白原理为次氯酸钙与二氧化碳、水反应生成碳酸钙和次氯酸,次氯 酸具有漂白作用,二氧化碳与氯化钙不反应,故 B 错误; C.碳酸钾和氯化铵在溶液中水解促进生成氨气,降低肥效,施肥时,草木灰( 有效成分为 K2CO3)不能与 NH4Cl 混合使用,故 C 正确; D.氯化铁能够与铜反应生成氯化亚铁和氯化铜,铜不能置换铁,故 D 错误。 故选:C。 【点评】本题考查化学实验方案的评价,涉及盐类水解的分析应用、氧化性强弱 判断等,掌握物质性质和反应实质是关键,为高考常见题型,注意相关知识 的学习与积累,难度不大. 3.(6 分)已知分解 1mol H2O2 放出热量 98kJ,在含少量 I﹣的溶液中,H2O2 分 解的机理为: H2O2+I﹣→H2O+IO﹣ 慢第 11 页(共 35 页) H2O2+IO﹣→H2O+O2+I﹣ 快下列有关该反应的说法正确的是( ) A.反应速率与 I﹣的浓度有关 B.IO﹣也是该反应的催化剂 C.反应活化能等于 98kJ•mol﹣1 D.v(H2O2)=v(H2O)=v(O2) 【考点】16:化学反应的基本原理;17:化学反应的能量变化规律;BB:反应 热和焓变;CA:化学反应速率的影响因素.菁优网版权所有 【专题】513:物质的性质和变化专题;517:化学反应中的能量变化. 【分析】A、反应速率的快慢主要决定于反应速率慢的第一步反应; B、反应的催化剂是 I﹣; C、分解 1mol 过氧化氢放出的热量是其△H.而非活化能; D、在一个化学反应中,用各物质表示的速率之比等于化学计量数之比; 【解答】解:A、已知:①H2O2+I﹣→H2O+IO﹣ 慢②H2O2+IO﹣→H2O+O2+I﹣ 快,过氧化氢分解快慢决定于反应慢的①,I﹣是①的反应物之一,其浓度大 小对反应不可能没有影响,例如,其浓度为 0 时反应不能发生,故 A 正确; B、将反应①+②可得总反应方程式,反应的催化剂是 I﹣,IO﹣只是中间产物, 故 B 错误; C、1mol 过氧化氢分解的△H=﹣98KJ/mol,△H 不是反应的活化能,是生成物 与反应物的能量差,故 C 错误; D、因为反应是在含少量 I﹣的溶液中进行的,溶液中水的浓度是常数,不能用 其浓度变化表示反应速率,故 D 错误。故选:A。 【点评】本题是 2014 年河北高考题,题目主要考查催化剂、活化能、化学反应 速率的相关知识,题目难度不大. 4.(6 分)X,Y,Z 均为短周期元素,X,Y 处于同一周期,X,Z 的最低价离 子分别为 X2﹣和 Z﹣,Y+和 Z﹣具有相同的电子层结构。下列说法正确的是( 第 12 页(共 35 页) )A.原子最外层电子数:X>Y>Z B.单质沸点:X>Y>Z D.原子序数:X>Y>Z C.离子半径:X2﹣>Y+>Z﹣ 【考点】1B:真题集萃;8F:原子结构与元素周期律的关系.菁优网版权所有 【专题】51C:元素周期律与元素周期表专题. 【分析】X、Z 的最低价离子分别为 X2﹣和 Z﹣,则 X 为第ⅥA 族元素,Z 为ⅦA 族元素;Y+和 Z﹣具有相同的电子层结构,则 Y 在 Z 的下一周期,则 Y 为 Na 元素,Z 为 F 元素,X、Y 同周期,则 X 为 S 元素,结合元素在周期表中的 位置以及元素周期律知识解答该题. 【解答】解:X、Z 的最低价离子分别为 X2﹣和 Z﹣,则 X 为第ⅥA 族元素,Z 为ⅦA 族元素;Y+和 Z﹣具有相同的电子层结构,则 Y 在 Z 的下一周期,则 Y 为 Na 元素,Z 为 F 元素,X、Y 同周期,则 X 为 S 元素, A.X、Y、Z 分别为 S、Na、F,原子最外层电子数分别为 6、1、7,故 A 错误; B.常温下 Na、S 为固体,F2 为气体,Na 的熔点较低,但钠的沸点高于硫,顺 序应为 Na>S>F2,故 B 错误; C.Na+、F﹣具有相同的核外电子排布,离子的核电荷数越大,半径越小,应为 F﹣ >Na+,故 C 错误; D.X、Y、Z 原子序数分别为 16、11、9,原子序数:X>Y>Z,故 D 正确。 故选:D。 【点评】本题考查原子结构与元素周期律的关系,为高考常见题型,侧重于学生 的分析能力的考查,题目难度不大,本题的关键是根据原子结构特点正确推 断元素的种类. 5.(6 分)溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误 的是( ) 第 13 页(共 35 页) A.溴酸银的溶解是放热过程 B.温度升高时溴酸银溶解速度加快 C.60℃时溴酸银的 Ksp 约等于 6×10﹣4 D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 【考点】62:溶解度、饱和溶液的概念;DH:难溶电解质的溶解平衡及沉淀转 化的本质.菁优网版权所有 【专题】519:物质的量浓度和溶解度专题. 【分析】A.根据图象中温度对溴酸银的溶解度影响可知溴酸银的溶解过程为吸 热过程; B.温度升高,可以加快物质的溶解速率; C.根据溶度积表达式及溶液中银离子和溴酸根离子的浓度计算; D.溴酸银的溶解度受温度的影响较小,可以通过重结晶法分离硝酸钾与溴酸银 的混合物。 【解答】解:A.根据图象可知,升高温度,溴酸银的溶解度增大,说明溴酸银 的溶解过程为吸热过程,故 A 错误; B.升高温度,溴酸银的溶解度增大,所以温度升高时溴酸银溶解速度加快,故 B 正确; C.60℃时溴酸银的溶解度为 0.6g,溴酸银的物质的量为: ≈2.5× 10﹣3mol,100.6g 溴酸银溶液的体积约为 100.6mL,溶液中银离子、溴酸根离 子浓度约为 2.5×10﹣2mol/L,所以 60℃时溴酸银的 Ksp=2.5×10﹣2×2.5×10﹣2 第 14 页(共 35 页) ≈6×10﹣4,故 C 正确; D.根据图象可知,溴酸银的溶解度受温度的影响不大,而硝酸钾的溶解度受温 度影响较大,所以硝酸钾中含有少量溴酸银,可用重结晶方法提纯,故 D 正 确; 故选:A。 【点评】本题考查了难溶物的溶解平衡、溶度积的表达式及计算、物质的分离与 提纯,题目难度中等,注意掌握难溶物的溶解平衡及其影响因素,明确溶度 积的概念及计算方法。 6.(6 分)下列有关仪器使用方法或实验操作正确的是( ) A.洗净的锥形瓶和容量瓶可以放进烘箱烘干 B.酸式滴定管装标准溶液前,必须先用该溶液润洗 C.酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差 D.用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体 【考点】U5:化学实验方案的评价.菁优网版权所有 【专题】25:实验评价题;541:化学实验常用仪器及试剂. 【分析】A.锥形瓶和容量瓶在使用时不需要烘干; B.滴定管在量取或者盛装溶液时必须润洗,否则会导致原溶液被蒸馏水稀释; C.锥形瓶不能润洗,否则导致待测液中溶质的物质的量偏大,滴定过程中消耗 的标准液体积偏大; D.容量瓶中加水超过刻度线,导致配制的溶液体积偏大,溶液浓度偏小,此次 配制失败. 【解答】解:A.锥形瓶、容量瓶中有少量的蒸馏水,不影响滴定结果或配制溶 液的浓度,所以不需要烘干锥形瓶或容量瓶,故 A 错误; B.酸式滴定管在盛放标准液之前,为了避免滴定管中的少量蒸馏水将标准液稀 释,应该先用标准液润洗,再盛放标准液,故 B 正确; C.滴定过程中,锥形瓶不能润洗,否则会导致锥形瓶中待测液的溶质的物质的 量偏大,测定结果偏高,故 C 错误; 第 15 页(共 35 页) D.用容量瓶配溶液时,若加水超过刻度线,此次配制失败,即使立即用滴管吸 出多余液体,也不会使配制的溶液浓度恢复正常,故 D 错误; 故选:B。 【点评】本题考查了常见计量仪器的构造及使用方法偏大,题目难度不大,注意 掌握常见仪器的构造及正确的使用方法,明确容量瓶、锥形瓶、滴定管的使 用方法. 7.(6 分)利用如图所示装置进行下列实验,能得出相应实验结论是( ) 选项 ①②③实验结论 ANa2S 稀硫酸 AgNO3 与 AgCl 的浊 液Ksp(AgCl)>Ksp(Ag2S) BCD浓硫酸 蔗糖 溴水 浓硫酸具有脱水性、氧化 性Na2SO3 Na2CO3 稀盐酸 浓硝酸 Ba(NO3)2 SO2 与可溶性钡盐均可生 溶液 成白色沉淀 Na2SiO3 溶液 酸性:硝酸>碳酸>硅酸 C.C D.D A.A B.B 【考点】U5:化学实验方案的评价.菁优网版权所有 【专题】25:实验评价题. 【分析】A.不发生沉淀的转化,AgNO3 与 AgCl 的浊液中,Qc(Ag2S)>Ksp( Ag2S),则生成 Ag2S; B.浓硫酸使蔗糖变黑,然后 C 与浓硫酸发生氧化还原反应生成二氧化硫,二氧 化硫与溴水发生氧化还原反应使其褪色; C.盐酸与亚硫酸钠生成二氧化硫,与 Ba(NO3)2 溶液发生氧化还原反应生成 硫酸钡沉淀; D.浓硝酸与碳酸钠反应生成二氧化碳,但浓硝酸易挥发,硝酸、碳酸均可与硅 酸钠溶液反应生成硅酸沉淀. 第 16 页(共 35 页) 【解答】解:A.图中装置和试剂不发生沉淀的转化,对 AgNO3 与 AgCl 的浊液 中,Qc(Ag2S)>Ksp(Ag2S),则生成 Ag2S,可发生沉淀的生成,则不能 比较溶度积,故 A 错误; B.浓硫酸具有脱水性使蔗糖变黑,然后 C 与浓硫酸发生氧化还原反应生成二氧 化硫,体现其强氧化性,最后二氧化硫与溴水发生氧化还原反应使其褪色, 故 B 正确; C.盐酸与亚硫酸钠生成二氧化硫,与 Ba(NO3)2 溶液发生氧化还原反应生成 硫酸钡沉淀,但 SO2 与可溶性钡盐不一定生成白色沉淀,如与氯化钡不反应, 故 C 错误; D.浓硝酸与碳酸钠反应生成二氧化碳,但浓硝酸易挥发,硝酸、碳酸均可与硅 酸钠溶液反应生成硅酸沉淀,则不能比较碳酸与硅酸的酸性,应排除硝酸的 干扰,故 D 错误; 故选:B。 【点评】本题考查化学实验方案的评价,为高频考点,涉及沉淀的生成与转化、 浓硫酸的性质、酸性比较、氧化还原反应等,把握化学反应原理及实验装置 中的反应为解答的关键,注意实验操作的可行性、评价性分析,题目难度不 大. 三、非选择题:包括必考题和选考题两部分(一)必考题(共 58 分) 8.(13 分)乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验 室制备乙酸异戊酯的反应、装置示意图和有关数据如图 1、2 及表格: 第 17 页(共 35 页) 图 1 图 2 图 3 密度/(g•cm﹣3) 相对分子质量 沸点/℃ 水中溶解性 88 60 0.8123 1.0492 0.8670 131 118 142 异戊醇 乙酸 微溶 溶130 乙酸异戊酯 实验步骤: 难溶 在 A 中加入 4.4g 异戊醇、6.0g 乙酸、数滴浓硫酸和 2~3 片碎瓷片,开始缓慢加 热 A,回流 50min,反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和 碳酸氢钠溶液和水洗涤;分出的产物加入少量无水 MgSO4 固体,静置片刻, 过滤除去 MgSO4 固体,进行蒸馏纯化,收集 140﹣143℃馏分,得乙酸异戊酯 3.9g. 回答下列问题: (1)仪器 B 的名称是 球形冷凝管 ; (2)在洗涤操作中,第一次水洗的主要目的是 洗掉大部分硫酸和醋酸 ,第 二次水洗的主要目的是 洗掉碳酸氢钠 ; (3)在洗涤、分液操作中,应充分振荡、然后静置,待分层后 d (填标号) a.直接将乙酸异戊酯从分液漏斗的上口倒出 b.直接将乙酸异戊酯从分液漏斗的下口放出 c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出 d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出 (4)本实验中加入过量乙酸的目的是 提高醇的转化率 ; 第 18 页(共 35 页) (5)实验中加入少量无水 MgSO4 的目的是 干燥乙酸异戊酯 ; (6)在蒸馏操作中,仪器选择及安装都正确的是(如图 3) b (填标号) (7)本实验的产率是 c (填标号) a.30% b.40% c.60% d.90% (8)在进行蒸馏操作时,若从 130℃便开始收集馏分,会使实验的产率偏 高 (填“高”或“低”),其原因是 会收集少量未反应的异戊醇 . 【考点】U3:制备实验方案的设计.菁优网版权所有 【专题】24:实验设计题. 【分析】(1)根据题中仪器 B 的构造判断该仪器的名称; (2)在洗涤操作中,第一次洗涤的主要目的是除去大部分催化剂硫酸和醋酸; 第二次水洗,主要目的是除去产品中残留的碳酸氢钠; (3)根据乙酸异戊酯的密度及正确的分液操作方法进行解答; (4)根据反应物对增加一种反应物的浓度,可以使另一种反应物的转化率提高 进行判断加入过量乙酸的目的; (5)少量无水硫酸镁能够吸收乙酸异戊酯中少量的水分,起到干燥作用; (6)先根据温度计在蒸馏操作中的作用排除 ad,再根据球形冷凝管容易使产品 滞留,不能全部收集到锥形瓶中,得出正确结论; (7)先计算出乙酸和异戊醇的物质的量,然后判断过量情况,根据不足量计算 出理论上生成乙酸异戊酯的物质的量,最后根据实际上制取的乙酸异戊酯计 算出产率; (8)若从 130℃便开始收集馏分此时的蒸气中含有异戊醇,会收集少量的未反 应的异戊醇,导致获得的乙酸异戊酯质量偏大. 【解答】解:(1)由装置中仪器 B 的构造可知,仪器 B 的名称为球形冷凝管, 故答案为:球形冷凝管; (2)反应后的溶液要经过多次洗涤,在洗涤操作中,第一次洗涤的主要目的是 除去大部分催化剂硫酸和醋酸;第一步中饱和碳酸氢钠溶液既可以除去未洗 净的醋酸,也可以降低酯的溶解度,但第一步洗涤后生成的酯中混有碳酸氢 钠,所以第二次水洗,主要目的是除去产品中残留的碳酸氢钠, 第 19 页(共 35 页) 故答案为:洗掉大部分硫酸和醋酸;洗掉碳酸氢钠; (3)由于酯的密度比水小,二者互不相溶,因此水在下层,酯在上层;分液时, 要先将水层从分液漏斗的下口放出,待到两层液体界面时关闭分液漏斗的活 塞,再将乙酸异戊酯从上口放出,所以正确的为 d, 故答案为:d; (4)酯化反应是可逆反应,增大反应物的浓度可以使平衡正向移动;增加一种 反应物的浓度,可以使另一种反应物的转化率提高,因此本实验中加入过量 乙酸的目的是提高转化率, 故答案为:提高醇的转化率; (5)实验中加入少量无水硫酸镁的目的是吸收酯中少量的水分,对其进行干燥, 故答案为:干燥乙酸异戊酯; (6)在蒸馏操作中,温度计的水银球要放在蒸馏烧瓶的支管口处,所以 ad 错误 ;c 中使用的是球形冷凝管容易使产品滞留,不能全部收集到锥形瓶中,因此 仪器及装置安装正确的是 b, 故答案为:b; ( 7 ) 乙 酸 的 物 质 的 量 为 : n= =0.1mol , 异 戊 醇 的 物 质 的 量 为 : n= =0.05mol,由于乙酸和异戊醇是按照 1:1 进行反应,所以乙酸过 量,生成乙酸异戊酯的量要按照异戊醇的物质的量计算,即理论上生成 0.05mol 乙 酸 异 戊 酯 ; 实 际 上 生 成 的 乙 酸 异 戊 酯 的 物 质 的 量 为 : =0.03mol,所以实验中乙酸异戊酯的产率为: ×100%=60% ,故答案为:c; (8)在进行蒸馏操作时,若从 130℃便开始收集馏分此时的蒸气中含有异戊醇, 会收集少量的未反应的异戊醇,因此会导致产率偏高, 故答案为:高;会收集少量未反应的异戊醇. 【点评】本题为一道高考题,考查了常见仪器的构造与安装、混合物的分离、提 纯、物质的制取、药品的选择及使用、物质产率的计算等知识,题目难度较 大,试题涉及的题量较大,知识点较多,充分培养了学生的分析、理解能力 第 20 页(共 35 页) 及灵活应用所学知识的能力. 9.(15 分)次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答 下列问题: (1)H3PO2 是一元中强酸,写出其电离方程式 H3PO2⇌H2PO2 +H+ ; ﹣(2)H3PO2 及 NaH2PO2 均可将溶液中的 Ag+还原为银,从而可用于化学镀银。 ①H3PO2 中,P 元素的化合价为 +1 ; ②利用 H3PO2 进行化学镀银反应中,氧化剂与还原剂的物质的量之比为 4:1, 则氧化产物为 H3PO4 (填化学式); ③NaH2PO2 为 正盐 (填“正盐”或“酸式盐”),其溶液显 弱碱性 (填“弱 酸性”、“中性”或“弱碱性”); (3)H3PO2 的工业制法是:将白磷(P4)与 Ba(OH)2 溶液反应生成 PH3 气体 和 Ba(H2PO2),后者再与 H2SO4 反应,写出白磷与 Ba(OH) 溶液反应的 22化学方程式 2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑ ; (4)H3PO2 也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和 阴膜分别只允许阳离子、阴离子通过): ①写出阳极的电极反应式 2H2O﹣4e﹣=O2↑+4H+ ; ②分析产品室可得到 H3PO2 的原因 阳极室的 H+穿过阳膜扩散至产品室,原料 ﹣室的 H2PO2 穿过阴膜扩散至产品室,二者反应生成 H3PO2 ; ③早期采用“三室电渗析法”制备 H3PO2,将“四室电渗析法”中阳极室的稀硫酸用 H3PO2 稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室 与产品室,其缺点是产品中混有 PO43﹣(或 HPO42﹣、H2PO4 、H3PO4) ﹣﹣杂质,该杂质产生的原因是 H2PO2 或 H3PO2 被氧化 。 第 21 页(共 35 页) 【考点】1B:真题集萃;B1:氧化还原反应;D3:电解质在水溶液中的电离;DI :电解原理;EI:磷.菁优网版权所有 【专题】51I:电化学专题;52:元素及其化合物. 【分析】(1)根据 H3PO2 是一元中强酸可知,H3PO2 是弱电解质,溶液中部分 电离出氢离子,据此写出电离方程式; (2)①根据化合物中总化合价为 0 计算出 P 元素的化合价; ②先判断氧化剂、氧化剂,然后根据氧化剂与还原剂的物质的量之比为 4:1 计 算出反应产物中 P 的化合价; ③根据 H3PO2 是一元中强酸,可以判断 NaH2PO2 为正盐,由于为 H3PO2 为弱电 解质,则 NaH2PO2 为强碱弱酸盐,则溶液显示弱碱性; (3)根据题干信息“将白磷(P4)与 Ba(OH)2 溶液反应生成 PH3 气体和 Ba( H2PO2)2”写出该反应的化学方程式为; ﹣(4)①根据阳极中阴离子为硫酸根离子、氢氧根离子和 H2PO2 ,判断放电能力 强弱,然后写出阳极的电极反应式; ②根据图示“四室电渗析法”工作原理分析产品室可得到 H3PO2 的原因; ③根据 H3PO2 及 NaH2PO2 均容易被氧化分析该装置缺点。 【解答】解:(1)H3PO2 是一元中强酸,溶液中部分电离出氢离子,所以其电 离方程式为:H3PO2⇌H2PO2 +H+, ﹣故答案为:H3PO2⇌H2PO2 +H+; ﹣(2)①H3PO2 中,总化合价为 0,其中氢元素为+1 价,氧元素为﹣2 价,则 P 元素的化合价为:+1 价, 第 22 页(共 35 页) 故答案为:+1; ②该反应中 Ag+为氧化剂,H3PO2 为还原剂,氧化剂与还原剂的物质的量之比为 4:1,设反应产物中 P 的化合价为 x,根据化合价升降相等可得,4×(1﹣0) =1×(x﹣1),解得 x=5,所以氧化产物为+5 价的 H3PO4, 故答案为:H3PO4; ③由于 H3PO2 是一元中强酸,所以 NaH2PO2 为正盐,由于为 H3PO2 为弱电解质, 则 NaH2PO2 为强碱弱酸盐,溶液显示弱碱性, 故答案为:正盐;弱碱性; (3)H3PO2 的工业制法是:将白磷(P4)与 Ba(OH)2 溶液反应生成 PH3 气体 和 Ba(H2PO2)2,该反应的化学方程式为:2P4+3Ba(OH)2+6H2O=3Ba( H2PO2)2+2PH3↑, 故答案为:2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑; ﹣(4)①由于阳极中阴离子为硫酸根离子、氢氧根离子和 H2PO2 ,其中放电能力 最强的是氢氧根离子,则阳极发生的电极反应为:2H2O﹣4e﹣=O2↑+4H+, 故答案为:2H2O﹣4e﹣=O2↑+4H+; ②产品室可得到 H3PO2 的原因是因为:阳极室的 H+穿过阳膜扩散至产品室,原 ﹣料室的 H2PO2 穿过阴膜扩散至产品室,二者反应生成 H3PO2, 故答案为:阳极室的 H+穿过阳膜扩散至产品室,原料室的 H2PO2 穿过阴膜扩散 ﹣至产品室,二者反应生成 H3PO2; ③早期采用“三室电渗析法”制备 H3PO2,将“四室电渗析法”中阳极室的稀硫酸用 H3PO2 稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室 与产品室,其缺点是阳极产生的氧气会把 H2PO2 或 H3PO2 氧化成 PO43﹣,产 ﹣品中混有 PO43﹣(或 HPO42﹣、H2PO4 、H3PO4), ﹣﹣﹣故答案为:PO43﹣(或 HPO42﹣、H2PO4 、H3PO4);H2PO2 或 H3PO2 被氧化。 【点评】本题考查了盐的水解原理、电解原理、弱电解质的电离、氧化还原反应 等知识,题目难度较大,试题涉及的知识点较多,充分考查了学生对所学知 第 23 页(共 35 页) 识的掌握情况。 10.(15 分)乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水 合法生产,回答下列问题: (1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H), 再水解生成乙醇,写出相应反应的化学方程式 C2H4+H2SO4→C2H5OSO3H、 C2H5OSO3H+H2O→C2H5OH+H2SO4 ; (2)已知: 甲醇脱水反应 2CH3OH(g)═CH3OCH3(g)+H2O(g)△H1=﹣23.9kJ•mol﹣1 甲醇制烯烃反应 2CH3OH(g)═C2H4(g)+2H2O(g)△H2=﹣29.1kJ•mol﹣1 乙醇异构化反应 C2H5OH(g)═CH3OCH3(g)△H3=+50.7kJ•mol﹣1 则乙烯气相直接水合反应 C2H4(g)+H2O(g)═C2H5OH(g)的△H= ﹣45.5 kJ•mol﹣1,与间接水合法相比,气相直接水合法的优点是 无副产品,原子利 用率 100% ; (3)如图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中 :=1:1) ①列式计算乙烯水合制乙醇反应在图中 A 点的平衡常数 Kp= 0.07(MPa)﹣1 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数); ②图中压强(P1,P2,P3,P4)大小顺序为 p1<p2<p3<p4 ,理由是 反应分 子数减少,相同温度下,压强升高乙烯转化率提高 ; ③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度 290℃ 第 24 页(共 35 页) ,压强 6.9MPa, :=0.6:1,乙烯的转化率为 5%,若要进一步提 高乙烯转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有 将产物乙醇液化移去 、 增加 比 。 :【考点】1B:真题集萃;BE:热化学方程式;C8:化学平衡常数的含义;CB: 化学平衡的影响因素;CM:转化率随温度、压强的变化曲线.菁优网版权所有 【专题】517:化学反应中的能量变化;51E:化学平衡专题. 【分析】(1)乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),效仿乙酸乙 酯水解,将水分成氢原子和羟基生成乙醇和硫酸; (2)利用盖斯定律构造目标热化学方程式并求焓变,气相直接水合法原子利用 率 100%; (3)①列出 Kp 表达式,利用三段法计算平衡分压带入表达式计算即可; ②在相同温度下由于乙烯转化率为 p1<p2<p3<p4,由 C2H4(g)+H2O(g) →C2H5OH(g)可知正反应为气体体积减小的反应,根据压强对平衡移动的 影响分析; ③若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以改 变物质的浓度。 【解答】解:(1)乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),化学方 程式为 C2H4+H2SO4→C2H5OSO3H,硫酸氢乙酯水解生成乙醇和硫酸,化学方 程式为 C2H5OSO3H+H2O→C2H5OH+H2SO4, 故答案为:C2H4+H2SO4→C2H5OSO3H、C2H5OSO3H+H2O→C2H5OH+H2SO4; (2)已知:甲醇脱水反应 ①2CH3OH(g)═CH3OCH3(g)+H2O(g)△ H1=﹣23.9kJ•mol﹣1 甲醇制烯烃反应 ②2CH3OH(g)═C2H4(g)+2H2O(g)△H2=﹣29.1kJ•mol﹣1 乙醇异构化反应 ③C2H5OH(g)═CH3OCH3(g)△H3=+50.7kJ•mol﹣1, 根据盖斯定律①﹣②﹣③可得:C2H4(g)+H2O(g)═C2H5OH(g)△H=( ﹣23.9+29.1﹣50.7)kJ/mol=﹣45.5kJ/mol; 第 25 页(共 35 页) 乙烯直接水化法中反应物中所有原子全部都变成生成物,所以原子利用率 100%, 没有副产品, 故答案为:﹣45.5;无副产品,原子利用率 100%; (3)①C2H4(g)+H2O(g)═C2H5OH(g) 开始:1 转化:0.2 平衡:0.8 乙醇占 100.2 0.8 0.2 0.2 = ,乙烯和水各占 = ,则乙醇的分压为 7.85MPa× =0.87MPa,乙烯和水的分压为 7.85MPa× =3.49MPa, =0.07(MPa)﹣1, 所以 Kp= =故答案为:0.07(MPa)﹣1; ②在相同温度下由于乙烯转化率为 p1<p2<p3<p4,由 C2H4(g)+H2O(g)═ C2H5OH(g)可知正反应为气体体积减小的反应,所以增大压强,平衡正向 移动,乙烯的转化率提高,因此压强关系是 p1<p2<p3<p4, 故答案为:p1<p2<p3<p4;反应分子数减少,相同温度下,压强升高乙烯转化 率提高; ③若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以改 变物质的浓度,如从平衡体系中将产物乙醇分离出来,或增大水蒸气的浓度, 改变二者物质的量的比等, 故答案为:将产物乙醇液化移去;增加 :比。 【点评】本题考查了化学方程式的书写、压强对平衡移动的影响、物质制取方案 的比较、反应热及平衡常数的计算等知识,综合性非常强,该题是高考中的 常见题型,属于中等难度较大,侧重于学生分析问题、解决问题、知识迁移 能力的培养。 【化学-选修 2:化学与技术】 11.(15 分)磷矿石主要以磷酸钙[Ca3(PO4)2•H2O]和磷灰石[Ca5F(PO4)3, 第 26 页(共 35 页) Ca5(OH)(PO4) ]等形式存在,图(a)为目前国际上磷矿石利用的大致情 3况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸,图(b)是热法磷酸 生产过程中由磷灰石制单质磷的流程: 部分物质的相关性质如下: 熔点/℃ 44 沸点/℃ 280.5 备注 白磷 PH3 ﹣133.8 ﹣90 ﹣87.8 ﹣86 难溶于水、有还原性 易水解 SiF4 回答下列问题: (1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的 69 % ;(2)以磷矿石为原料,湿法磷酸过程中 Ca5F(PO4) 反应化学方程式为: Ca5F 3(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑ .现有 1t 折合含有 P2O5 约 30%的 磷灰石,最多可制得到 85%的商品磷酸 0.49 t. (3)如图(b)所示,热法磷酸生产过程的第一步是将 SiO2、过量焦炭与磷灰 石混合,高温反应生成白磷.炉渣的主要成分是 CaSiO3 (填化学式). 冷凝塔 1 的主要沉积物是 液态白磷 ,冷凝塔 2 的主要沉积物是 固态白 磷 . 第 27 页(共 35 页) (4)尾气中主要含有 SiF4、CO ,还含有少量的 PH3、H2S 和 HF 等.将尾 气先通入纯碱溶液,可除去 SiF4、H2S、HF ;再通入次氯酸钠溶液,可除 去 PH3 .(均填化学式) (5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是 产品纯度高 . 【考点】U3:制备实验方案的设计.菁优网版权所有 【专题】18:实验分析题;25:实验评价题;43:演绎推理法;548:制备实验 综合. 【分析】(1)由图(a)可知生产含磷肥料,约占磷矿石使用量的比例为:4%+96% ×85%×80%=69%; (2)以磷矿石为原料,用过量的硫酸溶解 Ca5F(PO4) 可制得磷酸,根据质量 3守恒书写化学方程式;根据 P 元素守恒可得关系式 P2O5~2H3PO4,依据此关 系式计算; (3)将 SiO2、过量焦炭与磷灰石混合,高温除了反应生成白磷之外,得到的难 溶性固体是 CaSiO3;根据冷却塔 1、2 的温度与白磷的熔点比较分析白磷的状 态; (4)二氧化硅和 HF 反应生成四氟化硅气体,过量的焦炭不完全燃烧生成 CO, 因此在尾气中主要含有 SiF4、CO,还含有少量的 PH3、H2S 和 HF 等;将尾 气通入纯碱溶液,SiF4、HF、H2S 与碳酸钠反应而除去,次氯酸具有强氧化 性,可除掉强还原性的 PH3; (5)相比于湿法磷酸,热法磷酸工艺所得产品纯度大; 【解答】解:(1)由图(a)可知生产含磷肥料,约占磷矿石使用量的比例为: 4%+96%×85%×80%=69%, 故答案为:69; (2)以磷矿石为原料,用过量的硫酸溶解 Ca5F(PO4) 可制得磷酸,根据质量 3守 恒 定 律 可 得 反 应 的 化 学 方 程 式 为Ca5F ( PO4 ) 3+5H2SO4=3H3PO4+5CaSO4+HF↑; 根据 P 元素守恒可得关系式 P2O5~2H3PO4,142 份 P2O5 可制取 196 份磷酸,1t 折合含有 P2O5 约 30%的磷灰石,含有 P2O5 的质量为 0.3t,所以可制得到 85% 第 28 页(共 35 页) 的商品磷酸的质量为 =0.49t, 故答案为:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑;0.49; (3)将 SiO2、过量焦炭与磷灰石混合,高温除了反应生成白磷之外,得到的难 溶性固体是 CaSiO3;冷却塔 1 的温度是 70℃,280.5℃>t>44℃,所以此时主 要的沉积物是液态白磷;冷却塔 2 的温度是 18℃,低于白磷的熔点,故此时 的主要沉积物是固体白磷, 故答案为:CaSiO3;液态白磷;固态白磷; (4)二氧化硅和 HF 反应生成四氟化硅气体,过量的焦炭不完全燃烧生成 CO, 因此在尾气中主要含有 SiF4、CO,还含有少量的 PH3、H2S 和 HF 等;将尾 气通入纯碱溶液,SiF4、HF、H2S 与碳酸钠反应而除去,次氯酸具有强氧化 性,可除掉强还原性的 PH3, 故答案为:SiF4、CO;SiF4、H2S、HF;PH3; (5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但是所得产品纯度大,杂 质少,因此逐渐被采用, 故答案为:产品纯度高. 【点评】本题考查了化工生产流程图,涉及磷矿石的主要用途、反应原理和有关 计算,该题是高考中的常见题型,题目难度中等,侧重对学生分析问题、解 答问题能力的培养. 【化学-选修 3:物质结构与性质】 12.早期发现的一种天然二十面体准晶颗粒由 Al、Cu、Fe 三种金属元素组成, 回答下列问题: (1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 X 射线衍射 方法区分晶体、准晶体和非晶体. ( 2 ) 基 态Fe 原 子 有4 个 未 成 对 电 子 , Fe3+ 的 电 子 排 布 式 为1s22s22p63s23p63d5 ,可用硫氰化钾检验 Fe3+,形成的配合物的颜色为 血红 色 . (3)新制备的 Cu(OH) 可将乙醛(CH3CHO)氧化成乙酸,而自身还原成 Cu2O 2,乙醛中碳原子的杂化轨道类型为 sp3、sp2 ;1mol 乙醛分子中含有的 σ 键 第 29 页(共 35 页) 的数目为 6NA ,乙酸的沸点明显高于乙醛,其主要原因是 乙酸存在分子 间氢键 .Cu2O 为半导体材料,在其立方晶胞内部有 4 个氧原子,其余氧原 子位于面心和顶点,则该晶胞中有 16 个铜原子. (4)Al 单质为面心立方晶体,其晶胞参数 a=0.405nm,晶胞中铝原子的配位数 为12 , 列 式 表 示Al 单 质 的 密 度 g•cm﹣3(不必计算出结果). 【考点】1B:真题集萃;86:原子核外电子排布;96:共价键的形成及共价键 的主要类型;99:配合物的成键情况;9I:晶胞的计算;A6:不同晶体的结 构微粒及微粒间作用力的区别.菁优网版权所有 【专题】51C:元素周期律与元素周期表专题;51D:化学键与晶体结构. 【分析】(1)晶体对 X 射线发生衍射,非晶体不发生衍射,准晶体介于二者之 间; (2)根据 Fe 原子的核外电子排布式确定未成对电子数,失去电子变为铁离子时 ,先失去 4s 上的电子后失去 3d 上的电子,硫氰化铁为血红色; (3)乙醛中甲基上的 C 采取 sp3 杂化类型,醛基中的 C 采取 sp2 杂化类型;1 个 乙醛分子含有 6 个 σ 键和一个 π 键;乙酸分子间可形成氢键导致沸点较高; 根据 O 数目和 Cu2O 中 Cu 和 O 的比例计算晶胞中 Cu 原子的数目; (4)在 Al 晶体的一个晶胞中与它距离相等且最近的 Al 原子在通过这个顶点的 三个面心上,面心占 ,通过一个顶点可形成8 个晶胞. 【解答】解:(1)从外观无法区分三者,但用 X 光照射挥发现:晶体对 X 射线 发生衍射,非晶体不发生衍射,准晶体介于二者之间,因此通过有无衍射现 象即可确定, 故答案为:X 射线衍射; (2)26 号元素 Fe 基态原子核外电子排布式为 1s22s22p63s23p63d64s2,可知在 3d 上存在 4 个未成对电子,失去电子变为铁离子时,先失去 4s 上的 2 个电子后 失去 3d 上的 1 个电子,因此 Fe3+的电子排布式为 1s22s22p63s23p63d5,硫氰化 铁为血红色, 第 30 页(共 35 页) 故答案为:4;1s22s22p63s23p63d5;血红色; (3)乙醛中甲基上的 C 形成 4 条 σ 键,无孤电子对,因此采取 sp3 杂化类型, 醛基中的 C 形成 3 条 σ 键和 1 条 π 键,无孤电子对,采取 sp2 杂化类型;1 个 乙醛分子含有 6 个 σ 键和一个 π 键,则 1mol 乙醛含有 6molσ 键,即 6NA 个 σ 键;乙酸分子间可形成氢键,乙醛不能形成氢键,所以乙酸的沸点高于乙醛; 该晶胞中 O 原子数为 4×1+6× +8× =8,由 Cu2O 中 Cu 和 O 的比例可知该 晶胞中铜原子数为 O 原子数的 2 倍,即为 16 个; 故答案为:sp3、sp2;6NA;乙酸存在分子间氢键;16; (4)在 Al 晶体的一个晶胞中与它距离相等且最近的 Al 原子在通过这个顶点的 三个面心上,面心占 ,通过一个顶点可形成8 个晶胞,因此该晶胞中铝原 子的配位数为 8×3× =12;一个晶胞中 Al 原子数为 8× =4,因此 Al 度的密ρ= = =g•cm﹣3, 故答案为: .【点评】本题考查了晶体的性质、原子核外电子排布规律、共价键类型、氢键、 杂化类型、晶胞配位数及密度的计算,综合性非常强,为历年高考选作常考 题型,难度中等,其中晶胞配位数以及密度的计算是本题的难点. 【化学-选修 5:有机化学基础】 13.席夫碱类化合物 G 在催化、药物、新材料等方面有广泛应用。合成 G 的一 种路线如下: 已知以下信息: 第 31 页(共 35 页) ①②1molB 经上述反应可生成 2molC,且 C 不能发生银镜反应。 ③D 属于单取代芳香烃,其相对分子质量为 106。 ④核磁共振氢谱显示 F 苯环上有两种化学环境的氢。 ⑤回答下列问题: (1)由 A 生成 B 的化学方程式为 (CH3)2CH﹣CCl(CH3)2+NaOH CH3)2C=C(CH3)2+NaCl+H2O ,反应类型为 消去反应 ; (( 2 ) E 的 化 学 名 称 是对 硝 基 乙 苯, 由D 生 成E 的 化 学 方 程 式 为+HO﹣NO2 +H2O ; (3)G 的结构简式为 ; (4)F 的同分异构体中含有苯环的还有 19 种(不考虑立体异构),其中核 磁 共 振 氢 谱 中 有4 组 峰 , 且 面 积 比 为6 : 2 : 2 : 1 的 是 ,(写出其中的一种的结 构简式)。 (5)由苯和化合物 C 经如下步骤可合成 N﹣异丙基苯胺。 反应条件 1 所选择的试剂为 浓硝酸、浓硫酸 ;反应条件 2 所选择的试剂为 Fe 粉/盐酸 ;I 的结构简式为 。 【考点】HB:有机物的推断.菁优网版权所有 【专题】534:有机物的化学性质及推断. 第 32 页(共 35 页) 【分析】A 的分子式为 C6H13Cl,为己烷的一氯代物,在氢氧化钠醇溶液、加热 条件下发生消去反应得到 B 为烯烃,1mol B 发生信息①中氧化反应生成 2mol C,且 C 不能发生银镜反应,B 为对称结构烯烃,且不饱和 C 原子没有 H 原 子,故 B 为(CH3)C=C(CH3),C 为(CH3)C=O,逆推可知 A 为(CH3 222)2CH﹣CCl(CH3)2.D 属于单取代芳烃,其相对分子质量为 106,D 含有 一个苯环,侧链式量=106﹣77=29,故侧链为﹣CH2CH3,D 为 ,核磁共振氢谱显示 F 苯环上有两种化学环境的氢,故 D 发生乙基对位取代反 应生成 E 为 ,则 F 为 ,由 F 的分子式可知,E 中硝基被还原为﹣NH2 ,C 与 F 发生信息⑤中反应,分子间脱去 1 分子 水形成 N=C 双键得到 G,则 G 为 ,据此解答。 【解答】解:A 的分子式为 C6H13Cl,为己烷的一氯代物,在氢氧化钠醇溶液、 加热条件下发生消去反应得到 B 为烯烃,1mol B 发生信息①中氧化反应生成 2mol C,且 C 不能发生银镜反应,B 为对称结构烯烃,且不饱和 C 原子没有 H 原子,故 B 为(CH3)2C=C(CH3)2,C 为(CH3)2C=O,逆推可知 A 为( CH3)CH﹣CCl(CH3).D 属于单取代芳烃,其相对分子质量为 106,D 含 22有一个苯环,侧链式量=106﹣77=29,故侧链为﹣CH2CH3,D 为 ,核磁共振氢谱显示 F 苯环上有两种化学环境的氢,故 D 发生乙基对位取代 反应生成 E 为 ﹣NH2,则 F 为 ,由 F 的分子式可知,E 中硝基被还原为 ,C 与 F 发生信息⑤中反应,分子间脱去 1 分子水形成 N=C 双键得到 G,则 G 为 。(1)由 A 生成 B 的化学方程式为:(CH3)2CH﹣CCl(CH3)2+NaOH CH3)2C=C(CH3)2+NaCl+H2O,属于消去反应, (故答案为:(CH3 )2CH﹣CCl(CH3 )2+NaOH 2+NaCl+H2O;消去反应; (CH3 )2C=C(CH3 ) 第 33 页(共 35 页) (2)由上述分析可知,E 为 ,化学名称是对硝基乙苯,由 D 生成E的化学方程式为:+HO﹣NO2 +H2O, 故答案为:对硝基乙苯;+HO﹣NO2 +H2O; (3)由上述分析可知,G 的结构简式为 ,故答案为: ;(4)F 为 ,含有苯环同分异构体中, 若取代基为氨基、乙基,还有邻位、间位 2 种, 若只有一个取代基,可以为﹣CH(NH2)CH3、﹣CH2CH2NH2、﹣NH﹣CH2CH3 、﹣CH2NHCH3、﹣N(CH3)2,有 5 种; 若取代为 2 个,还有﹣CH3、﹣CH2NH2 或﹣CH3、﹣NHCH3,各有邻、间、对 三种,共有 6 种; 若取代基有 3 个,即﹣CH3、﹣CH3、﹣NH2,2 个甲基相邻,氨基有 2 种位置, 2 个甲基处于间位,氨基有 3 种位置,2 个甲基处于对位,氨基有 1 种位置, 共有 2+3+1=6 种, 故符合条件的同分异构体有:2+5+6+6=19, 其中核磁共振氢谱为 4 组峰,且面积比为 6:2:2:1,说明含有 2 个﹣CH3,可 以是 ,故答案为:19; ;第 34 页(共 35 页) (5)由苯与浓硝酸、浓硫酸在加热条件下得到 H 为硝基苯,硝基苯在 Fe 粉/盐 酸条件下还有得到 I 为 ,再与(CH3)2C=O 反应得到 ,最后加成反应还原得到 ,故反应条件 1 所选用的试剂为:浓硝酸、浓硫酸,反应条件 2 所选用的试剂为: Fe 粉/稀盐酸,I 的结构简式为 ,故答案为:浓硝酸、浓硫酸;Fe 粉/盐酸; 。【点评】本题考查有机物推断与合成,需要学生对给予的信息进行运用,能较好 的考查学生自学能力,要充分利用合成路线中有机物的分子式,关键是确定 A 与 D 的结构,再利用正、逆推法相结合进行推断,(4)中同分异构体问题为 易错点,难度中等。 第 35 页(共 35 页)
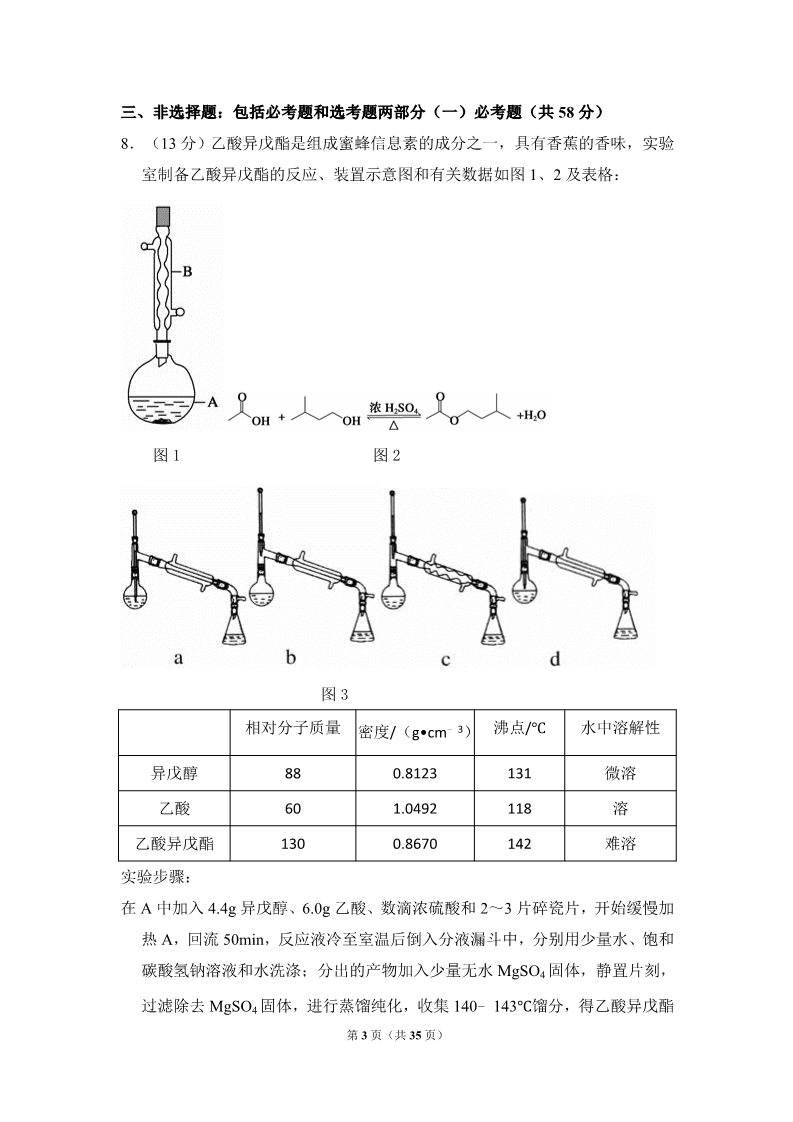
2014 年全国统一高考化学试卷(新课标Ⅰ) 一、选择题(本题共 7 小题,每小题 6 分,共 42 分) 1.(6 分)下列化合物中同分异构体数目最少的是( ) A.戊烷 B.戊醇 C.戊烯 D.乙酸乙酯 2.(6 分)化学与社会、生活密切相关,对下列现象或事实的解释正确的是( ) 选项 现象或事实 用热的烧碱溶液洗去油污 漂白粉在空气中久置变质 解释 ABNa2CO3 可直接和油污反应 漂白粉中的 CaCl2 与空气中的 CO2 反应生成 CaCO3 C施肥时,草木灰(有效成分为 K2CO3)不 K2CO3 与 NH4Cl 反应生成氨气 能与 NH4Cl 混合使用 会降低肥效 FeCl3 能从含有 Cu2+的溶液中置 DFeCl3 溶液可用于铜质印刷线路板制作 换出铜 A.A B.B C.C D.D 3.(6 分)已知分解 1mol H2O2 放出热量 98kJ,在含少量 I﹣的溶液中,H2O2 分 解的机理为: H2O2+I﹣→H2O+IO﹣ 慢H2O2+IO﹣→H2O+O2+I﹣ 快下列有关该反应的说法正确的是( ) A.反应速率与 I﹣的浓度有关 B.IO﹣也是该反应的催化剂 C.反应活化能等于 98kJ•mol﹣1 D.v(H2O2)=v(H2O)=v(O2) 4.(6 分)X,Y,Z 均为短周期元素,X,Y 处于同一周期,X,Z 的最低价离 子分别为 X2﹣和 Z﹣,Y+和 Z﹣具有相同的电子层结构。下列说法正确的是( )A.原子最外层电子数:X>Y>Z C.离子半径:X2﹣>Y+>Z﹣ B.单质沸点:X>Y>Z D.原子序数:X>Y>Z 第 1 页(共 35 页) 5.(6 分)溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误 的是( ) A.溴酸银的溶解是放热过程 B.温度升高时溴酸银溶解速度加快 C.60℃时溴酸银的 Ksp 约等于 6×10﹣4 D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 6.(6 分)下列有关仪器使用方法或实验操作正确的是( ) A.洗净的锥形瓶和容量瓶可以放进烘箱烘干 B.酸式滴定管装标准溶液前,必须先用该溶液润洗 C.酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差 D.用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体 7.(6 分)利用如图所示装置进行下列实验,能得出相应实验结论是( ) 选项 ①②③实验结论 ANa2S 稀硫酸 AgNO3 与 AgCl Ksp(AgCl)>Ksp(Ag2S) 的浊液 BC浓硫酸 蔗糖 溴水 浓硫酸具有脱水性、氧化性 Na2SO3 稀盐酸 Ba(NO3)2 溶 SO2 与可溶性钡盐均可生成 白色沉淀 液DNa2CO3 浓硝酸 Na2SiO3 溶液 酸性:硝酸>碳酸>硅酸 A.A B.B C.C D.D 第 2 页(共 35 页) 三、非选择题:包括必考题和选考题两部分(一)必考题(共 58 分) 8.(13 分)乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验 室制备乙酸异戊酯的反应、装置示意图和有关数据如图 1、2 及表格: 图 1 图 2 图 3 密度/(g•cm﹣3) 相对分子质量 沸点/℃ 水中溶解性 88 60 0.8123 1.0492 0.8670 131 118 142 异戊醇 乙酸 微溶 溶130 乙酸异戊酯 实验步骤: 难溶 在 A 中加入 4.4g 异戊醇、6.0g 乙酸、数滴浓硫酸和 2~3 片碎瓷片,开始缓慢加 热 A,回流 50min,反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和 碳酸氢钠溶液和水洗涤;分出的产物加入少量无水 MgSO4 固体,静置片刻, 过滤除去 MgSO4 固体,进行蒸馏纯化,收集 140﹣143℃馏分,得乙酸异戊酯 第 3 页(共 35 页) 3.9g. 回答下列问题: (1)仪器 B 的名称是 ; (2)在洗涤操作中,第一次水洗的主要目的是 是 ; ,第二次水洗的主要目的 (3)在洗涤、分液操作中,应充分振荡、然后静置,待分层后 ) (填标号 a.直接将乙酸异戊酯从分液漏斗的上口倒出 b.直接将乙酸异戊酯从分液漏斗的下口放出 c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出 d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出 (4)本实验中加入过量乙酸的目的是 (5)实验中加入少量无水 MgSO4 的目的是 (6)在蒸馏操作中,仪器选择及安装都正确的是(如图 3) (7)本实验的产率是 (填标号) a.30% b.40% c.60% d.90% (8)在进行蒸馏操作时,若从 130℃便开始收集馏分,会使实验的产率偏 (填“高”或“低”),其原因是 . ; ; (填标号) 9.(15 分)次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答 下列问题: (1)H3PO2 是一元中强酸,写出其电离方程式 (2)H3PO2 及 NaH2PO2 均可将溶液中的 Ag+还原为银,从而可用于化学镀银。 ①H3PO2 中,P 元素的化合价为 ; ②利用 H3PO2 进行化学镀银反应中,氧化剂与还原剂的物质的量之比为 4:1, ; 则氧化产物为 (填化学式); ③NaH2PO2 为 (填“正盐”或“酸式盐”),其溶液显 (填“弱酸性” 、“中性”或“弱碱性”); (3)H3PO2 的工业制法是:将白磷(P4)与 Ba(OH)2 溶液反应生成 PH3 气体 和 Ba(H2PO2),后者再与 H2SO4 反应,写出白磷与 Ba(OH) 溶液反应的 22第 4 页(共 35 页) 化学方程式 ; (4)H3PO2 也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和 阴膜分别只允许阳离子、阴离子通过): ①写出阳极的电极反应式 ; ②分析产品室可得到 H3PO2 的原因 ; ③早期采用“三室电渗析法”制备 H3PO2,将“四室电渗析法”中阳极室的稀硫酸用 H3PO2 稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室 与产品室,其缺点是产品中混有 杂质,该杂质产生的原因是 。 10.(15 分)乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水 合法生产,回答下列问题: (1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H), 再水解生成乙醇,写出相应反应的化学方程式 ; (2)已知: 甲醇脱水反应 2CH3OH(g)═CH3OCH3(g)+H2O(g)△H1=﹣23.9kJ•mol﹣1 甲醇制烯烃反应 2CH3OH(g)═C2H4(g)+2H2O(g)△H2=﹣29.1kJ•mol﹣1 乙醇异构化反应 C2H5OH(g)═CH3OCH3(g)△H3=+50.7kJ•mol﹣1 则乙烯气相直接水合反应 C2H4 (g)+H2O(g)═C2H5OH(g)的△H= kJ•mol﹣1,与间接水合法相比,气相直接水合法的优点是 (3)如图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中 =1:1) ; :第 5 页(共 35 页) ①列式计算乙烯水合制乙醇反应在图中 A 点的平衡常数 Kp= 压代替平衡浓度计算,分压=总压×物质的量分数); (用平衡分 ; ②图中压强(P1,P2,P3,P4)大小顺序为 ,理由是 ③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度 290℃ ,压强 6.9MPa, =0.6:1,乙烯的转化率为 5%,若要进一步提 :高乙烯转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有 、 。 【化学-选修 2:化学与技术】 11.(15 分)磷矿石主要以磷酸钙[Ca3(PO4)2•H2O]和磷灰石[Ca5F(PO4)3, Ca5(OH)(PO4) ]等形式存在,图(a)为目前国际上磷矿石利用的大致情 3况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸,图(b)是热法磷酸 生产过程中由磷灰石制单质磷的流程: 第 6 页(共 35 页) 部分物质的相关性质如下: 熔点/℃ 沸点/℃ 280.5 备注 44 白磷 PH3 ﹣133.8 ﹣90 ﹣87.8 ﹣86 难溶于水、有还原性 易水解 SiF4 回答下列问题: (1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的 % ;(2)以磷矿石为原料,湿法磷酸过程中 Ca5F(PO4)3 反应化学方程式为: .现有 1t 折合含有 P2O5 约 30%的磷灰石,最多可制得到 85%的商品磷酸 t. (3)如图(b)所示,热法磷酸生产过程的第一步是将 SiO2、过量焦炭与磷灰 石混合,高温反应生成白磷.炉渣的主要成分是 (填化学式).冷凝 塔 1 的主要沉积物是 (4)尾气中主要含有 入纯碱溶液,可除去 填化学式) ,冷凝塔 2 的主要沉积物是 . ,还含有少量的 PH3、H2S 和 HF 等.将尾气先通 ;再通入次氯酸钠溶液,可除去 .(均 (5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是 . 【化学-选修 3:物质结构与性质】 12.早期发现的一种天然二十面体准晶颗粒由 Al、Cu、Fe 三种金属元素组成, 回答下列问题: (1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体、准晶体和非晶体. (2)基态 Fe 原子有 硫氰化钾检验 Fe3+,形成的配合物的颜色为 (3)新制备的 Cu(OH) 可将乙醛(CH3CHO)氧化成乙酸,而自身还原成 Cu2O 个未成对电子,Fe3+的电子排布式为 ,可用 . 2,乙醛中碳原子的杂化轨道类型为 数目为 ;1mol 乙醛分子中含有的 σ 键的 .Cu2O 为 ,乙酸的沸点明显高于乙醛,其主要原因是 第 7 页(共 35 页) 半导体材料,在其立方晶胞内部有 4 个氧原子,其余氧原子位于面心和顶点, 则该晶胞中有 个铜原子. (4)Al 单质为面心立方晶体,其晶胞参数 a=0.405nm,晶胞中铝原子的配位数 g•cm﹣3(不必计算出结果). 为 ,列式表示 Al 单质的密度 【化学-选修 5:有机化学基础】 13.席夫碱类化合物 G 在催化、药物、新材料等方面有广泛应用。合成 G 的一 种路线如下: 已知以下信息: ①②1molB 经上述反应可生成 2molC,且 C 不能发生银镜反应。 ③D 属于单取代芳香烃,其相对分子质量为 106。 ④核磁共振氢谱显示 F 苯环上有两种化学环境的氢。 ⑤回答下列问题: (1)由 A 生成 B 的化学方程式为 ,反应类型为 ; (2)E 的化学名称是 (3)G 的结构简式为 ,由 D 生成 E 的化学方程式为 ; ; (4)F 的同分异构体中含有苯环的还有 种(不考虑立体异构),其中核 磁共振氢谱中有 4 组峰,且面积比为 6:2:2:1 的是 ,(写出其中 的一种的结构简式)。 (5)由苯和化合物 C 经如下步骤可合成 N﹣异丙基苯胺。 第 8 页(共 35 页) 反应条件 1 所选择的试剂为 结构简式为 。 ;反应条件 2 所选择的试剂为 ;I 的 第 9 页(共 35 页) 2014 年全国统一高考化学试卷(新课标Ⅰ) 参考答案与试题解析 一、选择题(本题共 7 小题,每小题 6 分,共 42 分) 1.(6 分)下列化合物中同分异构体数目最少的是( ) A.戊烷 B.戊醇 C.戊烯 D.乙酸乙酯 【考点】I4:同分异构现象和同分异构体.菁优网版权所有 【专题】531:同系物和同分异构体. 【分析】戊烷只存在碳链异构,戊醇和戊烯存在碳链异构、位置异构,乙酸乙酯 存在碳链异构、官能团异构、位置异构. 【解答】解:戊烷只存在碳链异构,同分异构体为 3 种,而戊醇和戊烯存在碳链 异构、位置异构,乙酸乙酯存在碳链异构、官能团异构、位置异构,异构类 型越多,同分异构体的数目越多,因此戊醇、戊烯和乙酸乙酯的同分异构体 的数目均大于 3 种, 故选:A。 【点评】本题主要考查了同分异构体数目的判断,可通过同分异构体的类型进行 简单判断,难度不大. 2.(6 分)化学与社会、生活密切相关,对下列现象或事实的解释正确的是( ) 选项 现象或事实 解释 A用热的烧碱溶液洗去油污 Na2CO3 可直接和油污反 应B漂白粉在空气中久置变质 漂白粉中的 CaCl2 与空气 中的 CO2 反 应生成 CaCO3 第 10 页(共 35 页) C施肥时,草木灰(有效成分为 K2CO3) K2CO3 与 NH4Cl 反应生成 不能 氨气会降低 肥效 与 NH4Cl 混合使用 FeCl3 溶液可用于铜质印刷线路板制作 FeCl3 能从含有 Cu2+的溶 D液中置换出铜 A.A B.B C.C D.D 【考点】FH:硅和二氧化硅;GF:钠的重要化合物;GL:两性氧化物和两性氢 氧化物;IC:乙烯的用途.菁优网版权所有 【分析】A.依据盐类水解的性质及油脂水解的性质解答; B.漂白粉漂白原理为次氯酸钙与二氧化碳、水反应生成碳酸钙和次氯酸; C.依据盐类水解的性质解答; D.氯化铁能够与铜反应生成氯化亚铁和氯化铜. 【解答】解:A.油脂在碱性环境下水解生成可溶性物质,碳酸钠为强碱弱酸盐 水解显碱性,升高温度促进盐类水解,所以用热的纯碱溶液洗去油污,碳酸 钠与油脂不直接反应,故 A 错误; B.漂白粉漂白原理为次氯酸钙与二氧化碳、水反应生成碳酸钙和次氯酸,次氯 酸具有漂白作用,二氧化碳与氯化钙不反应,故 B 错误; C.碳酸钾和氯化铵在溶液中水解促进生成氨气,降低肥效,施肥时,草木灰( 有效成分为 K2CO3)不能与 NH4Cl 混合使用,故 C 正确; D.氯化铁能够与铜反应生成氯化亚铁和氯化铜,铜不能置换铁,故 D 错误。 故选:C。 【点评】本题考查化学实验方案的评价,涉及盐类水解的分析应用、氧化性强弱 判断等,掌握物质性质和反应实质是关键,为高考常见题型,注意相关知识 的学习与积累,难度不大. 3.(6 分)已知分解 1mol H2O2 放出热量 98kJ,在含少量 I﹣的溶液中,H2O2 分 解的机理为: H2O2+I﹣→H2O+IO﹣ 慢第 11 页(共 35 页) H2O2+IO﹣→H2O+O2+I﹣ 快下列有关该反应的说法正确的是( ) A.反应速率与 I﹣的浓度有关 B.IO﹣也是该反应的催化剂 C.反应活化能等于 98kJ•mol﹣1 D.v(H2O2)=v(H2O)=v(O2) 【考点】16:化学反应的基本原理;17:化学反应的能量变化规律;BB:反应 热和焓变;CA:化学反应速率的影响因素.菁优网版权所有 【专题】513:物质的性质和变化专题;517:化学反应中的能量变化. 【分析】A、反应速率的快慢主要决定于反应速率慢的第一步反应; B、反应的催化剂是 I﹣; C、分解 1mol 过氧化氢放出的热量是其△H.而非活化能; D、在一个化学反应中,用各物质表示的速率之比等于化学计量数之比; 【解答】解:A、已知:①H2O2+I﹣→H2O+IO﹣ 慢②H2O2+IO﹣→H2O+O2+I﹣ 快,过氧化氢分解快慢决定于反应慢的①,I﹣是①的反应物之一,其浓度大 小对反应不可能没有影响,例如,其浓度为 0 时反应不能发生,故 A 正确; B、将反应①+②可得总反应方程式,反应的催化剂是 I﹣,IO﹣只是中间产物, 故 B 错误; C、1mol 过氧化氢分解的△H=﹣98KJ/mol,△H 不是反应的活化能,是生成物 与反应物的能量差,故 C 错误; D、因为反应是在含少量 I﹣的溶液中进行的,溶液中水的浓度是常数,不能用 其浓度变化表示反应速率,故 D 错误。故选:A。 【点评】本题是 2014 年河北高考题,题目主要考查催化剂、活化能、化学反应 速率的相关知识,题目难度不大. 4.(6 分)X,Y,Z 均为短周期元素,X,Y 处于同一周期,X,Z 的最低价离 子分别为 X2﹣和 Z﹣,Y+和 Z﹣具有相同的电子层结构。下列说法正确的是( 第 12 页(共 35 页) )A.原子最外层电子数:X>Y>Z B.单质沸点:X>Y>Z D.原子序数:X>Y>Z C.离子半径:X2﹣>Y+>Z﹣ 【考点】1B:真题集萃;8F:原子结构与元素周期律的关系.菁优网版权所有 【专题】51C:元素周期律与元素周期表专题. 【分析】X、Z 的最低价离子分别为 X2﹣和 Z﹣,则 X 为第ⅥA 族元素,Z 为ⅦA 族元素;Y+和 Z﹣具有相同的电子层结构,则 Y 在 Z 的下一周期,则 Y 为 Na 元素,Z 为 F 元素,X、Y 同周期,则 X 为 S 元素,结合元素在周期表中的 位置以及元素周期律知识解答该题. 【解答】解:X、Z 的最低价离子分别为 X2﹣和 Z﹣,则 X 为第ⅥA 族元素,Z 为ⅦA 族元素;Y+和 Z﹣具有相同的电子层结构,则 Y 在 Z 的下一周期,则 Y 为 Na 元素,Z 为 F 元素,X、Y 同周期,则 X 为 S 元素, A.X、Y、Z 分别为 S、Na、F,原子最外层电子数分别为 6、1、7,故 A 错误; B.常温下 Na、S 为固体,F2 为气体,Na 的熔点较低,但钠的沸点高于硫,顺 序应为 Na>S>F2,故 B 错误; C.Na+、F﹣具有相同的核外电子排布,离子的核电荷数越大,半径越小,应为 F﹣ >Na+,故 C 错误; D.X、Y、Z 原子序数分别为 16、11、9,原子序数:X>Y>Z,故 D 正确。 故选:D。 【点评】本题考查原子结构与元素周期律的关系,为高考常见题型,侧重于学生 的分析能力的考查,题目难度不大,本题的关键是根据原子结构特点正确推 断元素的种类. 5.(6 分)溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误 的是( ) 第 13 页(共 35 页) A.溴酸银的溶解是放热过程 B.温度升高时溴酸银溶解速度加快 C.60℃时溴酸银的 Ksp 约等于 6×10﹣4 D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 【考点】62:溶解度、饱和溶液的概念;DH:难溶电解质的溶解平衡及沉淀转 化的本质.菁优网版权所有 【专题】519:物质的量浓度和溶解度专题. 【分析】A.根据图象中温度对溴酸银的溶解度影响可知溴酸银的溶解过程为吸 热过程; B.温度升高,可以加快物质的溶解速率; C.根据溶度积表达式及溶液中银离子和溴酸根离子的浓度计算; D.溴酸银的溶解度受温度的影响较小,可以通过重结晶法分离硝酸钾与溴酸银 的混合物。 【解答】解:A.根据图象可知,升高温度,溴酸银的溶解度增大,说明溴酸银 的溶解过程为吸热过程,故 A 错误; B.升高温度,溴酸银的溶解度增大,所以温度升高时溴酸银溶解速度加快,故 B 正确; C.60℃时溴酸银的溶解度为 0.6g,溴酸银的物质的量为: ≈2.5× 10﹣3mol,100.6g 溴酸银溶液的体积约为 100.6mL,溶液中银离子、溴酸根离 子浓度约为 2.5×10﹣2mol/L,所以 60℃时溴酸银的 Ksp=2.5×10﹣2×2.5×10﹣2 第 14 页(共 35 页) ≈6×10﹣4,故 C 正确; D.根据图象可知,溴酸银的溶解度受温度的影响不大,而硝酸钾的溶解度受温 度影响较大,所以硝酸钾中含有少量溴酸银,可用重结晶方法提纯,故 D 正 确; 故选:A。 【点评】本题考查了难溶物的溶解平衡、溶度积的表达式及计算、物质的分离与 提纯,题目难度中等,注意掌握难溶物的溶解平衡及其影响因素,明确溶度 积的概念及计算方法。 6.(6 分)下列有关仪器使用方法或实验操作正确的是( ) A.洗净的锥形瓶和容量瓶可以放进烘箱烘干 B.酸式滴定管装标准溶液前,必须先用该溶液润洗 C.酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差 D.用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体 【考点】U5:化学实验方案的评价.菁优网版权所有 【专题】25:实验评价题;541:化学实验常用仪器及试剂. 【分析】A.锥形瓶和容量瓶在使用时不需要烘干; B.滴定管在量取或者盛装溶液时必须润洗,否则会导致原溶液被蒸馏水稀释; C.锥形瓶不能润洗,否则导致待测液中溶质的物质的量偏大,滴定过程中消耗 的标准液体积偏大; D.容量瓶中加水超过刻度线,导致配制的溶液体积偏大,溶液浓度偏小,此次 配制失败. 【解答】解:A.锥形瓶、容量瓶中有少量的蒸馏水,不影响滴定结果或配制溶 液的浓度,所以不需要烘干锥形瓶或容量瓶,故 A 错误; B.酸式滴定管在盛放标准液之前,为了避免滴定管中的少量蒸馏水将标准液稀 释,应该先用标准液润洗,再盛放标准液,故 B 正确; C.滴定过程中,锥形瓶不能润洗,否则会导致锥形瓶中待测液的溶质的物质的 量偏大,测定结果偏高,故 C 错误; 第 15 页(共 35 页) D.用容量瓶配溶液时,若加水超过刻度线,此次配制失败,即使立即用滴管吸 出多余液体,也不会使配制的溶液浓度恢复正常,故 D 错误; 故选:B。 【点评】本题考查了常见计量仪器的构造及使用方法偏大,题目难度不大,注意 掌握常见仪器的构造及正确的使用方法,明确容量瓶、锥形瓶、滴定管的使 用方法. 7.(6 分)利用如图所示装置进行下列实验,能得出相应实验结论是( ) 选项 ①②③实验结论 ANa2S 稀硫酸 AgNO3 与 AgCl 的浊 液Ksp(AgCl)>Ksp(Ag2S) BCD浓硫酸 蔗糖 溴水 浓硫酸具有脱水性、氧化 性Na2SO3 Na2CO3 稀盐酸 浓硝酸 Ba(NO3)2 SO2 与可溶性钡盐均可生 溶液 成白色沉淀 Na2SiO3 溶液 酸性:硝酸>碳酸>硅酸 C.C D.D A.A B.B 【考点】U5:化学实验方案的评价.菁优网版权所有 【专题】25:实验评价题. 【分析】A.不发生沉淀的转化,AgNO3 与 AgCl 的浊液中,Qc(Ag2S)>Ksp( Ag2S),则生成 Ag2S; B.浓硫酸使蔗糖变黑,然后 C 与浓硫酸发生氧化还原反应生成二氧化硫,二氧 化硫与溴水发生氧化还原反应使其褪色; C.盐酸与亚硫酸钠生成二氧化硫,与 Ba(NO3)2 溶液发生氧化还原反应生成 硫酸钡沉淀; D.浓硝酸与碳酸钠反应生成二氧化碳,但浓硝酸易挥发,硝酸、碳酸均可与硅 酸钠溶液反应生成硅酸沉淀. 第 16 页(共 35 页) 【解答】解:A.图中装置和试剂不发生沉淀的转化,对 AgNO3 与 AgCl 的浊液 中,Qc(Ag2S)>Ksp(Ag2S),则生成 Ag2S,可发生沉淀的生成,则不能 比较溶度积,故 A 错误; B.浓硫酸具有脱水性使蔗糖变黑,然后 C 与浓硫酸发生氧化还原反应生成二氧 化硫,体现其强氧化性,最后二氧化硫与溴水发生氧化还原反应使其褪色, 故 B 正确; C.盐酸与亚硫酸钠生成二氧化硫,与 Ba(NO3)2 溶液发生氧化还原反应生成 硫酸钡沉淀,但 SO2 与可溶性钡盐不一定生成白色沉淀,如与氯化钡不反应, 故 C 错误; D.浓硝酸与碳酸钠反应生成二氧化碳,但浓硝酸易挥发,硝酸、碳酸均可与硅 酸钠溶液反应生成硅酸沉淀,则不能比较碳酸与硅酸的酸性,应排除硝酸的 干扰,故 D 错误; 故选:B。 【点评】本题考查化学实验方案的评价,为高频考点,涉及沉淀的生成与转化、 浓硫酸的性质、酸性比较、氧化还原反应等,把握化学反应原理及实验装置 中的反应为解答的关键,注意实验操作的可行性、评价性分析,题目难度不 大. 三、非选择题:包括必考题和选考题两部分(一)必考题(共 58 分) 8.(13 分)乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验 室制备乙酸异戊酯的反应、装置示意图和有关数据如图 1、2 及表格: 第 17 页(共 35 页) 图 1 图 2 图 3 密度/(g•cm﹣3) 相对分子质量 沸点/℃ 水中溶解性 88 60 0.8123 1.0492 0.8670 131 118 142 异戊醇 乙酸 微溶 溶130 乙酸异戊酯 实验步骤: 难溶 在 A 中加入 4.4g 异戊醇、6.0g 乙酸、数滴浓硫酸和 2~3 片碎瓷片,开始缓慢加 热 A,回流 50min,反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和 碳酸氢钠溶液和水洗涤;分出的产物加入少量无水 MgSO4 固体,静置片刻, 过滤除去 MgSO4 固体,进行蒸馏纯化,收集 140﹣143℃馏分,得乙酸异戊酯 3.9g. 回答下列问题: (1)仪器 B 的名称是 球形冷凝管 ; (2)在洗涤操作中,第一次水洗的主要目的是 洗掉大部分硫酸和醋酸 ,第 二次水洗的主要目的是 洗掉碳酸氢钠 ; (3)在洗涤、分液操作中,应充分振荡、然后静置,待分层后 d (填标号) a.直接将乙酸异戊酯从分液漏斗的上口倒出 b.直接将乙酸异戊酯从分液漏斗的下口放出 c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出 d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出 (4)本实验中加入过量乙酸的目的是 提高醇的转化率 ; 第 18 页(共 35 页) (5)实验中加入少量无水 MgSO4 的目的是 干燥乙酸异戊酯 ; (6)在蒸馏操作中,仪器选择及安装都正确的是(如图 3) b (填标号) (7)本实验的产率是 c (填标号) a.30% b.40% c.60% d.90% (8)在进行蒸馏操作时,若从 130℃便开始收集馏分,会使实验的产率偏 高 (填“高”或“低”),其原因是 会收集少量未反应的异戊醇 . 【考点】U3:制备实验方案的设计.菁优网版权所有 【专题】24:实验设计题. 【分析】(1)根据题中仪器 B 的构造判断该仪器的名称; (2)在洗涤操作中,第一次洗涤的主要目的是除去大部分催化剂硫酸和醋酸; 第二次水洗,主要目的是除去产品中残留的碳酸氢钠; (3)根据乙酸异戊酯的密度及正确的分液操作方法进行解答; (4)根据反应物对增加一种反应物的浓度,可以使另一种反应物的转化率提高 进行判断加入过量乙酸的目的; (5)少量无水硫酸镁能够吸收乙酸异戊酯中少量的水分,起到干燥作用; (6)先根据温度计在蒸馏操作中的作用排除 ad,再根据球形冷凝管容易使产品 滞留,不能全部收集到锥形瓶中,得出正确结论; (7)先计算出乙酸和异戊醇的物质的量,然后判断过量情况,根据不足量计算 出理论上生成乙酸异戊酯的物质的量,最后根据实际上制取的乙酸异戊酯计 算出产率; (8)若从 130℃便开始收集馏分此时的蒸气中含有异戊醇,会收集少量的未反 应的异戊醇,导致获得的乙酸异戊酯质量偏大. 【解答】解:(1)由装置中仪器 B 的构造可知,仪器 B 的名称为球形冷凝管, 故答案为:球形冷凝管; (2)反应后的溶液要经过多次洗涤,在洗涤操作中,第一次洗涤的主要目的是 除去大部分催化剂硫酸和醋酸;第一步中饱和碳酸氢钠溶液既可以除去未洗 净的醋酸,也可以降低酯的溶解度,但第一步洗涤后生成的酯中混有碳酸氢 钠,所以第二次水洗,主要目的是除去产品中残留的碳酸氢钠, 第 19 页(共 35 页) 故答案为:洗掉大部分硫酸和醋酸;洗掉碳酸氢钠; (3)由于酯的密度比水小,二者互不相溶,因此水在下层,酯在上层;分液时, 要先将水层从分液漏斗的下口放出,待到两层液体界面时关闭分液漏斗的活 塞,再将乙酸异戊酯从上口放出,所以正确的为 d, 故答案为:d; (4)酯化反应是可逆反应,增大反应物的浓度可以使平衡正向移动;增加一种 反应物的浓度,可以使另一种反应物的转化率提高,因此本实验中加入过量 乙酸的目的是提高转化率, 故答案为:提高醇的转化率; (5)实验中加入少量无水硫酸镁的目的是吸收酯中少量的水分,对其进行干燥, 故答案为:干燥乙酸异戊酯; (6)在蒸馏操作中,温度计的水银球要放在蒸馏烧瓶的支管口处,所以 ad 错误 ;c 中使用的是球形冷凝管容易使产品滞留,不能全部收集到锥形瓶中,因此 仪器及装置安装正确的是 b, 故答案为:b; ( 7 ) 乙 酸 的 物 质 的 量 为 : n= =0.1mol , 异 戊 醇 的 物 质 的 量 为 : n= =0.05mol,由于乙酸和异戊醇是按照 1:1 进行反应,所以乙酸过 量,生成乙酸异戊酯的量要按照异戊醇的物质的量计算,即理论上生成 0.05mol 乙 酸 异 戊 酯 ; 实 际 上 生 成 的 乙 酸 异 戊 酯 的 物 质 的 量 为 : =0.03mol,所以实验中乙酸异戊酯的产率为: ×100%=60% ,故答案为:c; (8)在进行蒸馏操作时,若从 130℃便开始收集馏分此时的蒸气中含有异戊醇, 会收集少量的未反应的异戊醇,因此会导致产率偏高, 故答案为:高;会收集少量未反应的异戊醇. 【点评】本题为一道高考题,考查了常见仪器的构造与安装、混合物的分离、提 纯、物质的制取、药品的选择及使用、物质产率的计算等知识,题目难度较 大,试题涉及的题量较大,知识点较多,充分培养了学生的分析、理解能力 第 20 页(共 35 页) 及灵活应用所学知识的能力. 9.(15 分)次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答 下列问题: (1)H3PO2 是一元中强酸,写出其电离方程式 H3PO2⇌H2PO2 +H+ ; ﹣(2)H3PO2 及 NaH2PO2 均可将溶液中的 Ag+还原为银,从而可用于化学镀银。 ①H3PO2 中,P 元素的化合价为 +1 ; ②利用 H3PO2 进行化学镀银反应中,氧化剂与还原剂的物质的量之比为 4:1, 则氧化产物为 H3PO4 (填化学式); ③NaH2PO2 为 正盐 (填“正盐”或“酸式盐”),其溶液显 弱碱性 (填“弱 酸性”、“中性”或“弱碱性”); (3)H3PO2 的工业制法是:将白磷(P4)与 Ba(OH)2 溶液反应生成 PH3 气体 和 Ba(H2PO2),后者再与 H2SO4 反应,写出白磷与 Ba(OH) 溶液反应的 22化学方程式 2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑ ; (4)H3PO2 也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和 阴膜分别只允许阳离子、阴离子通过): ①写出阳极的电极反应式 2H2O﹣4e﹣=O2↑+4H+ ; ②分析产品室可得到 H3PO2 的原因 阳极室的 H+穿过阳膜扩散至产品室,原料 ﹣室的 H2PO2 穿过阴膜扩散至产品室,二者反应生成 H3PO2 ; ③早期采用“三室电渗析法”制备 H3PO2,将“四室电渗析法”中阳极室的稀硫酸用 H3PO2 稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室 与产品室,其缺点是产品中混有 PO43﹣(或 HPO42﹣、H2PO4 、H3PO4) ﹣﹣杂质,该杂质产生的原因是 H2PO2 或 H3PO2 被氧化 。 第 21 页(共 35 页) 【考点】1B:真题集萃;B1:氧化还原反应;D3:电解质在水溶液中的电离;DI :电解原理;EI:磷.菁优网版权所有 【专题】51I:电化学专题;52:元素及其化合物. 【分析】(1)根据 H3PO2 是一元中强酸可知,H3PO2 是弱电解质,溶液中部分 电离出氢离子,据此写出电离方程式; (2)①根据化合物中总化合价为 0 计算出 P 元素的化合价; ②先判断氧化剂、氧化剂,然后根据氧化剂与还原剂的物质的量之比为 4:1 计 算出反应产物中 P 的化合价; ③根据 H3PO2 是一元中强酸,可以判断 NaH2PO2 为正盐,由于为 H3PO2 为弱电 解质,则 NaH2PO2 为强碱弱酸盐,则溶液显示弱碱性; (3)根据题干信息“将白磷(P4)与 Ba(OH)2 溶液反应生成 PH3 气体和 Ba( H2PO2)2”写出该反应的化学方程式为; ﹣(4)①根据阳极中阴离子为硫酸根离子、氢氧根离子和 H2PO2 ,判断放电能力 强弱,然后写出阳极的电极反应式; ②根据图示“四室电渗析法”工作原理分析产品室可得到 H3PO2 的原因; ③根据 H3PO2 及 NaH2PO2 均容易被氧化分析该装置缺点。 【解答】解:(1)H3PO2 是一元中强酸,溶液中部分电离出氢离子,所以其电 离方程式为:H3PO2⇌H2PO2 +H+, ﹣故答案为:H3PO2⇌H2PO2 +H+; ﹣(2)①H3PO2 中,总化合价为 0,其中氢元素为+1 价,氧元素为﹣2 价,则 P 元素的化合价为:+1 价, 第 22 页(共 35 页) 故答案为:+1; ②该反应中 Ag+为氧化剂,H3PO2 为还原剂,氧化剂与还原剂的物质的量之比为 4:1,设反应产物中 P 的化合价为 x,根据化合价升降相等可得,4×(1﹣0) =1×(x﹣1),解得 x=5,所以氧化产物为+5 价的 H3PO4, 故答案为:H3PO4; ③由于 H3PO2 是一元中强酸,所以 NaH2PO2 为正盐,由于为 H3PO2 为弱电解质, 则 NaH2PO2 为强碱弱酸盐,溶液显示弱碱性, 故答案为:正盐;弱碱性; (3)H3PO2 的工业制法是:将白磷(P4)与 Ba(OH)2 溶液反应生成 PH3 气体 和 Ba(H2PO2)2,该反应的化学方程式为:2P4+3Ba(OH)2+6H2O=3Ba( H2PO2)2+2PH3↑, 故答案为:2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑; ﹣(4)①由于阳极中阴离子为硫酸根离子、氢氧根离子和 H2PO2 ,其中放电能力 最强的是氢氧根离子,则阳极发生的电极反应为:2H2O﹣4e﹣=O2↑+4H+, 故答案为:2H2O﹣4e﹣=O2↑+4H+; ②产品室可得到 H3PO2 的原因是因为:阳极室的 H+穿过阳膜扩散至产品室,原 ﹣料室的 H2PO2 穿过阴膜扩散至产品室,二者反应生成 H3PO2, 故答案为:阳极室的 H+穿过阳膜扩散至产品室,原料室的 H2PO2 穿过阴膜扩散 ﹣至产品室,二者反应生成 H3PO2; ③早期采用“三室电渗析法”制备 H3PO2,将“四室电渗析法”中阳极室的稀硫酸用 H3PO2 稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室 与产品室,其缺点是阳极产生的氧气会把 H2PO2 或 H3PO2 氧化成 PO43﹣,产 ﹣品中混有 PO43﹣(或 HPO42﹣、H2PO4 、H3PO4), ﹣﹣﹣故答案为:PO43﹣(或 HPO42﹣、H2PO4 、H3PO4);H2PO2 或 H3PO2 被氧化。 【点评】本题考查了盐的水解原理、电解原理、弱电解质的电离、氧化还原反应 等知识,题目难度较大,试题涉及的知识点较多,充分考查了学生对所学知 第 23 页(共 35 页) 识的掌握情况。 10.(15 分)乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水 合法生产,回答下列问题: (1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H), 再水解生成乙醇,写出相应反应的化学方程式 C2H4+H2SO4→C2H5OSO3H、 C2H5OSO3H+H2O→C2H5OH+H2SO4 ; (2)已知: 甲醇脱水反应 2CH3OH(g)═CH3OCH3(g)+H2O(g)△H1=﹣23.9kJ•mol﹣1 甲醇制烯烃反应 2CH3OH(g)═C2H4(g)+2H2O(g)△H2=﹣29.1kJ•mol﹣1 乙醇异构化反应 C2H5OH(g)═CH3OCH3(g)△H3=+50.7kJ•mol﹣1 则乙烯气相直接水合反应 C2H4(g)+H2O(g)═C2H5OH(g)的△H= ﹣45.5 kJ•mol﹣1,与间接水合法相比,气相直接水合法的优点是 无副产品,原子利 用率 100% ; (3)如图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中 :=1:1) ①列式计算乙烯水合制乙醇反应在图中 A 点的平衡常数 Kp= 0.07(MPa)﹣1 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数); ②图中压强(P1,P2,P3,P4)大小顺序为 p1<p2<p3<p4 ,理由是 反应分 子数减少,相同温度下,压强升高乙烯转化率提高 ; ③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度 290℃ 第 24 页(共 35 页) ,压强 6.9MPa, :=0.6:1,乙烯的转化率为 5%,若要进一步提 高乙烯转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有 将产物乙醇液化移去 、 增加 比 。 :【考点】1B:真题集萃;BE:热化学方程式;C8:化学平衡常数的含义;CB: 化学平衡的影响因素;CM:转化率随温度、压强的变化曲线.菁优网版权所有 【专题】517:化学反应中的能量变化;51E:化学平衡专题. 【分析】(1)乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),效仿乙酸乙 酯水解,将水分成氢原子和羟基生成乙醇和硫酸; (2)利用盖斯定律构造目标热化学方程式并求焓变,气相直接水合法原子利用 率 100%; (3)①列出 Kp 表达式,利用三段法计算平衡分压带入表达式计算即可; ②在相同温度下由于乙烯转化率为 p1<p2<p3<p4,由 C2H4(g)+H2O(g) →C2H5OH(g)可知正反应为气体体积减小的反应,根据压强对平衡移动的 影响分析; ③若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以改 变物质的浓度。 【解答】解:(1)乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),化学方 程式为 C2H4+H2SO4→C2H5OSO3H,硫酸氢乙酯水解生成乙醇和硫酸,化学方 程式为 C2H5OSO3H+H2O→C2H5OH+H2SO4, 故答案为:C2H4+H2SO4→C2H5OSO3H、C2H5OSO3H+H2O→C2H5OH+H2SO4; (2)已知:甲醇脱水反应 ①2CH3OH(g)═CH3OCH3(g)+H2O(g)△ H1=﹣23.9kJ•mol﹣1 甲醇制烯烃反应 ②2CH3OH(g)═C2H4(g)+2H2O(g)△H2=﹣29.1kJ•mol﹣1 乙醇异构化反应 ③C2H5OH(g)═CH3OCH3(g)△H3=+50.7kJ•mol﹣1, 根据盖斯定律①﹣②﹣③可得:C2H4(g)+H2O(g)═C2H5OH(g)△H=( ﹣23.9+29.1﹣50.7)kJ/mol=﹣45.5kJ/mol; 第 25 页(共 35 页) 乙烯直接水化法中反应物中所有原子全部都变成生成物,所以原子利用率 100%, 没有副产品, 故答案为:﹣45.5;无副产品,原子利用率 100%; (3)①C2H4(g)+H2O(g)═C2H5OH(g) 开始:1 转化:0.2 平衡:0.8 乙醇占 100.2 0.8 0.2 0.2 = ,乙烯和水各占 = ,则乙醇的分压为 7.85MPa× =0.87MPa,乙烯和水的分压为 7.85MPa× =3.49MPa, =0.07(MPa)﹣1, 所以 Kp= =故答案为:0.07(MPa)﹣1; ②在相同温度下由于乙烯转化率为 p1<p2<p3<p4,由 C2H4(g)+H2O(g)═ C2H5OH(g)可知正反应为气体体积减小的反应,所以增大压强,平衡正向 移动,乙烯的转化率提高,因此压强关系是 p1<p2<p3<p4, 故答案为:p1<p2<p3<p4;反应分子数减少,相同温度下,压强升高乙烯转化 率提高; ③若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以改 变物质的浓度,如从平衡体系中将产物乙醇分离出来,或增大水蒸气的浓度, 改变二者物质的量的比等, 故答案为:将产物乙醇液化移去;增加 :比。 【点评】本题考查了化学方程式的书写、压强对平衡移动的影响、物质制取方案 的比较、反应热及平衡常数的计算等知识,综合性非常强,该题是高考中的 常见题型,属于中等难度较大,侧重于学生分析问题、解决问题、知识迁移 能力的培养。 【化学-选修 2:化学与技术】 11.(15 分)磷矿石主要以磷酸钙[Ca3(PO4)2•H2O]和磷灰石[Ca5F(PO4)3, 第 26 页(共 35 页) Ca5(OH)(PO4) ]等形式存在,图(a)为目前国际上磷矿石利用的大致情 3况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸,图(b)是热法磷酸 生产过程中由磷灰石制单质磷的流程: 部分物质的相关性质如下: 熔点/℃ 44 沸点/℃ 280.5 备注 白磷 PH3 ﹣133.8 ﹣90 ﹣87.8 ﹣86 难溶于水、有还原性 易水解 SiF4 回答下列问题: (1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的 69 % ;(2)以磷矿石为原料,湿法磷酸过程中 Ca5F(PO4) 反应化学方程式为: Ca5F 3(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑ .现有 1t 折合含有 P2O5 约 30%的 磷灰石,最多可制得到 85%的商品磷酸 0.49 t. (3)如图(b)所示,热法磷酸生产过程的第一步是将 SiO2、过量焦炭与磷灰 石混合,高温反应生成白磷.炉渣的主要成分是 CaSiO3 (填化学式). 冷凝塔 1 的主要沉积物是 液态白磷 ,冷凝塔 2 的主要沉积物是 固态白 磷 . 第 27 页(共 35 页) (4)尾气中主要含有 SiF4、CO ,还含有少量的 PH3、H2S 和 HF 等.将尾 气先通入纯碱溶液,可除去 SiF4、H2S、HF ;再通入次氯酸钠溶液,可除 去 PH3 .(均填化学式) (5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是 产品纯度高 . 【考点】U3:制备实验方案的设计.菁优网版权所有 【专题】18:实验分析题;25:实验评价题;43:演绎推理法;548:制备实验 综合. 【分析】(1)由图(a)可知生产含磷肥料,约占磷矿石使用量的比例为:4%+96% ×85%×80%=69%; (2)以磷矿石为原料,用过量的硫酸溶解 Ca5F(PO4) 可制得磷酸,根据质量 3守恒书写化学方程式;根据 P 元素守恒可得关系式 P2O5~2H3PO4,依据此关 系式计算; (3)将 SiO2、过量焦炭与磷灰石混合,高温除了反应生成白磷之外,得到的难 溶性固体是 CaSiO3;根据冷却塔 1、2 的温度与白磷的熔点比较分析白磷的状 态; (4)二氧化硅和 HF 反应生成四氟化硅气体,过量的焦炭不完全燃烧生成 CO, 因此在尾气中主要含有 SiF4、CO,还含有少量的 PH3、H2S 和 HF 等;将尾 气通入纯碱溶液,SiF4、HF、H2S 与碳酸钠反应而除去,次氯酸具有强氧化 性,可除掉强还原性的 PH3; (5)相比于湿法磷酸,热法磷酸工艺所得产品纯度大; 【解答】解:(1)由图(a)可知生产含磷肥料,约占磷矿石使用量的比例为: 4%+96%×85%×80%=69%, 故答案为:69; (2)以磷矿石为原料,用过量的硫酸溶解 Ca5F(PO4) 可制得磷酸,根据质量 3守 恒 定 律 可 得 反 应 的 化 学 方 程 式 为Ca5F ( PO4 ) 3+5H2SO4=3H3PO4+5CaSO4+HF↑; 根据 P 元素守恒可得关系式 P2O5~2H3PO4,142 份 P2O5 可制取 196 份磷酸,1t 折合含有 P2O5 约 30%的磷灰石,含有 P2O5 的质量为 0.3t,所以可制得到 85% 第 28 页(共 35 页) 的商品磷酸的质量为 =0.49t, 故答案为:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑;0.49; (3)将 SiO2、过量焦炭与磷灰石混合,高温除了反应生成白磷之外,得到的难 溶性固体是 CaSiO3;冷却塔 1 的温度是 70℃,280.5℃>t>44℃,所以此时主 要的沉积物是液态白磷;冷却塔 2 的温度是 18℃,低于白磷的熔点,故此时 的主要沉积物是固体白磷, 故答案为:CaSiO3;液态白磷;固态白磷; (4)二氧化硅和 HF 反应生成四氟化硅气体,过量的焦炭不完全燃烧生成 CO, 因此在尾气中主要含有 SiF4、CO,还含有少量的 PH3、H2S 和 HF 等;将尾 气通入纯碱溶液,SiF4、HF、H2S 与碳酸钠反应而除去,次氯酸具有强氧化 性,可除掉强还原性的 PH3, 故答案为:SiF4、CO;SiF4、H2S、HF;PH3; (5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但是所得产品纯度大,杂 质少,因此逐渐被采用, 故答案为:产品纯度高. 【点评】本题考查了化工生产流程图,涉及磷矿石的主要用途、反应原理和有关 计算,该题是高考中的常见题型,题目难度中等,侧重对学生分析问题、解 答问题能力的培养. 【化学-选修 3:物质结构与性质】 12.早期发现的一种天然二十面体准晶颗粒由 Al、Cu、Fe 三种金属元素组成, 回答下列问题: (1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 X 射线衍射 方法区分晶体、准晶体和非晶体. ( 2 ) 基 态Fe 原 子 有4 个 未 成 对 电 子 , Fe3+ 的 电 子 排 布 式 为1s22s22p63s23p63d5 ,可用硫氰化钾检验 Fe3+,形成的配合物的颜色为 血红 色 . (3)新制备的 Cu(OH) 可将乙醛(CH3CHO)氧化成乙酸,而自身还原成 Cu2O 2,乙醛中碳原子的杂化轨道类型为 sp3、sp2 ;1mol 乙醛分子中含有的 σ 键 第 29 页(共 35 页) 的数目为 6NA ,乙酸的沸点明显高于乙醛,其主要原因是 乙酸存在分子 间氢键 .Cu2O 为半导体材料,在其立方晶胞内部有 4 个氧原子,其余氧原 子位于面心和顶点,则该晶胞中有 16 个铜原子. (4)Al 单质为面心立方晶体,其晶胞参数 a=0.405nm,晶胞中铝原子的配位数 为12 , 列 式 表 示Al 单 质 的 密 度 g•cm﹣3(不必计算出结果). 【考点】1B:真题集萃;86:原子核外电子排布;96:共价键的形成及共价键 的主要类型;99:配合物的成键情况;9I:晶胞的计算;A6:不同晶体的结 构微粒及微粒间作用力的区别.菁优网版权所有 【专题】51C:元素周期律与元素周期表专题;51D:化学键与晶体结构. 【分析】(1)晶体对 X 射线发生衍射,非晶体不发生衍射,准晶体介于二者之 间; (2)根据 Fe 原子的核外电子排布式确定未成对电子数,失去电子变为铁离子时 ,先失去 4s 上的电子后失去 3d 上的电子,硫氰化铁为血红色; (3)乙醛中甲基上的 C 采取 sp3 杂化类型,醛基中的 C 采取 sp2 杂化类型;1 个 乙醛分子含有 6 个 σ 键和一个 π 键;乙酸分子间可形成氢键导致沸点较高; 根据 O 数目和 Cu2O 中 Cu 和 O 的比例计算晶胞中 Cu 原子的数目; (4)在 Al 晶体的一个晶胞中与它距离相等且最近的 Al 原子在通过这个顶点的 三个面心上,面心占 ,通过一个顶点可形成8 个晶胞. 【解答】解:(1)从外观无法区分三者,但用 X 光照射挥发现:晶体对 X 射线 发生衍射,非晶体不发生衍射,准晶体介于二者之间,因此通过有无衍射现 象即可确定, 故答案为:X 射线衍射; (2)26 号元素 Fe 基态原子核外电子排布式为 1s22s22p63s23p63d64s2,可知在 3d 上存在 4 个未成对电子,失去电子变为铁离子时,先失去 4s 上的 2 个电子后 失去 3d 上的 1 个电子,因此 Fe3+的电子排布式为 1s22s22p63s23p63d5,硫氰化 铁为血红色, 第 30 页(共 35 页) 故答案为:4;1s22s22p63s23p63d5;血红色; (3)乙醛中甲基上的 C 形成 4 条 σ 键,无孤电子对,因此采取 sp3 杂化类型, 醛基中的 C 形成 3 条 σ 键和 1 条 π 键,无孤电子对,采取 sp2 杂化类型;1 个 乙醛分子含有 6 个 σ 键和一个 π 键,则 1mol 乙醛含有 6molσ 键,即 6NA 个 σ 键;乙酸分子间可形成氢键,乙醛不能形成氢键,所以乙酸的沸点高于乙醛; 该晶胞中 O 原子数为 4×1+6× +8× =8,由 Cu2O 中 Cu 和 O 的比例可知该 晶胞中铜原子数为 O 原子数的 2 倍,即为 16 个; 故答案为:sp3、sp2;6NA;乙酸存在分子间氢键;16; (4)在 Al 晶体的一个晶胞中与它距离相等且最近的 Al 原子在通过这个顶点的 三个面心上,面心占 ,通过一个顶点可形成8 个晶胞,因此该晶胞中铝原 子的配位数为 8×3× =12;一个晶胞中 Al 原子数为 8× =4,因此 Al 度的密ρ= = =g•cm﹣3, 故答案为: .【点评】本题考查了晶体的性质、原子核外电子排布规律、共价键类型、氢键、 杂化类型、晶胞配位数及密度的计算,综合性非常强,为历年高考选作常考 题型,难度中等,其中晶胞配位数以及密度的计算是本题的难点. 【化学-选修 5:有机化学基础】 13.席夫碱类化合物 G 在催化、药物、新材料等方面有广泛应用。合成 G 的一 种路线如下: 已知以下信息: 第 31 页(共 35 页) ①②1molB 经上述反应可生成 2molC,且 C 不能发生银镜反应。 ③D 属于单取代芳香烃,其相对分子质量为 106。 ④核磁共振氢谱显示 F 苯环上有两种化学环境的氢。 ⑤回答下列问题: (1)由 A 生成 B 的化学方程式为 (CH3)2CH﹣CCl(CH3)2+NaOH CH3)2C=C(CH3)2+NaCl+H2O ,反应类型为 消去反应 ; (( 2 ) E 的 化 学 名 称 是对 硝 基 乙 苯, 由D 生 成E 的 化 学 方 程 式 为+HO﹣NO2 +H2O ; (3)G 的结构简式为 ; (4)F 的同分异构体中含有苯环的还有 19 种(不考虑立体异构),其中核 磁 共 振 氢 谱 中 有4 组 峰 , 且 面 积 比 为6 : 2 : 2 : 1 的 是 ,(写出其中的一种的结 构简式)。 (5)由苯和化合物 C 经如下步骤可合成 N﹣异丙基苯胺。 反应条件 1 所选择的试剂为 浓硝酸、浓硫酸 ;反应条件 2 所选择的试剂为 Fe 粉/盐酸 ;I 的结构简式为 。 【考点】HB:有机物的推断.菁优网版权所有 【专题】534:有机物的化学性质及推断. 第 32 页(共 35 页) 【分析】A 的分子式为 C6H13Cl,为己烷的一氯代物,在氢氧化钠醇溶液、加热 条件下发生消去反应得到 B 为烯烃,1mol B 发生信息①中氧化反应生成 2mol C,且 C 不能发生银镜反应,B 为对称结构烯烃,且不饱和 C 原子没有 H 原 子,故 B 为(CH3)C=C(CH3),C 为(CH3)C=O,逆推可知 A 为(CH3 222)2CH﹣CCl(CH3)2.D 属于单取代芳烃,其相对分子质量为 106,D 含有 一个苯环,侧链式量=106﹣77=29,故侧链为﹣CH2CH3,D 为 ,核磁共振氢谱显示 F 苯环上有两种化学环境的氢,故 D 发生乙基对位取代反 应生成 E 为 ,则 F 为 ,由 F 的分子式可知,E 中硝基被还原为﹣NH2 ,C 与 F 发生信息⑤中反应,分子间脱去 1 分子 水形成 N=C 双键得到 G,则 G 为 ,据此解答。 【解答】解:A 的分子式为 C6H13Cl,为己烷的一氯代物,在氢氧化钠醇溶液、 加热条件下发生消去反应得到 B 为烯烃,1mol B 发生信息①中氧化反应生成 2mol C,且 C 不能发生银镜反应,B 为对称结构烯烃,且不饱和 C 原子没有 H 原子,故 B 为(CH3)2C=C(CH3)2,C 为(CH3)2C=O,逆推可知 A 为( CH3)CH﹣CCl(CH3).D 属于单取代芳烃,其相对分子质量为 106,D 含 22有一个苯环,侧链式量=106﹣77=29,故侧链为﹣CH2CH3,D 为 ,核磁共振氢谱显示 F 苯环上有两种化学环境的氢,故 D 发生乙基对位取代 反应生成 E 为 ﹣NH2,则 F 为 ,由 F 的分子式可知,E 中硝基被还原为 ,C 与 F 发生信息⑤中反应,分子间脱去 1 分子水形成 N=C 双键得到 G,则 G 为 。(1)由 A 生成 B 的化学方程式为:(CH3)2CH﹣CCl(CH3)2+NaOH CH3)2C=C(CH3)2+NaCl+H2O,属于消去反应, (故答案为:(CH3 )2CH﹣CCl(CH3 )2+NaOH 2+NaCl+H2O;消去反应; (CH3 )2C=C(CH3 ) 第 33 页(共 35 页) (2)由上述分析可知,E 为 ,化学名称是对硝基乙苯,由 D 生成E的化学方程式为:+HO﹣NO2 +H2O, 故答案为:对硝基乙苯;+HO﹣NO2 +H2O; (3)由上述分析可知,G 的结构简式为 ,故答案为: ;(4)F 为 ,含有苯环同分异构体中, 若取代基为氨基、乙基,还有邻位、间位 2 种, 若只有一个取代基,可以为﹣CH(NH2)CH3、﹣CH2CH2NH2、﹣NH﹣CH2CH3 、﹣CH2NHCH3、﹣N(CH3)2,有 5 种; 若取代为 2 个,还有﹣CH3、﹣CH2NH2 或﹣CH3、﹣NHCH3,各有邻、间、对 三种,共有 6 种; 若取代基有 3 个,即﹣CH3、﹣CH3、﹣NH2,2 个甲基相邻,氨基有 2 种位置, 2 个甲基处于间位,氨基有 3 种位置,2 个甲基处于对位,氨基有 1 种位置, 共有 2+3+1=6 种, 故符合条件的同分异构体有:2+5+6+6=19, 其中核磁共振氢谱为 4 组峰,且面积比为 6:2:2:1,说明含有 2 个﹣CH3,可 以是 ,故答案为:19; ;第 34 页(共 35 页) (5)由苯与浓硝酸、浓硫酸在加热条件下得到 H 为硝基苯,硝基苯在 Fe 粉/盐 酸条件下还有得到 I 为 ,再与(CH3)2C=O 反应得到 ,最后加成反应还原得到 ,故反应条件 1 所选用的试剂为:浓硝酸、浓硫酸,反应条件 2 所选用的试剂为: Fe 粉/稀盐酸,I 的结构简式为 ,故答案为:浓硝酸、浓硫酸;Fe 粉/盐酸; 。【点评】本题考查有机物推断与合成,需要学生对给予的信息进行运用,能较好 的考查学生自学能力,要充分利用合成路线中有机物的分子式,关键是确定 A 与 D 的结构,再利用正、逆推法相结合进行推断,(4)中同分异构体问题为 易错点,难度中等。 第 35 页(共 35 页)
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





