

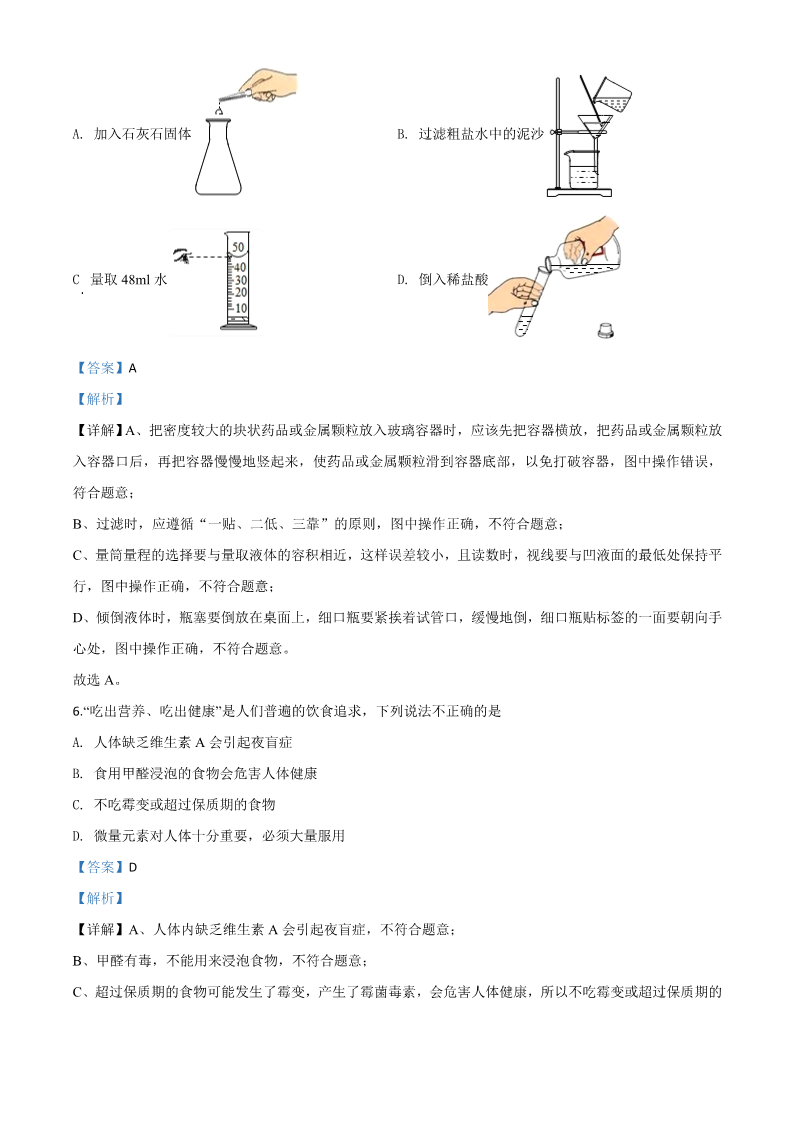


2020 年贵港市初中学业水平考试试卷 化学 (本试卷分第Ⅰ卷和第Ⅱ卷,考试时间 60 分钟,赋分 100 分) 注意:答案一律填写在答题卡上,在试卷上作答无效。考试结束将本试卷和答题卡一并交回。 可能用到的相对原子质量:H-1 C1-35.5 K-39Ca-40 Zn-65 C-12 N-14 Ag-108 O-16 Na-23 Mg-24 亲爱的同学,你已经步入了化学世界的殿堂,积累了许多化学知识,相信你会通过本份试卷 向人们展示你的聪明才智。祝你考试顺利! 第 I 卷(选择题,共 42 分) 一、我会选择(每小题 3 分,共 42 分)每小题只有一个选项符合题意,请用 2B 铅笔将答题 卡上对应题目的答案标号涂黑,如需改动,必須先用橡皮擦干净后,再改涂其他答案标号。 1. 下列物质的用途利用其物理性质的是 A. 小苏打用于治疗胃酸过多症 活性炭用于净化饮用水 氢气用作清洁燃料 B. C. D. 稀有气体用作保护气 B【答案】 【解析】 【详解】A、小苏打用于治疗胃酸过多是利用小苏打的碱性,与胃酸中的盐酸反应,是利用了其化学性质, 不符合题意; B、活性炭用作吸附剂,是利用了活性炭的吸附性,不需要发生化学变化就能表现出来,是利用了其物理性 质,符合题意; C、氢气用作燃料,是利用了氢气的可燃性,需要通过化学变化才表现出来,是利用了其化学性质,不符合 题意; D、稀有气体用作保护气,是利用了稀有气体的化学性质稳定,需要通过化学变化才表现出来,是利用了其 化学性质,不符合题意; 故选:B 。2. 将厨房中的下列物质放入适量水中,充分搅拌,不能形成溶液的是 A. 植物油 B. 食盐 C. 食醋 D. 白糖 A【答案】 【解析】 【详解】A、植物油不溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液。 B、食盐易溶于水,加入水中形成均一、稳定的混合物,属于溶液。 C、食醋易溶于水,加入水中形成均一、稳定的混合物,属于溶液。 D、白糖易溶于水,加入水中形成均一、稳定的混合物,属于溶液。 故选:A。 3. 下列实验现象描述正确的是 A. 细铁丝在氧气中剧烈燃烧,火星四射,生成四氧化三铁 B. 往锌粒中加入稀硫酸,产生气泡 C. 电解水实验中,负极上产生的气体使带火星的木条复燃 D. 往氯化铜溶液中滴加氢氧化钠溶液,产生红褐色沉淀 B【答案】 【解析】 【详解】A、细铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体,生成四氧化三铁是实验结论,说法错误; B、锌是活泼金属,与稀硫酸反应生成硫酸锌和氢气,故往锌粒中加入稀硫酸,产生气泡,说法正确; C、电解水实验中,根据“正氧负氢”,负极上产生的气体是氢气,不能使带火星的木条复燃,说法错误; D、氯化铜与氢氧化钠反应生成氢氧化铜蓝色沉淀和氯化钠,往氯化铜溶液中滴加氢氧化钠溶液,产生蓝色 沉淀,说法错误。 故选:B。 加热 Cu+2H SO ( 浓) CuSO +SO +2H O 4. 在化学反应 中没有涉及到的物质类别是 24422A. 单质 【答案】 【解析】 B. 氧化物 C. 酸 D. 碱 D【详解】铜是由同种元素组成的纯净物,属于单质;浓硫酸是电离时产生的阳离子全部都是氢离子的化合 物,属于酸;硫酸铜是由铜离子和硫酸根离子构成的化合物,属于盐;二氧化硫、水都是由两种元素组成, 且其中一种元素是氧元素的化合物,属于氧化物。故没有涉及碱。 故选 D。 5. 我市今年初中学业水平实验操作考试中,下列操作错误的是 A. 加入石灰石固体 B. 过滤粗盐水中的泥沙 C 量取 48ml 水 D. 倒入稀盐酸 A【答案】 【解析】 【详解】A、把密度较大的块状药品或金属颗粒放入玻璃容器时,应该先把容器横放,把药品或金属颗粒放 入容器口后,再把容器慢慢地竖起来,使药品或金属颗粒滑到容器底部,以免打破容器,图中操作错误, 符合题意; B、过滤时,应遵循“一贴、二低、三靠”的原则,图中操作正确,不符合题意; C、量筒量程的选择要与量取液体的容积相近,这样误差较小,且读数时,视线要与凹液面的最低处保持平 行,图中操作正确,不符合题意; D、倾倒液体时,瓶塞要倒放在桌面上,细口瓶要紧挨着试管口,缓慢地倒,细口瓶贴标签的一面要朝向手 心处,图中操作正确,不符合题意。 故选 A。 6. “吃出营养、吃出健康”是人们普遍的饮食追求,下列说法不正确的是 A. 人体缺乏维生素 A 会引起夜盲症 B. 食用甲醛浸泡的食物会危害人体健康 C. 不吃霉变或超过保质期的食物 D. 微量元素对人体十分重要,必须大量服用 D【答案】 【解析】 【详解】A、人体内缺乏维生素 A 会引起夜盲症,不符合题意; B、甲醛有毒,不能用来浸泡食物,不符合题意; C、超过保质期的食物可能发生了霉变,产生了霉菌毒素,会危害人体健康,所以不吃霉变或超过保质期的 食物,不符合题意; D、微量元素对人体作用十分重要,但要合理摄入,否则会引起中毒,符合题意。故选 D 7. 6 月 26 日是“国际禁毒日”,下列物质不属于毒品的是 A. 大麻 B. 冰毒 C. 咖啡 D. 摇头丸 C【答案】 【解析】 【详解】大麻、冰毒、摇头丸都属于毒品,咖啡是一种饮品。 故选 C。 8. 下列说法正确的是 A. 利用洗洁精的乳化作用,可洗去餐具上的油污 B. 降低温度一定能使不饱和溶液变为饱和溶液 C. 水能灭火是因为水能降低可燃物的着火点 D. 氧气的化学性质比较活泼,可以跟任何物质发生反应 A【答案】 【解析】 【详解】A、洗洁精具有乳化作用,能够乳化油污,所以可以使用洗洁精洗去餐具上的油污,选项正确; B、降低温度不一定能使不饱和溶液变为饱和溶液,如氢氧化钙的溶解度随温度升高反而减小,将氢氧化钙 的不饱和溶液变为饱和溶液可以通过升温的方法来实现,选项错误; C、水能灭火是因为水能够吸收热量使可燃物的温度降低至可燃物的着火点以下来实现灭火,选项错误; D、虽然氧气的化学性质比较活泼,但并不能可以跟任何物质发生反应,选项错误,故选 A。 9. 下列做法与我市创建全国文明城市要求不相符的是 A. 倡导低碳出行 B. 工业废水经处理达标后排放 C. 生活垃圾随意丢弃 D. 大力推广使用新能源公交车 C【答案】 【解析】 【详解】A、倡导低碳出行,减少化石燃料的使用,保护环境,符合要求; B、工业废水经处理达标后排放,可以防止水污染,符合要求; C、生活垃圾随意丢弃,会造成环境污染和资源浪费,不符合要求; D、大力推广使用新能源公交车,减少化石燃料的使用,保护环境,符合要求; 故选:C。 10. 如图是某个化学反应的微观模拟示意图,从图中获得的信息不正确的是 A. 反应前后各种原子的种类、数目不变 B. 该反应不属于置换反应 C. 反应中参加反应的分子个数比为 1:1 D. 反应前后共涉及 3 种分子 C【答案】 【解析】 【详解】A、由图可知,化学反应前后,原子的种类、数目不变,从图中获得的信息正确,不符合题意; B、由图可知,一个“ ”分子未参与反应,该反应符合“多变一”的特点,属于化合反应,从图中 获得的信息正确,不符合题意; C、由图可知,一个“ ”分子未参与反应,参加反应的分子个数比为:2:1,从图中获得的信息不正 确,符合题意; 的信D、由图可知,反应前后,共涉及“ ”、“ ”、“ ”三种分子,从图中获得 息正确,不符合题意。 故选 C。 11. 推理是学习化学的一种方法。以下推理正确的是 A. 质子数决定元素种类,则质子数相同的微粒一定属于同种元素 B. 根据质量守恒定律,1g 氢气与 9g 氧气反应一定生成 10g 水 C. 有机物一定含有碳元素,则含碳元素的化合物一定是有机物 D. 在室温下,酸性溶液的 pH<7,则 pH<7 的溶液一定是酸性溶液 D【答案】 【解析】 【详解】A、质子数相同的微粒不一定属于同种元素,如氖原子与水分子中的质子数都是 10,但两种微粒 就不属于同一种元素,选项错误; B、氢气与氧气燃烧时,参加反应的两种物质的质量比=4:32,则 1g 氢气与 9g 氧气反应时,参加反应的 氧气的质量为 8g,生成水的质量为 9g,选项错误; C、含碳元素的化合物不一定是有机物,如 CO、CO2 虽然含有碳元素,但其化学性质与无机物相似,属于 无机物,选项错误; D、由 pH 于溶液酸碱性的关系可知,酸性溶液的 pH<7,pH<7 的溶液一定是酸性溶液,选项正确,故选 D。 12. 下列物质的转化不能一步实现的是 Ca(OH)2 NaOH Mg(OH)2 A. Fe2O3 Fe Ag B. C. D. H2SO4 HCl HNO3 Na2CO3 NaCl MgCl2 D【答案】 【解析】 【详解】A、氢氧化钙溶液能够与碳酸钠溶液反应生成氢氧化钠,氢氧化钠溶液可以与氯化镁溶液反应生成 氢氧化镁沉淀,各步都能一步反应实现,选项正确; B、氧化铁可以与一氧化碳在高温条件下反应生成铁,铁可以与硝酸银溶液反应生成银,各步都能一步反应 实现,选项正确; C、硫酸可以与氯化钡溶液反应生成硫酸钡沉淀和盐酸,盐酸可以与硝酸银溶液反应生成氯化银沉淀和硝酸, 各步都能一步反应实现,选项正确; D、碳酸钠溶液能够与稀盐酸反应生成氯化钠,生成氯化镁需要氯化钠与某种碱或盐反应,而生成的氯化镁 与含钠的化合物均溶于水,没有沉淀生成,不符合复分解反应的条件,所以氯化钠不能一步反应生成氯化 镁,选项错误,故选 D。 13. 现有一包由 2.4g 镁、6.5g 锌、1.6g 碳混合而成的粉末,把它加入到一定量的硝酸银溶液中,反应结束后, 经过滤、洗涤、干燥,测得滤渣含有三种物质。则滤渣的质量可能是 A. 10.5g 【答案】 【解析】 B. 35.6g C. 44.8g D. 45.8g B【详解】现有一包由 2.4g 镁、6.5g 锌、1.6g 碳混合而成的粉末,把它加入到一定量的硝酸银溶液中,由于 金属活动性:Mg>Zn>Ag,故镁先与硝酸银反应生成硝酸镁和银,待镁完全反应后,锌再与硝酸银反应生 成硝酸锌和银,碳与硝酸银不反应,反应结束后,经过滤、洗涤、干燥,测得滤渣含有三种物质,故滤渣 肯定是银、锌、碳,镁已经完全反应,镁可能恰好与硝酸银完全反应,也可能锌已经置换了部分硝酸银, 但锌未完全反应。 Mg+2AgNO =Mg(NO ) +2Ag 镁与硝酸银反应: ,24 份镁置换出 216 份银,故 2.4g 镁完全反应,生成 33 2 Zn+2AgNO =Zn(NO ) +2Ag 21.6 g 银,锌与硝酸银反应: ,65 份锌置换出 216 份银,故 6.5g 锌完全反 33 2 应能置换成 21.6g 银,由于镁可能恰好与硝酸银完全反应,也可能锌已经置换了部分硝酸银。故滤渣的质量: 21.6g+6.5g+1.6g=29.7≤滤渣质量<21.6g+21.6g+1.6g=44.8g。 故选 B。 14. 下列各组物质鉴别方案的描述,错误的是 A. KNO3、Na2SO4、Ba(OH)2、MgCl2 四种溶液,需另加试剂方可鉴别 B. MgCl2、HCl、KOH、NaCl 四种溶液,利用组内物质即可鉴别 C. Na2CO3、NH4NO3、NaOH、NaCl 四种固体,利用水及组内物质都无法鉴别 D. NaCl、NaOH、CaO、CuSO4 四种固体,只用适量水即可鉴别 BC 【答案】 【解析】 【详解】A、硝酸钾不和其它三种物质反应,硫酸钠和氢氧化钡生成硫酸钡白色沉淀和氢氧化钠,氢氧化钡 和氯化镁反应生成氢氧化镁白色沉淀和氯化钡,均生成白色沉淀,不能鉴别氯化镁和硫酸钠,需要另加试 剂方可鉴别,故 A 正确; B、氯化镁和氢氧化钾反应生成氢氧化镁白色沉淀和氯化钾,盐酸和氢氧化钠反应生成氯化钠和水,但无明 显现象,氯化钠和四种物质均不反应,即使盐酸能使氢氧化镁溶解,利用组内物质不能鉴别氯化镁和氢氧 化钾,故 B 不正确; C、硝酸铵溶于水温度降低,氢氧化钠溶于水温度升高,碳酸钠和氯化钠溶于水温度几乎不变。硝酸铵和碳 酸钠反应生成硝酸钠、水、二氧化碳和氨气,硝酸铵和氯化钠不反应,利用水及组内物质能够鉴别,故 C 不正确; D、NaCl、NaOH、CaO、CuSO4 四种固体,加入适量水,氧化钙和水反应放出大量热,会使水沸腾,氢氧 化钠溶于水温度升高但不会沸腾,硫酸铜溶液显蓝色,氯化钠溶于水没有颜色且温度没有明显变化,则只 用适量水即可鉴别,故 D 正确。故选 BC。 第Ⅱ卷(非选择题,共 58 分) 二、我会填空(每空 1 分,共 16 分) 15. 请用数字和化学符号填空: (1)保持氮气化学性质的微粒_________; (2)3 个金原子_______; (3)海水中含量最多的阳离子_______; (4)酒精________。 Na+ N2 C H OHC H O 或2 5 (1). (2). (3). (4). 【答案】 【解析】 3Au 26N【详解】(1)分子是保持物质化学性质的最小粒子,保持氮气化学性质的微粒是氮分子,符号为 ;2(2)原子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数 字,所以 3 个金原子表示为 3Au; (3)在海水中,含量靠前的元素种类排序为:氧、氢、氯、钠、镁、硫、钙,但水电离出的氢离子和氢氧 +根离子较少,所以海水中含量最多的阳离子是钠离子,符号为 ;Na C H OHC H O 或 。 (4)酒精是乙醇的俗称,化学式为 262516. 芯片是电脑、手机等的核心部件,碳基芯片采用石墨烯碳纳米管工艺,性能比硅基芯片更好,我国已突 破半导体碳纳米管关键材料的技术瓶颈,请回答: (1)石墨烯碳纳米管具有良好的________性。 (2)如图是硅元素在元素周期表中的部分信息及原子结构示意图,图中 n=_____,硅的相对原子质量是 ______,硅元素位于元素周期表中的第____周期。 (3)化学反应中元素化合价升高的物质是还原剂,元素化合价降低的物质是氧化剂。在制硅反应 高温 SiO2 +2C Si+2CO 中还原剂是______,发生还原反应的物质是______。 SiO2 (6). (1). (2). (3). (4). (5). C【答案】 【解析】 导电 428.09 三【详解】(1)根据题意可知,石墨烯碳纳米管具有良好的导电性。 (2)如图是硅元素在元素周期表中的部分信息及原子结构示意图,原子中质子数=核外电子数,图中 n=14-8-2=4,硅的相对原子质量是 28.09,硅元素核外有三个电子层,位于元素周期表中的第三周期。 (3)化学反应中元素化合价升高的物质是还原剂,元素化合价降低的物质是氧化剂,在制硅反应 高温 SiO2 +2C Si+2CO SiO 中,碳的化合价由 0 价升高为+2 价,故还原剂是 C, 2 中硅元素化合价由+4 SiO 价降为 0 价,故发生还原反应的物质是 。217. 众志成城,抗击新冠,新冠肺炎疫情在我国已得到了有效控制。请用所学的化学知识回答下列问题: (1)用“84 消毒液”对校园环境进行消杀工作,消毒时会闻到刺激性气味,其原因是微粒在__; “84 消毒液” 的有效成分是次氯酸钠(NaClO),次氯酸钠由______种元素组成,其中氯元素的化合价为____价。 (2)火神山医院的建成向世界展示了“中国速度”。建设过程中用到挖掘机,挖掘机常用柴油作燃料,柴油 燃烧时将_____能转化为热能,挖掘机铲斗是用合金制成的,主要利用了合金的_____物理性质;用 HDPE 防渗膜为医院地下基础穿上“防护服”,HDPE 是一种高密度聚乙烯塑料,其属于___材料。 (1). (2). (3). (4). (5). (6). 合成 【答案】 【解析】 不断的运动 3+1 化学 硬度大 【详解】(1)可以个很远就能闻到气味是因为分子在不断的运动;从次氯酸钠的化学式 NaClO 可知,次氯 酸钠是由 Na、Cl、O3 种元素组成;次氯酸钠中,钠元素显+1 价,氧元素显-2 价,设次氯酸钠中氯元素的 化合价为 x,根据化合物中各元素的化合价代数和为零,则有:(+1)+x+(-2)=0,x=+1,次氯酸钠中氯元素的 化合价为+1 价; (2)燃烧是将柴油的化学能转化成为热能;合金对比纯金属有硬度大、熔点低的优点,铲斗主要用于铲土, 因此利用的是合金硬度大的物理性质;高密度聚乙烯塑料属于合成材料; 故答案为:不断的运动;3;+1;化学;硬度大;合成。 三、我会回答(18 题除化学方程式每空 2 分外,其余每空 1 分,19 题每空 2 分,共 12 分) 18. 碳酸钾广泛应用于玻璃、纺织印染和肥皂生产等领域,制取碳酸钾的工艺流程示意图如下: 温度/°C 010 20 30 40 60 80 100 K2CO3 的溶解度 107.0 109.0 111.0 114.0 117.0 126.0 139.0 156.0 /g 根据以上图表信息,回答下列问题: (1)生成碳酸钾的化学方程式为___________。 (2)上述流程中可循环使用的物质是________,NH4Cl 在农业上可用作______。 (3)得到 K2CO3 晶浆的结晶方法是____。 (4)上述流程中洗涤 K2CO3 晶体应选用_____(填序号)。 ①NH4Cl 溶液 ②热水 ③饱和 K2CO3 溶液 (1). 2KCl+2NH3 +CO2 +H2O=K2CO3 +2NH4Cl (2). (3). 氮肥 (4). 【答案】 有机萃剂 (5). 蒸发结晶 【解析】 ③【详解】(1)由图可知,饱和氯化钾溶液和氨气、二氧化碳反应生成碳酸钾和氯化铵,该反应的化学方程 2KCl+2NH +CO +H O=K CO +2NH Cl 式为: ;322234(2)由图可知,上述流程中可循环使用的物质是有机萃剂; 氯化铵含氮元素,可做氮肥; (3)由表中数据可知,碳酸钾的溶解度受温度影响不大,得到 K2CO3 品浆的结晶方法是:蒸发结晶; (4)①NH4Cl 溶液还可以继续溶解碳酸钾,不能用来洗涤碳酸钾,不符合题意; ②热水能溶解碳酸钾,不能用来洗涤碳酸钾,不符合题意; ③饱和 K2CO3 溶液不能继续溶解碳酸钾,可用来洗涤碳酸钾,符合题意。 故选③。 19. 一包不纯的氯化钾粉末,杂质可能是硫酸钠、氢氧化钠、氯化钠、硝酸钡中的一种或几种。为确定其成 分,某兴趣小组的同学进行如下实验: 实验一:取少量该粉末于烧杯中,加蒸馏水,充分搅拌,得到无色澄清溶液,往溶液中通入 CO2,产生白 色沉淀。 实验二:取 14.0g 该粉末于烧杯中,加入蒸馏水完全溶解,再加入足量的硝酸银溶液和稀硝酸,充分反应后, 产生 28.7g 白色沉淀。 根据以上信息,回答下列问题: (1)杂质中一定没有___________,一定有__________。 (2)实验一中产生白色沉淀的化学方程式为_____________。 (1). (2). 氢氧化钠、硝酸钡、氯化钠 【答案】 硫酸钠 (3). Na2CO3 +Ba(NO3 )2═BaCO3 +2NaNO3 【解析】 【详解】实验一: 取少量该粉末于烧杯中,加蒸馏水,充分搅拌,得到无色澄清溶液,不可能同时含有硫酸钠和硝酸钡,往 溶液中通入 CO2,产生白色沉淀,可知一定含氢氧化钠和硝酸钡,二氧化碳先与氢氧化钠反应生成碳酸钠 和水,碳酸钠与硝酸钡反应生成碳酸钡沉淀和硝酸钠,则一定不含硫酸钠。 实验二: 取 14.0g 该粉末于烧杯中,加入蒸馏水完全溶解,再加入足量的硝酸银溶液和稀硝酸,充分反应后,产生 28.7g 白色沉淀,不溶于稀硝酸的白色沉淀为氯化银,氯离子只能来自氯化钾或氯化钠; 设 14g氯化钾与硝酸银充分反应生成氯化银沉淀的质量为 x,则 KCl AgNO3 ═ AgCl KNO3 27 74.5 14g 143.5 x74.5 143.5 14g x解得 x=27g<28.7g; 设 14g 氯化钠与硝酸银充分反应生成氯化银沉淀的质量为 y,则 NaCl AgNO3 ═ AgCl NaNO3 34.3 58.5 14g 143.5 y58.5 143.5 14g y解得 y=34.3g>28.7g;可知一定含有氯化钠; (1)综上所述,杂质中一定含氢氧化钠、硝酸钡、氯化钠,一定不含硫酸钠。 (2)实验一中产生白色沉淀的反应为碳酸钠与硝酸钡反应生成碳酸钡沉淀和硝酸钠,反应的化学方程式为 Na2CO3 +Ba(NO3 )2═BaCO3 +2NaNO3 。四、我会实验(除 20(1)每空 1 分外,其余每空 2 分,共 22 分) 20. 根据下列装置回答问题: (1)写出标号仪器的名称:①_______;②______。 (2)实验室用装置 B 制取氧气的化学方程式为________。 (3)下列混合气体(括号内气体为杂质)能用装置 C 进行除杂、干燥、收集的是_____(填序号)。 ①O2(CO2) ②CO2(HCl) ③NH3(O2) ④H2(H Cl) (4)利用装置 D 进行实验探究得出铁生锈的条件是____;若 U 形管水中的丝棉也产生少量锈迹,说明该 实验还需改进,你的改进方法是______________。 MnO 2H2O2 2 2H2O+O2 (1). (2). (3). (4). (5). 铁与氧气 【答案】 铁架台 酒精灯 ④(6). 和水直接接触 【解析】 在盛有凉开水的 U 型管两边的液面上滴加植物油 【详解】(1)标号①的名称是:铁架台;标号②的名称是:酒精灯; (2)装置 B 适用于固液不加热反应制取气体,故适用于过氧化氢和二氧化锰制取氧气,过氧化氢在二氧化 MnO 2H O 2 2H O+O 锰的催化下分解为水和氧气,该反应的化学方程式为: ;2222(3)①O2(CO2):二氧化碳能与氢氧化钠反应生成碳酸钠和水,氧气与氢氧化钠不反应,且氧气不与浓硫 酸反应,可用浓硫酸干燥,但是氧气的密度比空气大,收集时,应从长管进入,不符合题意; ②CO2(HCl):二氧化碳和氯化氢都能与氢氧化钠反应,不但除去了杂质,也除去了原物质,不符合题意; ③NH3(O2):氨气能与浓硫酸反应,不能用浓硫酸干燥,且氧气与氢氧化钠不反应,达不到除杂的目的, 不符合题意; ④H2(H Cl):氢氧化钠能与氯化氢反应生成氯化钠和水,与氢气不反应,且氢气与浓硫酸不反应,可用浓 硫酸干燥,氢气的密度比空气小,收集时,可从短管进入,符合题意。 故选④; (4)潮湿的钢丝棉与空气接触,生锈,干燥的钢丝棉与空气接触,不生锈,说明铁生锈的条件之一是与水 接触,潮湿的钢丝棉与空气接触,生锈,水底的钢丝棉与空气隔绝,不生锈,说明生锈的条件是与空气(或 氧气)接触,故铁生锈的条件是:铁与氧气和水直接接触; 的若 U 形管水中 丝棉也产生少量锈迹,说明少量的氧气溶解在水中,使钢丝棉生锈,可在盛有凉开水的U 型管两边的液面上滴加植物油,隔绝空气(或氧气)。 21. 某校甲、乙兴趣小组同学在学习酸、碱、盐、金属的化学性质后,分别做了 A、B、C 三组实验: 甲、乙小组同学都观察到 C 组实验的现象为________。 实验结束后,甲、乙小组同学分别同时将三组实验反应后的物质各倒入一个洁净的烧杯中,都观察到有气 泡产生,甲、乙小组同学分别对气体成分及充分反应后烧杯中溶液的溶质成分进行探究。 【查阅资料】 2Al 2NaOH 2H O=2NaAlO 3H ①222NaAlO2 HCl H2O NaCl Al(OH)3 Al(OH) NaOH=NaAlO 2H O ②③322【实验探究】 实验操作 实验现象 实验结论 甲紫色石蕊溶 气体为CO2、H2;溶液中溶质一 液变红色 定含有AlCl3、NaCl、___、HCl 取少量烧杯中的溶液于试管中,滴入紫色石蕊溶液 组乙组分别取少量烧杯 中的溶液于两支 往一支试管中先滴入足量 只观察到溶 气体为H2;溶液中溶质一定含有 BaCl2 溶液,再滴入无色酚酞 液变红色NaAlO2、NaCl、NaOH 试管中 溶液 往另一支试管中不断滴入稀 盐酸 _____ 【交流与反思】 (1)乙小组同学讨论后认为,甲组同学得出气体成分的结论不严谨,其理由是______。 (2)甲、乙小组同学所做实验相同,得出的实验结论却不同,原因是________。 【拓展与应用】只用一条化学方程式表示 AlCl3 与过量 NaOH 在溶液中的反应:____。 (1). (2). (3). (4). 紫色石 【答案】 产生白色沉淀 CaCl2 一开始无明显现象,后产生白色沉淀 蕊试液变红,溶液显酸性,碳酸钙一定与稀盐酸反应生成了二氧化碳,但是仅凭有气泡产生,无法得出产 AlCl3 +4NaOH=NaAlO2 +3NaCl+2H2O (6). (5). 生了氢气 【解析】 所用试剂的量不同 【详解】碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,故观察到产生白色沉淀; 实验探究:甲组:取少量烧杯中的溶液于试管中,滴入紫色石蕊溶液,紫色石蕊溶液变红色,紫色石蕊试 液遇酸变红,紫色石蕊试液变红色,说明溶液显酸性,A:铝与稀盐酸反应生成氯化铝和氢气;B:氢氧化 钙和稀盐酸反应生成氯化钙和水;C:碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,烧杯中溶液显酸性, 说明稀盐酸过量,故产生的氢氧化钠和稀盐酸反应生成了氯化钠和水,碳酸钙和稀盐酸也反应生成了氯化 钙、二氧化碳和水,故溶液中溶质一定含有 AlCl3、NaCl、CaCl2、HCl; 乙组:分别取少量烧杯中的溶液于两支试管中,往一支试管中先滴入足量 BaCl2 溶液,再滴入无色酚酞溶液, 只观察到溶液变红色,氯化钡能与碳酸钠反应生成碳酸钡和氯化钠,没有观察到白色沉淀产生,说明溶液 中不含碳酸钠,无色酚酞试液遇碱变红,溶液变红色,说明溶液显碱性,实验结论为:气体为 H2;溶液中 溶质一定含有 NaAlO2、NaCl、NaOH,故往另一支试管中不断滴入稀盐酸,氢氧化钠先与稀盐酸反应生成 NaAlO HCl H O NaCl Al(OH) 氯化钠和水,待完全反应后, 现象,后产生白色沉淀; ,故实验现象为:一开始无明显 223交流与反思:(1)由分析可知,紫色石蕊试液变红,溶液显酸性,碳酸钙一定与稀盐酸反应生成了二氧化 碳,但是仅凭有气泡产生,无法得出产生了氢气; (2)甲、乙小组同学所做实验相同,得出的实验结论却不同,原因是:所用试剂的量不同; AlCl +3NaOH=Al(OH) +3NaCl 拓展与应用:氯化铝与氢氧化钠反应: ,33Al(OH) NaOH=NaAlO 2H O ,故只用一条化学方程式表示 AlCl3 与过量 NaOH 在溶液中的反应为: 322AlCl +4NaOH=NaAlO +3NaCl+2H O 。322五、我会计算(共 8 分) 22. 我市覃塘区石灰石资源丰富,某石灰厂为了测定某石灰石样品中 CaCO3 的质量分数,往盛有 300g 稀盐 酸的烧杯中依次加入粉碎后的石灰石样品(杂质不与盐酸反应),充分反应后,实验数据记录如下: 实验次数 第一次 25 第二次 15 第三次 10 第四次 5石灰石样品/g 烧杯中物质总质量/g 316.2 326.8 m337.4 (1)CaCO3 中钙、碳、氧三种元素的质量比为多少;(写最简比) (2)表中 m= ;(3)所用稀盐酸的溶质质量分数为多少; (4)求该石灰石样品中 CaCO3 的质量分数。(写出计算过程) 【答案】10:3:12;332.4;9.7%;80% 【解析】 【详解】(1)CaCO3 中钙、碳、氧三种元素的质量比为 40:12:(16×3)=10:3:12; 第一次:生成二氧化碳的质量为 25g+300g-316.2g=8.8g;设第一次加入 25g 样品中碳酸钙的质量为 x,则 CaCO3 +2HCl=CaCl2 +H2O+CO2 100 x44 8.8g 100 x44 8.8g 解得 x=20g; 20g 25g 100% 80% 该石灰石样品中 CaCO3 的质量分数为 ;第四次加入样品后,累计生成二氧化碳的质量为 25g+15g+10g+5g+300g-337.4g=17.6g,设生成 17.6g 二氧化 碳需要石灰石样品的质量为 y,消耗稀盐酸溶质质量为 z,则 CaCO3 +2HCl=CaCl2 +H2O+CO2 100 73 z44 80%y 17.6g 100 80%y 73 z,44 17.6g 44 17.6g 解得 y=50g,z=29.2g; 恰好为前三次加入样品的总质量,即第三次加入样品后,稀盐酸恰好完全反应,故 m=50g+300g-17.6g=332.4g; 29.2g 100% 9.7% 所用稀盐酸的溶质质量分数为 ;300g 答:CaCO3 中钙、碳、氧三种元素的质量比为 10:3:12;表中 m=332.4;所用稀盐酸的溶质质量分数为 9.7%;该石灰石样品中 CaCO3 的质量分数为 80%。 本试卷的题干 0635
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





