



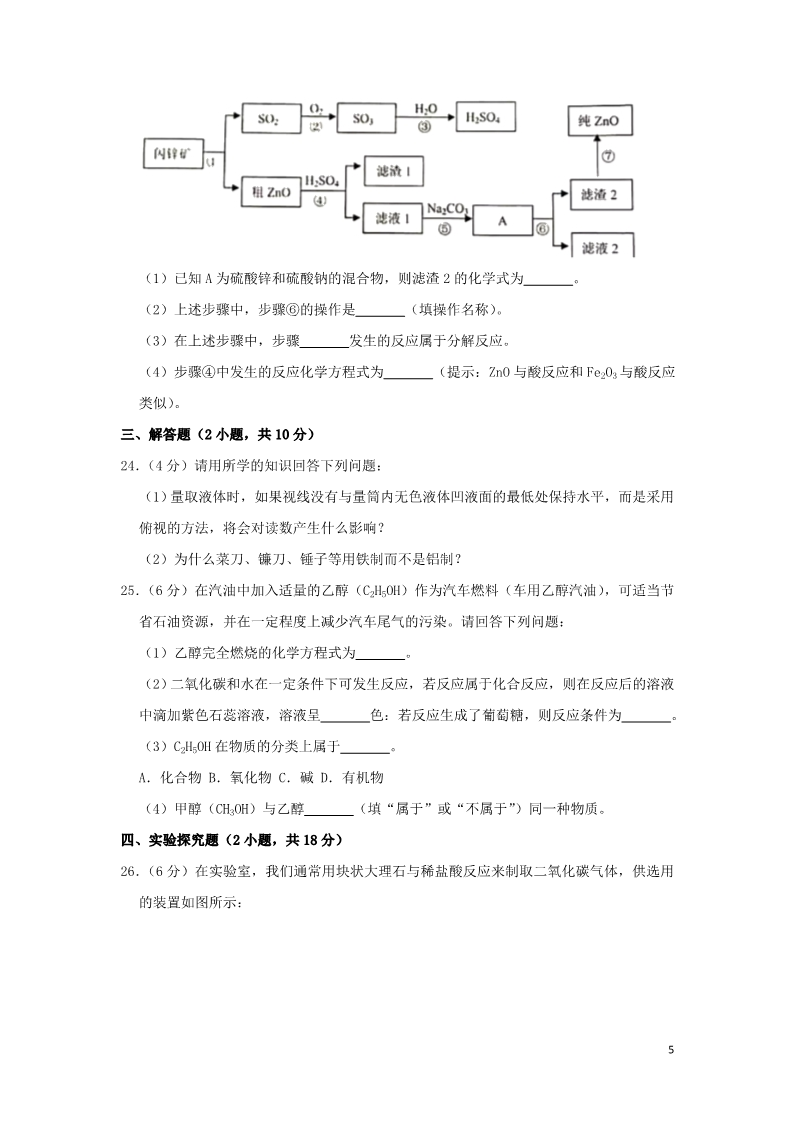
2019年湖南省株洲市中考化学试卷 一、选择题(每题 2分,总共 40分) 1.(2分)下列过程中一定发生了化学变化的是( ) A.干冰气化 B.塑料降解 C.铁水铸成锅 2.(2分)下列与燃烧和爆炸有关的图标中不正确的是( ) D.汽油除油污 A. 禁止吸烟 B. 禁止燃放鞭炮 C. 禁止放易燃物 D. 禁止烟火 3.(2分)下列物质中属于化合物的是( ) A.铝片 B.钢材 C.白酒 D.蔗糖 4 .( 2 分 ) 下 列 有 关 化 学 实 验 操 作 的 图 示 中 正 确 的 是 () A.①② B.②④ C.③④ D.① 5.(2分)某小孩食欲不振、生长迟缓、发育不良,下列适合改善该小孩症状的食品是( ) A.高钙奶 6.(2分)取用粉末状固体化学药品时,应使用的仪器是( ) A.滴管 B.研钵 C.药匙 B.补铁剂 C.补锌剂 D.海带汤 D.镊子 7.(2分)2019年是“国际化学元素周期表年”。制出第一张元素周期表的科学家的是( ) A.舍勒 B.道尔顿 C.门捷列夫 D.阿伏伽德罗 8.(2分)下列说法中正确的是( ) A.凡是生成盐和水的反应都是中和反应 B.盐类物质中不一定含有金属元素 C.饱和溶液降温一定能析出晶体 D.碳酸饱和溶液的浓度比硼酸不饱和溶液的浓度大 9.(2分)构建“单质及其化合物的价、类关系图”是学习化学的一种重要方法。如图是华 1雪同学在化学学习中构建的“碳及其化合物的价、类关系图”。碳纳米管具有尺寸小、机 械强度高,导电性好等特点。在材料、催化、信息等诸多领域中具有重要的应用前景。 图中与碳纳米管对应的点是( ) A.A B.B C.C D.D 10.(2分)我国海水晒盐具有悠久的历史,所得“盐”的主要成分是( ) A.Na2SO4 11.(2分)将石油加热炼制,不可能得到的产品是( ) A.煤焦油 B.润滑油 C.柴油 12.(2分)一些重要作物最适宜生长的土壤的 pH范围如下: B.NaCl C.CaCl2 D.Na2CO3 D.煤油 作物 水稻 马铃薯 草莓 薄荷 pH 6~7 4.8~5.5 5~7.5 7~8 下列说法中正确的是( ) A.水稻和薄荷生长都适宜酸性土壤 B.草莓生长只适宜酸性土壤 C.马铃薯生长不适宜碱性土壤 D.以上作物都不适宜碱性土壤 13.(2分)下列选项中各种溶质的溶液混合,无明显现象的是( ) A.NaOH、NH4Cl、Fe2(SO4)3 C.KCl、CH3COOH、Na2CO3 B.KNO3、AgNO3、NaCl D.H2SO4、K2SO4、HNO3 14.(2分)如图为某元素原子的结构示意图。下列有关叙述不正确的是( ) A.该元素的原子序数为 17 2B.在该结构示意图中 x=7 C.该元素的原子在化学反应中容易得到电子 D.该元素为硫,是一种非金属元素 15.(2分)下列化肥中,从外观即可与其他化肥区别的是( ) A.硝酸铵 B.磷矿粉 C.氯化钾 D.硫化钾 16.(2分)化学与生产、生活息息相关,下列说法中不正确的是( ) A.农药本身有毒,应该及早制订有关法律禁止施用农药 B.“中国居民平衡膳食宝塔”为我们提供了合理选择食物的指南 C.长期偏食和挑食不利于身体健康 D.运动员在剧烈运动、大量出汗后,常会饮用一些含无机盐的运动饮料 17.(2分)下列说法不正确的是( ) A.空气的成分按体积计算大约是:氮气 78%,氧气 21%,其他成分 1% B.地球上的水储量是丰富的,但可供利用的淡水资源是有限的 C.棉花、羊毛、蚕丝、涤纶、尼伦和腈纶等都是合成纤维 D.基本营养素包括蛋白质、糖类、油脂、维生素、无机盐和水六大类 18.(2分)过氧乙酸对细菌和病毒具有高效、快速杀灭作用,广泛应用于环境的消毒,如 图为过氧乙酸的分子结构图(其中 下列有关说法正确的是( ) 代表碳原子, 代表氢原子, 代表氧原子), A.过氧乙酸的化学式是 CH3COOOH(或 C2H4O3) B.过氧乙酸是由碳、氢、氧三种元素构成的 C.过氧乙酸中碳、氢、氧三种元素的质量比是 12:1:16 D.过氧乙酸中碳元素的质量分数是 40% 19.(2分)造纸是我国古代四大发明之一。早期的纸张生产中,常常用纸表面涂敷某种物 质的工艺,但存在副作用,该物质易导致纸张发生酸性腐蚀,使纸张变脆易破损,该物 质是( ) A.烧碱 B.明矾 C.草木灰 D.熟石灰 20.(2分)如图为 KNO3和 NaC1的溶解度曲线,下列说法不正确的是( ) 3A.20℃时,KNO3的溶解度为 31.6g B.a点处 KNO3和 NaCl两种溶液中溶质的质量分数相等 C.40℃时,100g水中可溶解 KNO3固体 63.9g D.0℃时,NaC1饱和溶液中溶质的质量分数为 35.7% 二、解答题(共 3小题,满分 8分) 21.(3分)纯净的二氧化硅是现代光学及光纤制品的基本原料。请回答下列问题: (1)二氧化硅的化学性质很不活泼,氢氟酸(HF)是唯一可以与之发生反应的酸(生成 物为水和四氟化硅气体),该反应的化学方程式为 (2)二氧化硅与碳酸钙在高温下反应生成硅酸钙(CaSiO3)和二氧化碳:在物质的分类 ①单质②化合物③氧化物④酸⑤碱⑥盐中,硅酸钙属于 (填序号)。 。 22.在探究金属活动性顺序时,华雪同学把两根绕成螺旋状的洁净铜丝分别浸入硫酸铝溶液、 硝酸银溶液中,过一会儿取出: (1)铜丝浸入硫酸铝溶液中,可观察到的现象是: (2)铜丝浸入硝酸银溶液中,可观察到铜丝上有 色。 。 色物质生成,溶液逐渐变成蓝 (3)铜丝浸入硝酸银溶液中,离子数目减少的是 (4)根据上述实验所观察到的现象,华雪同学 铜、银的金属活动性顺序 Al>Cu>Ag ,离子数目增加的是 。 (填“能”或者“不能”)证明铝、 23.(5分)氧化锌软膏可用于急性或亚急性皮炎、湿疹、痱子及轻度、小面积的皮肤溃疡。 闪锌矿(主要成分为 ZnS)是含锌的主要矿物质之一,高温煅烧闪锌矿生成氧化锌和 SO2,以氧化锌产品为原料制备纯氧化锌的生产工艺流程如图: 4(1)已知 A为硫酸锌和硫酸钠的混合物,则滤渣 2的化学式为 (2)上述步骤中,步骤⑥的操作是 (填操作名称)。 发生的反应属于分解反应。 。 (3)在上述步骤中,步骤 (4)步骤④中发生的反应化学方程式为 类似)。 (提示:ZnO与酸反应和 Fe2O3与酸反应 三、解答题(2小题,共 10分) 24.(4分)请用所学的知识回答下列问题: (1)量取液体时,如果视线没有与量筒内无色液体凹液面的最低处保持水平,而是采用 俯视的方法,将会对读数产生什么影响? (2)为什么菜刀、镰刀、锤子等用铁制而不是铝制? 25.(6分)在汽油中加入适量的乙醇(C2H5OH)作为汽车燃料(车用乙醇汽油),可适当节 省石油资源,并在一定程度上减少汽车尾气的污染。请回答下列问题: (1)乙醇完全燃烧的化学方程式为 。 (2)二氧化碳和水在一定条件下可发生反应,若反应属于化合反应,则在反应后的溶液 中滴加紫色石蕊溶液,溶液呈 色:若反应生成了葡萄糖,则反应条件为 。 。 (3)C2H5OH在物质的分类上属于 A.化合物 B.氧化物 C.碱 D.有机物 (4)甲醇(CH3OH)与乙醇 (填“属于”或“不属于”)同一种物质。 四、实验探究题(2小题,共 18分) 26.(6分)在实验室,我们通常用块状大理石与稀盐酸反应来制取二氧化碳气体,供选用 的装置如图所示: 5(1)写出仪器 a的名称为 。 (2)若要制取并收集一瓶 CO2,不可以选择的装置是 (填图中装置对应的字母)。 (3)CO2是一种酸性氧化物(能与碱起反应生成盐和水的氧化物)。为探究 CO2确实能和 NaOH发生化学反应,华雪同学选用了下列两种装置进行实验,都证明了 CO2和 NaOH确实 发生了化学反应。请回答下列问题: ①选择装置 I时,可观察到的实验现象为: ②选择装置Ⅱ时,可观察到烧杯内的水沿着导管倒流入锥形瓶中,产生该实验现象的原 因是: 。 ③CO2和 NaOH溶液反应的化学方程式为 。 。 27.(12分)菱铁矿和赤铁矿一样,也是工业上冶炼铁的一种矿物。某种菱铁矿中铁元素的 主要存在形式是碱式碳酸亚铁,为测定碱式碳酸亚铁[xFeCO3•yFe(HO)2•zH2O]的组成, 华雪同学在老师的指导下设计了如图实验装置: 【查阅资料】 a.碱式碳酸亚铁受热会完全分解生成 FeO、CO2以 H2O。 6b.FeO是一种黑色粉末,它不稳定,在空气中加热,可被氧化成四氧化三铁。 c.石灰是 NaOH及 CaO的混合物,可以吸收 CO2和 H2O 【实验步骤】 (1)检查装置的 后,准备称取 3.40g碱式碳酸亚铁粉末放在装置 B中,连接仪 器。 (2) (3)关闭弹簧夹 K,加热装置 B至装置 C中导管末端无气泡冒出,再打开弹簧夹 K,缓 缓通空气一段时间,这样操作的目的是 。 (4)再次准确称量装置 C、D、E的质量,所得数据如下 ,鼓入一段时间空气,准确称量装置 C、D、E的质量。 装置 C/g 200.00 200.36 装置 D/g 180.00 180.88 装置 E/g 180.00 180.00 加热前 加热后 (5)图,分析表中数据可知:3.40g碱式碳酸亚铁受热分解过程中生成 H2O的质量为 g,CO2的质量为 g,装置 E的作用是 。 【实验结论】 在 xFeCO3•yFe(HO)2•zH2O中,氢原子与氧原子的个数之比为 。 【实验反思】 (1)装置 A的作用是 (2)实验结束后,装置 B中的残留固体可能全部是 FeO.也可能全部是 Fe3O4.还可能 是 。 (3)为了得到装置 B中残留固体的组成,华雪同学称得装置 B中残留固体质量为 2.24g 。 后,通过计算可知:残留固体的组成及各成分的质量为 。 五、计算题(2小题,共 10分) 28.(4分)超市购物小票上含有 BPA(双酚 A),网上流传消费者接触小票会致癌。我国规 定:超市购物小票上双酚 A的含量应不超过 0.6mg/Kg.按照这个标准,收银员即使每天 接触小票 10个小时,双酚 A通过接触进入人体的量也不会比安全剂量低几十倍。因此, 普通消费者一天接触几张购物小票,致癌概率是完全可以忽略不计的。 (1)双酚 A的化学式为 C15H16O2,其相对分子质量为 。 (2)若每张超市购物小票的质量为 5g,则其中含有双酚 A的质量应不能超过 mg 7才能符合国家标准。 29.(6分)在锥形瓶中加入 80.0g质量分数为 10%的硫酸铜溶液,塞好橡胶塞。将几根铁钉 用砂纸打磨干净后在天平上称得质量为 56.0g,再将盛有硫酸铜溶液的锥形瓶和铁钉一起 放在天平上称量,记录所称得质量 m1.将上述铁钉浸到硫酸铜溶液中,待反应一段时间 后溶液颜色改变时,将盛有硫酸铜溶液和锥形瓶放在天平上称量,记录所称的质量为 m2。 (1)m1 (2)锥形瓶的质量为 (3)若硫酸铜反应完全,求此时所得溶液的质量(写出计算结果)。 m2(填“>”或“=”或“<”)。 (用含 m1或 m2的代数式表示)。 82019年湖南省株洲市中考化学试卷 参考答案与试题解析 一、选择题(每题 2分,总共 40分) 1.(2分)下列过程中一定发生了化学变化的是( ) A.干冰气化 B.塑料降解 C.铁水铸成锅 D.汽油除油污 【解答】解:A、干冰气化没有新物质生成,属于物理变化;故选项错误; B、塑料降解生成新物质,属于化学变化;故选项正确; C、铁水铸成锅没有新物质生成,属于物理变化;故选项错误; D、汽油除油污没有新物质生成,属于物理变化;故选项错误; 故选:B。 2.(2分)下列与燃烧和爆炸有关的图标中不正确的是( ) A. 禁止吸烟 B. 禁止燃放鞭炮 C. 禁止放易燃物 D. 禁止烟火 【解答】解:A、图中所示标志是禁止吸烟标志,故选项错误。 B、图中所示标志是禁止燃放鞭炮标志,故选项错误。 C、图中所示标志是禁止带火种标志,故选项正确。 D、图中所示标志是禁止烟火标志,故选项错误。 故选:C。 3.(2分)下列物质中属于化合物的是( ) A.铝片 B.钢材 C.白酒 D.蔗糖 【解答】解:A、铝是由铝元素组成的纯净物,是单质; B、钢主要成分是铁,还含有碳等物质,是混合物; C、白酒中含有水和酒精等物质,是混合物; D、蔗糖是由不同种元素组成的纯净物,是化合物。 故选:D。 94 .( 2 分 ) 下 列 有 关 化 学 实 验 操 作 的 图 示 中 正 确 的 是 () A.①② B.②④ C.③④ D.① 【解答】解:①使用酒精灯时要注意“两查、两禁、一不可”,熄灭酒精灯时,不能用嘴 吹灭酒精灯,应用灯帽盖灭,图中所示操作正确。 ②氢气的密度比空气的小,应从短导管通入,将空气从长导管排出,图中所示操作错误。 ③给试管中的液体加热时,用酒精灯的外焰加热试管里的液体,且液体体积不能超过试 管容积的,图中液体超过试管容积的,图中所示操作错误。 ④蒸发时,应用玻璃棒不断搅拌,以防止局部温度过高,造成液体飞溅,图中所示操作 错误。 故选:D。 5.(2分)某小孩食欲不振、生长迟缓、发育不良,下列适合改善该小孩症状的食品是( ) A.高钙奶 B.补铁剂 C.补锌剂 D.海带汤 【解答】解:小孩食欲不振、生长迟缓、发育不良,主要是由于缺锌引起的,需要合理 补锌。 A.高钙奶的营养成分主要是钙元素,故 A错误; B.补铁剂的营养成分主要是铁元素,故 B错误; C.补锌剂的营养成分主要是锌元素,故 C正确; D.海带汤的营养成分主要是碘元素,故 D错误。 故选:C。 6.(2分)取用粉末状固体化学药品时,应使用的仪器是( ) A.滴管 B.研钵 C.药匙 D.镊子 【解答】解:取用粉末状药品时可以用药匙。 故选:C。 7.(2分)2019年是“国际化学元素周期表年”。制出第一张元素周期表的科学家的是( ) A.舍勒 B.道尔顿 C.门捷列夫 D.阿伏伽德罗 【解答】解:A、舍勒通过实验测定了空气的组成,但受传统学说的影响,错过了发现空 10 气组成的机会,故选项错误。 B、道尔顿在化学上的主要贡献是提出了原子学说,故选项错误。 C、门捷列夫在化学上的主要贡献是发现了元素周期律,并编制出元素周期表,故选项正 确。 D、阿伏伽德罗在化学上的主要贡献是提出了分子的概念,并创立了分子学说,故选项错 误。 故选:C。 8.(2分)下列说法中正确的是( ) A.凡是生成盐和水的反应都是中和反应 B.盐类物质中不一定含有金属元素 C.饱和溶液降温一定能析出晶体 D.碳酸饱和溶液的浓度比硼酸不饱和溶液的浓度大 【解答】解:A、中和反应生成盐和水,但生成盐和水的反应不一定是中和反应,如 CO2+2NaOH═Na2CO3+H2O,故选项推理错误。 B、盐类物质中不一定含有金属元素,如硝酸铵,故选项说法正确。 C、有些物质的溶解度随着温度的降低而增大,饱和溶液降温不一定能析出晶体,故选项 说法错误。 D、选项说法没有指明温度,且溶质种类不同,碳酸饱和溶液的浓度不一定比硼酸不饱和 溶液的浓度大,故选项说法错误。 故选:B。 9.(2分)构建“单质及其化合物的价、类关系图”是学习化学的一种重要方法。如图是华 雪同学在化学学习中构建的“碳及其化合物的价、类关系图”。碳纳米管具有尺寸小、机 械强度高,导电性好等特点。在材料、催化、信息等诸多领域中具有重要的应用前景。 图中与碳纳米管对应的点是( ) A.A B.B C.C D.D 11 【解答】解:碳纳米管是由碳元素组成的纯净物,是单质,单质中碳元素化合价是 0,因 此图中与碳纳米管对应的点是 A。 故选:A。 10.(2分)我国海水晒盐具有悠久的历史,所得“盐”的主要成分是( ) A.Na2SO4 B.NaCl C.CaCl2 D.Na2CO3 【解答】解:我国海水晒盐具有悠久的历史,所得“盐”的主要成分是氯化钠。 故选:B。 11.(2分)将石油加热炼制,不可能得到的产品是( ) A.煤焦油 B.润滑油 C.柴油 D.煤油 【解答】解:石油属于混合物,它是由汽油、煤油、柴油、润滑油、机油等沸点不同物 质混合而成的,石油通过分馏即可得到上述物质。将煤隔绝空气加强热,可生成焦炭、 煤焦油、煤气、焦炉气等产物,煤气、煤焦油、焦炉气均属于煤加工的产品。 A.煤焦油属于煤加工的产品,故选项符合题意。 B.润滑油属于石油加工的产品,故选项不合题意。 C.柴油属于石油加工的产品,故选项不合题意。 D.煤油属于石油加工的产品,故选项不合题意。 故选:A。 12.(2分)一些重要作物最适宜生长的土壤的 pH范围如下: 作物 水稻 马铃薯 草莓 薄荷 pH 6~7 4.8~5.5 5~7.5 7~8 下列说法中正确的是( ) A.水稻和薄荷生长都适宜酸性土壤 B.草莓生长只适宜酸性土壤 C.马铃薯生长不适宜碱性土壤 D.以上作物都不适宜碱性土壤 【解答】解:溶液的 pH>7,溶液显碱性;pH=7,溶液显中性;pH<7,溶液显酸性。 A.由数据可知,薄荷适宜生长的土壤 pH为 7~8,即土壤略显碱性,故错误; B.由数据可知,草莓适宜生长的土壤的 pH为 5~7.5,即土壤略显碱性,故错误; C.由数据可知,马铃薯适宜生长的土壤的 pH为 4.8~5.5,即土壤显酸性,不适宜在碱 12 性土壤中生长,故正确; D.由数据可知,薄荷适宜生长的土壤 pH为 7~8,即土壤略显碱性,故错误。 故选:C。 13.(2分)下列选项中各种溶质的溶液混合,无明显现象的是( ) A.NaOH、NH4Cl、Fe2(SO4)3 C.KCl、CH3COOH、Na2CO3 B.KNO3、AgNO3、NaCl D.H2SO4、K2SO4、HNO3 【解答】解:A、NaOH溶液与 NH4Cl、Fe2(SO4)3反应,分别放出有刺激性气味的气体、 产生红褐色沉淀,有明显现象,故选项错误。 B、AgNO3、NaCl反应生成氯化银白色沉淀,有明显现象,故选项错误。 C、CH3COOH、Na2CO3反应产生二氧化碳气体,有明显现象,故选项错误。 D、三者不反应,混合后无明显现象,故选项正确。 故选:D。 14.(2分)如图为某元素原子的结构示意图。下列有关叙述不正确的是( ) A.该元素的原子序数为 17 B.在该结构示意图中 x=7 C.该元素的原子在化学反应中容易得到电子 D.该元素为硫,是一种非金属元素 【解答】解:A、由某原子结构示意图为可以看出:圆圈内的数字是 17,该元素的原子序 数为 17,故选项说法正确。 B、当质子数=核外电子数,为原子,在该结构示意图中 x=7,x=17﹣2﹣8=7,故选项 说法正确。 C、最外层电子数是 7,在化学反应中易得到 1个电子而形成阴离子,故选项说法正确。 D、圆圈内的数字是 17,为氯元素,故选项说法错误。 故选:D。 15.(2分)下列化肥中,从外观即可与其他化肥区别的是( ) A.硝酸铵 B.磷矿粉 C.氯化钾 D.硫化钾 13 【解答】解:A、硝酸铵为白色晶体。 B、磷矿粉是灰白色的固体。 C、氯化钾为白色晶体。 D、硫化钾为白色晶体。 硝酸铵、氯化钾、硫化钾从外观看均为白色晶体,只有磷矿粉是灰白色粉末,故从外观 看与磷矿粉可与其他化肥相区别。 故选:B。 16.(2分)化学与生产、生活息息相关,下列说法中不正确的是( ) A.农药本身有毒,应该及早制订有关法律禁止施用农药 B.“中国居民平衡膳食宝塔”为我们提供了合理选择食物的指南 C.长期偏食和挑食不利于身体健康 D.运动员在剧烈运动、大量出汗后,常会饮用一些含无机盐的运动饮料 【解答】解:A.农药有毒,应该及早制订有关法合理施用农药,故 A错误; B.“平衡膳食宝塔”是根据平衡膳食的原则转化成各类食物的大致比例,并以直观的宝 塔形式表示出来,为我们提供了合理选择食物的指南,故 B正确; C.青青少年长期偏食、挑食会导致营养不良,不利于身体健康,要合理膳食,故 C正确; D.因为汗的成分是水、无机盐、尿素,故大量出汗后,应该饮用一些含无机盐的运动原 料,故 D正确。 故选:A。 17.(2分)下列说法不正确的是( ) A.空气的成分按体积计算大约是:氮气 78%,氧气 21%,其他成分 1% B.地球上的水储量是丰富的,但可供利用的淡水资源是有限的 C.棉花、羊毛、蚕丝、涤纶、尼伦和腈纶等都是合成纤维 D.基本营养素包括蛋白质、糖类、油脂、维生素、无机盐和水六大类 【解答】解:A.空气的成分按体积计算大约是:氮气 78%,氧气 21%,其他成分 1%,故 正确; B.地球上的水储量是丰富的,但可供利用的淡水资源是有限的,故正确; C.棉花、羊毛、蚕丝属于天然纤维;涤纶、尼伦和腈纶属于合成纤维,故错误; D.人体所需的基本营养素包括蛋白质、糖类、油脂、维生素、无机盐和水六大类,故正 确。 14 故选:C。 18.(2分)过氧乙酸对细菌和病毒具有高效、快速杀灭作用,广泛应用于环境的消毒,如 图为过氧乙酸的分子结构图(其中 下列有关说法正确的是( ) 代表碳原子, 代表氢原子, 代表氧原子), A.过氧乙酸的化学式是 CH3COOOH(或 C2H4O3) B.过氧乙酸是由碳、氢、氧三种元素构成的 C.过氧乙酸中碳、氢、氧三种元素的质量比是 12:1:16 D.过氧乙酸中碳元素的质量分数是 40% 【解答】解:A、1个过氧乙酸分子是由 2个碳原子、4个氢原子和 3个氧原子构成的, 则过氧乙酸的化学式是 CH3COOOH(或 C2H4O3),故选项说法正确。 B、过氧乙酸是由碳、氢、氧三种元素组成的,故选项说法错误。 C、过氧乙酸中碳、氢、氧元素的质量比为(12×2):(1×4):(16×3)=12:1:16, 故选项说法错误。 D、过氧乙酸中碳元素的质量分数是×100%≈31.6%,故选项说法错误。 故选:A。 19.(2分)造纸是我国古代四大发明之一。早期的纸张生产中,常常用纸表面涂敷某种物 质的工艺,但存在副作用,该物质易导致纸张发生酸性腐蚀,使纸张变脆易破损,该物 质是( ) A.烧碱 B.明矾 C.草木灰 D.熟石灰 【解答】解:早期的纸张生产中,常在纸表面涂敷明矾的工艺,利用的是明矾水解出氢 离子,溶液呈酸性,在酸性环境下,纤维素水解,使高分子链断裂,从而使纸张变脆易 破裂; 故选:B。 20.(2分)如图为 KNO3和 NaC1的溶解度曲线,下列说法不正确的是( ) 15 A.20℃时,KNO3的溶解度为 31.6g B.a点处 KNO3和 NaCl两种溶液中溶质的质量分数相等 C.40℃时,100g水中可溶解 KNO3固体 63.9g D.0℃时,NaC1饱和溶液中溶质的质量分数为 35.7% 【解答】解:A、通过分析溶解度曲线可知,20℃时,KNO3的溶解度为 31.6g,故 A正确; B、a点处 KNO3和 NaCl两种物质的溶解度相等,所以 a点处溶液中溶质的质量分数相等, 故 B正确; C、40℃时,硝酸钾的溶解度是 63.9g,所以 100g水中可溶解 KNO3固体 63.9g,故 C正确; D、0℃时,氯化钠的溶解度是 35.7g,所以 NaC1饱和溶液中溶质的质量分数为×100%≠ 35.7%,故 D错误。 故选:D。 二、解答题(共 3小题,满分 8分) 21.(3分)纯净的二氧化硅是现代光学及光纤制品的基本原料。请回答下列问题: (1)二氧化硅的化学性质很不活泼,氢氟酸(HF)是唯一可以与之发生反应的酸(生成 物为水和四氟化硅气体),该反应的化学方程式为 SiO2+4HF=SiF4↑+2H2O 。 (2)二氧化硅与碳酸钙在高温下反应生成硅酸钙(CaSiO3)和二氧化碳:在物质的分类 ①单质②化合物③氧化物④酸⑤碱⑥盐中,硅酸钙属于 ②⑥ (填序号)。 【解答】解:(1)二氧化硅和氢氟酸反应生成水和四氟化硅,化学方程式为:SiO2+4HF= SiF4↑+2H2O; (2)硅酸钙(CaSiO3)由钙元素、硅元素和氧元素组成属于化合物;由钙离子和硅酸根 离子构成,属于盐。 故答案为: (1)SiO2+4HF=SiF4↑+2H2O; (2)②⑥。 16 22.在探究金属活动性顺序时,华雪同学把两根绕成螺旋状的洁净铜丝分别浸入硫酸铝溶液、 硝酸银溶液中,过一会儿取出: (1)铜丝浸入硫酸铝溶液中,可观察到的现象是: 无现象 。 (2)铜丝浸入硝酸银溶液中,可观察到铜丝上有 银白 色物质生成,溶液逐渐变成蓝 色。 (3)铜丝浸入硝酸银溶液中,离子数目减少的是 Ag+ ,离子数目增加的是 Cu2+ 。 (4)根据上述实验所观察到的现象,华雪同学 能 (填“能”或者“不能”)证明铝、 铜、银的金属活动性顺序 Al>Cu>Ag 【解答】解:(1)由于金属活动性铝大于铜,若把铜丝浸入硫酸铝溶液中,观察到无明 显现象,说明铜的金属活动性比铝弱; 在金属活动性顺序中,铜位于氢的后面,铜不能与稀硫酸发生置换反应; (2)由于金属活动性铜大于银,将铜丝浸入硝酸银溶液中,生成硝酸铜溶液和银,铜丝 表面覆盖一层银白色物质,溶液由无色逐渐变成蓝色, (3)铜丝浸入硝酸银溶液中,生成硝酸铜溶液和银,其中银离子得到电子转化为银原子, 铜原子失去电子转换为铜离子; (4)根据铜丝浸入硫酸铝溶液中,无明显现象,说明金属活动性铝大于铜,铜丝浸入硝 酸银溶液中,铜丝表面覆盖一层银白色物质,溶液由无色逐渐变成蓝色,说明金属活动 性铜大于银,可得铝、铜、银的金属活动性顺序 Al>Cu>Ag。 故答案为:(1)无现象;(2)银白;(3)Ag+;Cu2+;(4)能。 23.(5分)氧化锌软膏可用于急性或亚急性皮炎、湿疹、痱子及轻度、小面积的皮肤溃疡。 闪锌矿(主要成分为 ZnS)是含锌的主要矿物质之一,高温煅烧闪锌矿生成氧化锌和 SO2,以氧化锌产品为原料制备纯氧化锌的生产工艺流程如图: (1)已知 A为硫酸锌和硫酸钠的混合物,则滤渣 2的化学式为 ZnCO3 。 (2)上述步骤中,步骤⑥的操作是 过滤 (填操作名称)。 17 (3)在上述步骤中,步骤 ⑦ 发生的反应属于分解反应。 (4)步骤④中发生的反应化学方程式为 ZnO+H2SO4=ZnSO4+H2O (提示:ZnO与酸反应 和 Fe2O3与酸反应类似)。 【解答】解: (1)由于滤渣 2分解为氧化锌,所以滤渣 2的化学式为 ZnCO3。 (2)上述步骤中,步骤⑥得到滤渣和滤液,所以是过滤。 (3)在上述步骤中,步骤⑦发生是碳酸锌受热分解为氧化锌和二氧化碳,所以属于分解 反应。 (4)步骤④中发生氧化锌和硫酸能反应生成硫酸锌和水,对应的反应化学方程式为 ZnO+H2SO4=ZnSO4+H2O。 故答案为: (1)ZnCO3。 (2)过滤。 (3)⑦。 (4)ZnO+H2SO4=ZnSO4+H2O。 三、解答题(2小题,共 10分) 24.(4分)请用所学的知识回答下列问题: (1)量取液体时,如果视线没有与量筒内无色液体凹液面的最低处保持水平,而是采用 俯视的方法,将会对读数产生什么影响? (2)为什么菜刀、镰刀、锤子等用铁制而不是铝制? 【解答】解:(1)量取液体时,如果视线没有与量筒内无色液体凹液面的最低处保持水 平,而是采用俯视的方法,则会使读数偏大,故填:偏大; (2)菜刀、镰刀、锤子等用铁制而不是铝制,是因为铁的硬度大于铝,故填:铁的硬度 比铝大。 25.(6分)在汽油中加入适量的乙醇(C2H5OH)作为汽车燃料(车用乙醇汽油),可适当节 省石油资源,并在一定程度上减少汽车尾气的污染。请回答下列问题: (1)乙醇完全燃烧的化学方程式为 C2H5OH+3O2 2CO2+3H2O 。 (2)二氧化碳和水在一定条件下可发生反应,若反应属于化合反应,则在反应后的溶液 中滴加紫色石蕊溶液,溶液呈 红 色:若反应生成了葡萄糖,则反应条件为 光照 。 18 (3)C2H5OH在物质的分类上属于 AD 。 A.化合物 B.氧化物 C.碱 D.有机物 (4)甲醇(CH3OH)与乙醇 不属于 (填“属于”或“不属于”)同一种物质。 【解答】解:(1)乙醇完全燃烧生成二氧化碳和水,反应的化学方程式为:C2H5OH+3O2 2CO2+3H2O; (2)常温下,二氧化碳和水可以化合生成碳酸,碳酸溶液显酸性,可使紫色石蕊溶液变 红色;同时绿色植物也可以在光照下,利用二氧化碳和水合成葡萄糖同时放出氧气; (3)C2H5OH是含碳的化合物,属于有机物; (4)甲醇(CH3OH)与乙醇,用不同化学式表示,其构成不同,属于不同物质。 故答案为:(1)C2H5OH+3O2 2CO2+3H2O;(2)红;光照;(3)AD;(4)不属于。 四、实验探究题(2小题,共 18分) 26.(6分)在实验室,我们通常用块状大理石与稀盐酸反应来制取二氧化碳气体,供选用 的装置如图所示: (1)写出仪器 a的名称为 长颈漏斗 。 (2)若要制取并收集一瓶 CO2,不可以选择的装置是 BE或 BF (填图中装置对应的字 母)。 (3)CO2是一种酸性氧化物(能与碱起反应生成盐和水的氧化物)。为探究 CO2确实能和 NaOH发生化学反应,华雪同学选用了下列两种装置进行实验,都证明了 CO2和 NaOH确实 发生了化学反应。请回答下列问题: ①选择装置 I时,可观察到的实验现象为: 气球变大 。 19 ②选择装置Ⅱ时,可观察到烧杯内的水沿着导管倒流入锥形瓶中,产生该实验现象的原 因是: CO2与 NaOH反应,锥形瓶内气压减小 。 ③CO2和 NaOH溶液反应的化学方程式为 CO2+2NaOH=Na2CO3+H2O 。 【解答】解:(1)长颈漏斗方便加液体药品,故答案为:长颈漏斗; (2)实验室制取 CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸 反应生成氯化钙和水和二氧化碳,因此不需要加热。二氧化碳能溶于水,密度比空气的 密度大,因此只能用向上排空气法收集;若要制取并收集一瓶 CO2,不可以选择的装置是 加热装置,不能用向下排空气法和排水法收集;故答案为:BE或 BF; (3)如图,①选择装置 I时,可观察到的实验现象为:气球变大;②选择装置Ⅱ时,可 观察到烧杯内的水沿着导管倒流入锥形瓶中,产生该实验现象的原因是:CO2与 NaOH反 应,锥形瓶内气压减小;③CO2和 NaOH溶液反应生成碳酸钠和水,配平即可;故答案为: ①气球变大;②CO2与 NaOH反应,锥形瓶内气压减小;③CO2+2NaOH=Na2CO3+H2O; 27.(12分)菱铁矿和赤铁矿一样,也是工业上冶炼铁的一种矿物。某种菱铁矿中铁元素的 主要存在形式是碱式碳酸亚铁,为测定碱式碳酸亚铁[xFeCO3•yFe(HO)2•zH2O]的组成, 华雪同学在老师的指导下设计了如图实验装置: 【查阅资料】 a.碱式碳酸亚铁受热会完全分解生成 FeO、CO2以 H2O。 b.FeO是一种黑色粉末,它不稳定,在空气中加热,可被氧化成四氧化三铁。 c.石灰是 NaOH及 CaO的混合物,可以吸收 CO2和 H2O 【实验步骤】 (1)检查装置的 气密性 后,准备称取 3.40g碱式碳酸亚铁粉末放在装置 B中,连接 仪器。 (2) 打开弹簧夹 K ,鼓入一段时间空气,准确称量装置 C、D、E的质量。 20 (3)关闭弹簧夹 K,加热装置 B至装置 C中导管末端无气泡冒出,再打开弹簧夹 K,缓 缓通空气一段时间,这样操作的目的是 使 B中分解生成的二氧化碳和水蒸气全部被 D、 C装置吸收 。 (4)再次准确称量装置 C、D、E的质量,所得数据如下 装置 C/g 200.00 200.36 装置 D/g 180.00 180.88 装置 E/g 180.00 180.00 加热前 加热后 (5)图,分析表中数据可知:3.40g碱式碳酸亚铁受热分解过程中生成 H2O的质量为 0.36 g,CO2的质量为 0.88 g,装置 E的作用是 防止空气中的水蒸气和二氧化碳被 D装置吸收 。 【实验结论】 在 xFeCO3•yFe(HO)2•zH2O中,氢原子与氧原子的个数之比为 4:3 。 【实验反思】 (1)装置 A的作用是 除去空气中的水和二氧化碳 。 (2)实验结束后,装置 B中的残留固体可能全部是 FeO.也可能全部是 Fe3O4.还可能是 FeO、Fe3O4 。 (3)为了得到装置 B中残留固体的组成,华雪同学称得装置 B中残留固体质量为 2.24g 后,通过计算可知:残留固体的组成及各成分的质量为 FeO和 Fe3O4质量分别为 1.08g 和 1.16g 。 【解答】解:【实验步骤】 (1)检查装置的气密性后,准备称取 3.40g碱式碳酸亚铁粉末放在装置 B中,连接仪器。 故填:气密性。 (2)打开弹簧夹 K,鼓入一段时间空气,准确称量装置 C、D、E的质量。 故填:打开弹簧夹 K。 (3)关闭弹簧夹 K,加热装置 B至装置 C中导管末端无气泡冒出,再打开弹簧夹 K,缓 缓通空气一段时间,这样操作的目的是使 B中分解生成的二氧化碳和水蒸气全部被 D、C 装置吸收。 故填:使 B中分解生成的二氧化碳和水蒸气全部被 D、C装置吸收。 (4)再次准确称量装置 C、D、E的质量,所得数据如下 21 (5)分析表中数据可知:3.40g 碱式碳酸亚铁受热分解过程中生成 H2O 的质量为: 200.36g﹣200.00g=0.36g,CO2的质量为:180.88g﹣180.00g=0.88g,装置 E的作用是 防止空气中的水蒸气和二氧化碳被 D装置吸收。 故填:0.36;0.88;防止空气中的水蒸气和二氧化碳被 D装置吸收。 【实验结论】 在 xFeCO3•yFe(HO)2•zH2O中,氢元素质量:0.36g×=0.04g,氧元素质量:(0.36g﹣ 0.04g)+0.88g×+(3.40g﹣0.36g﹣0.88g)×=0.48g,氢原子与氧原子的个数之比 为::=4:3。 故填:4:3。 【实验反思】 (1)装置 A的作用是除去空气中的水和二氧化碳。 故填:除去空气中的水和二氧化碳。 (2)实验结束后,装置 B中的残留固体可能全部是 FeO,也可能全部是 Fe3O4.还可能是 FeO、Fe3O4。 故填:FeO、Fe3O4。 (3)如果残留固体是氧化亚铁,则氧化亚铁质量:3.40g﹣0.36g﹣0.88g=2.16g, 如果残留固体是四氧化三铁,则四氧化三铁质量:2.16g×÷=2.32g, 称得装置 B中残留固体质量为 2.24g,大于 2.16g,小于 2.32g,通过计算可知:残留固 体是氧化亚铁和四氧化三铁的混合物; 设氧化亚铁质量为 x,则四氧化三铁质量为 2.24g﹣x, 根据题意有:x×+(2.24g﹣x)×=2.16g×, x=1.08g,则四氧化三铁质量:2.24g﹣1.08g=1.16g, 故填:FeO和 Fe3O4质量分别为 1.08g和 1.16g。 五、计算题(2小题,共 10分) 28.(4分)超市购物小票上含有 BPA(双酚 A),网上流传消费者接触小票会致癌。我国规 定:超市购物小票上双酚 A的含量应不超过 0.6mg/Kg.按照这个标准,收银员即使每天 接触小票 10个小时,双酚 A通过接触进入人体的量也不会比安全剂量低几十倍。因此, 普通消费者一天接触几张购物小票,致癌概率是完全可以忽略不计的。 (1)双酚 A的化学式为 C15H16O2,其相对分子质量为 228 。 (2)若每张超市购物小票的质量为 5g,则其中含有双酚 A的质量应不能超过 0.003 22 mg才能符合国家标准。 【解答】解:(1)双酚 A的相对分子质量为 12×15+1×16+16×2=228。 (2)超市购物小票上双酚 A的含量应不超过 0.6mg/Kg,若每张超市购物小票的质量为 5g, 则其中含有双酚 A的质量应不能超过 0.6mg=0.003mg。 故答案为: (1)228; (2)0.003。 29.(6分)在锥形瓶中加入 80.0g质量分数为 10%的硫酸铜溶液,塞好橡胶塞。将几根铁钉 用砂纸打磨干净后在天平上称得质量为 56.0g,再将盛有硫酸铜溶液的锥形瓶和铁钉一起 放在天平上称量,记录所称得质量 m1.将上述铁钉浸到硫酸铜溶液中,待反应一段时间 后溶液颜色改变时,将盛有硫酸铜溶液和锥形瓶放在天平上称量,记录所称的质量为 m2。 (1)m1 = m2(填“>”或“=”或“<”)。 (2)锥形瓶的质量为 m1﹣136g(或 m2﹣136g) (用含 m1或 m2的代数式表示)。 (3)若硫酸铜反应完全,求此时所得溶液的质量(写出计算结果)。 【解答】解:(1)m1=m2。 故填:=。 (2)锥形瓶的质量为:m1﹣(56.0g+80.0g)=m1﹣136g,或 m2﹣(56.0g+80.0g)=m2﹣ 136g, 故填:m1﹣136g(或 m2﹣136g)。 (3)设反应的铁的质量为 x,生成铜质量为 y, Fe+CuSO4═FeSO4+Cu, 56 x160 64 80.0g×10% y==, x=2.8g,y=3.2g, 若硫酸铜反应完全,此时所得溶液的质量:80.0g+2.8g﹣3.2g=79.6g, 答:若硫酸铜反应完全,此时所得溶液的质量是 79.6g。 23 24
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





