


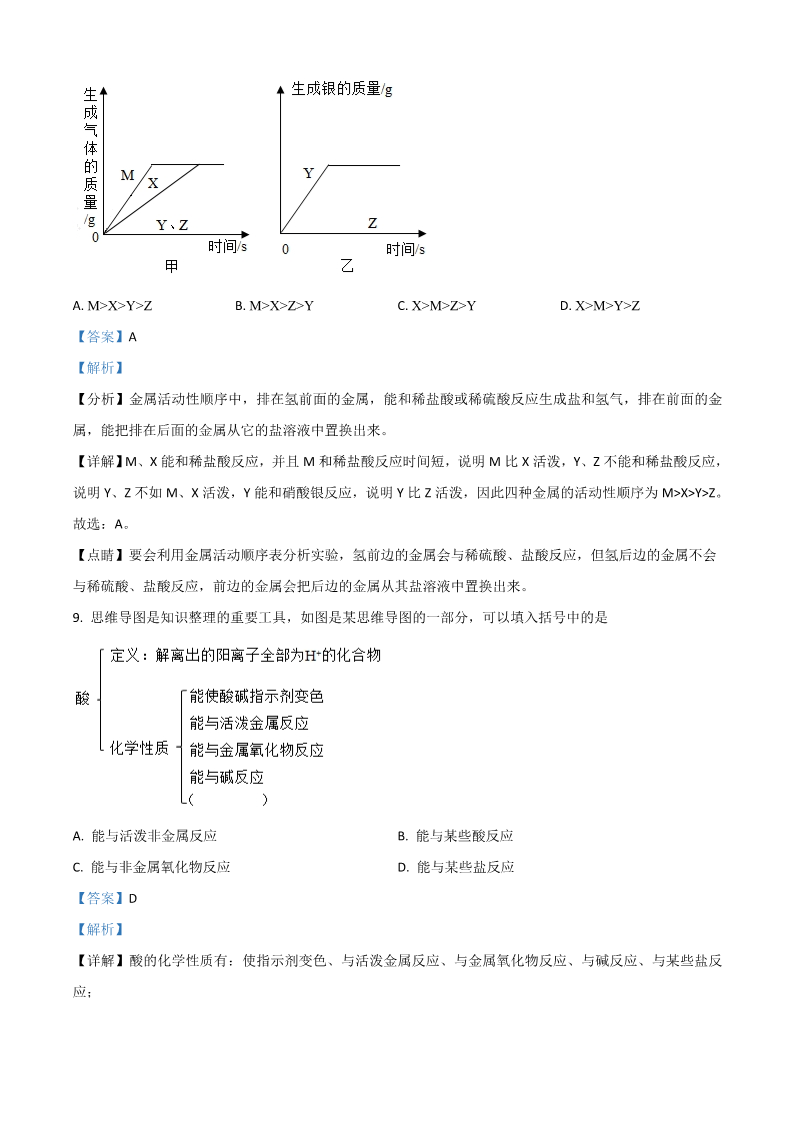

化学试题 可能用到的相对原子质量:H-1 O-16 Si-28 S-32 Na-23 Ca-40 Cu-64 三、选择题(本题共 12 小题,每小题 2 分,共 24 分。在每个小题给出的四个选项中,只有一 项是符合题目要求的。) 1. 下列诗句中不涉及化学变化的是 千锤万凿出深山 A. B. D. 化作春泥更护花 爆竹声中一岁除 C. 蜡炬成灰泪始干 A【答案】 【解析】 A【详解】 、千锤万凿出深山只是物质形状的变化,没有生成新物质,物理变化; 、化作春泥更护花,涉及物质的腐败,生成新物质,化学变化; 、蜡炬成灰泪始干,蜡烛燃烧生成二氧化碳和水,化学变化; BCD、爆竹声中一岁除,涉及燃烧、爆炸,化学变化。 A故选 。 2. 化学与我们的生活息息相关下列说法错误的是 缺钙会导致骨质疏松 A. B. D. 贫血的人补充的铁越多越好 吃水果蔬菜可以补充维生素 C. 人体所需的热量主要来自糖类 B【答案】 【解析】 A【详解】 、老年人缺钙会导致骨质疏松,幼儿及青少年缺钙会患佝偻病,不符合题意; BC、贫血可补充铁元素,但是不是越多越好,应适量,符合题意; 、人体所需的热量主要来自于糖类,糖类是主要的供能物质,不符合题意; D、水果、蔬菜富含维生素,不符合题意。 B故选 。 3. 下列物质按照混合物、碱、氧化物顺序排列的是 冰水混合物、苛性钠、二氧化锰 食盐水、纯碱、干冰 A. B. D. 液化石油气、熟石灰、二氧化硫 天然气、氢氧化钾、大理石 C. B【答案】 【解析】 AA【详解】 、冰水混合物,属于纯净物,错误。 B、液化石油气含有多种物质属于混合物,熟石灰是氢氧化钙属于碱,二氧化锰两种元素组成且含有氧元素, B属于氧化物, 正确。 CC、纯碱是碳酸钠,属于盐, 错误。 DD、大理石主要成分是碳酸钙,大理石属于混合物, 错误。 B故选: 。 4. A. 下列有关化学用语的说法正确的是 -B. D. 2N2 表示 4 个氮原子 Cl 中的“-”表示氯元素的化合价为-1 价 C. CO32- 表示一个碳酸根 H 既可以表示氢元素,也可以表示一个氢原子 D【答案】 【解析】 A2N 2【详解】 、化学式前面的数字表示分子个数,故2 表示 个氮分子,不符合题意; BCl- 、位于离子符号中元素或原子团的右上角,表示一个离子所带的电荷数。故 中的表示 个氯离子带 “-” 11个单位的负电荷,不符合题意; CCO2 1表示 个碳酸根离子,不符合题意; 、3DH1、 可以表示氢元素,也可以表示 个氢原子,符合题意。 D故选 。 5. 下列有关空气的说法错误的是 A. B. D. 氮气是制造氮肥的重要原料 氧气约占空气体积的 21% C. 空气中稀有气体所占比例虽小但用途广泛 空气污染不会造成臭氧层空洞 D【答案】 【解析】 A【详解】 、氮气是制造氮肥的重要原料,故选项说法正确; BC21% ,故选项说法正确; 、氧气约占空气体积的 、空气中稀有气体所占比例虽小但用途广泛,故选项说法正确; D、臭氧层空洞主要是应为冰箱等冷藏装置使用了氟化物作为制冷剂,氟化物会与臭氧反应,使它分解为氧 气,会造成臭氧层空洞,故选项说法错误。 D故选: 。 6. 下列反应的化学方程式书写正确的是 高温 Fe O +3CO 2Fe+3CO2 A. 高炉炼铁: 232Fe+6HCl=2FeCl +3H B. C. D. 盐酸除铁锈: 32Na CO +2HCl=2NaCl+H O+ CO 小苏打治疗胃酸过多: 23222Al+3O =Al O 3铝制品耐腐蚀: 22A【答案】 【解析】 【分析】 高温 Fe O +3CO 2Fe+3CO 2 ,A 正确。 【详解】A、高炉炼铁: 23Fe O +6HCl=2FeCl +3H O B、铁锈主要成分是氧化铁,化学方程式 ,B 错误。 2332NaHCO +HCl=NaCl+H O+ CO C、小苏打是碳酸氢钠,化学方程式 ,C 错误。 3224Al+3O =2Al O D、铝和氧气反应生成氧化铝, 故选:A。 3 ,D 错误。 22的下列对宏观事实 解释错误的是 7. A. 品红在热水中扩散的更快—温度升高,分子运动加快 B. 铁在空气中只发生红热现象,在氧气中剧烈燃烧—氧气含量不同 C. 一氧化碳和二氧化碳化学性质不同—原子种类不同,性质不同 D. 明矾可以净水—生成的胶状物能吸附杂质 C【答案】 【解析】 A【详解】 、品红在热水中扩散的更快是因为温度升高,分子运动加快,正确; BC、铁在空气中只发生红热现象,在氧气中剧烈燃烧是因为氧气含量不同,氧气浓度越大反应越剧烈,正确; 、分子是保持物质化学性质的最小粒子;一氧化碳和二氧化碳化学性质不同是因为分子种类不同,化学性 质不同,错误; D、明矾可以净水是因为生成的胶状物能吸附杂质,正确。 C故选 。 8. 将足量 X、Y、Z、M 四种金属分别投入等质量、等质量分数的稀盐酸中(反应关系如图甲),把金属 Y、Z 分别投入硝酸银溶液中(反应关系如图乙),据此判断 X、Y、Z、M 的金属活动性顺序是 A. B. C. D. X>M>Y>Z M>X>Y>Z M>X>Z>Y X>M>Z>Y A【答案】 【解析】 【分析】金属活动性顺序中,排在氢前面的金属,能和稀盐酸或稀硫酸反应生成盐和氢气,排在前面的金 属,能把排在后面的金属从它的盐溶液中置换出来。 M【详解】 、 能和稀盐酸反应,并且和稀盐酸反应时间短,说明 XMMXY Z 比活泼, 、不能和稀盐酸反应, M>X>Y>Z 。YZMXY说明 、 不如、 活泼, 能和硝酸银反应,说明 YZ比 活泼,因此四种金属的活动性顺序为 A故选: 。 【点睛】要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会 与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来。 9. 思维导图是知识整理的重要工具,如图是某思维导图的一部分,可以填入括号中的是 A. B. D. 能与活泼非金属反应 能与某些酸反应 能与某些盐反应 C. 能与非金属氧化物反应 D【答案】 【解析】 【详解】酸的化学性质有:使指示剂变色、与活泼金属反应、与金属氧化物反应、与碱反应、与某些盐反 应; D故选 。10. 下列实验操作正确的是 A. B. D. 浓硫酸稀释 液体读数 C. 收集氢气 熄灭酒精灯 C【答案】 【解析】 A【详解】 、浓硫酸的稀释,将浓硫酸沿烧杯壁缓慢加入到水中,并用玻璃棒不断搅拌,故操作错误; BC、用量筒量取液体,读数时视线与凹液面最低处平行,故操作错误; 、根据氢气密度比空气小,用该装置收集氢气时应从短管通入,故操作正确; D、熄灭酒精灯时,要用灯帽盖灭,不可用嘴吹,故操作错误; C故择 ; 的下列常见物质 除杂方法错误的是 11. 选项 A物质 杂质 所用方法 二氧化碳 氯化钠 氯酸钾 氧化钙 一氧化碳 硝酸钾 氯化钾 碳酸钙 通过灼热的氧化铜 加水溶解,蒸发结晶 加水溶解,过滤 高温煅烧 BCDA. B. C. D. DABCC【答案】 【解析】 【分析】根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时 ①被提纯物质不得改变。除杂质题至少要满足两个条件: 加入的试剂只能与杂质反应,不能与原物质反应; ②反应后不能引入新的杂质。 ACO 【详解】 、能与灼热的氧化铜反应生成铜和二氧化碳,符合除杂原则,故选项所采取的方法正确; B、硝酸钾的溶解度随温度的升高而增大,且变化较大,所以用冷却热饱和溶液的结晶方法,氯化钠的溶解 .度随温度的升高而增大,但变化不大,所以用蒸发溶剂的结晶方法,当两种混合,谁多用谁的方法 现在氯 化钠较多,所以蒸发结晶方法,故选项所采取的方法正确; C、氯化钾和氯酸钾都是易溶于水的白色固体,不能鉴别,故选项所采取的方法错误; D、高温煅烧反而会将碳酸钙变成氧化钙,符合除杂原则,故选项所采取的方法正确。 C故选: 。 【点睛】 12. “归纳推理”是化学学习过程中常用的思维方法,以下类推结果正确的是 单质是由同种元素组成,则由同种元素组成的物质都是单质 碳酸钙能与盐酸反应生成二氧化碳,则碳酸钠也能与盐酸反应生成二氧化碳 石墨能够导电,则由碳元素组成的金刚石也能导电 A. B. C. D. 堆放杂物的纸箱着火可用水浇灭,则所有物质着火都可用水浇灭 B【答案】 【解析】 A【详解】 、单质是由同种元素组成,由同种元素组成的物质不都是单质,例如氧气和臭氧组成的混合物, 错误; BC、碳酸钙能与盐酸反应生成二氧化碳,则碳酸钠也能与盐酸反应生成二氧化碳,正确; 、石墨能够导电,而由碳元素组成的金刚石不能导电,因为两者碳原子的排列方式不同,错误; D、堆放杂物的纸箱着火可用水浇灭,不是所有物质着火都可用水浇灭,例如电器着火,错误。 B故选 。二、非选择题(共 7 小题,共 36 分) 13. 阅读材料,回答下列问题。 绿色环保汽车 2021 年两会期间,我国提出 2030 年前实现“碳达峰”,2060 年前实现“碳中和”。目前汽车普遍使用的燃料是 汽油和煤油,不仅产生大量二氧化碳,还因燃烧不充分释放了一氧化碳、颗粒物以及氮氧化物等有害物质, 既造成资源浪费,污染环境。开发能够取代汽油的新能源,生产和使用环保型、零污染的绿色汽车是实现“碳 中和”的有效措施。 发展绿色环保汽车,主要有以下途径: 一是改进现有车型:采用铝合金、钛合金、塑料等轻量化材料,为汽车“减肥”,从而降低然油消耗;改进发 动机的燃烧方式,使汽油能充分燃烧;使用催化净化装置,将尾气中的有害物质转化为无害物质再排放等。 二是开发汽车代用燃料,主要包括天然气、乙醇、生物柴油、氢气等,实现能源多元化。三是大力发展电 动汽车。电动汽车具有效率高,在使用地点“零排放”的特点,尤其是氢燃料电池汽车,受到人们的广泛关注。 开发利用电动汽车已成为发展绿色环保汽车的重要途径。 _______ (1)汽车尾气中的 (2)铝合金的硬度一般比纯铝的硬度 _______ (A 一氧化碳 B 氮氧化物)会造成酸雨。 _______ (A 大 B 小)。 (A 天然气 B 乙醇)。 _______ (3)属于可再生能源的是 (4)属于有机合成材料的是 (5)氢气被认为是最理想的清洁燃料的原因是 (A 生物柴油 B 塑料)。 _______ 。(1). (2). (3). (4). (5). 热值高,产物是水无污染 【答案】 【解析】 【分析】 BABB【详解】(1)氮氧化物和水生成硝酸,形成硝酸型酸雨,故选:B。 (2)合金硬度大于纯金属,故填:A。 (3)煤、石油、天然气属于化石能源,不可再生能源,乙醇属于可再生能演,故选:B。 (4)生物柴油属于燃料,塑料属于有机合成材料,故选:B。 (5)氢气燃烧产物是水,且氢气燃烧热值高,故被称为最理想的清洁燃料,故填:热值高,产物是水无污 染。 14. 溶液在生产、生活中起着十分重要的作用。请回答(1)-(2)题。 (1)如图,在木块上滴几滴水,将装有某种固体的大烧杯放置于木块上,向大烧杯中加水进搅拌,结果木块 上的水结冰了,则大烧杯内的固体可能是_______。 A 氯化钠 (2)用汽油或加了洗涤剂的水都能除去衣服上的油污,两者去油污的原理分别是_______。 A 乳化、乳化 B 乳化、溶解 C 溶解、乳化 D 溶解、溶解 如图是甲、乙、丙三种固体物质的溶解度曲线。请回答(3)(4)题。 B 硝酸铵 C 氢氧化钠 D 蔗糖 (3)现有 t1℃时甲乙、丙三种物质的饱和溶液,将这三种溶液分别升温到 t2℃,所得溶液中溶质质量分数大小 关系是_______。 A 甲=乙>丙 B 乙>甲=丙 C 乙>甲>丙 D 甲>乙>丙 (4)为了将近饱和的丙溶液变为饱和溶液,可采用的方法有_______(有 2-3 个选项符合题意)。 A 加固体丙 【答案】 【解析】 【分析】 B 加水 (2). C 降低温度 (3). D 蒸发浓缩 (1). (4). AD BCC【详解】(1)大烧杯中加水搅拌,结果木块上的水结冰了,说明溶解吸热,则大烧杯内的固体可能是硝酸 铵,硝酸铵溶解吸热,故填:B。 (2)汽油去除油污,属于溶解,洗涤剂含有表面活性剂去除油污属于乳化,故选:C。 (3)t1℃时溶解度乙>甲=丙,故饱和溶液溶质质量分数乙>甲=丙,有 t1℃时甲乙、丙三种物质的饱和溶液, 将这三种溶液分别升温到 t2℃,甲乙溶解度变大,变为不饱和溶液,溶质质量分数不变,丙溶解度减小溶质 结晶析出,溶质质量分数减小,升温到 t2℃所得溶液中溶质质量分数大小乙>甲>丙,故选:C。 (4)丙温度升高溶解度减小,为了将近饱和的丙溶液变为饱和溶液,可采用的方法有增加溶质,蒸发溶剂, 或升高温度,故选:AD。 15. 单质硫、硫化氢燃烧时会生成同种有毒的气体。请回答下列问题。 (1)如图是硫原子的结构示意图,其中 x=___,在化学反应中该原子容易___(“得到”或“失去”)电子。 硫化氢在空气中燃烧的微观示意图如下: (2)硫化氢中硫元素的化合价是_______。 (3)生成的有毒气体中各元素的质量比为_______。 (4)写出上述反应的化学方程式_______。 点燃 2H2S+3O2 (5). 2SO2 +2H2O (1). 8 (2). (3). -2 (4). 1:1 【答案】 【解析】 得到 1=16=2+x+6 x=8 【详解】( )在原子中,质子数 核外电子数,故, ; 64硫原子的最外层电子数为 ,大于 ,在化学反应中,容易得到电子; 221( )由图可知,每个硫化氢分子由个氢原子和 个硫原子构成,故硫化氢的化学式为:,硫化氢中 H S 2+1 +1×2+x=0 x氢元素显 价,设硫元素的化合价为,根据化合物中,正、负化合价的代数和为零,可得:( ), x=-2 ;3SO( )生成的有毒气体是二氧化硫,二氧化硫中、 元素的质量比为: :( 32 16×2=1:1 );4( )由图可知,该反应为硫化氢和氧气在点燃的条件下反应生成二氧化硫和水,该反应的化学方程式为: 点燃 2H2S+3O2 2SO +2H O 。2 2 16. 下图是实验室常用的实验装置,请回答下列问题。 _______ (1)图中仪器 a 的名称为 。_______ (2)若用装置 B 制取氧气,相应反应的化学方程式为 ,若用此法制备并收集干燥的氧气,则装置的连 _______ _______ 接顺序为 B→ →。(3)实验室用装置 A、F 进行碳还原氧化铜的实验,为了检验反应的产物,装置 F 中应盛放的试剂是 _______ _______ 。,反应过程中该装置内的现象为 MnO 2H2O2 2 O2 +2H2O (1). (2). (3). (4). (5). 澄清石灰水 【答案】 锥形瓶 FD(6). 变浑浊 【解析】 【详解】(1)图中仪器 a 的名称为锥形瓶。 (2)若用装置 B 制取氧气,反应为固液不加热反应,过氧化氢在二氧化锰催化作用下生成氧气和水, MnO 2H2O2 2 O +2H O ;氧气密度大于空气,向上排空气法收集的气体较干燥,故收集装置选择 D; 22若用此法制备并收集干燥的氧气,需要首先将生成气体通过盛有浓硫酸干燥剂的装置 F 干燥(氧气长进短出, 从左端导管进入),再收集,故装置的连接顺序为 B→F→D。 (3)实验室用装置 A、F 进行碳还原氧化铜的实验,反应生成二氧化碳气体,二氧化碳能使澄清石灰水变浑 浊,故为了检验反应的产物,装置 F 中应盛放的试剂是澄清石灰水,反应过程中该装置内的现象为溶液变 浑浊。 17. 某班同学在做“某些酸、碱、盐之间是否发生反应”的探究实验时发现,酸碱之间的反应,往往没有明 显的现象。那么如何判断酸碱发生了化学反应呢? 【提出问题】如何判断酸、碱溶液发生了化学反应? 【实验药品】一定质量分数的稀盐酸、一定质量分数的氢氧化钠溶液(稀)、酚酞溶液、蒸馏水 【实验探究】 (1)甲小组在烧杯中加入 50mL 氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入稀盐酸,发现_______(填 现象),证明氢氧化钠溶液与稀盐酸发生了化学反应,该反应的化学方程式为_______。 (2)乙小组进行了以下三个实验,并用温度传感器测定实验过程中的温度变化情况,得到了如下图所示的三 条曲线。 实验 1:50mL 稀盐酸与 50mL 氢氧化钠溶液混合(曲线 a); 实验 2:50mL 稀盐酸与 50mL 蒸馏水混合(曲线 b); 实验 3:50mL 氢氧化钠溶液与 50mL 蒸馏水混合(曲线 c)。 结合实验目的分析,增加实验 2、实验 3 的目的是_______。 对比三条曲线,可以得到如下结论:①氢氧化钠溶液和稀盐酸一定发生了化学反应。②酸碱中和反应是 _______反应(填“放热”或“吸热”)。 【交流与反思】 (3)甲小组认为,通过实验探究(2)得出“中和反应是放热反应”的结论不严谨,应该补充_______实验。 (1). (2). (3). 【答案】 溶液先变为红色,后变为无色 NaOH+HCl=NaCl+H2O (4). (5). 盐酸、氢氧化钠溶 液稀释时也会放出少量热,通过对比可证明中和反应放热 放热 一个其他酸和碱发生的中和 反应 【解析】 【分析】 【详解】[实验探究] (1)甲小组在烧杯中加入 50mL 氢氧化钠溶液,滴入几滴酚酞溶液,氢氧化钠溶液呈碱性,能使酚酞变红, 用滴管慢慢滴入稀盐酸,因为生成的氯化钠呈中性,酚酞在中性时呈无色,所以当氢氧化钠完全反应时, 溶液就会由红色变为无色,故整个实验中观察到的现象是:溶液先变为红色,后变为无色,该现象证明氢 氧化钠溶液与稀盐酸发生了化学反应。氢氧化钠和盐酸反应生成氯化钠和水,化学方程式为: NaOH+HCl=NaCl+H2O。 (2)乙小组进行了三个实验,并用温度传感器测定实验过程中的温度变化情况,得到了题中所示的三条曲线。 因为实验目的是通过中和反应时放出热量,从而判断酸、碱溶液发生了化学反应,所以增加实验 2、实验 3 的目的是:盐酸、氢氧化钠溶液稀释时也会放出少量热,通过对比可证明中和反应放热。 对比三条曲线可知,实验 1 中 20 多秒后溶液的温度达到最高 24℃,此时反应结束,而实验 2、实验 3 中最 高温度都低于 22℃,因此可得到的结论②是:酸碱中和反应是放热反应。 [交流与反思] (3)因为氢氧化钠和盐酸反应只是中和反应中的一个,不具有普遍意义,所以通过实验探究(2)得出“中和反 应是放热反应”的结论不严谨,应该补充一个其他酸和碱发生的中和反应实验(如稀硫酸和氢氧化钾的反 应)。如果通过补充实验也得出反应中放热的结果,就能得出“中和反应是放热反应”的结论。 18. 以黄铜矿(主要成分为 CuFeS2)为原料,采用生物炼铜是现代炼铜的新工艺,同时还可以获得绿矾 (FeSO4﹒7H2O),流程如下: 耐酸铜细菌 4 CuFeS+17O +2H SO 4CuSO +2Fe SO+_____ 2 4 (1)步骤①中的化学方程式: 。222443____ Fe+Fe ( SO ) =3FeSO (2)步骤②中的反应有两个:反应一是 4 ,该反应属于_______(填基本反应类型),反 24 3 应二的化学方程式为_______。 (3)加入的 A 是_______(填化学式)。 (4)获得绿矾的“一系列操作”为:蒸发浓缩、_______、过滤等。 Fe+CuSO4 =FeSO4 +Cu (1). (2). (3). (4). (5). 降温结 【答案】 2H2O 化合反应 H2SO4 晶【解析】 【详解】(1)化学反应前后原子种类数目不变,反应前铜、铁、硫、氧、氢原子数目分别为 4、4、10、42、 4,反应后铜、铁、硫、氧、氢原子数目分别为 4、4、10、40、0,故空格填:2H2O。 Fe+Fe ( SO ) =3FeSO (2) 反应 4 符合多变一特点,属于化合反应;由(1)分析可知,步骤①中得到硫酸铜, 24 3 Fe+CuSO =FeSO +Cu 加入过量铁粉,会发生反应二:铁和硫酸铜生成铜和硫酸亚铁, 。44(3)加入的 A 后分离出铜,得到溶液最终制得绿矾,故 A 为硫酸 H2SO4。 (4)获得绿矾的“一系列操作”为:蒸发浓缩、降温结晶、过滤等。 19. 取一氧化碳还原氧化铜实验的固体残留物 20g,向其中加入稀硫酸,剩余固体质量与加入稀硫酸质量关 系如图所示,请回答下列问题。 (1)所取固体残留物中铜的质量为_______g。 (2)求 a 点处溶液中溶质的质量分数(写出计算过程)。 【答案】①17.5g ②解:设反应生成的硫酸铜的质量为 x。 CuO+H2SO4 =CuSO4 +H2O 80 160 2.5g x80 2.5g 160 xx=5g a 点时溶液的总质量为:37.5g+(20g-17.5g)=40g 则 a 点溶液中溶质的质量分数为: 5g 100%=12.5% 40g a答: 点溶液中溶质的质量分数为 12.5% 。【解析】 【详解】(1) 一氧化碳还原氧化铜实验的固体残留物中有铜和氧化铜,加入过量的稀硫酸,氧化铜和稀硫酸 反应,铜不反应,则剩余的固体质量就是铜的质量,故填 17.5g; (2)详解见答案;
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





