

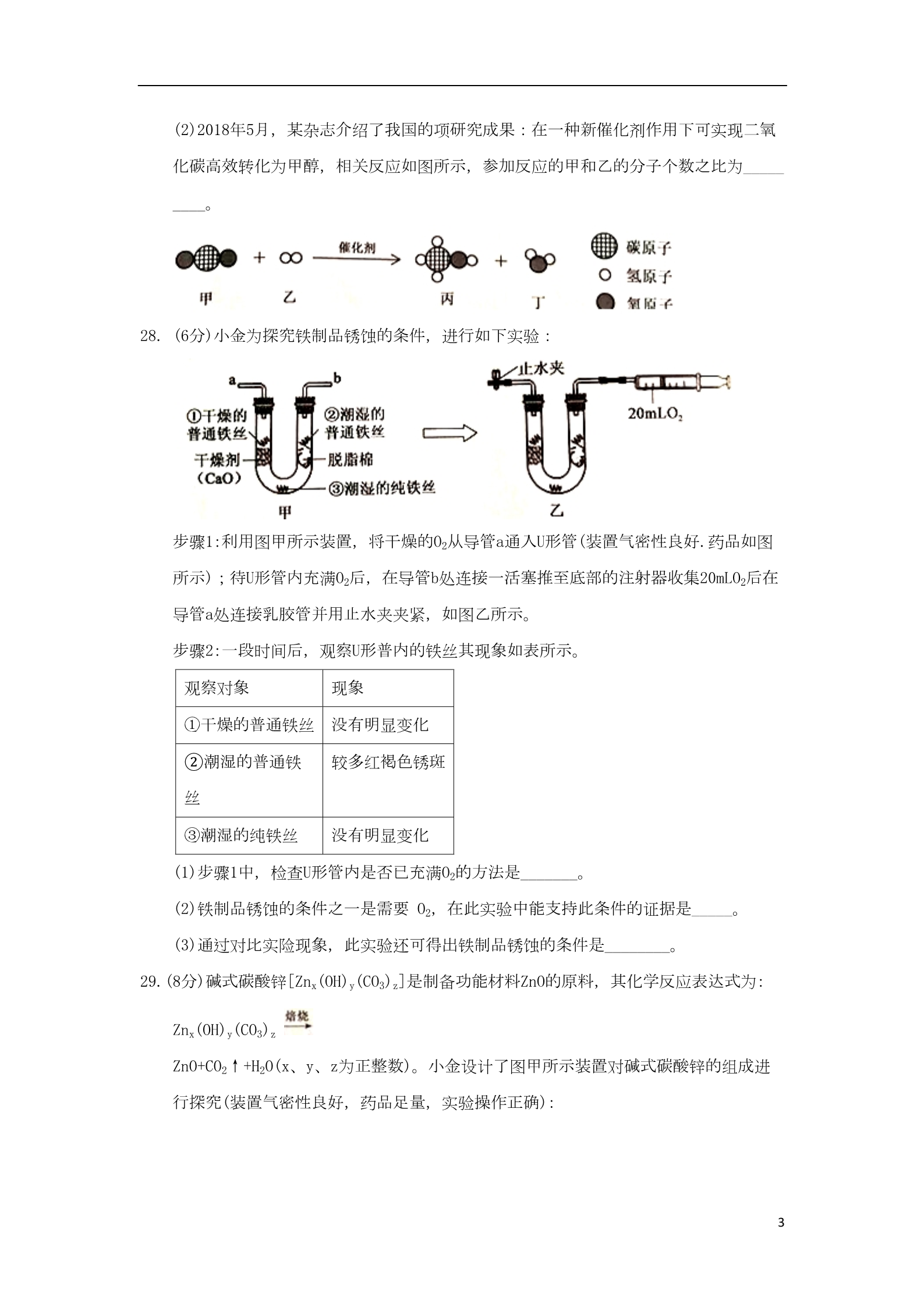
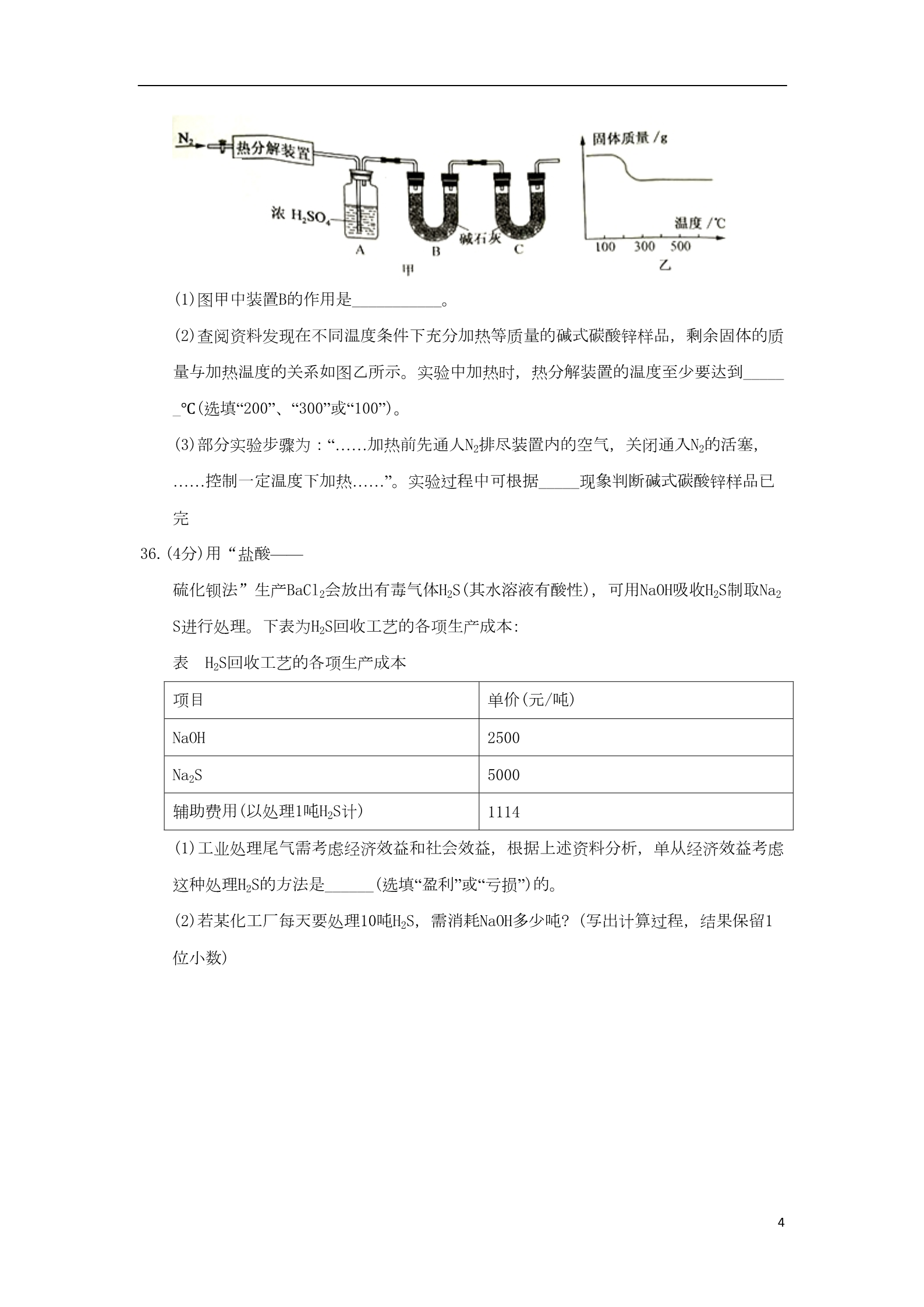

浙江省杭州市2018年中考化学真题试题 1.南京理工大学胡炳成团队用新方法制得了NaN5·3H2O.该化合物中含有N5- 等微粒。已知N为7号元素,则下列有关说法正确的是 A. N5-是一种单质 B.1个N5-带1个单位的正电荷 D.1个N5-中共含有35个电子 C.1个N5-中共含有35个质子 2.一种用软锰矿(主要成分是MnO2)制备KMnO4的工艺中主要涉及下列反应: △①2MnO2+O2+ 4KOH 2K2MnO4+ 2H2O ②2K2MnO4+2H2O==2KMnO4+2KOH+H2↑ 下列有关说法正确的是 A. K2MnO4中锰元素显十7价 C.反应②属于复分解反应 B. KMnO4属于盐类物质 D.该制法中K2MnO4是主要原料 10.右图为氢气还原氧化铜的实验装置图,下列有关分析正确的是 A.装置中试管口需略向下倾斜,主要是为了利于通入氢气 B.在给试管内药品加热前,需先通氢气排尽试管内的空气 C.待药品完全反应后,需同时撤去酒精灯和通氢气的导管 D.该实验装置也可直接用于一氧化碳还原氧化铜的实验 116.小金在做硫燃烧实验时,进行了如下操作:①在铺有细沙的燃烧匙里放入少量硫;② 将燃烧匙在酒精灯火焰上加热,直至硫燃烧;③将燃烧匙伸入盛有氧气的集气瓶中(集 气瓶内盛有滴加紫色石装试液的少量水)。实验中可观察到的现象与结论不符合的是 A.对比①和②可说明硫燃烧需要达到一定的温度 B.对比②和③中硫的燃烧现象说明氧气具有助燃性 C.在③中观察到紫色石蕊试液变红,说明硫燃烧是化学变化 D.在③中观察到紫色石蕊试液变红,说明硫燃烧产物是一种酸 19.小金做了如下实验:将4.2克铁粉和4.0克氧化铜粉末均匀混合,然后一次性投入盛有200 克9.8%稀硫酸的大烧杯中。观察到如下现象:立即出现红色固体,前阶段没有明显的气 泡产生,后阶段产生大量无色气泡,充分反应后上层清液是浅绿色。由此小金作出下 列判断,其中不合理的是 A.“立即出现红色固体”是由于很快发生了如下转化:CuO CuSO4 Cu B.“产生大量无色气泡”是由于发生了如下反应:Fe+ H2SO4=FeSO4+H2↑ C.该实验条件下,硫酸铜比稀硫酸更容易跟铁粉发生反应 D.在不同浓度的硫酸铜和稀疏酸的混合溶液中投入铁粉,都是硫酸铜先跟铁粉反应 23.(4分)某化工厂利用含有1% – 2%BaCO3的废料制取BaCl2(废料中其他物质不溶于水和稀盐酸、且不与稀盐酸反应)。 其部分流程如下: 滤渣必须经过充分洗涤,确保其中Ba2+含最达到规定标准才能作为固体度弃物处理, 检验Ba2+的试剂可用______,洗涤滤渣的主要目的是________。 24.(4分)CO2的转化和利用是一个热门的研究课题。回答下列相关问题: (1)2016年我国科研人员研制出一种“可呼吸CO2”的电池,放电时该电池“吸收CO,2” ,充电时该电池“放出CO2”。放电时,金属钠和CO2发生置换反应生成一种非金属单质 和一种常见的盐,写出此反应的化学方程式_________。 2(2)2018年5月,某杂志介绍了我国的项研究成果:在一种新催化剂作用下可实现二氧 化碳高效转化为甲醇,相关反应如图所示,参加反应的甲和乙的分子个数之比为_____ ____。 28. (6分)小金为探究铁制品锈蚀的条件,进行如下实验: 步骤1:利用图甲所示装置,将干燥的O2从导管a通入U形管(装置气密性良好.药品如图 所示);待U形管内充满O2后,在导管b处连接一活塞推至底部的注射器收集20mLO2后在 导管a处连接乳胶管并用止水夹夹紧,如图乙所示。 步骤2:一段时间后,观察U形普内的铁丝其现象如表所示。 观察对象 现象 ①干燥的普通铁丝 没有明显变化 ②潮湿的普通铁 较多红褐色锈斑 没有明显变化 丝③潮湿的纯铁丝 (1)步骤1中,检查U形管内是否已充满O2的方法是_______。 (2)铁制品锈蚀的条件之一是需要 O2,在此实验中能支持此条件的证据是_____。 (3)通过对比实险现象,此实验还可得出铁制品锈蚀的条件是________。 29.(8分)碱式碳酸锌[Znx(OH)y(CO3)z]是制备功能材料ZnO的原料,其化学反应表达式为: Znx(OH)y(CO3)z ZnO+CO2↑+H2O(x、y、z为正整数)。小金设计了图甲所示装置对碱式碳酸锌的组成进 行探究(装置气密性良好,药品足量,实验操作正确): 3(1)图甲中装置B的作用是___________。 (2)查阅资料发现在不同温度条件下充分加热等质量的碱式碳酸锌样品,剩余固体的质 量与加热温度的关系如图乙所示。实验中加热时,热分解装置的温度至少要达到_____ _℃(选填“200”、“300”或“100”)。 (3)部分实验步骤为:“……加热前先通人N2排尽装置内的空气,关闭通入N2的活塞, ……控制一定温度下加热……”。实验过程中可根据_____现象判断碱式碳酸锌样品已 完36.(4分)用“盐酸—— 硫化钡法”生产BaCl2会放出有毒气体H2S(其水溶液有酸性),可用NaOH吸收H2S制取Na2 S进行处理。下表为H2S回收工艺的各项生产成本: 表 H2S回收工艺的各项生产成本 项目 单价(元/吨) 2500 NaOH Na2S 5000 辅助费用(以处理1吨H2S计) 1114 (1)工业处理尾气需考虑经济效益和社会效益,根据上述资料分析,单从经济效益考虑 这种处理H2S的方法是______(选填“盈利”或“亏损”)的。 (2)若某化工厂每天要处理10吨H2S,需消耗NaOH多少吨? (写出计算过程,结果保留1 位小数) 4参考答案 1C 2B 10B 16D 19D 23.(4分)稀硫酸 防止固体废弃物中可溶性钡盐对环境的污染 24. (4分)(1)4Na+3CO2=2Na2CO3+C (2)1:3 28. (6分) (1)将带火量的木条放置在b导管口.若木条复燃,则证明U形管内已充满O2 (2)观察到注射器活塞向左移动(或注射器内O2体积减少) (3)水分和金属的内部结构 29. (8分) (1)吸收反应生成的CO2;(2)300 (3)一段时间.A装置中的长导管管口不再有气泡冒出;(4)5:6:2 36.(4分) (1)盈利 (2)23.5吨 5
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





