
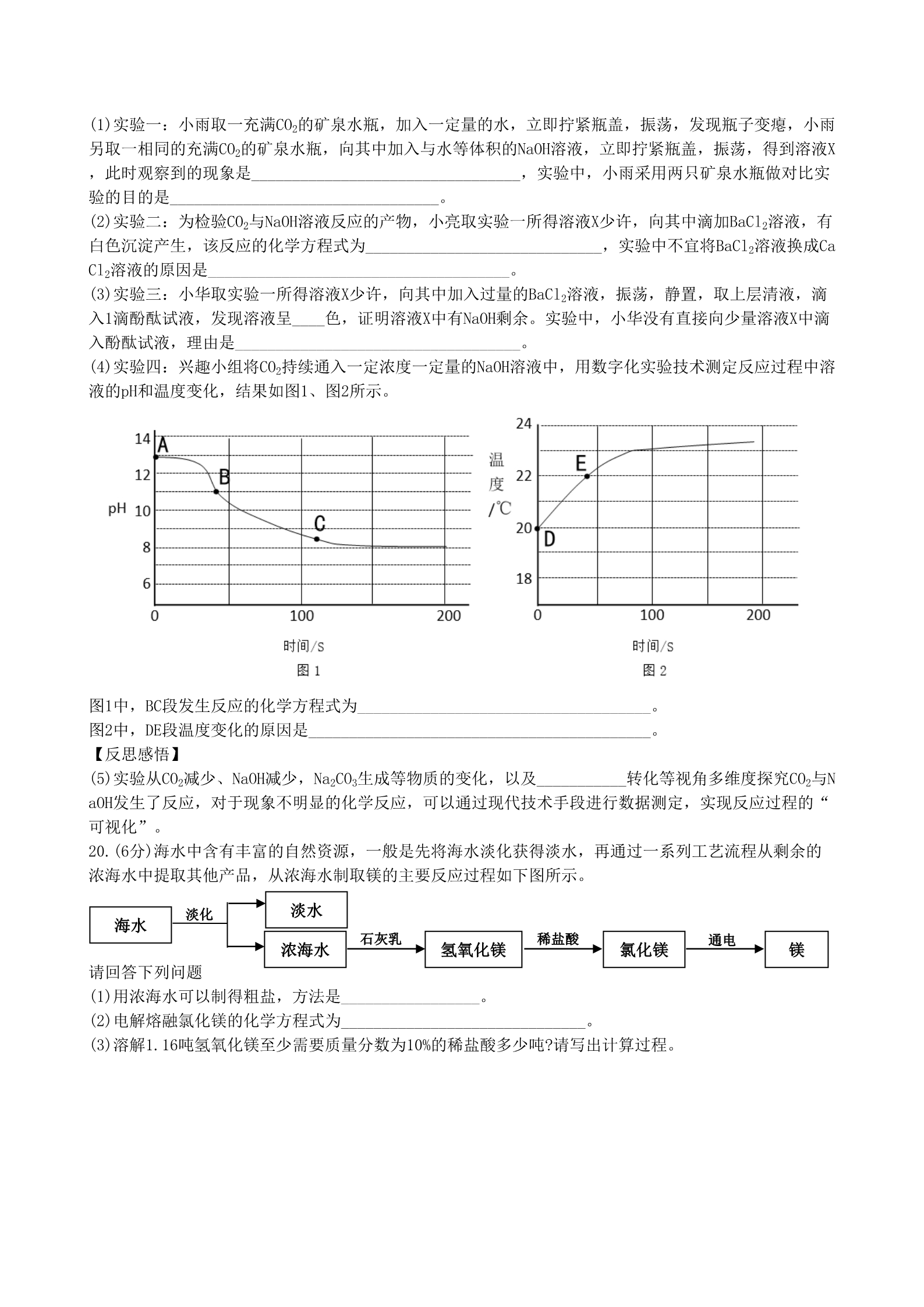

江苏省泰州市2018年中考化学真题试题 (考试时间:化学、物理共150分钟题号范围:化学1~20;物理21~50) (化学满分:60分) 请注意:1.本试卷分选择题和非选择题两个部分 2.答题卡正面为化学学科的答题范围,反面为物理学科的答题范围。所有试题的答案均填写在 答题卡上,答案写在试卷上无效。 可能用到的相对原子质量:H-1 C-12 N—14 O-16 F-19 Mg-24 Cl-35.5 第一部分 选择题(共20分) 第1~10题,每小题只有一个选项符合题意。每小题1分,共10分。 1.习近平总书记提出“绿水青山就是金山银山”的理念,下列做法符合这一理念的有 A.发展清洁能源 B.随意焚烧秸秆 C.乱丢废旧电池 D.提倡毁林造田 2.下列变化属于化学变化的是 A.玻璃破碎 3.下列物质由离子构成的是 A.二氧化碳 B.水 4.下列物质可用作钾肥的是 A.KCl B.NH4HCO3 5.下列厨房用品中,易溶于水形成溶液的是 A.花生油 B.面粉 C.白糖 6.下列物质的用途中,主要利用其物理性质的是 B.石蜡熔化 C.食物腐败 D.汽油挥发 C.金刚石 D.氯化钠 C.(NH4)3PO4 D.Na2SO4 D.辣椒粉 A.用生石灰做干燥剂 C.用铜丝制作导线 B.用氢气制造燃料电池 D.用稀盐酸除去水垢 7.下列实验操作正确的是 毛玻璃片的 粗糙面向下 A.塞紧胶塞 B.贮存氧气 C.过滤 B.2个氢原子:H2 D.吹灭酒精灯 8.下列化学用语表示正确的是 A.钙离子:Ca+2 2- C.氧化钠中氧元素化合价:Na2O D.3个氯分子:3Cl2 9.芯片是内含集成电路的硅片,下图是硅元素在元素周期表中的相关信息,下列说法正确的是 A.硅元素属于金属元素 B.硅元素的原子序数为14 14 Si 硅C.硅元素的相对原子质量为28.09g D.硅元素是地壳中含量最高的元素 28.09 10.下列做法正确的是 A.用肥皂水区分硬水和软水 B.用活性炭净化水就可以得到纯水 C.用酚酞试液区分二氧化碳气体和氯化氢气体 D.用pH试纸测定溶液pH时,应先用蒸馏水将试纸润湿 第11- 15题,每小题有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确得1分;错选得0 分。每小题2分,共10分。 11.化学概念在逻辑上存在如下关系 ⅠⅡⅠⅡⅠ Ⅱ 并列关系 交叉关系 包含关系 下列对概念间相互关系的说法正确的是 A.混合物与纯净物属于交叉关系 B.糖类与淀粉属于并列关系 C.中和反应与复分解反应属于并列关系 D.合成材料与塑料属于包含关系12.C22H19FN4O2为抗癌新药西达苯胺的化学式。下列关于西达苯胺的说法 正确的是 A.西达苯胺是一种有机物 B.西达苯胺由碳、氢、氧、氮四种元素组成 C西达苯胺中碳元素和氮元素的质量比为11:2 D.西达苯胺各元素的质量分数中氧元素的质量分数最小 13.下列对实验意外事故的处理方法错误的是 A.若不慎将稀硫酸溅入眼睛,要先用手揉眼睛,再立即用水冲洗 B.若不慎将烧碱溶液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液 C.若不慎将燃着的酒精灯碰倒,洒出的酒精在桌面上燃烧,应立刻用湿抹布扑盖 D.若不慎将少量浓硫酸沾到皮肤上,应立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液 14.下列有关物质的鉴别、除杂、分离所用的试剂或方法正确的是 选项 实验目的 所用试剂或方法 AgNO3溶液 水ABCD鉴别氯化钾溶液和硫酸钾溶液 鉴别氢氧化钠固体和硝酸铵固体 除去氯化钠溶液中的硝酸钾 分离氯化钾固体与二氧化锰 降温结晶 溶解、过滤 15.下图是某汽车尾气净化装置中发生反应的微观示意图。下列说法正确的是 一氢原子(核电荷数为1) 催化剂 一氧原子(核电荷数为8) 一氮原子(核电荷数为7) XYZWA.该反应中,Z是由Y分解生成的 B一个Y和W分子中均有10个电子 C.参加反应的X与生成的Z的质量比为9:7 D.化学反应前后,催化剂的质量和性质一定不变 第二部分 非选择题(共40分) 16.(8分)化学是人类进步的阶梯。 (1)航天服是保障航天员的生命活动和工作能力的个人密闭装备。航天服保暖层通常含有合成纤维、羊毛 等材料,羊毛的主要成分是__________,燃烧羊毛时有________________气味。 (2)造船业已成为泰州市的一项支柱产业。造船需要大量钢铁,未经处理的钢铁易锈蚀,锈蚀的主要原因 是__________________,请写出防止钢铁锈蚀的一种方法:__________________。 (3)制作“蔬菜面条”时,常常在面粉中加入一定量的蔬菜汁,“蔬菜面条”比普通面条多提供的营养物 质主要是________和矿物质。取一根普通面条,在面条上滴1滴碘水,可以观察到面条表面呈______色。 (4)大量使用煤、石油、________等化石燃料会产生SO2等污染物,这些污染物溶于雨水后会形成________ ,因此,使用时应该进行脱硫处理。 17.(9分)请回答下列实验问题: (1)现提供下列装置 甲ABCDEF①上图C装置中,甲仪器的名称是__________。 ②实验室将双氧水加入二氧化锰粉末制取氧气,发生装置是____(填序号),反应的化学方程式为_______ _____________,若用E装置收集氧气,当有______________时,开始收集气体。 ③实验室可以按照“B→F→F→真空气囊”的装置顺序制取纯净的CO2气体,B装置中发生反应的化学方程 式为________________________________,第一个F装置盛放试剂的作用是__ ______________,第二个F装置盛放的试剂为______________。 (2)实验室用氯化钠固体配制50g15%的氯化钠溶液的步骤有:计算、称取氯化钠、量取水、溶解、转移。 ①在溶解过程中,玻璃棒的作用是____________________________。 ②下列操作中,可能导致配制氯化钠溶液的溶质质量分数偏大的是_______(填序号)。 a.称取时,将氯化钠置于托盘天平的右盘 b.量取水时俯视读数 c.用已有少量水的烧杯溶解氯化钠 d.转移时,有少量溶液溅出 18.(8分)A~I是初中化学常见物质。A与B在高温条件下反应生成C和D,该反应在工业上口可用于冶炼金 属,A和C是组成元素相同的两种气体,D在气体E中燃烧生成黑色固体B. (1)固态C的俗名是_________,实验室区分气体A和C的液体试剂为_______________。 (2)E、F的化学式分别为_________、_________。 高温 (3)A+B—→ C+D的化学方程式为____________________,D+F→G+H的反应类型是__________。 (4)向F的溶液中加入一定量的D,充分反应后,过滤,向滤渣中滴加I的稀溶液,有气泡产生,同时生成G ,则滤渣的成分是____________,I的化学式为_________。 19.(9分)为探究CO2与NaOH溶液发生的反应,某兴趣小组尝试用不同的方式进行实验。 【查阅资料】 Ⅰ.20℃时,几种物质在水中的溶解度见下表: 物质 Na2CO3 21.5 NaHCO3 9.6 Ca(OH)2 0.165 Ba(OH)2 3.89 溶解度/g Ⅱ.本实验条件下,Na2CO3溶液和NaHCO3溶液的pH分别约为11.0和8.5。 【实验探究】 (1)实验一:小雨取一充满CO2的矿泉水瓶,加入一定量的水,立即拧紧瓶盖,振荡,发现瓶子变瘪,小雨 另取一相同的充满CO2的矿泉水瓶,向其中加入与水等体积的NaOH溶液,立即拧紧瓶盖,振荡,得到溶液X ,此时观察到的现象是_________________________________,实验中,小雨采用两只矿泉水瓶做对比实 验的目的是_________________________________。 (2)实验二:为检验CO2与NaOH溶液反应的产物,小亮取实验一所得溶液X少许,向其中滴加BaCl2溶液,有 白色沉淀产生,该反应的化学方程式为_____________________________,实验中不宜将BaCl2溶液换成Ca Cl2溶液的原因是_____________________________________。 (3)实验三:小华取实验一所得溶液X少许,向其中加入过量的BaCl2溶液,振荡,静置,取上层清液,滴 入1滴酚酞试液,发现溶液呈____色,证明溶液X中有NaOH剩余。实验中,小华没有直接向少量溶液X中滴 入酚酞试液,理由是___________________________________。 (4)实验四:兴趣小组将CO2持续通入一定浓度一定量的NaOH溶液中,用数字化实验技术测定反应过程中溶 液的pH和温度变化,结果如图1、图2所示。 图1中,BC段发生反应的化学方程式为____________________________________。 图2中,DE段温度变化的原因是__________________________________________。 【反思感悟】 (5)实验从CO2减少、NaOH减少,Na2CO3生成等物质的变化,以及___________转化等视角多维度探究CO2与N aOH发生了反应,对于现象不明显的化学反应,可以通过现代技术手段进行数据测定,实现反应过程的“ 可视化”。 20.(6分)海水中含有丰富的自然资源,一般是先将海水淡化获得淡水,再通过一系列工艺流程从剩余的 浓海水中提取其他产品,从浓海水制取镁的主要反应过程如下图所示。 淡水 淡化 海水 石灰乳 稀盐酸 通电 浓海水 氢氧化镁 氯化镁 镁请回答下列问题 (1)用浓海水可以制得粗盐,方法是_________________。 (2)电解熔融氯化镁的化学方程式为______________________________。 (3)溶解1.16吨氢氧化镁至少需要质量分数为10%的稀盐酸多少吨?请写出计算过程。
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





