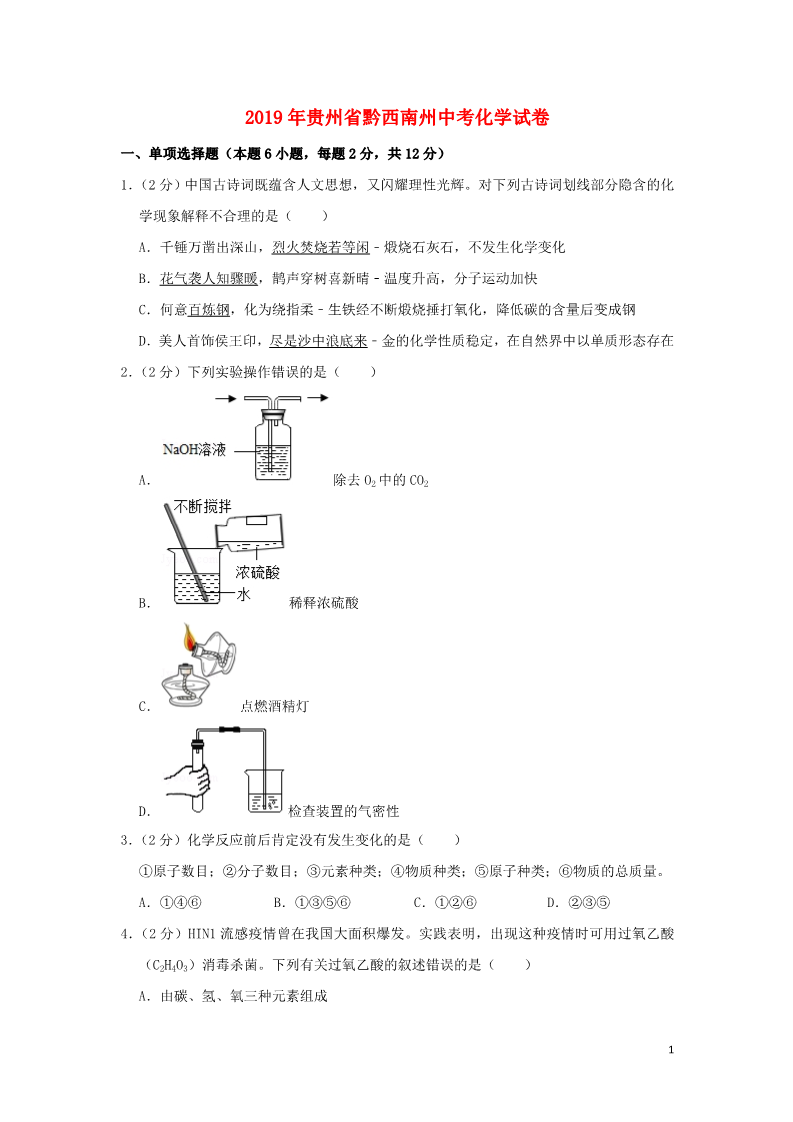


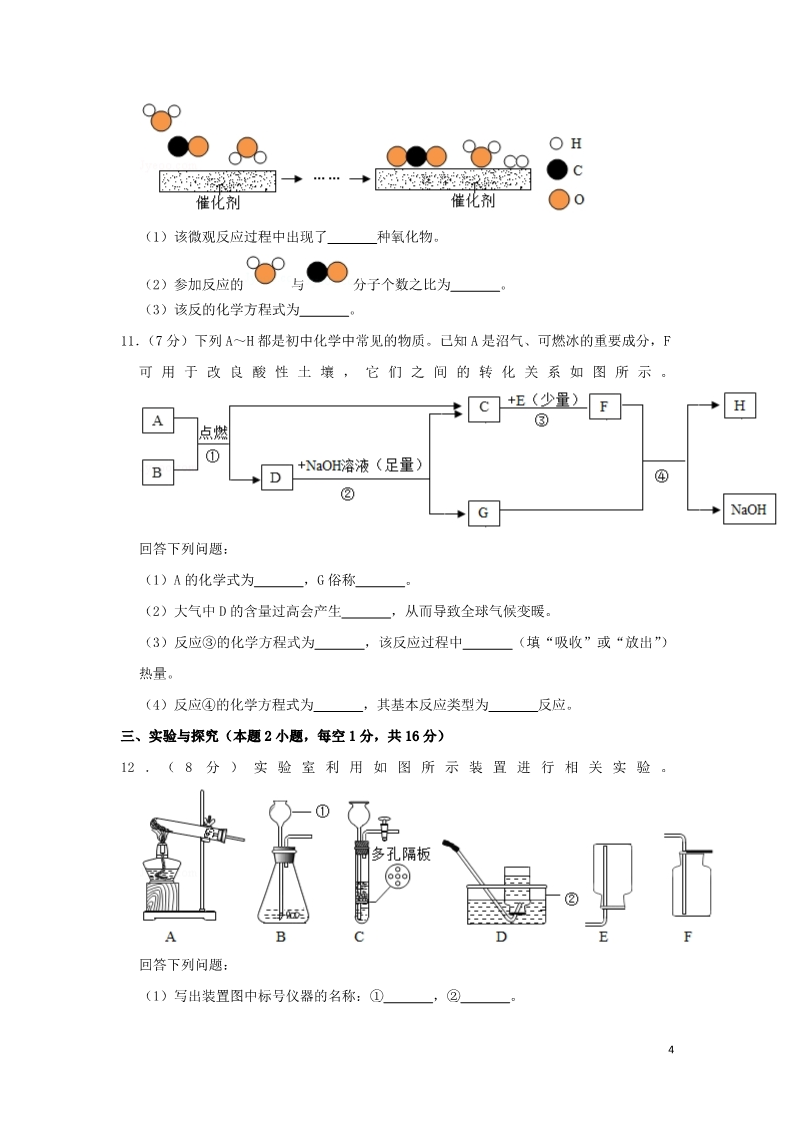
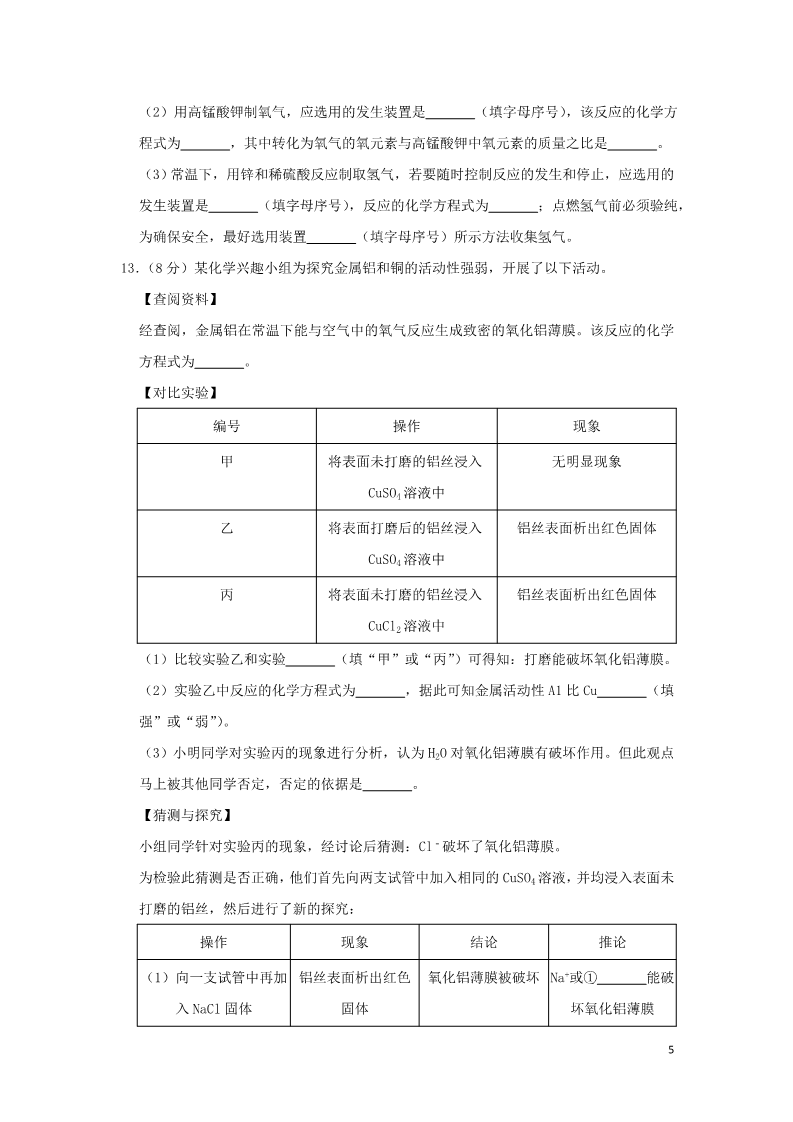
2019年贵州省黔西南州中考化学试卷 一、单项选择题(本题 6小题,每题 2分,共 12分) 1.(2分)中国古诗词既蕴含人文思想,又闪耀理性光辉。对下列古诗词划线部分隐含的化 学现象解释不合理的是( ) A.千锤万凿出深山,烈火焚烧若等闲﹣煅烧石灰石,不发生化学变化 B.花气袭人知骤暖,鹊声穿树喜新晴﹣温度升高,分子运动加快 C.何意百炼钢,化为绕指柔﹣生铁经不断煅烧捶打氧化,降低碳的含量后变成钢 D.美人首饰侯王印,尽是沙中浪底来﹣金的化学性质稳定,在自然界中以单质形态存在 2.(2分)下列实验操作错误的是( ) A. 除去 O2中的 CO2 B. C. D. 稀释浓硫酸 点燃酒精灯 检查装置的气密性 3.(2分)化学反应前后肯定没有发生变化的是( ) ①原子数目;②分子数目;③元素种类;④物质种类;⑤原子种类;⑥物质的总质量。 A.①④⑥ B.①③⑤⑥ C.①②⑥ D.②③⑤ 4.(2分)HIN1流感疫情曾在我国大面积爆发。实践表明,出现这种疫情时可用过氧乙酸 (C2H4O3)消毒杀菌。下列有关过氧乙酸的叙述错误的是( ) A.由碳、氢、氧三种元素组成 1B.其分子中含有臭氧(O3) C.既是纯净物,也是化合物 D.碳、氢、氧元素的质量比为 6:1:12 5.(2分)下列各实验方案能达到其实验目的是( ) 选项 实验目的 实验方案 AB鉴别氢氧化钠溶液和稀盐酸 分别取样滴加紫色石蕊溶液 除去 NaOH溶液中混有的 加入足量稀盐酸 Na2CO3 CD除去 CO2中混有少量的 CO 在足够的氧气中点燃 鉴别氮气和二氧化碳 将燃着的木条分别伸入气体 中A.A B.B C.C D.D 6.(2分)下列各组离子在溶液中能大量共存的是( ) A.Na+、H+、Cl﹣、OH﹣ C.Na+、H+、NO3﹣、CO32﹣ B.Ag+、K+、Cl﹣、NO3﹣ D.H+、Mg2+、SO42﹣、Cl﹣ 二、填空题(本题 5小题,每空 1分,共 24分) 7.(5分)用化学用语填空: (1)3个二氧化硫分子: 。 (2)保持氩气化学性质的最小粒子 。 (3)空气中含量最多的气体: (4)氧化铁中铁元素的化合价: (5)13号元素原子的结构示意图: 。 。 。 8.(6分)化学与人类生活、生产活动息息相关。根据所学化学知识回答下列问题: (1)生活中常用 来区分硬水和软水。 (2)人的胃液里含有适量的 (填名称),可以帮助消化。 (3)食用“加铁酱油”可预防贫血,其中的“铁”是指 子”)。 (填“元素”或“原 (4)厨房油锅着火,盖上锅盖可以立即灭火,其原理是 。 (5)将少量某塑料样品在密闭容器中与足量的 O2反应,生成了 CO2和 H2O,由此可知该 2塑料中一定含有 元素。 (6)稀土有“工业的维生素”的美誉。稀土元素 Tm在元素周期表中的信息如图,下列 有关 Tm的判断错误的是 ①原子的质子数为 69 ②属于金属元素 (填序号)。 ③原子的中子数为 69 ④相对原子质量为 168.9 9.(3分)如图所示为①KNO3②NaCl③H3BO3的溶解度曲线,由图可知: (1)当温度为 10℃时,KNO3、NaCl 和 H3BO3 三种物质的溶解度由大到小的顺序为 (用序号作答)。 (2)当温度为 t℃时,在三种物质的饱和溶液中溶质的质量分数由大到小的顺序为 (用序号作答)。 (3)要将 P 点处的 KNO3 溶液变成饱和溶液,可采取的措施有:加入 KNO3 固体、 等(任写一条)。 10.( 3 分 ) 工 业 上 使 用 一 种 国 产 低 温 催 化 剂 生 产 氢 气 的 反 应 过 程 如 图 所 示 3(1)该微观反应过程中出现了 种氧化物。 (2)参加反应的 与分子个数之比为 。 (3)该反的化学方程式为 。 11.(7分)下列 A~H都是初中化学中常见的物质。已知 A是沼气、可燃冰的重要成分,F 可 用 于 改 良 酸 性 土 壤 , 它 们 之 间 的 转 化 关 系 如 图 所 示 。 回答下列问题: (1)A的化学式为 ,G俗称 。 (2)大气中 D的含量过高会产生 (3)反应③的化学方程式为 热量。 ,从而导致全球气候变暖。 ,该反应过程中 (填“吸收”或“放出”) (4)反应④的化学方程式为 ,其基本反应类型为 反应。 三、实验与探究(本题 2小题,每空 1分,共 16分) 12 . (8 分 ) 实 验 室 利 用 如 图 所 示 装 置 进 行 相 关 实 验 。 回答下列问题: (1)写出装置图中标号仪器的名称:① ,② 。 4(2)用高锰酸钾制氧气,应选用的发生装置是 程式为 (填字母序号),该反应的化学方 。 ,其中转化为氧气的氧元素与高锰酸钾中氧元素的质量之比是 (3)常温下,用锌和稀硫酸反应制取氢气,若要随时控制反应的发生和停止,应选用的 发生装置是 (填字母序号),反应的化学方程式为 ;点燃氢气前必须验纯, 为确保安全,最好选用装置 (填字母序号)所示方法收集氢气。 13.(8分)某化学兴趣小组为探究金属铝和铜的活动性强弱,开展了以下活动。 【查阅资料】 经查阅,金属铝在常温下能与空气中的氧气反应生成致密的氧化铝薄膜。该反应的化学 方程式为 。 【对比实验】 编号 操作 现象 甲将表面未打磨的铝丝浸入 无明显现象 CuSO4溶液中 乙将表面打磨后的铝丝浸入 铝丝表面析出红色固体 铝丝表面析出红色固体 CuSO4溶液中 丙将表面未打磨的铝丝浸入 CuCl2溶液中 (1)比较实验乙和实验 (填“甲”或“丙”)可得知:打磨能破坏氧化铝薄膜。 (2)实验乙中反应的化学方程式为 强”或“弱”)。 ,据此可知金属活动性 A1比 Cu (填 (3)小明同学对实验丙的现象进行分析,认为 H2O对氧化铝薄膜有破坏作用。但此观点 马上被其他同学否定,否定的依据是 【猜测与探究】 。 小组同学针对实验丙的现象,经讨论后猜测:Cl﹣破坏了氧化铝薄膜。 为检验此猜测是否正确,他们首先向两支试管中加入相同的 CuSO4溶液,并均浸入表面未 打磨的铝丝,然后进行了新的探究: 操作 (1)向一支试管中再加 铝丝表面析出红色氧化铝薄膜被破坏 Na+或① 入 NaCl固体 固体坏氧化铝薄膜 现象 结论 推论 能破 5(2)向另一支试管中再 加入 Na2SO4固体 ② 氧化铝薄膜未被破 Na+和 SO42﹣都不能 破坏氧化铝薄膜 坏【结论与反思】 得出结论:前述猜测 (填“正确”或“不正确”) 总结反思:本次探究充分运用了比较法和控制变量法 四、计算题(本题共 8分) 14.(8分)为测定某氧化铜和铜的固体混合物中氧化铜的质量分数,小勇同学取 20g固体 混合物置于烧杯中,将 100g稀硫酸分为四等份依次加入其中进行实验,测得数据如下: 次序 ①②③④加入稀硫酸的质 25 25 25 25 量/g 剩余固体的质量 16 a10 10 /g 回答列问题: (1)原固体混合物中,氧化铜的质量分数为 。 (2)上表中,a的值为 ,实验③所得溶液中的溶质是 (填化学式)。 (3)计算该实验所用稀硫酸中溶质的质量分数。(写出计算过程,结果精确到 0.1%) 62019年贵州省黔西南州中考化学试卷 参考答案与试题解析 一、单项选择题(本题 6小题,每题 2分,共 12分) 1.【解答】解:A、烈火焚烧是石灰石高温分解生成氧化钙和二氧化碳,是化学变化,错误; B、花气袭人知骤暖说明分子的运动与温度有关,温度高,分子的运动快,正确; C、炼钢的过程是不断减少生铁中的含碳量的过程,正确; D、尽是沙中浪底来说明金的化学性质稳定,在自然界中以单质存在,正确; 故选:A。 2.【解答】解:A、二氧化碳能与氢氧化钠溶液反应,氧气不能,图中装置起洗气功能时进 气管与出气管的方向是“长进短出”,图中所示装置正确。 B、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热 量及时的扩散;一定不能把水注入浓硫酸中;图中所示操作正确。 C、使用酒精灯时要注意“两查、两禁、一不可”,禁止用一酒精灯去引燃另一酒精灯, 图中所示操作错误。 D、检查装置气密性的方法:把导管的一端浸没在水里,双手紧贴容器外壁,若导管口有 气泡冒出,装置不漏气;图中所示操作正确。 故选:C。 3.【解答】解:化学反应前后,原子的数目不变;分子的数目可能不变,也可能改变;元素 的种类一定不变;物质的种类一定改变;原子的种类一定不变;物质的总质量一定不变, 观察选项, 故选:B。 4.【解答】解:A.由化学式 C2H4O3可知,过氧乙酸是由碳、氢、氧三种元素组成的,故正 确; B.分子是由原子构成的,过氧乙酸分子是由碳原子、氢原子和氧原子构成的,其中不含 臭氧分子,故错误; C.由化学式 C2H4O3可知,过氧乙酸是由一种物质组成的,属于纯净物,该纯净物是由三 种元素组成的,属于化合物,故正确; D.过氧乙酸中碳、氢、氧三种元素的质量比为:(12×2):(1×4):(16×3)=6:1: 12,故正确。 7故选:B。 5.【解答】解:A、氢氧化钠溶液和稀盐酸分别显碱性、酸性、分别能使紫色石蕊溶液变蓝 色、红色,可以鉴别,故选项实验方案能达到其实验目的。 B、Na2CO3、NaOH溶液均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符 合除杂原则,故选项实验方案不能达到其实验目的。 C、除去二氧化碳中的一氧化碳不能够通氧气点燃,这是因为除去气体中的气体杂质不能 使用气体,否则会引入新的气体杂质,故选项实验方案不能达到其实验目的。 D、氮气和二氧化碳均不能燃烧、不能支持燃烧,均能使燃着的木条熄灭,不能鉴别,故 选项实验方案不能达到其实验目的。 故选:A。 6.【解答】解:A、H+与 OH﹣两种离子能结合成水,不能大量共存,故选项错误。 B、Ag+、Cl﹣、两种离子能结合成氨气和水,不能大量共存,故选项错误。 C、H+、CO32﹣两种离子能结合成水和二氧化碳,故选项错误。 D、四种离子间不能结合成沉淀、气体或水,能大量共存,故选项正确。 故选:D。 二、填空题(本题 5小题,每空 1分,共 24分) 7.【解答】解:(1)3个二氧化硫分子就是在二氧化硫化学式的前面加上数字 3,故填: 3SO2。 (2)保持氩气化学性质的最小粒子是氩原子,故填:Ar。 (3)空气中含量最多的气体是氮气,故填:N2。 (4)氧化铁中铁元素的化合价为+3,故填: O 。 2 3 (5)13号元素原子的结构示意图为 ,故填: 。8.【解答】解:(1)生活中常用肥皂水来区分硬水和软水; (2)人的胃液里含有适量的盐酸,可以帮助消化; (3)物质是由元素组成的,食用“加铁酱油”可预防贫血,其中的“铁”是指元素; (4)隔绝空气、降低可燃物的温度至着火点以下、移除可燃物都可以灭火。厨房油锅着 火,盖上锅盖可以立即灭火,其原理是隔绝空气; 8(5)将少量某塑料样品在密闭容器中与足量的 O2反应,生成了 CO2和 H2O,由此可知该 塑料中一定含有碳元素和氢元素; (6)根据稀土元素 Tm在元素周期表中的信息可知: ①原子的质子数为 69,故①正确; ②铥字是“金”字旁,属于金属元素,故②正确; ③质子数等核外电子数,根据中子数关系不大,故③错误; ④相对原子质量为 168.9,故④正确。 故答案为: (1)肥皂水; (2)盐酸; (3)元素; (4)隔绝空气; (5)碳、氢; (6)③。 9.【解答】解:(1)由溶解度曲线可知,当温度为 10℃时,KNO3、NaCl和 H3BO3三种物质的 溶解度由大到小的顺序为:NaCl>KNO3>H3BO3;故答案为:NaCl>KNO3>H3BO3; (2)当温度为 t℃时,在三种物质的饱和溶液中溶质的质量分数由大到小的顺序为:NaCl =KNO3>H3BO3;故答案为:NaCl=KNO3>H3BO3; (3)要将 P点处的 KNO3溶液变成饱和溶液,可采取的措施有:加入 KNO3固体、蒸发水 分、降低温度等;故答案为:蒸发水分或降低温度; 10.【解答】解:由微观反应示意图可知,该反应是由水和一氧化碳在低温催化剂的作用下 反应生成二氧化碳和氢气,化学方程式为:CO+H2O H2+CO2。 (1)氧化物是由两种元素组成,且其中一种元素是氧元素的化合物,所以一氧化碳、水 和二氧化碳均属于氧化物;故填:3; (2)由化学方程式可知,参加反应的水分子与一氧化碳分子的个数比为 1:1;故填:1: 1; (3)由微观反应示意图可知,该反应是由水和一氧化碳在低温催化剂的作用下反应生成 二 氧 化 碳 和 氢 气 , 化 学 方 程 式 为 : CO+H2O H2+CO2 . 故 填 : 9CO+H2O H2+CO2。 11.【解答】解:(1)A~H都是初中化学中常见的物质,A是沼气、可燃冰的重要成分,所 以 A是甲烷,F可用于改良酸性土壤,所以 F是氢氧化钙,甲烷和 B点燃生成 D和 C,D 会与氢氧化钠反应,所以 D是二氧化碳,B是氧气,甲烷和氧气在点燃的条件下生成二氧 化碳和水,所以 C是水,水和 E反应生成氢氧化钙,所以 E是氧化钙,二氧化碳和氢氧 化钠反应生成碳酸钠,所以 G是碳酸钠,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧 化钠,所以 H是碳酸钙,经过验证,推导正确,所以 A的化学式为 CH4,G俗称纯碱; (2)大气中 D的含量过高会产生温室效应,从而导致全球气候变暖; (3)反应③是氧化钙和水反应生成氢氧化钙,化学方程式为:CaO+H2O=Ca(OH)2,该 反应过程中放出热量; (4)反应④是碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,化学方程式为: Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,其基本反应类型为复分解反应。 故答案为:(1)CH4,纯碱; (2)温室效应; (3)CaO+H2O=Ca(OH)2,放出; (4)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,复分解。 三、实验与探究(本题 2小题,每空 1分,共 16分) 12.【解答】解:(1)①长颈漏斗;②水槽; (2)高锰酸钾制取氧气需要加热,A装置适用;高锰酸钾在加热的条件下生成锰酸钾、 二氧化锰和氧气,化学方程式为:2KMnO4 知每 8个氧原子,转化成一个氧分子,所以转化为氧气的氧元素与高锰酸钾中氧元素的 质量之比= =25%; K2MnO4+MnO2+O2↑;根据化学方程式可 (3)锌和稀硫酸反应制取氢气,属于固液常温型,并且要随时控制反应的发生和停止, 适合用 C装置作发生装置;化学方程式为:Zn+H2SO4=ZnSO4+H2↑;氢气具有可燃性,当 混有一定量的空气时点燃会发生爆炸,因此收集到的气体纯度一定要高,可选用 D装置 收集。 故答案为: (1)长颈漏斗;水槽; 10 (2)A;2KMnO4 K2MnO4+MnO2+O2↑;25%; (3)C;Zn+H2SO4=ZnSO4+H2↑;D。 13.【解答】解:【查阅资料】金属铝在常温下能与空气中的氧气反应生成致密的氧化铝薄膜 的化学方程式为 4Al+3O2=2Al2O3,故填:4Al+3O2=2Al2O3。 【对比实验】(1)设计实验要注意控制变量,乙和甲一个是打磨的一个是没有打磨的, 故的比较实验乙和实验甲可得知打磨能破坏氧化铝薄膜,故填:甲。 (2)实验乙中是铝和硫酸铜反应生成硫酸铝和铜,反应的化学方程式为 2Al+3CuSO4═Al2 (SO4)3+3Cu,据此可知金属活动性 A1比 Cu强,故填:2Al+3CuSO4═Al2(SO4)3+3Cu; 强。 (3)H2O对氧化铝薄膜镁没有破坏作用。因为甲中硫酸铜溶液也含有水,没有明显现象, 故填:甲中硫酸铜溶液也含有水,没有明显现象。 【猜测与探究】氯化钠中含有钠离子和氯离子,故可能是氯离子破坏了氧化铝薄膜,加 入硫酸钠固体,氧化铝薄膜未被破坏,故不会有明显棉花,故填: 操作 (1)向一支试管中再加 铝丝表面析出红色氧化铝薄膜被破坏 Na+或①Cl﹣能破坏 入 NaCl固体 固体氧化铝薄膜 (2)向另一支试管中再 ②铝丝表面没有变氧化铝薄膜未被破 Na+和 SO42﹣都不能 加入 Na2SO4固体 破坏氧化铝薄膜 【结论与反思】 现象 结论 推论 化坏得出结论:根据实验可以看出,氯离子能破坏氧化铝薄膜,故前述猜测正确,故填:正 确。 四、计算题(本题共 8分) 14.【解答】解: 根据第一次固体减少 4g,而第三次后质量不变,说明第二次也减少 4g,所以 a=12,第 三次氧化铜完全反应,剩余的 10g为铜单质,所以氧化铜的质量为 10g,原固体混合物中, 氧化铜的质量分数为 ×100%=50%,实验③中硫酸过量,所以所得溶液中的溶质是剩 余的硫酸和生成的硫酸铜,对应的化学式为 H2SO4、CuSO4。 25g稀硫酸与 4g氧化铜完全反应 11 设该实验所用稀硫酸中溶质的质量分数为 x CuO+H2SO4=CuSO4+H2O 80 4g 98 25gx =x=19.6% 故答案为: (1)50%。 (2)12; H2SO4、CuSO4。 (3)19.6%。 12
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





