



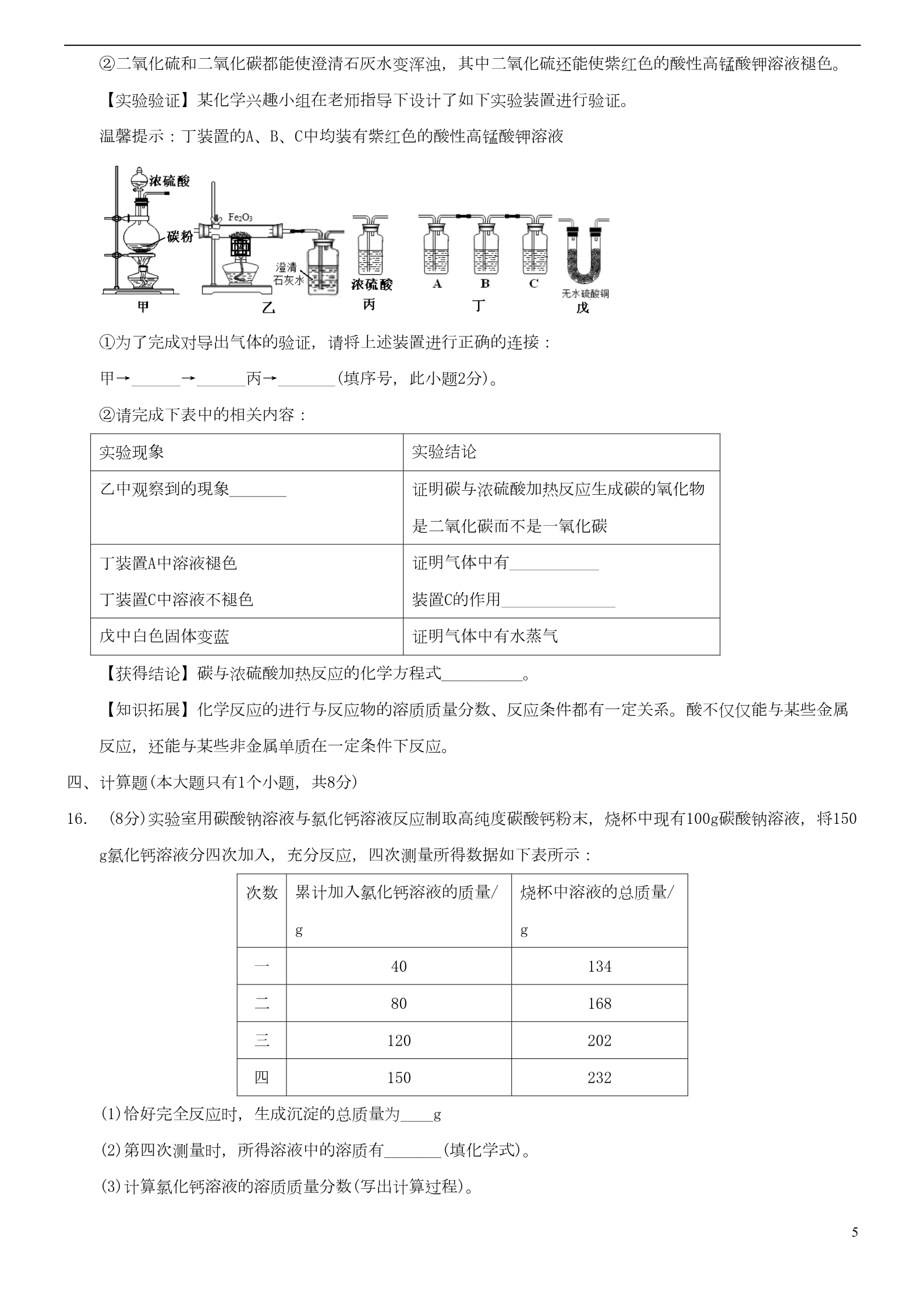
四川省达州市2018年中考化学真题试题 满分75分 时间50分钟 相对原子质量:H-1 C-12 O-16 F-19 Cl-35.5 Ca-40 Fe-56 Zn-65 第Ⅰ卷 (选择题 24分) 一、选择题(在每小题给出的四个选项中,只有一项符合题目要求.每小题3分,共24分) 1.日常生活中的下列现象,没有发生化学变化的是 ( A.食物腐败 B. 绿色植物光合作用 C.矿石粉碎 D.铵态氮肥与熟石灰混合施用 2.化学与我们的生活息息相关,下列说法错误的是 ( A.人体的需的热量主要来自粮类 B.新能源包括核能、风能和太阳能等 ))C.有机高分子合成材料包括塑料、合成纤维和合成橡胶等 D.钙是人体所需要的一种微量元素,缺钙会导致贫血病 3.近年,科学家在较低的温度下,第一次制得了七氧化二氟,它在高温下化学性质也比较稳定。下列有关七氧 化二氟的说法正确的是 ( A. 氟氧元素的质量比为2:7 C. 氟元素的化合价为-1价 )B. 七氧化二氟属于氧化物 D.一定不能和其他物质发生化学反应 4.一氧化碳在氧气中燃烧,火焰呈蓝色,同时放出大量的热,其反应的微观过程如下图所示,根据此图判断, 下列说法正确的是 ( )A.该反应是置换反应 C.化学反应前后分子的种类和数目都不变 B.化学反应前后元素的种类不变 D.发生反应前,一氧化碳和氧气的质量比是7:4 5.右图表示a、b、c三种物质的溶解度曲线。下列说法正确的是( A.P点表示t1℃时a、b溶液的溶质质量分数相等 )B.t1℃时a、c饱和溶液升温到t2℃,均变为不饱和 C.a中含有少量b时, 可采用蒸发结晶的方法提纯a D.t1℃时,125克b的饱和溶液中,含有b物质25克 6.误差分析是定量实验的一个重要内容,下列分析正确的是( A.用量筒量取10mL水,仰视读数,会导致水的实际体积偏小 B.测定溶液的pH,先用水将pH试纸润湿,会导致测出的pH偏大 )C.测定空气中氧气的体积分数,铜粉的量不足,会导致测出氧气的体积分数偏小 D.配制6%的氯化钠溶液,氯化钠中含有杂质,会导致氯化钠的质量分数偏大 17.在pH=7的无色溶液中,下列离子可以大量共存的是( )A.Na+、Ca2+、NO3-、CO32- C. Ba2+、K+、OH-、NO3- B. NH4+、Cu2+、Cl-、SO42- D. Na+、K+、NO3-、Cl- 8.下列图像不能正确反映具对应变化关系的是( )A.盛有空气的密闭容器中点燃红磷 B. 用二氧化锰和过氧化氢溶液制氧气 C.向氯化镁和盐酸的混合溶液中,连滴加入氢氧化钡溶液 D.分别向等质量的锌粉和铁粉中,加入足量等质量分数的稀盐酸 第Ⅱ卷 (非选择题 51分) 二、填空题(本大题5个小题,化学方程式每个2分。13小题每空2分,其余每空1分,共23分) 9. (4分)请从C、H、O、Cl、K中选择合适的元素,用化学用语填空: (1)两个氢原子________; (2)供给动物时吸的气体__________; (3)草木灰的主要成分是碳酸钾,加入稀盐酸会产生大量的气泡。请写出该反应的化学方程式__________。 10. (4 分)图甲是铝元素在元素周期表中的相关信息,图乙是几种微粒的结构示意图,仔细分析答题: (1)图甲中,铝元素的信息有处错误,请加以改正_________; (2)铝原子的相对原子质量_________ ; (3)图乙中,属于稳定结构的原子是____ (填序号, 下同); (4)图乙中,与铝不属于同一周期元素的是_________。 11. (6分) 某县自来水的水源地是一个大型水库,某化学兴趣小组开展了一次净化水的实践活动。请回答下列 问题: (1)对所取水样进行过滤、除了滤纸和上图提供的仪器外,还需要的一种玻璃仪器是_________。 2(2)向滤液中加入活性炭,利用其________性除出异味,再次过滤。 (3)为了检验所得滤液是否为硬水,取样加入__________。根据产生白色垢状物或泡沫的多少进行判断。 (4)自来水的生产过程中常用液氯灭菌,它会与水发生如下发应: Cl2+H2O=HCl+HClO(次氯酸),次氯酸不稳定易分解:2HClO=2HCl+O2↑。该兴趣小组的小君同学用久置后的 自来水配制硝酸银溶液,有白色沉淀出现。请解释产生沉淀的原因_______________________(用化学方程 式表示)。 (5)保护水环境,珍爱水资源,是每个公民应尽的责任和义务,下列做法有利于保护水资源的是_______(填 字号)。 A.化肥和农药的过度使用 B.工业废水处理达标后排放 C.实验室的废液不经处理直接排放 D.燃煤中加入石灰石作为固流剂,减少酸雨对水源的污染 12. (5分)A- I是初中化学常见的物质,其中A是最简单的有机物,其两种元素质量比为3:1,在空气中不完全燃烧,生 成物中C和D的元素组成相同,C的固态常用于人工降雨,F是黑色粉来,G是紫红色固体,H是红色粉末,它 们之间存在如图所示的关系: 请回答下列问题: (1) A、E的化学式分别为________,_________; (2)在化学变化中,元素化合价升高的反应物是还原剂,元素化合价降低的反应物是氧化剂。D和H发生的反 应中,_________是氧化剂; (3)I生成G的化学方程式_________。 13.(4 分)取一定质量的碳酸钙,高温加热一段时间后,得到氧化钙和碳酸钙的固体混合物,其中碳、氧元素 质量比为3:14,那么该固体混合物作氧化钙和碳酸钙的质量比为_________;取该固体混合物25.6g. 加入 溶质质量分数10%的稀盐酸219g,恰好完全反应。将所得溶液蒸发、结晶,最后得到固体的质量为________ _g。 三、实验与探究题(本大题2个小题,化学方程式每个2分,其余每空1分、共20分) 14. (8分)氢氧化钠是重要的工业原料,也是实验室的常用药品小明和小芳做了如下探究: (1)小明春阅资料得知,氢氧化钠溶液露置在空气中容易变质,其变质的化学方程式___________________ 。3(2)小明向怎氧化钠溶波中加入稀硫酸,该中和反应的实质是_________________ ;然后,对反应后废液的溶质进行了如下探究: 【提出问题】氢氧化钠溶液和稀硫酸反应后,溶质是什么? 【查阅资料】硫酸钠溶液呈中性。 【猜想假设】猜想I 硫酸钠和氢氧化钠;猜想II 硫酸钠和硫酸;猜想III______。 【设计实验】 实验结论 实验操作 实验现象 溶液无明显变化 ①取少量废液于试管中,滴 入几滴酚酞试液 猜想_____不成立 ②另取少量废液于试管中, 滴入几滴氯化钡溶液 ____________ 猜想II成立 【反思与评价】小芳认为实验操作②得出的结论不成立。为了证明猜想II成立,可以向废液中加入少量氧 化铜粉末,原因是_______________________________(用化学方程式表示)。 15. (12分)无论在化学世界里,还是在日常生活中,酸是广泛存在而又非常重要的物质。下面对常见的酸—— 硫酸的部分性 质进行探究。 (1)浓硫酸的特性 ①向一个烧杯中加入一定质量的浓硫酸,总质量为m1;敞口放置在空气中一段时间后,总质量为m2,那么 ,m1_____m2(选填“>、=、<“)。 ②如右图所示,将水滴入装有浓硫酸的锥形瓶中(锥形瓶和木板用熔化的石蜡粘在 一起),观察到液滴四溅。据此分析,下列关于浓硫酸的叙述正确的是____。 A.稀释浓硫酸时, 一定要将浓硫酸缓慢注入水中 B.稀释浓硫酸时,一定要 将水缓慢注入浓硫酸中 C.浓硫酸充分溶于水后,可以将锥形瓶从木板上轻轻提离 (2)与金属反应 向装有镁、铁、铜的A、B、C三只试管中(如右图),分别加入等质量等质量分数的稀硫酸 ,不能观察到明显现象的是______(填序号);请写出反应最剧烈的试管中发生反应的化学 方程式________________________________。 (3)与非金属反应 将冷的浓硫酸加入到装有碳粉的圆底烧瓶中,无明显现象;加热该混合物,有大量气泡产生,现对导出的 气体成分进行验证。 【查阅资料】 ①碳与浓硫酸在加热时,除了生成水之外,还生成二氧化碳和碳的一种氧化物; 4②二氧化硫和二氧化碳都能使澄清石灰水变浑浊,其中二氧化硫还能使紫红色的酸性高锰酸钾溶液褪色。 【实验验证】某化学兴趣小组在老师指导下设计了如下实验装置进行验证。 温馨提示:丁装置的A、B、C中均装有紫红色的酸性高锰酸钾溶液 ①为了完成对导出气体的验证,请将上述装置进行正确的连接: 甲→______→______丙→_______(填序号,此小题2分)。 ②请完成下表中的相关内容: 实验结论 实验现象 乙中观察到的現象_______ 证明碳与浓硫酸加热反应生成碳的氧化物 是二氧化碳而不是一氧化碳 证明气体中有___________ 装置C的作用______________ 证明气体中有水蒸气 丁装置A中溶液褪色 丁装置C中溶液不褪色 戊中白色固体变蓝 【获得结论】碳与浓硫酸加热反应的化学方程式__________。 【知识拓展】化学反应的进行与反应物的溶质质量分数、反应条件都有一定关系。酸不仅仅能与某些金属 反应,还能与某些非金属单质在一定条件下反应。 四、计算题(本大题只有1个小题,共8分) 16. (8分)实验室用碳酸钠溶液与氯化钙溶液反应制取高纯度碳酸钙粉末,烧杯中现有100g碳酸钠溶液,将150 g氯化钙溶液分四次加入,充分反应,四次测量所得数据如下表所示: 累计加入氯化钙溶液的质量/ 烧杯中溶液的总质量/ 次数 gg一二三四40 80 134 168 202 232 120 150 (1)恰好完全反应时,生成沉淀的总质量为____g (2)第四次测量时,所得溶液中的溶质有_______(填化学式)。 (3)计算氯化钙溶液的溶质质量分数(写出计算过程)。 5参考答案 答案仅供参考,考生如有其他合理答案,参照评分。 一、选择题(在每小题给出的四个选项中,只有一项符合题目要求.每小题3分,共24分) 题号 1C2D3B4B5D6C7D8A答案 二、填空题(本大题5个小题,化学方程式每个2分。13小题每空2分,其余每空1分,共23分) 9. (4分)(1)2H; (2)O2; (3)K2CO3+2HCl=2KCl+H2O+CO2↑ 10. (4 分)(1)Al (2)26.98; (3)AD; (4)A。 11. (6分) (1) 玻璃棒 (2)吸附 (3)肥皂水 (4) HCl+AgNO3=AgCl↓+HNO3 (5) B D 12. (5分)(1) CH4, H2; (2)Fe2O3或氧化铁 13.(4 分)7:25; 33.3。 (3)Fe+CuSO4=FeSO4+Cu 三、实验与探究题(本大题2个小题,化学方程式每个2分,其余每空1分、共20分) 14. (8分)(1)2NaOH+CO2=Na2CO3+H2O (2)氢离子与氢氧根离子结合生成水或H++OH-=H2O 【猜想假设】硫酸钠 【反思与评价】CuO+H2SO4=CuSO4+H2O 15. (12分)(1)① < ②A C (2)C Mg+H2SO4=MgSO4+H2↑ (3)① 戊 ②乙中红色粉末不变色,澄清石灰水变浑浊 二氧化硫或SO2 证明SO2被除净 【设计实验】① I ②有白色沉淀生成 丁乙△【获得结论】C+2H2SO4 CO2↑+2SO2↑+2H2O 四、计算题(本大题只有1个小题,共8分) 16. (8分) (1)18(2)NaCl CaCl2 (3)设第一次加入的氯化钙溶液中溶质质量为X CaCl2+Na2CO3=CaCO3↓+2NaCl 111 100 6g X111:X=100:6g X=6.66g 6.66g 40g 氯化钙溶液的溶质质量分数: ×100%=16.7% 答:略 6
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





