
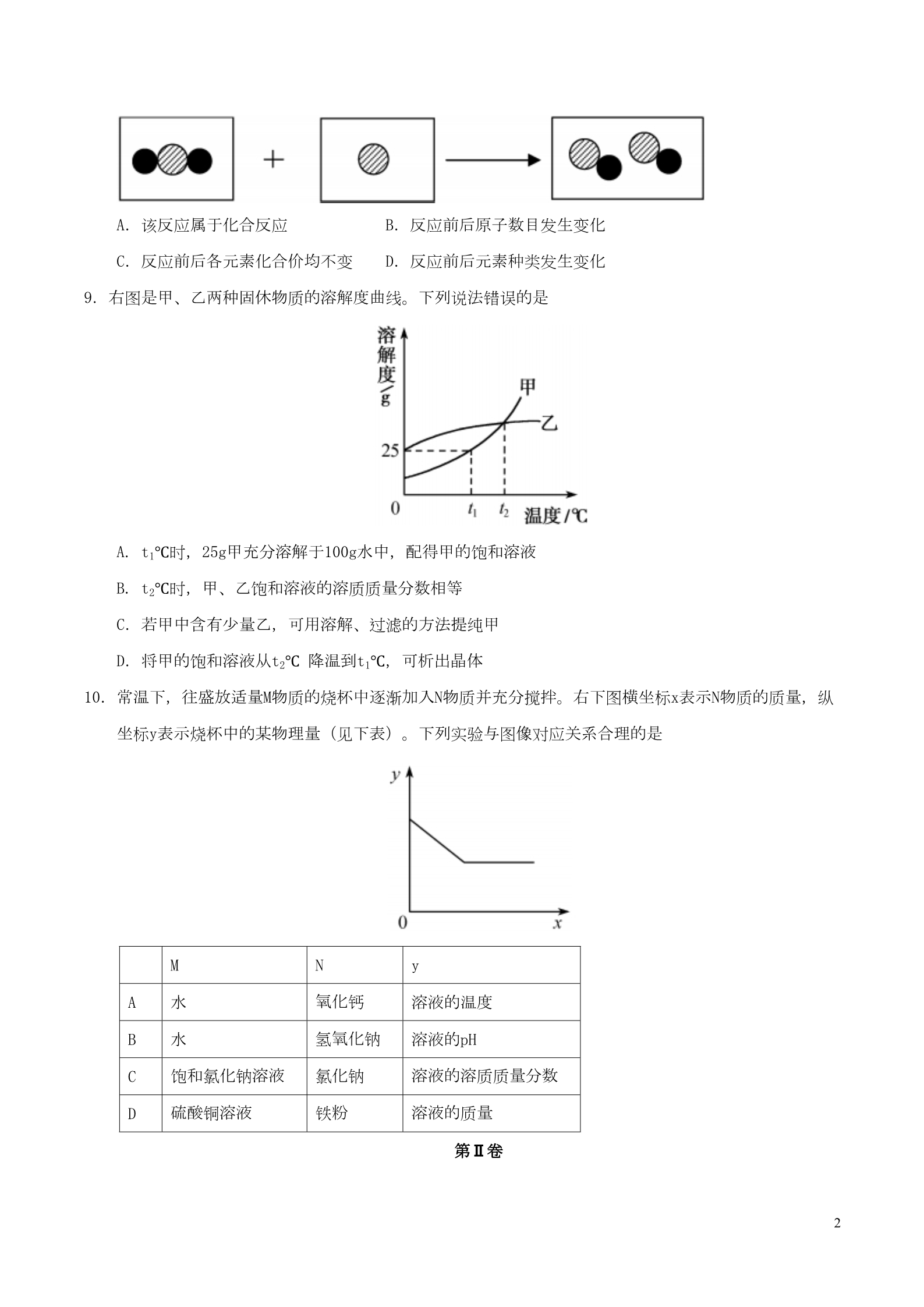



福建省2017年中考化学真题试题 第I卷 本卷共10小题,每小题3分,共30分。在每小题给出的四个选项中,只有一个选项符合题目要求。 1.下列可供人呼吸的气体是 A.氧气 2.人体缺乏某种元素会导致骨质疏松症,该元素是 A.铁 B.碘 C.钙 D.锌 3.中药砒霜的主要成分为三氧化二砷( As2O3),可用于治疗肿瘤。其中砷元素的化合价为 B.氢气 C.氮气 D.二氧化碳 A.-3 B.+3 C.-2 D.+2 4.下列人体体液中,酸性最强的是 A.唾液(pH约6.6~7.1) B.胃液(pH约0.8~1.5) D.血液(pH约7.35~7.45) C.胆汁(pH约6.8~7.4) 5.下列四支试管小,铁钉锈蚀最快的是 6.欲配制10.0%的NaCI溶液50 g,部分操作如下图所示,正确的是 7.十八世纪,拉瓦锡用放大镜聚集日光使玻璃罩内的金刚石燃烧,得到二氧化碳。坦南特进一步研究确 认金刚石仅由碳元素组成。下列说法错误的是 A.金刚石属于有机物 C.金刚石具有可燃性 B.金刚石燃烧过程放出热量 D.聚集日光使温度达到金刚石的着火点 8.炼铁炉中某反应的微观示意图(不同的球代表不同原子)如下所示。下列说法正确的是 1A.该反应属于化合反应 B.反应前后原子数目发生变化 D.反应前后元素种类发生变化 C.反应前后各元素化合价均不变 9.右图是甲、乙两种固休物质的溶解度曲线。下列说法错误的是 A. t1℃时,25g甲充分溶解于100g水中,配得甲的饱和溶液 B. t2℃时,甲、乙饱和溶液的溶质质量分数相等 C.若甲中含有少量乙,可用溶解、过滤的方法提纯甲 D.将甲的饱和溶液从t2℃ 降温到t1℃,可析出晶体 10.常温下,往盛放适量M物质的烧杯中逐渐加入N物质并充分搅拌。右下图横坐标x表示N物质的质量,纵 坐标y表示烧杯中的某物理量(见下表)。下列实验与图像对应关系合理的是 MNy氧化钙 氢氧化钠 氯化钠 铁粉 ABCD水溶液的温度 溶液的pH 水饱和氯化钠溶液 硫酸铜溶液 溶液的溶质质量分数 溶液的质量 第Ⅱ卷 2本卷共6题,共45分。 11.(5分) 近期,央视对“用棉花代替肉松制‘肉松饼’”的消息进行辟谣。资料表明:肉松是用动物肌肉制作的蓬 松絮状肉制品,棉花主要含有植物纤维。 (1)棉花属于_______(填“天然”或“合成”)有机高分子材料。 (2)肉松中含量最多的营养素是_______。 (3)町用燃烧法鉴别肉松与棉花,点燃时闻到烧焦羽毛气味的是_______。 (4)制作肉松饼使用的发酵粉中含有碳酸氢铵(NH4HCO3)。碳酸氢铵中氢和氧两种元素的质量比为_____ 。12.(7分) 农业废弃物是指农业生产过程中废弃的有机物,如秸秆、蔗渣等。 (1)农业废弃物经发酵处理可获得沼气(主要成分为甲烷)。甲烷完全燃烧的化学方程式为_______。 (2)闽籍科学家张俐娜发明了一种快速溶解农业废弃物的“神奇溶剂”。该“神奇溶剂”小氢氧化钠、尿素 和水的质量比为7:12:81。 ①“神奇溶剂”是一种溶液,其溶质有_______。 ②某次生产需用到100 kg“神奇溶剂”。现仪川氢氧化钠溶液和尿素来配制,所用的氢氧化钠溶液的溶质质量分数为_______( 列出计算式即可)。 ③利用该“神奇溶剂”溶解农业废弃物生产的新型纤维素膜,在土壤中能完全降解。利用此膜替代普通 塑料,可缓解的环境问题是_______(写一点)。 13.(6分) 模型是联系宏观与微观的桥梁。 (1)右图是钠原子结构示意图。 ①x的数值为_______。 ②“11”指的是_______。 ③钠原子在化学反应中易失去1个电子,形成_______(填离子符号)。 (2)下图是氢分子和氧分子运动的示意图。 3①在A、B和C中,能比较得出“温度越高,分子运动速率越快”的是______(填标号)。 ②从图中可见,影响分子运动速率的因素除温度外,还与______有关。 ③举一个能说明“温度升高,分子运动速率加快”的生活事例:________。 14.(7分) 右图是包含物质A、B、C、D和盐酸卡片的“化学拼图”,相邻两张卡片所标的物质(或其溶液)间能发 生反应。 (1)A不可能是______(填标号)。 a.Mg b.Fe c.Ag d.Zn (2)若B为铁锈的主要成分Fe2O3,B与盐酸反应的化学方程式为______。 (3)若C为碳酸钠 ①C与D的反应属于______(填基本反应类型)。 ②D与盐酸反应的化学方程式为______(写一个)。 ③将二氧化碳通入C溶液,可化合生成碳酸氢钠( NaHCO3),该反应的反应物有______种。 15.(15分) (1)化学小组选用下图装置制取并收集氧气。 4①仪器的名称:a是______,b是______。 ②实验事制取氧气的化学方程式为______(写一个),实验时对应的气体发生和收集装置分别是____ __(填标号,下同)和______。 (2)碘化钾(KI)足白色固体,保存不当会被氧化为单质碘(I2)而泛黄变质。化学小组查得以下资料: I.对于碘化钾变质的原理,有两种不同的反应: 甲:4KI+O2+2CO2= 2K2CO3+2I2 乙:4KI+O2+2H2O=4KOH+2I2 Ⅱ.KOH与NaOH的化学性质相似。 为探究碘化钾变质原理的合理性,开展以下实验。 【实验过程】 [实验1] 取适量碘化钾固体暴露于空气小一段时间,观察到固体泛黄。往泛黄的固体中加入足量稀硫酸,产生 无色无味的气体,通入澄清石灰水中,澄清石灰水变浑浊。 ①石灰水变浑浊的原冈是______(用化学方程式表示)。 ②化学小组认为:据此现象,还不能得出“反应甲是造成碘化钾变质的原因”的结论。理由是____。 [实验2] 按右上图所示装置进行实验,数日后,观察到碘化钾固体无泛黄现象。 ③据此现象,可得出的结论是______。 [实验3] 5按右下图所示装置进行实验,数日后,观察到碘化钾同体无泛黄现象。 查阅文献获知,常温下某些气体和固体反应须在潮湿环境中进行。化学小组据此改进实验,很快观察 到固体泛黄的现象。 ④简述化学小组改进实验的具体措施:___________。 【实验结论】 ⑤根据上述实验,化学小组得出结论:碘化钾固体泛黄变质是碘化钾与_____共同作用的结果。 16.(5分) “人工固氮”每年能生产11.9亿吨氨(NH3),反应原理为: N2+3H2 2NH3。 (1)根据化学方程式计算:“人工固氮”每年固定氮气的质量是多少? (2)每年全球“雷电固氮”约能固定0.98亿吨氮气,“人工固氮”固定氮气的质量相当于“雷电固氮”的____ 倍。 6一、选择题:每小题3分,共30分。 1.A 2.C 3.B 4.B 5.D 6.D 7.A 8.A 9.C 10.D 二、非选择题:共6题,共45分。 11.(5分) (1)天然 (2)蛋白质 (3)肉松 (4)5:48 12.(7分) (1)CH4+2O2 CO2+2H2O 7(2)①氢氧化钠、尿素(或其他合理答案);② 100%(或其他合理答案);③白色污染( 7 81 或其他合理答案) 13.(6分) (1)①8;②钠原子的质子数为11(或其他合理答案);③Na+ (2)①BC;②分子种类(或其他合理答案);③湿衣服在阳光下比在阴凉处干得快(或其他合理答案 )14.(7分) (1)c;(2)Fe2O3+6HCl= 2FeCl3+3H2O;(3)①复分解反应; ②2HCl+Ca(OH)2= CaCl2+2H2O(或“2HCl+Ba(OH)2= BaCl2+2H2O”);③3 15.(15分) (1)①试管 酒精灯 ②2KMnO4 K2MnO4+MnO2+ O2↑(或“2H2O2 2H2O+O2↑”等其他合理答案); A(或“B”) 说明:气体发生装置与化学方程式相对应才得分:没写化学方程式只填气体发生装置不得分 D(2)①CO2+Ca(OH)2=CaCO3↓+H2O ②无法判断K2CO3是按反应甲原理产生,还是按反应乙原理生成的KOH吸收空气中的CO2而产生的(或其 他合理答案) ③反应乙不是造成碘化钾泛黄的原因(或其他合理答案) 7④往瓶中再加入少量水(或其他舍理答案) ⑤氧气、水和二氧化碳 16.(5分)(1)9.8亿吨;(2)10 8
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





