



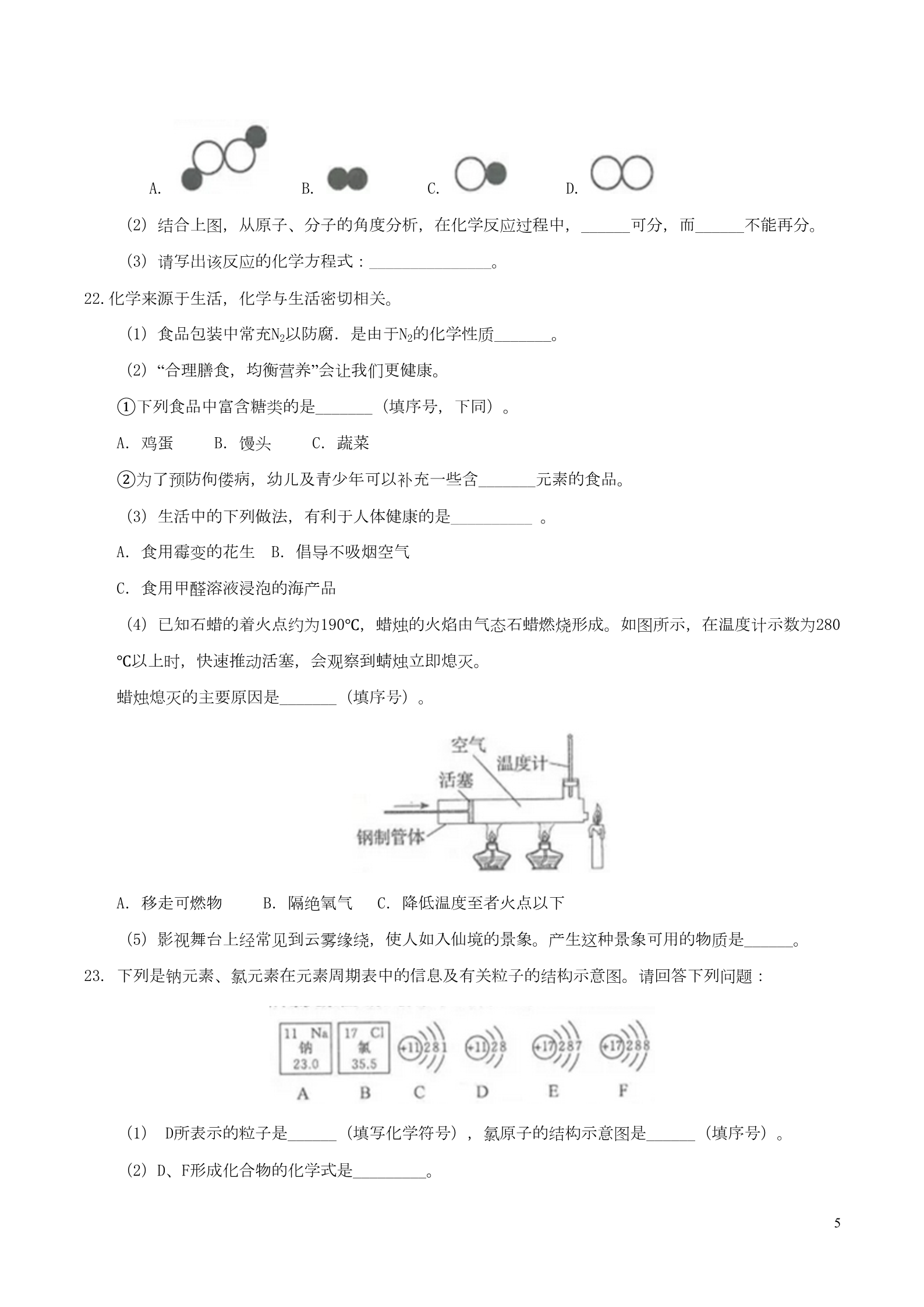
山东省临沂市2017年中考化学真题试题 1.下列过程属于化学变化的是 A. 海水晒盐 B.酒精挥发 C.钢铁生锈 D.品红扩散 2.下列几种常见的物质中,属于化合物的是 A.火碱 B.金刚石 C.碘酒 D.洁净的空气 3.氧气能被压缩在钢瓶中贮存,说明 A.氧分子的大小发生改变 B.氧分子可以再分 D.氧分子之间有间隔 C.氧分子总是在不断运动 4.实验室长期保存下列药品的方法中,不正确的是 A.氢氧化钠密封保存在试剂瓶中 C.浓盐酸密封保存在试剂瓶中 B.硝酸银溶液密封保存在棕色试剂瓶中 D.少量氨水保存在烧杯中 5.在氧气中燃烧,发出耀眼的白光且有白烟产生的是 A.木炭 B.镁 C.铁 D.硫 6.豆腐是人们喜爱的食物,营养丰富,能为人体提供所需的多种氨基酸,其中含量最多的是亮氨酸(C6H1 3NO2),关于亮氨酸的说法正确的是 A.亮氨酸是氧化物 B.亮氨酸中碳元素的质量分数为27.3% C.一个亮氨酸分子由22个原子构成 D.亮氨酸中碳、氢、氮、氧四种元素的质量比为6:13:l:2 7.下列做法错误的是 A.洒出的洒精在桌上燃烧起来,立刻用水扑灭 B.生活中把水煮沸来降低水的硬度 C.液化石油气泄露,立即关闭阀门并开窗通风 D.回收各种废弃塑料,减少白色污染 8.煤燃烧产生的废气中含有SO2,SO2是大气污染的主要气体之一,用NaOH、Na2SO3溶液可将90%以上的SO2 吸收。涉及的反应有: ①2NaOH+SO2=Na2SO3+H2O ② Na2SO3+SO2+H2O=2NaHSO3 ③2NaHSO3+NaOH=Na2SO3+H2O 1下列说法中,不正确的是 A.反应② 发生的是化合反应 C. Na2SO3中硫元素的化合价是+4 B.反应③ 说明NaHSO3属于酸 D.反应① 说明SO2与CO2有相似的化学性质 9.农作物种植过程中可以施用下列化肥,其中属于复合肥的是 A.NH4NO3 B.KNO3 C.Ca(H2PO4)2 D.CO(NH2)2 10.下列实验操作中,不正确的是 11.核电荷数多于核外电子数的粒子一定是 A.分子 B.原子 C.阴离子 D.阳离子 12.除去下列物质中的少量杂质,下列实验方案不能达到目的的是 物质(括号内为杂质) 实验方案 通过足量灼热钢网 ABCD氮气(氧气) 氯化钙溶液(盐酸) 铁粉(铜粉) 加入足量碳酸钙粉末,过滤 加入足量稀盐酸,过滤,洗涤,干燥 在空代中充分灼烧 氧化铜(木炭粉) 13.下列化学方程式书写正确的是 A.2NaOH+CuSO4=Cu(OH)2↓+NaSO4 B. Ba(NO3)2+H2SO4=BaSO4↓+HNO3 高温 C.C+2CuO 2Cu+CO2 D.Fe2O3+6HCl=2FeC12+3H2O 14.甲、乙两种固体物质的溶解度曲线如右图所示。下列说法正确的是 2A. 20℃时,甲溶液中溶质的质量分数一定比乙溶液的大 B.将40℃时甲的一定量饱和溶液降温至20℃,溶液质量不变 C.甲的溶解度大于乙的溶解度 D. 40℃时,分别在100g水中各加入30g甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液 15.下列做法不科学的是 A.为便于观察,在教室内关闭门窗做红碑、白磷嫩烧的对比实孩 B.用嫩着的木条区分二氧化碳和氧气 C.在实验室里,将同体药品配制成济液进行化学反应,以提高反应速率 D.测溶液的pH时,用玻璃棒旅取待渊液滴到pH试纸上,把其显示的颜色与标准比色卡比较 16.类推是化学学习中常川的思雄方法。下列类推正确的是 A.活泼金属或酸反应有气体产生,则与酸反应产生气体的一定是活泼金属 B.酸与碱发生中和反应生成盐和水,则生成盐和水的反应一定是中和反应 C.单质一定是由同种元素组成的物质.则由同种元素组成的物质一定是单质 D.碱性溶液能使酚酞溶液变红,则能使阶酞溶液变红的溶液一定是碱性溶液 17.有X、Y、Z三种金属,X在常溢下就能与氧气反应,Y、Z在常很下几乎不与氧气反应;如果把Y和Z分别 放入硝酸银溶液中,过一会儿,在Z表面有银析出,而Y没有变化。根据以上实验事实,到断X、Y、Z 三种金属的活动性由强弱的顺序正确的是 A. XY Z B. XZ Y C. YZ X D. ZY X 18.通常情祝下,铜不和稀硫酸反应。但是把一小块铜片放入适量稀硫酸中,同时加入X再加热,可以发 生如下反应:2Cu+2H2SO4(稀)+X 2CuSO4+2H2O,下列说法正确的是 A.反应前后各元素的化合价役有变化 C.反应后溶液的质量减少 B.反应物X 的化学式是O2 D.反应后溶液会由蓝色变为无色 第II卷(非选择题 共64分) 3二、填空与简答题(每个化学方程式2分,其他每空1分,共40 ) 19.用化学符号或化学式填空。 (1) 2个氮原子_______; (3)小苏打_______;; (2)3个五氧化二磷分子_________; (4)铝元素_______。 20.水是生命之源,也是工农业生产不可缺少的物质。合理利用和保护水资源是我们义不容辞的责任。 (1)下列做法不合理的是______(填序号)。 ①严格监管化肥和农药的使用 ②积极探索污水处理的新技术 ③不间断地放水洗衣服 (2)利用右图所示的简易装置可把海水转化为淡水。下列说法错误的是______(填序号)。 a.小容器中的水为淡水 b.大容器中得到的溶液一定是氯化钠的饱和溶液 c.获得淡水的快慢与温度有关 (3)市售“自热米饭”的自加热原理:饭盒夹层中的水与生石灰接触,反应放出大量热。该反应的化学 方程式为_________。 (4)自来水厂生产自来水的过程中,常加入_______,用来吸附水中一些溶解性的杂质,除去臭味。 21.下图为某化学反应在催化剂作用下的微观模拟示意图,其中“ ”和“ ”分别表示氢原子和氧原子 。(1)虚线框内应填的微观图示是_______________(填序号)。 4A. B. C. D. (2)结合上图,从原子、分子的角度分析,在化学反应过程中,______可分,而______不能再分。 (3)请写出该反应的化学方程式:_______________。 22.化学来源于生活,化学与生活密切相关。 (1)食品包装中常充N2以防腐.是由于N2的化学性质_______。 (2)“合理膳食,均衡营养”会让我们更健康。 ①下列食品中富含糖类的是_______(填序号,下同)。 A.鸡蛋 B.馒头 C.蔬菜 ②为了预防佝偻病,幼儿及青少年可以补充一些含_______元素的食品。 (3)生活中的下列做法,有利于人体健康的是__________ 。 A.食用霉变的花生 B.倡导不吸烟空气 C.食用甲醛溶液浸泡的海产品 (4)已知石蜡的着火点约为190℃,蜡烛的火焰由气态石蜡燃烧形成。如图所示,在温度计示数为280 ℃以上时,快速推动活塞,会观察到蜻烛立即熄灭。 蜡烛熄灭的主要原因是_______(填序号)。 A.移走可燃物 B.隔绝氧气 C.降低温度至者火点以下 (5)影视舞台上经常见到云雾缘绕,使人如入仙境的景象。产生这种景象可用的物质是______。 23. 下列是钠元素、氯元素在元素周期表中的信息及有关粒子的结构示意图。请回答下列问题: (1) D所表示的粒子是______(填写化学符号),氯原子的结构示意图是______(填序号)。 (2)D、F形成化合物的化学式是_________。 5(3)与元素的化学性质关系最密切的是______(填序号)。 ①原子的核外电子数 ③元素的原子序数 ②元素的相对原子质量 ④原子的最外层电子数 24.用玻璃棒蘸硫酸在白纸上写字,如右图。 (1)现象:放置一会儿发现用______(填“浓”或“稀“) 硫酸在白纸上写的字变黑。 (2)结论:同种酸由于______不同,它们的性质不完全相同。 25.食醋中一般含有3%~5%的醋酸,醋酸又叫乙酸(CH3COOH),是无色有刺激性气味的液体,能溶于水。 (1)食醋可以除去水壶内的水垢,水垢的主要成分之一是碳酸钙。除水垢时,可在水壶中加入水, 倒入适量食醋,浸泡一段时间,碳酸钙会转变成可溶性的酷酸钙而被除掉,化学方程式为CaCO3+2CH3C OOH=Ca(CH3COO)2+H2O+CO2↑。 (2)在熬制骨头汤时,常常在汤中加入少量食醋,因为骨头中含有不溶于水的磷酸钙,磷酸钙与醋 酸反应生成可溶性的磷酸二氢钙,能够增加汤内的含钙量,促进人体对钙、磷的吸收和利用。 (3)食醋不仅在厨房中大显身手,还是一种杀菌剂,冬天在屋子里熬食醋可以杀灭细菌,对预防感 口有很大作用。 (4)饮酒过量的人可以用食醋来解酒。因为乙酸能与乙醇发生反应生成乙酸乙酯( CH3COOC 2H5)和水,从而达到解洒的目的。 (5)醋酸能与活泼金属发生置换反应产生氢气,家用铝盆等金属制品不能用来盛放食醋,以免被腐 蚀。 根据以上内容,回答下列问题: (a)乙酸属于_____( 填“有机化合物”或“无机化合物”) 。 (b)乙酸的物理性质________(任答一条)。 (c)食醋能用来解酒的原因是________。 (d)用食醋除水垢,该反应属于基本反应类型中的_________反应。 (e)用铁锅炒菜时,放一点食醋能更好补铁的原因是________。 26.据央视2017年5月18日报道,我国在南海神狐海域从海底以下可燃冰矿藏中成功开采出天然气,成为 全球首例,对缓解我国的能源危机具有非常重要的作用。 6(1)天然气的主要成分是甲烷,甲烷在空气中充分燃烧的化学方程式是________。 (2)开采可燃冰矿藏关键技术之一是防止其泄漏,如果开采过程中大量气体泄漏,会比二氧化碳造 成的___________更严重。 27. A、B、C、D、E、F、G是初中化学常见的物质,A是赤铁矿的主要成分,B、D组成元素相同,E是最轻 的气体.根锯图中相互转化关系回答下列问题(部分反应物、生成物、反应条件已略去)。 (1)写出C、G的化学式:C_______, G________。 (2)写出有关反应的化学方程式: ①_____________;②_______________。 三、实验探究题(每个化学方程式2分,共他每空l分,共12分) 28.根据下图回答问题。 (1)实验室用高锰酸钾制取氧气,选用的发生装置是______(填序号)。 (2)实验室里用装置A制取二氧化碳,其反应的化学方程式是_________。 (3)用装置D收集氧气时,下列实验操作不正确的是______(填序号)。 a.加热前,将集气瓶装满水,用玻璃片盖住瓶口,倒立在盛水的水槽中 b.加热后,观察到水中导管口开始有气泡时,立即收集气体 c.待集气瓶里的水排完后,在水面下用玻璃片盖住瓶口,移出水槽正放在桌面上 29.某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动。请你和他们一起完成以下实验 探究。 7【演示实验】将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中。该反应的化学方程式是__________ ___。 【查阅资料】CaC12 滚液显中性 【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质的成分是什么? 【猜想与假设】针对疑问,甲组同学猜想如下: 猜想I:只有CaC12 猜想II:有__________ 猜想III:有CaC12和Ca(OH)2 猜想IV:有CaCl2、HCl和Ca(OH)2 乙组同学对以上猜想提出质疑,认为猜想IV不合理,其理由是_________________。 【实验探究】为了验证其余猜想,各小组进行了下列三个方案的探究。 实验方案 实验操作 滴加紫色石蕊溶液 通入CO2 滴加Na2CO3溶液 实验现象 产生白色沉淀 溶液中含有Ca(OH)2 溶液中含有Ca(OH)2 溶液中含有Ca(OH)2 ____________ __________ 实验结论 【得出结论】通过探究,全班同学一致确定猜想III是正确的。 【评价反思】 (1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他 们说明原因____________。 (2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外.还需要考虑_______。 四、计算短(30题4分,31题8分,共12分) 30.工业上常用红锌矿(主要含ZnO)和18~25%的稀硫酸为原料制取硫酸锌。 (1)硫酸锌中硫元素和氧元素的质量比是_________ 。 (2)l00g溶质质量分数为98%的浓硫酸配制成溶质质量分数为20%稀硫酸。需要水的质量是________ __。 31.某化学兴趣小组在实验室用硫酸铜溶液和氯化钡溶液反应制取少量氯化铜溶液。他们的实验过程和相 关数据如下(BaSO4不溶于水)。 8第一步:称得烧杯的质量是100g。 第二步:反应前称得烧杯、氯化钡溶液及硫酸铜溶液的总质量是346.6g。 第三步:两者恰好完全反应后,过滤,称得烧杯及滤液的总质量是300g。 请计算:(1)反应后生成沉淀的质量是________g。 (2)所排氯化铜溶液中溶质的质量分数(写出计算过程,精确到0.1%)。 91-5:CADDB 6-10:CABBA 11-15:DCCDA 16-18:DBB 19.(1)2N (2)3P2O3 (3)NaHCO3 (4)Al 20.(1)③(2)b (3)CaO+H2O=Ca(OH)2(4)活性炭 催化剂 21.(1)D(2)分子 原子(3)2H2O2 2H2O+O2↑ 22.(1)不活泼 (2)①B ②钙 (3)B (4)A (5)干冰 23.(1)Na+ B(2)NaCl (3)④ 24.(1)浓 (2)溶液浓度(或溶质的质量分数) 25.(a)有机化合物 (b)无色有刺激性气味的液体(或能溶于水) (c)乙酸能跟乙醇发生反应生成乙酸乙酯和水,从而达到解酒的目的。 (d)复分解 (e)醋酸能与铁发生反应生成易被人体吸收 的物质(答案合理可得分) 26.(1)CH4+2O2 CO2+2H2O (2)温室效应 高温 27.(1)Fe H2CO3 (2)①3CO+Fe2O3 2Fe+3CO2 ②2H2+O2 2H2O 28.(1)B(2)2HCl+CaCO3=CaCl2+H2O+CO2↑ (3)b 29.【演示实验】2HCl+Ca(OH)2=CaCl2+2H2O 【猜想与假设】CaCl2和HCl HCl和Ca(OH)2不能共存 【实验探究】石蕊溶液变蓝 溶液变浑浊 【评价反思】(1)CaCl2与Na2CO3反应也会生成白色沉淀,不能证明一定有Ca(OH)2存在 (2)反应物是否过量 30.(1)1:2 (2)390 31.(1)46.6 (2)13.5% 10
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





