


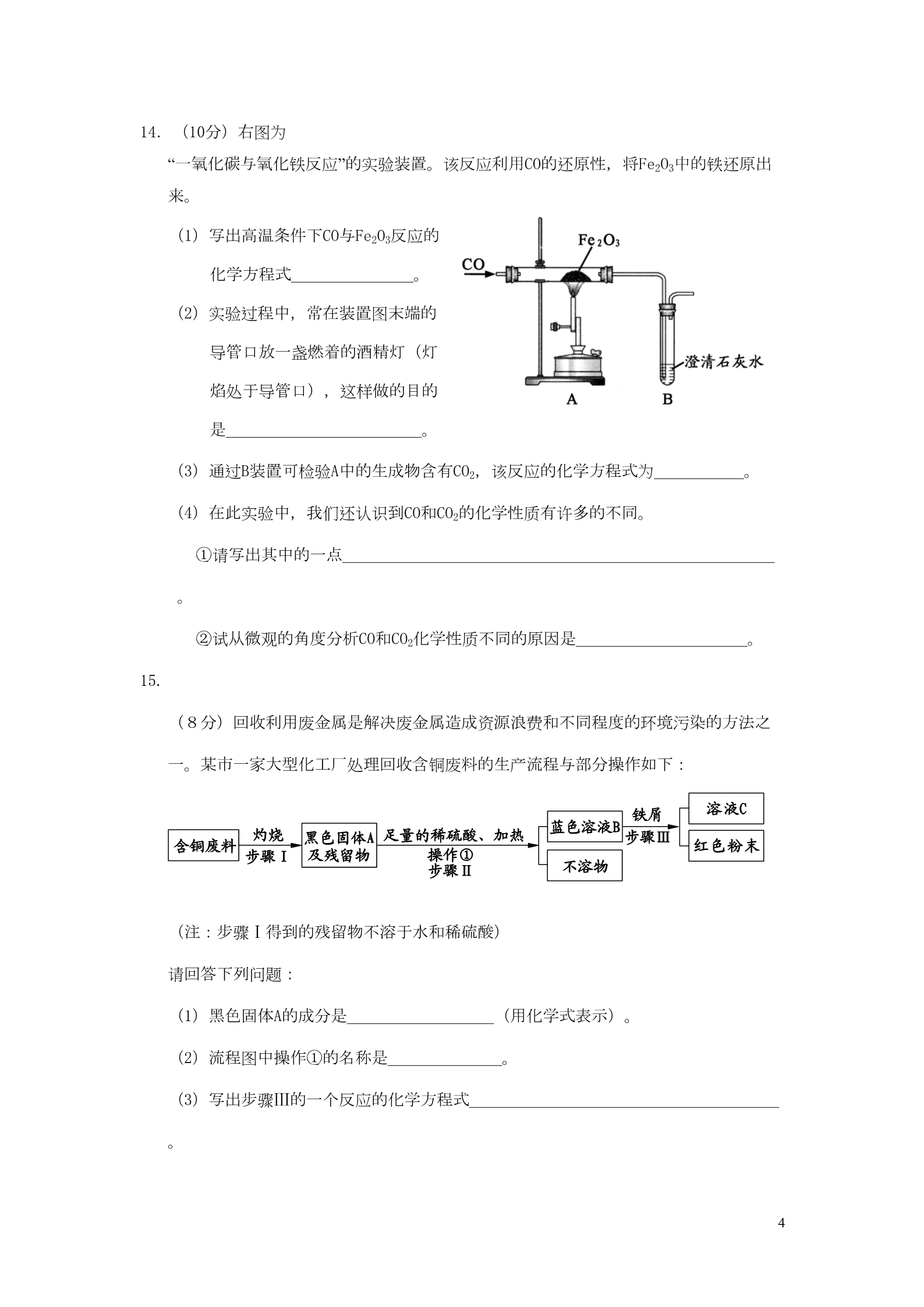

福建省龙岩市2015年中考化学真题试题 (满分:100分 考试时间:60分钟) 注意: 请把所有答案填涂或书写到答题卡上!请不要错位、越界答题! 在本试题上答题无效。 相对原子质量:H-1 C-12 O-16 K-39 Fe-56 第Ⅰ卷 选择卷 一、选择题(本大题共10小题,每题3分,计30分。每小题的四个选项中,只有一个 是正确的) 1.下列变化属于化学变化的是 A.木柴燃烧 B.酒精挥发 C.铁丝弯曲 C.石灰石 D.冰雪融化 D.浓盐酸 2.实验室保存下列物质,不需要密封保存的是 A.浓硫酸 B.氢氧化钠 3.下图所示的实验操作,正确的是 A.验满氧气 B.稀释浓硫酸 C.读取液体体积 D.过滤 4.三氧化二铋(Bi2O3)俗称铋黄,是制作防火纸的材料之一。三氧化二铋中铋元素的化合 价为 A.+3 B.+4 C.-2 D.+2 5.“洁厕灵”与“漂白精”不能混用,二者若混合易产生一种有毒气体X。反应原理为: NaClO + 2HCl = NaCl + X↑ + H2O ,则X的化学式为 A.H2 B.ClO2 C.O2 D.Cl2 6.下列关于O2、CO2的说法正确的是 A.都含有氧分子 B.CO2可用于灭火 C.植物的光合作用可将O2转化成CO2 D.鱼类能在水中生活,证明氧气易溶于水 17.下列是小明“配制50g溶质质量分数为20%的氯化钠溶液”的实验过程。正确的是 A.计算需要氯化钠10g 、水40g B.将氯化钠放到托盘天平右盘称量 C.将氯化钠放在量筒中溶解 D.将配制好的溶液转移一半后,小明认为剩余溶液溶质质量分数为10% 8.锂常被人们誉为“金属味精”。已知锂的核电荷数为3,锂比铝活泼。下列说法错误的是 A.锂是一种金属材料 B.锂原子核外有3个电子 D.锂不能与盐酸反应 C.锂具有良好的导电性 9.右图是甲乙两种固体物质的溶解度曲线,下列说法正确的是 A.甲的溶解度受温度的影响比乙小 B.t1℃时,甲、乙溶解度相等 C.t2℃时,甲的饱和溶液的溶质质量分数等于30% D.可采用降低温度的方法使乙的饱和溶液变为不饱和溶液 10.如图所示,其中甲、乙、丙、丁、戊分别是铁、盐酸、氢氧化钙、二氧化碳、碳酸钠 中的一种。图中相连的两圆表示相应物质能发生反应,已知乙是铁。下列说法错误的 是A.五种物质中,只有铁是单质 B.丙是盐酸 C.戊是氢氧化钙 D.甲与丁反应属于复分解反应 2第Ⅱ卷 非选择卷 二、非选择题(本题包含8题,共70分) 11.(6分)化学源于生活,服务于生活。请从化学的角度回答下列问题: (1)炒菜时油锅中的油不慎着火,可用锅盖盖灭。其灭火的原理是 。 (2)长期饮用硬水对人体健康不利。为了检验某水样是硬水还是软水,可往水样中加 。生活中常用 方法降低水的硬度。 入(3)铁在空气中锈蚀,实际上是铁跟氧气、水等物质作用,发生一系列复杂的化学反 应。请例举一种防止铁制栏杆生锈的措施 。 12.(6分)甲烷(CH4)是天燃气的主要成分。乙炔(C2H2)又称电石气,工业上常用它燃 烧产生的高温切割和焊接金属。 (1)CH4属于 (填“有机物”或“无机物”)。 (2)写出C2H2完全燃烧的化学方程式 ,该反应_________(填“放热”或“吸热”)。 (3)比较所含碳元素的质量分数大小: CH4 C2H2(填“﹤”、“=”或“﹥”)。 13.(8分)右图为电解水的实验装置图。接通电源观察两电极 都有气泡产生。 (1)通电一段时间后,玻璃管a收集到的气体是 , a、b两玻璃管收集的气体体积比约为 。 (2)下图为水分解的微观过程: ①水的分解过程中,不发生变化的微粒是 ②结合实验现象,写出水通电分解的化学方程式 。 。 (3)已知同温同压下,气体的体积比决定于气体的分子个数比。该实验中能够说明水 的化学式为“H2O”的实验现象是 。 (背面还有试题) 314.(10分)右图为 “一氧化碳与氧化铁反应”的实验装置。该反应利用CO的还原性,将Fe2O3中的铁还原出 来。 (1)写出高温条件下CO与Fe2O3反应的 化学方程式 。 (2)实验过程中,常在装置图末端的 导管口放一盏燃着的酒精灯(灯 焰处于导管口),这样做的目的 是 。 (3)通过B装置可检验A中的生成物含有CO2,该反应的化学方程式为 (4)在此实验中,我们还认识到CO和CO2的化学性质有许多的不同。 。 ①请写出其中的一点 。②试从微观的角度分析CO和CO2化学性质不同的原因是 。 15. (8分)回收利用废金属是解决废金属造成资源浪费和不同程度的环境污染的方法之 一。某市一家大型化工厂处理回收含铜废料的生产流程与部分操作如下: (注:步骤Ⅰ得到的残留物不溶于水和稀硫酸) 请回答下列问题: (1)黑色固体A的成分是 (用化学式表示)。 (2)流程图中操作①的名称是 。 (3)写出步骤Ⅲ的一个反应的化学方程式 。4(4)通常在步骤Ⅲ必须加入略过量的“铁屑”,原因是 。516.(12分)某兴趣小组利用下列实验装置,开展O2、CO2的实验室制取和有关性质的研 究。 ABC(1)写出A、C装置编号仪器的名称:① ②。(2)甲同学用稀盐酸和大理石在B装置中反应,该反应的化学方程式为 ,观察到试管中紫色石蕊试液 (填现象)。 (3)乙同学要用KMnO4固体来制取O2,应选用上图中的 装置(填字母),该反应的化学方程式为 ;在完成“氧气的制取与性质”的基础实验后,他还想进行蜡烛在不同浓度的氧气 中燃烧情况的探究,现要较简便地获得两瓶不同浓度的氧气,应选择收集氧气的 方法是 。 17.(12分)酸溶液和碱溶液混合会发生怎样的变化呢?某班级 同学开展如右图所示相关的实验。下面是两个小组的实验 记录与分析。请根据要求回答问题: (1)甲组同学往一定体积10%的氢氧化钠溶液样品中滴加10% 的盐酸(室温下),反应中溶液温度的变化记录如下: 加入盐酸的体积(V)/m 246810 12 14 16 18 20 L溶液温度上升 5. 9. 12. 16. 18. 17. 15. 14. 13. 12. (△t)/℃ 6813512656根据上表数据分析: ①当加入盐酸体积为 。mL时,表明NaOH与HCl恰好完全反应。此判断的依据是 ②当加入6 mL盐酸时,烧杯中溶液仍然呈红色,该溶液中含有的溶质有酚酞和 。6③教材指出:酸与碱中和反应的结果是酸和碱各自的特 性都消失。右图描述的是氢氧化钠与盐酸反应的微观实 质,请从微观的角度分析,甲、乙处应填入的化学符号 依次是 、 (2) 请你参与完成乙组同学的实验记录与分析。 实验操作 实验现象 现象一:有气泡产生 。 分析与结论 1.该氢氧化钠溶液样品 已变质 步骤一:往装有氢氧化钠溶液样品的 试管中先滴加2~3滴的 酚酞试液,再 现象二: 逐滴加入稀盐酸 2.溶液碱性消失 步骤二:取步骤一反应后的溶液,然 现象一:有气泡产生 后逐滴加入该氢氧化钠溶液样品 1.产生“气泡”这一现象 对应的化学方程式为 现象二:溶液开始不变 2.所取的步骤一反应后 色,后逐渐变成红色 的溶液 pH 7(填“﹤”、“=”或“﹥”) 18.(8分)高铁酸钾(K2FeO4)是一种集吸附、凝聚、杀菌等多功能的新型、高效能水处 理剂。198℃以下时能稳定存在,但受热易分解(4K2FeO4 2Fe2O3+4K2O+3O2↑)、遇水将变质(4K2FeO4+10H2O 问题 4Fe(OH)3 +8KOH+3O2↑)。 根据要求回答下列 :(1)取等质量的两份高铁酸钾固体分别加热、与水反应,请通过观察上述化学方程式 ,判断充分反应后产生氧气的质量_________(填“相等”、“不相等”或“无法确定” )。 (2)为检测实验室新买的高铁酸钾固体样品中高铁酸钾的质量分数,某同学取10g样 品进行实验,共收集到氧气0.96g。试通过计算求该样品中高铁酸钾的质量分数。 (已知:K2FeO4的相对分子质量为198) 72015年龙岩市初中毕业、升学考试 参 考 答 案 及 评 分 标 准 化 学 总说明: 1.考生若写出其它正确答案,可参照评分标准给分。 2.化学方程式中,化学式写错的不给分,化学式对而未配平的扣0.5分。 3.化学专用名词中出现错别字、元素符号有错误的均不给分。 4.凡试题中未特别指明某物质是写名称还是化学式,正确写出其一即可给分。 一、选择题(本大题共10题,每题3分,共计30分) 题号 1A2C3B4A5D6B7A8D9B10 C答案 二、非选择题(本大题共8题,共70分) 11.(6分) (1)隔绝氧气 …………………………………………………………………………(2分) (2)肥皂水 煮沸 …………………………………………………(每空1分,共2分) (3)涂油漆(其他合理答案均给分) ………………………………………………(2分) 12. (6分) (1)有机物 …………………………………………………………………………(1分) (2)2C H +5O 2 22 4CO +2H O 2 2 ………………………………………………(2分) 放热 …………………………………………………………………………(1分) (3)﹤ …………………………………………………………………………(2分) 13. (8分) (1)氢气或H2 ……………………………………………………………………(1分) : 2 1 …………………………………………………………………………(1分) (2)①原子(或氧原子、氢原子) ………………………………………………(2分) ②2H O 22H ↑+O ↑ 22……………………………………………………(2分) :(3)氢气与氧气的体积比约为2 1 …………………………………………(2分) 14. (10分) 8(1)3CO+Fe O 2 3 2Fe+3CO ………………………………………………(2分) 2(2)防止反应剩余的一氧化碳逸散,污染空气 ………………………………(2分) (3)Ca(OH)2+CO2 CaCO3↓+H2O ………………………………………………(2分) (4)①一氧化碳可燃,二氧化碳不可燃(其他合理答案均给分) ………………(2分) ② CO与 CO2分子的结构不同 …………(2分) ……………………………… 15. (8分) (1) CuO …………………………………………………………………………………(2分) (2)过滤 ……………………………………………………………………………………(2分) (3) Fe+CuSO4 Cu+FeSO4 (或Fe+H2SO4 H2↑+FeSO4) ……………(2分) (4)使CuSO4溶液充分反应(其他答案酌情给分) ………………………………(2分) 16. (12分) (1)酒精灯 长颈漏斗 …………………………………………………(每空1分,共2分) (2)CaCO3+2HCl (3) CaCl2+H2O+CO2↑ 变红 …………………(每空2分,共4分) A………………………………………………………………………………(2分) 2KMnO4 K2MnO4+MnO2+O2↑ ……………………………………………(2分) 排水法 …………………………………………………………………………………(2分) 17. (12分) (1)①10mL ②氯化钠和氢氧化钠 …………………………………………………(各1分,共2分) 中和反应放热,恰好完全反应时放出热量最多。 …(每空1分,共2分) -+③OH …………………………………………………(各1分,共2分) (2) 实验操作 H实验现象 分析与结 论 现象二:溶液由红色逐渐变成无色 略略1.Na2CO3+2HCl 2NaCl+H2O+CO2↑ 2.< ……………………………………… 略略(9每空2分,共6分) 18. (8分) (1)相等 ………………………………………………………………………(共2分) (2)解:设10g高铁酸钾固体样品中含高铁酸钾质量为X 4K2FeO4 2Fe2O3+4K2O+3O2↑) 792 X 96 0.96 ………………………………(2分) 792:96=X:0.96 ………………………(1分) X=7.92g …………………………………(1分) 7.92g÷10g×100%=79.2% …………(列式、答案各1分,共2分) 答: 该样品中高铁酸钾的质量分数为79.2% 说明:用化学方程式4K2FeO4+10H2O 4Fe(OH) 3+8KOH+3O2↑解题也行。 10
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





