

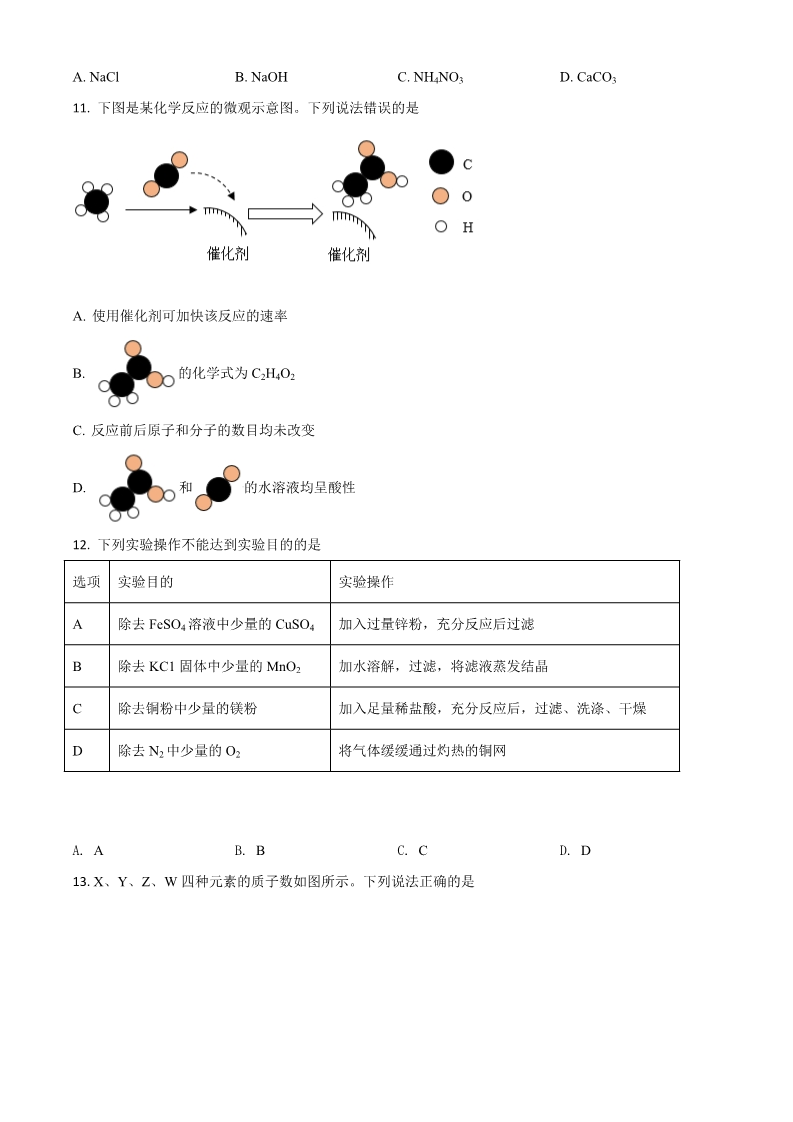
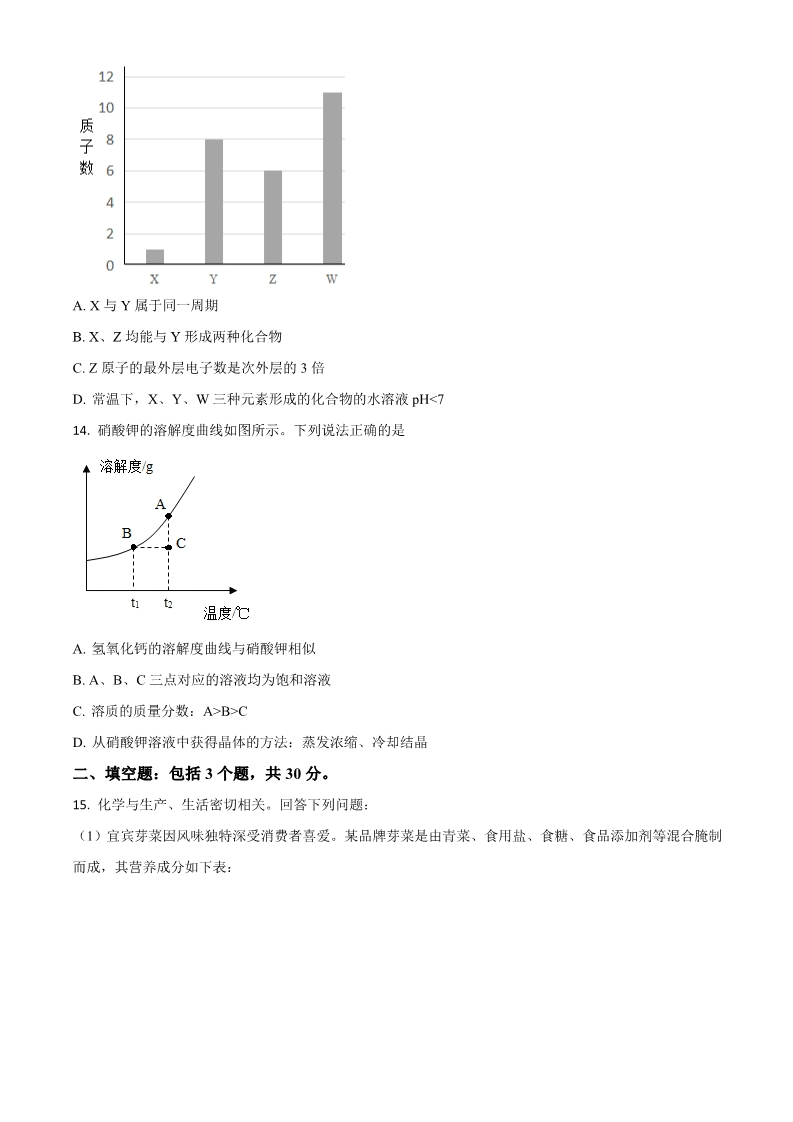

宜宾市 2020 年初中学业水平暨高中阶段学校招生考试 化学 (考试时间:60 分钟;全卷满分:100 分) 注意事项: 1.答题前、务必将自己的姓名、座位号、淮考证号填写在答题卡指定的位重并将答题卡背面座 位号对应标号涂黑。 2.答选择题时,务必使用 2B 铅笔将答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦 擦干净后,再选涂其它答案标号。 3.答非选择题时,务必使用 0:5 毫米黑色签字笔,将答案书写在答题卡规定的位置上。 4.所有题目必须在答题卡规定的位置上作答,在试卷上答题无效。 可能用到的相对原子质量:H1 C12 O16 S32 Cu64 一、选择题:包括 14 个小题,每小题 3 分,共 42 分,每小题只有一个选项符合题意。 1. A. 2. 空气中含量最多的气体是 B. C. D. CO2 O2 下列物质中富含蛋白质的是 B. 糖水 下列物质属于氧化物的是 N2 He A. 豆浆 C. 生理盐水 C. P2O5 D. 苏打水 3. A. HNO3 B. KMnO4 D. Cu(OH)2 4. 下列有关化学用语的表述错误的是 A. 氢氧根:OH- B. 金刚石:C60 C. 5 个臭氧分子:5O3 D. 氯原子的结构示意图: 5. 下列图示的实验操作正确的是 A. 闻气体气味 B. 稀释浓硫酸 C. 测溶液 pH D. 气密性检査 6. 水是生命的源泉。下列说法错误的是 A. 可用明矾净水 B. 水的三态变化属于物理变化 C. 可用肥皂水区别硬水和软水 的D. 电解水生成氢气和氧气 体积比为1:2 7. 铁是一种重要的金属。下列关于铁的叙述错误的是 A. 生铁是纯净物 B. 涂油漆可防止铁生锈 C. 工业上常用赤铁矿冶炼铁 D. 铁与硫酸铜溶液的反应属于置换反应 8. 下列有关盐的用途的说法错误的是 A. 氯化钠是重要的调味品 B. 可用亚硝酸钠代替食盐腌渍食品 C 小苏打可用于培制糕点 D. 碳酸钾可用作化学肥料 9. 五粮液是宜宾最亮丽的名片。下列有关乙醇(C2H6O)的说法错误的是 A. 75%的酒精溶液是常见的医用消毒剂 B. 实验室不慎打翻燃着的酒精灯,可用湿抹布扑灭 C. 在五粮液厂区附近就能闻到酒香味,这是分子运动的结果 D. 乙醇中 C、H、O 元素的质量比为 2:6:1 10. 取某固体物质 5g 加入 20mL 水中,测得溶液的温度随时间变化曲线如图所示。该固体物质可能是 A. NaCl B. NaOH C. NH4NO3 D. CaCO3 11. 下图是某化学反应的微观示意图。下列说法错误的是 A. 使用催化剂可加快该反应的速率 B. 的化学式为 C2H4O2 C. 反应前后原子和分子的数目均未改变 D. 和的水溶液均呈酸性 12. 下列实验操作不能达到实验目的的是 选项 实验目的 实验操作 ABCD除去 FeSO4 溶液中少量的 CuSO4 加入过量锌粉,充分反应后过滤 加水溶解,过滤,将滤液蒸发结晶 除去 KC1 固体中少量的 MnO2 除去铜粉中少量的镁粉 除去 N2 中少量的 O2 加入足量稀盐酸,充分反应后,过滤、洗涤、干燥 将气体缓缓通过灼热的铜网 A. A B. B C. C D. D 13. X、Y、Z、W 四种元素的质子数如图所示。下列说法正确的是 A. X 与 Y 属于同一周期 B. X、Z 均能与 Y 形成两种化合物 C. Z 原子的最外层电子数是次外层的 3 倍 D. 常温下,X、Y、W 三种元素形成的化合物的水溶液 pH<7 14. 硝酸钾的溶解度曲线如图所示。下列说法正确的是 A. 氢氧化钙的溶解度曲线与硝酸钾相似 B. A、B、C 三点对应的溶液均为饱和溶液 C. 溶质的质量分数:A>B>C D. 从硝酸钾溶液中获得晶体的方法:蒸发浓缩、冷却结晶 二、填空题:包括 3 个题,共 30 分。 15. 化学与生产、生活密切相关。回答下列问题: (1)宜宾芽菜因风味独特深受消费者喜爱。某品牌芽菜是由青菜、食用盐、食糖、食品添加剂等混合腌制 而成,其营养成分如下表: ①营养成分表中的“钠”是指_____________(选填“原子”、“分子”或“元素”),主要来源于______________。 ②从营养成分表可知,提供能量的主要物质是________________。 ③该品牌芽菜的外包装袋是由聚丙烯制成,聚丙烯属于______________(填字母序号)。 A 天然高分子材料 B 有机合成材料 C 金属材料 (2)从源头上减少和消除污染是“绿色化学”的重要理念。工业燃煤会产生大气污染物 SO2,为减少 SO2 的排放,煤燃烧时加入生石灰进行“固硫”。 ①化石燃料包括煤、_______________和天然气。 ②SO2 造成的环境污染问题主要是__________________。 ③煤燃烧时需不断鼓入空气,“固硫”最终生成 CaSO4。“固硫”的化学方程式是____________。 16. 阅读下面的短文,回答有关问题 新型灭菌消毒剂——ClO2 目前,新冠肺炎疫情肆虐全球。为抑制新冠病毒传播,“含氯消毒剂”被广泛使用,其中就包含一种新型 灭菌消毒剂——ClO2 在通常情况下,CIO2 是一种有刺激性气味的黄绿色气体,溶点-59℃,沸点 11°C。在 常温下,1L 水中大约能溶解 2.9gClO2。ClO2 受热或者见光易分解,具有强氧化性和很强的腐蚀性。含有 2% 的 ClO2 和 0.085%Na2CO3 的水溶液无色、无臭、无腐蚀性,常温下稳定,不易分解;该溶液用于杀菌、消 毒的同时,还有除臭、防霉、保鲜等作用,是特性优良,高效安全的消毒剂。我国从 2000 起就逐渐用 ClO2 取代氯气(Cl2)对饮用水进行消毒。 (1)ClO2 的名称是_____________,分子中氯元素的化合价是______________。 (2)下列消毒剂中,不属于“含氯消毒剂”的是____________(填字母序号)。 A84 消毒液(含 NaClO) B 双氧水 C 氯气 D 过氧乙酸(C2H4O3) (3)ClO2 的化学性质有_____________(写出两点即可)。 (4)下列有关 ClO2 的说法正确的是_____________(填字母序号)。 A0℃时,ClO2 为黄绿色气体 B 常温下,100g 水中大约能溶解 0.29gClO2 C 用棕色试剂瓶盛装 ClO2 并置于冷暗处保存 DClO2 溶液浓度越小杀菌效果越差 (5)ClO2 遇热水生成次氯酸(HClO)和两种气态单质。完成该反应的化学方程式: 8ClO2 +2H2O ______+______+______。 的工业上以石灰石为原料制备碳酸钙 工艺流程如下: 17. 回答下列问题: (1)石灰石粉末与稀盐酸反应的化学方程式是__________。实验室发生该反应时,发生装置应选_________ (填字母序号,下空同),收集气体时应选用_________。 (2)操作Ⅰ和操作Ⅱ为同一操作,其名称是_________,该操作需要用到的玻璃仪器有烧杯、玻璃棒和 _________。 (3)溶液 A 中先通入 NH3 的目的是提供碱性环境,增大 CO2 的溶解量,促使反应进行。 ①通 CO2 时,在溶液 B 中生成 CaCO3,该反应的化学方程式是_________。 ②为使溶液 B 中的物质顺利转化为 CaCO3,除了通 NH3 外,还可加入_________(填字母序号)。 ANaCl BNaOH CKOH D Ca(OH)2 三、实验与探究题:包括 2 个题,共 20 分 18. 实验室按下图步骤配制 100g 质量分数为 22%的蔗糖溶液。 回答下列问题: (1)所需蔗糖的质量为___________。 (2)用规格为__________(填“50”、“100”或“500”)mL 的量筒量取________mL 蒸馏水倒入盛有蔗糖 的烧杯中进行溶解。(水的密度约为 1g/cm3)。 (3)溶解时玻璃棒的作用是_________。 (4)下列情况会导致所配溶液中溶质的质量分数偏高的是_________(填字母序号) A 蔗糖中混有少量杂质 B 称量时蔗糖和砝码位置放反了(使用了游码) C 用于溶解蔗糖的烧杯洗净后残留有少量的水 D 用量筒量取水时,俯视读数 19. 某“自加热食品”发热包的主要成分为生石灰、活性炭、铝粉、铁粉、碳酸钠和氯化钙,其使用说明如 下图: 某化学兴趣小组对发热包进行了如下探究 探究 I:发热包的发热原理 将发热包中固体倒入烧杯中,加入适量水,发生剧烈反应,水很快沸腾。反应结束后,烧杯底部有大量固 体,继续加水搅拌,过滤、洗涤、干燥,得到固体混合物。 (1)发热包中的某成分与水反应放出大量的热,该反应的化学方程式是_____________。 探究Ⅱ:固体混合物的成分 查阅资料:单质铝既能与盐酸反应又能与氢氧化钠溶液反应,并产生 H2 的小组同学认为固体混合物 成分可能是:活性炭、铝粉、铁粉、碳酸钙和氢氧化钙。为进一步探究其成分, 小组同学设计并进行如下实验: (2)取少量固体于试管中,加水振荡,静置,滴入几滴酚酞溶液,溶液变为红色,证明固体中含有___________。 (3)另取少量固体于锥形瓶中,逐渐加入稀盐酸至不再产生气泡为止(如下图),反应停止后瓶底有黑色 固体剩余,溶液呈浅绿色。 ①反应停止后,瓶底的黑色固体为_____________,判断依据是__________。 ②当观察到___________现象,证明固体中含有 CaCO3。 ③证明固体中含有铁粉的现象是___________。 (4)设计实验方案证明固体混合物中含有铝粉。____________(可供选择的试剂:CuCl2 溶液、稀盐酸、 NaOH 溶液) 四、计算题:共 8 分。 20. 某实验小组为测定铜和氧化铜的混合物中铜元素的含量,取 20g 该固体混合物,向其中逐滴加入稀 H2SO4,测得剩余固体的质量与加入稀 H2SO4 的质量关系如下图所示。 回答下列问题: (1)写出滴加稀 H2SO4 时发生反应的化学方程式__________。 (2)该固体混合物中铜元素的质量为_________。 的(3)计算稀 H2SO4 中溶质 质量分数(写出计算过程)。 本试卷的题干 0635
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





