
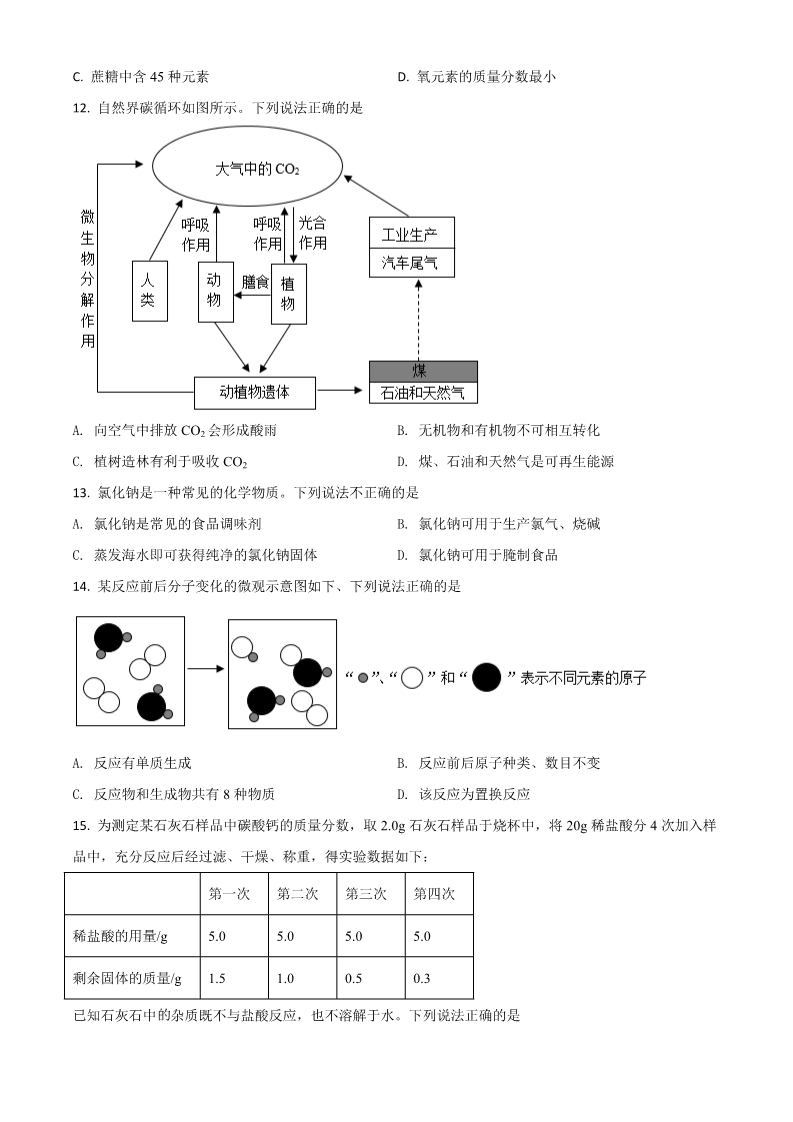
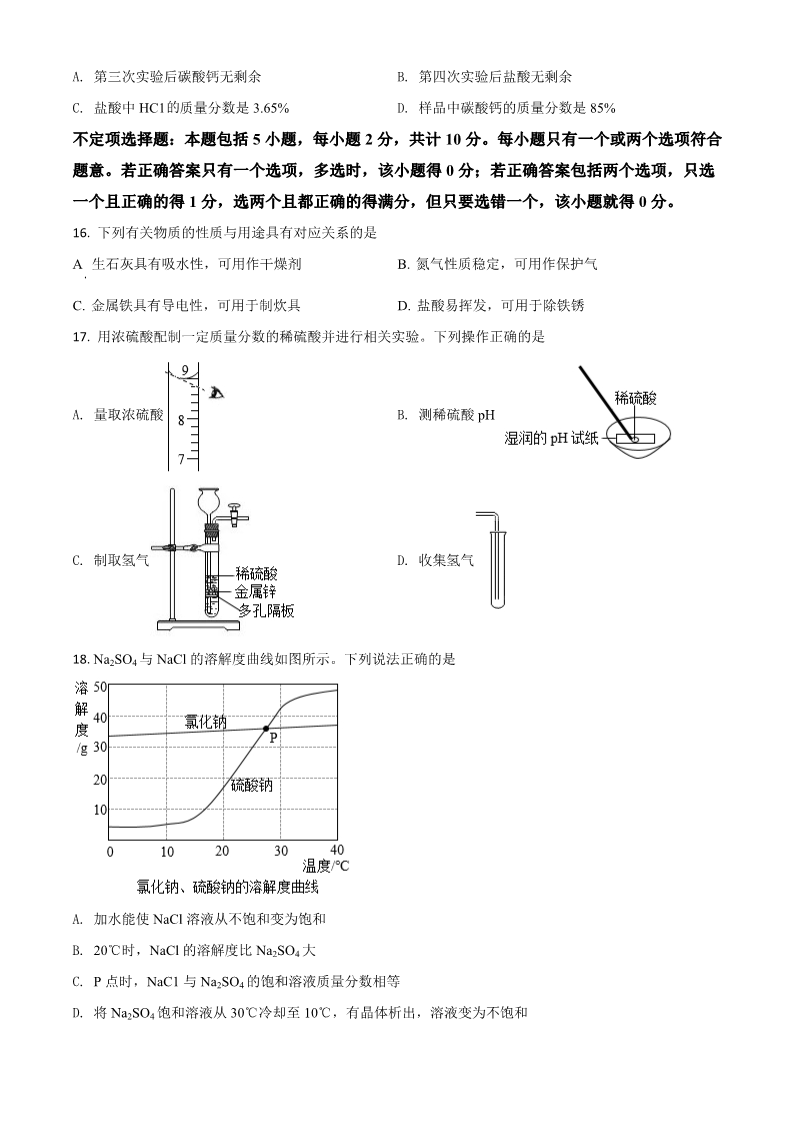


2021 年中考化学试题 选择题 单项选择题:本题包括 15 小题,每小题 2 分,共计 30 分。每小题只有一个选项符合题意。 1. A. 2. 人体中含有多种元素。下列属于人体必需微量元素的是 B. C. D. 氧铁碳氢下列过程中只发生物理变化的是 B. 冰雪融化 下列物质由分子构成的是 A. 高炉炼铁 C. 食物变质 C. 金刚石 D. 木材燃烧 D. 水 3. A. 氢氧化钾 B. 铝 4. 自然界中的物质大多数是化合物。下列化合物属于酸的是 A. KCl B. NaOH C. CuO D. HNO3 D. 抗腐蚀性 5. 金可制成金箔,拉成金丝,说明金具有良好的 A. 导电性 B. 延展性 C. 导热性 6. “安全重于泰山”。以下应张贴在“防火”场所的标志是 A. B. C. D. 2FeCl +Cu=CuCl +2X 7. FeCl3 溶液用于制作印刷电路板,反应为 。X 的化学式是 D. Fe(OH)3 32A. 8. B. C. Fe(OH)2 Fe FeCl2 下列物质对应组成不正确的是 A. 干冰:CO2 B. 小苏打:NaHCO3 C. 纯碱:Na2CO3 D. 熟石灰:CaO 9. 测得一些物质的 pH 如下,其中酸性最强的是 A. 肥皂水:pH=10.2 B. 唾液:pH=6.8 C. 柠檬汁:pH=2.5 D. 洗涤剂:pH=12.2 10. 下列属于化合反应的是 点燃 Δ3Fe+2O2 Fe3O4 NH4Cl NH3 +HCl A. B. D. BaCl2 +K2SO4 =BaSO4 +2KCl Zn+CuSO4 =Cu+ZnSO4 C. 11. 蔗糖的分子式为 C12H22O11,下列关于蔗糖的说法正确的是 B. A. H、O 原子个数比为 2:1 相对分子质量为(12+1+16) C. D. 氧元素的质量分数最小 蔗糖中含 45 种元素 12. 自然界碳循环如图所示。下列说法正确的是 A. 向空气中排放 CO2 会形成酸雨 C. 植树造林有利于吸收 CO2 B. 无机物和有机物不可相互转化 D. 煤、石油和天然气是可再生能源 13. 氯化钠是一种常见的化学物质。下列说法不正确的是 A. 氯化钠是常见的食品调味剂 C. 蒸发海水即可获得纯净的氯化钠固体 B. 氯化钠可用于生产氯气、烧碱 D. 氯化钠可用于腌制食品 14. 某反应前后分子变化的微观示意图如下、下列说法正确的是 A. 反应有单质生成 B. 反应前后原子种类、数目不变 D. 该反应为置换反应 C. 反应物和生成物共有 8 种物质 15. 为测定某石灰石样品中碳酸钙的质量分数,取 2.0g 石灰石样品于烧杯中,将 20g 稀盐酸分 4 次加入样 品中,充分反应后经过滤、干燥、称重,得实验数据如下: 第一次 5.0 第二次 5.0 第三次 5.0 第四次 5.0 稀盐酸的用量/g 剩余固体的质量/g 1.5 1.0 0.5 0.3 的已知石灰石中 杂质既不与盐酸反应,也不溶解于水。下列说法正确的是 A. 第三次实验后碳酸钙无剩余 B. 第四次实验后盐酸无剩余 的C. 盐酸中 HC1 质量分数是 3.65% D. 样品中碳酸钙的质量分数是 85% 不定项选择题:本题包括 5 小题,每小题 2 分,共计 10 分。每小题只有一个或两个选项符合 题意。若正确答案只有一个选项,多选时,该小题得 0 分;若正确答案包括两个选项,只选 一个且正确的得 1 分,选两个且都正确的得满分,但只要选错一个,该小题就得 0 分。 16. 下列有关物质的性质与用途具有对应关系的是 A 生石灰具有吸水性,可用作干燥剂 C. 金属铁具有导电性,可用于制炊具 B. 氮气性质稳定,可用作保护气 D. 盐酸易挥发,可用于除铁锈 17. 用浓硫酸配制一定质量分数的稀硫酸并进行相关实验。下列操作正确的是 A. 量取浓硫酸 B. 测稀硫酸 pH C. 制取氢气 D. 收集氢气 18. Na2SO4 与 NaCl 的溶解度曲线如图所示。下列说法正确的是 A. 加水能使 NaCl 溶液从不饱和变为饱和 B. 20℃时,NaCl 的溶解度比 Na2SO4 大 C. P 点时,NaC1 与 Na2SO4 的饱和溶液质量分数相等 D. 将 Na2SO4 饱和溶液从 30℃冷却至 10℃,有晶体析出,溶液变为不饱和 19. 根据下列实验操作和现象所得到的结论正确的是 选项 A实验操作和现象 结论 将某气体通过灼热的黑色氧化铜固体,固体变红 将铜片和银片投入稀硫酸中,均无气泡放出 向 NaOH 溶液中滴加稀盐酸,无明显现象 向某溶液中滴加酚酞试液,有红色出现 该气体是氢气 B铜、银的金属活动性相同 该过程中未发生化学反应 该溶液显碱性 CDA. A B. B C. C D. D 20. Fe2(SO4)3 溶液用于脱除 H2S,并由反应Ⅱ再生,原理如下图所示。下列说法正确的是 A. 反应过程中,S、O 和 Fe 的化合价发生了变化 B. 理论上每生成 16gS,需补充 200g Fe2(SO4)3 C. 理论上每生成 32gS,同时有 16gO2 参与反应 D. 理论上反应Ⅱ中每生成 18gH2O,同时消耗 152 g FeSO4 非选择题 21. 扬州被称为运河之都、文化之都和美食之都,自古人文荟萃。 (1)故人西辞黄鹤楼,烟花三月下扬州。一唐·李白 ①孟浩然“下扬州”的交通工具是木船。现代游船常用玻璃钢制造船体,玻璃钢属于______(填“复合材 料”或“金属材料”)。 ②现代人远行可乘坐飞机。铝锂合金材料大量运用于国产 C919 大飞机的制造,下列不属于铝锂合金性质的 是______(填字母)。 A.密度大 B.硬度大 C.抗腐蚀 ③汽车是重要的陆路交通工具。燃油车辆须加装尾气催化净化装置,该装置将尾气中的 CO 和 NO 转化成 CO2 和一种无污染的气体,发生反应的化学方程式是______。 (2)天下三分明月夜,二分无赖是扬州。一唐·徐凝 ①空气质量影响人们观赏明月。空气属于______(填“混合物”或“纯净物”)。 ②下列做法不利于改善空气质量的是______(填字母)。 A.风力发电 B.徒步出行 C.垃圾露天焚烧 ③煤的气化和液化可实现能源清洁化,改善空气质量。水煤气中 CO 和 H2 在高温、高压和催化剂条件下合 成甲醇(CH4O),该反应的化学方程式是______。 (3)前日扬州去,酒熟美蟹蜊。一宋·梅尧臣 ①蟹肉鲜美,富含蛋白质。蛋白质水溶液在加热时会生成沉淀,此沉淀______(填“能”或“不能”)重新 溶解于水中。 ②各种酒中都含有乙醇(C2H6O)。在酿酒过程中,粮食中的______(填糖类名称)先转化为葡萄糖,再经 发酵生成乙醇。 ③下列食品中富含维生素 C 的是______(填字母)。 A.盐水鹅 B.西红柿 C.大虾 22. 水是一种常见的溶剂,也是重要的资源。 (1)实验室用 NaC1 固体配制 50g15%NaCl 溶液。 ①使用托盘天平称取______gNaC1 固体。 ②溶解过程中需要用到的玻璃仪器有烧杯、量筒、胶头滴管和______(填仪器名称)。 (2)大多数天然淡水需要经过处理方可直接饮用。 ①工厂锅炉长期使用会形成水垢,可用盐酸去除。写出水垢中 Mg2(OH)CO3 溶于盐酸时发生反应的化学 2方程式______。 ②某家用净水机工作原理如下图所示: 净水机中,PP 棉净水原理是______(填“过滤”或“蒸馏”),颗粒活性炭可去除异味和余氯,是因为活性 炭具有良好的______性。 (3)扬州积极推进水环境整治,建设“秀美瘦西湖,文明新扬州”。 ①环保部门对水质进行长期监测,将水质从“优”到 “劣”分为Ⅰ~V 类。由如图可知,近年来扬州市Ⅱ~Ⅲ 类优良水质百分比明显呈______(填“上升”或“下降”)趋势。由此推断,扬州市主要水域的水质在______ (填“变好”或“变差”)。 ②产生这种变化趋势的原因可能是______(填字母)。 A.夜间排放工业污水 B.清理污染河道的淤泥 C.关停或整改存在污染隐患的企业 (4)污水未经处理直接排入河流,会使水面上藻类物质大量繁殖,水质恶化。某藻类含化学式为 C106H263O106N16P 的物质,则污水中导致藻类生长过快的营养元素是______(填元素名称)。 23. 氧气支持生命活动,也是一种重要的化工原料。 (1)实验室用如图所示的装置制取少量氧气。 ①仪器 a、仪器 b 的名称分别是______、______。 ②锥形瓶内发生反应的化学方程式是______。 (2)工业上有多种制取氧气的方法,如: 方法一:在低温、加压条件下,将空气液化。然后将温度升高至-196℃~-183℃之间,使液态氮气先蒸发, 剩余液态氧气储存于钢瓶里。 方法二:利用电解水的方法制取氧气,将得到的氧气干燥。在低温、加压条件下,使之转化为液态,储存 于钢瓶里。 ①从构成物质的微粒视角分析,在方法一空气液化过程中,主要改变的是______。 ②某工厂用方法二制取氧气,发现氧气的产量略小于理论值,且所得氧气中有淡淡的鱼腥气味。从元素守 恒角度分析,该鱼腥气味的气体是______(填化学式或名称)。 (3)氢气和氧气在 Pd 基催化剂表面可反应生成 H2O2,其微观示意图如下: “解离”时,结构被破坏的分子是______(填化学式)。 (4)为探究双氧水的分解,进行以下两个实验: ①氯化物对双氧水分解的影响。 反应条件:6.0mL30%双氧水,0.1g 氯化物,室温;实验时间:1.5h。 实验数据如下表所示: 氯化物 NaCl MgCl2 CuCl2 放出氧气的体积/mL 双氧水的分解率/% 2.0 4.0 420.0 63.18 0.30 0.60 由上表可知,双氧水保存时应绝对避免引入的离子是______(写离子符号)。 的②pH 对双氧水分解 影响。 反应条件:6.0mL30%双氧水,60℃;用 NaOH 溶液调 pH;实验时间:1.5h。实验结果如图所示: 由如图可知,pH 为______(填数字)时,双氧水的分解率最高。 (5)用双氧水可制得“鱼浮灵”、“钙多宝”。 ①“鱼浮灵”主要成分是 2Na2CO3·3H2O2,可迅速增加水体含氧量,其原因是______。 ②“钙多宝”主要成分是 CaO2,常温下能与水反应生成氢氧化钙和氧气。长时间存放的过氧化钙中含有主 要杂质是______(填化学式)、Ca(OH)2。 24. 天然气(主要成分为 CH4)作为清洁能源,正逐步走进城乡居民生活。 (1)“西气东输”工程利于国家能源和产业结构调整,极大改善了沿线居民生活质量。 ①为防止传输天然气的钢管被腐蚀,可采取的措施有______(写出一种)。 ②CH4 完全燃烧的化学方程式是______,该过程______(填“释放”或“吸收”)能量。 ③天然气的使用可有效减少酸雨形成。下列现象与酸雨有关的是______。 A.石刻文物被腐蚀 B.全球海平面上升 (2)工业上以 CH4 为原料生产 H2,制取原理如下图所示: 已知变换塔、洗涤塔发生的主要反应依次是: 一定条件 CO+H2O CO2 +H2 CO +H O=H CO ,2 22 3 m CH 4 =______。 ①“转化炉”中有 H2 产生,参加反应的 CH4 与 H2O 的质量比 m HO 2②“洗涤塔”中气体从塔底通入,水从塔顶喷淋。这样操作的优点是______。 ③若有 32gCH4 参与反应(假设各步反应都完全转化),理论上可制得______gH2。 (3)我国是世界上首个成功试采海域可燃冰的国家。可燃冰是 CH4 被 H2O 分子形成的笼包裹,在海底低 温和高压作用下形成的结晶物质。 ①可燃冰样品常存放于液氮储存罐中,其原因是______。 ②可燃冰有多种结构,某 H 型可燃冰的化学式为 CH4·xH2O,分析其结构发现:平均 34 个 H2O 分子构成 6 个笼,每个笼只容纳一个 CH4 或 H2O 分子,这 6 个笼内容纳的 CH4 与 H2O 分子个数比是______(填最小整 数比)。 25. 以某菱镁矿石(主要成分是 MgCO3,含少量 MnCO3、SiO2)制取 MgSO4·7H2O,流程如下: (1)“酸浸”时,为了提高浸取率,除了搅拌、提高硫酸浓度外,还可采取的措施有______(写出一种)。 此时,MnCO3 发生反应的化学方程式是______。 NaC1O+MnSO +H O=MnO +NaCl+H SO (2)“转化”时主要反应是 4 ,氯元素反应前后化合价变 4222化情况是______(填“升高”或“降低”)。 (3)硫酸镁溶液在不同温度下进行浓缩结晶,可得到不同的晶体: 温度/℃ -3.9-1.8 1.8-48.1 48.1-67.5 67.5-200 析出晶体 MgSO4·12H2O MgSO4·7H2O MgSO4·6H2O MgSO4·H2O 等 ①“操作 1”的具体操作是:蒸发浓缩滤液至表面有晶膜出现(此时 MgSO4 溶液已饱和)、______、过滤、 洗涤、低温干燥。 ②“操作 1”所得滤液中能分离出一种可循环使用的物质,该物质是______(填化学式)。循环使用的目的 是______。 (4)已知:MgSO4·7H2O 中镁元素质量分数为 9.76%,采用热分析法测定所得 MgSO4·7H2O 样品中镁元 素质量分数: ①未加热前,测得样品中镁元素质量分数略大于 9.76%,可能的原因是______。 ②高于 900℃后,测得剩余固体中镁元素质量分数大于 20%,可能的原因是______。 (5)若用 100t 菱镁矿石可制得 246 t MgSO4·7H2O 产品,忽略反应过程中镁元素损失,求该菱镁矿石中 MgCO3 的质量分数。(写出计算过程)______。
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





