
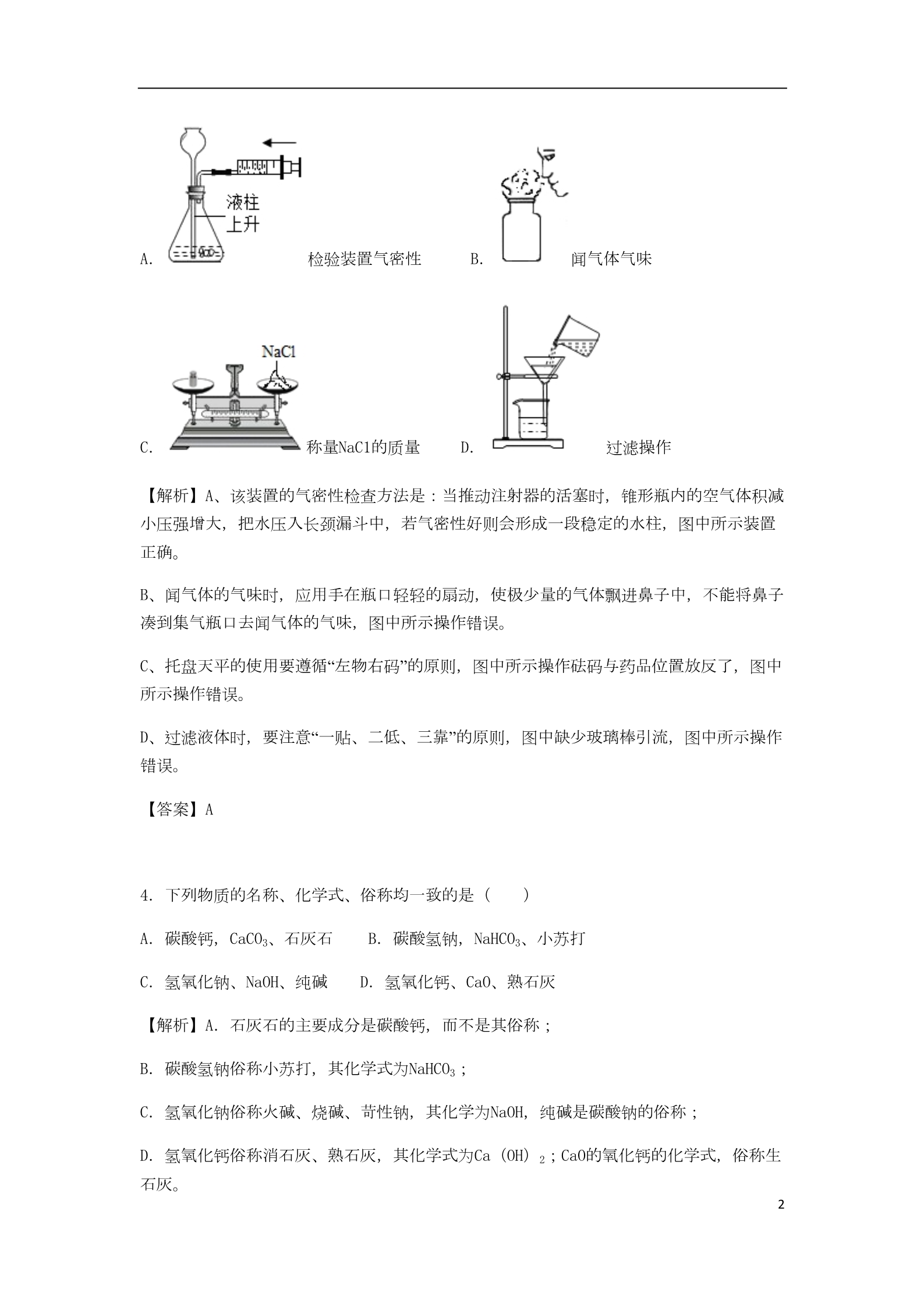



黑龙江省龙东地区2018年中考化学真题试题 一、选择题(本题共15小题,每小题2分,共30分,每小题只有一个正确选项,请将正确 选项的序号填入括号内) 1.下列变化与其它三种变化有本质不同的是( ) A.酒精挥发 B.海市蜃楼 C.面包发霉 D.制作雪雕 【解析】A、酒精挥发过程中只是状态发生改变,没有新物质生成,属于物理变化。 B、海市蜃楼过程中没有新物质生成,属于物理变化。 C、面包发霉过程中有新物质生成,属于化学变化。 D、制作雪雕过程中只是形状发生改变,没有新物质生成,属于物理变化。 【答案】C 2.下列物质中,前者属于单质、后者属于混合物的是( ) A.生铁、天然气 C.干冰、可乐 B.金刚石、净化后的空气 D.液氧、冰水混合物 【解析】A、生铁中含有铁和碳,属于混合物、天然气的主要成分是甲烷,属于混合物,不 符合题意; B、金刚石是由碳元素组成的单质、净化后的空气中含有氧气、氮气、二氧化碳等物质,属 于混合物,符合题意; C、干冰是固体的二氧化碳,属于化合物、可乐属于混合物,不符合题意; D、液氧属于单质、冰水混合物是由水一种物质组成,属于纯净物,不符合题意; 【答案】B 3.下列实验操作正确的是( ) 1A. 检验装置气密性 B. 闻气体气味 C. 称量NaC1的质量 D. 过滤操作 【解析】A、该装置的气密性检查方法是:当推动注射器的活塞时,锥形瓶内的空气体积减 小压强增大,把水压入长颈漏斗中,若气密性好则会形成一段稳定的水柱,图中所示装置 正确。 B、闻气体的气味时,应用手在瓶口轻轻的扇动,使极少量的气体飘进鼻子中,不能将鼻子 凑到集气瓶口去闻气体的气味,图中所示操作错误。 C、托盘天平的使用要遵循“左物右码”的原则,图中所示操作砝码与药品位置放反了,图中 所示操作错误。 D、过滤液体时,要注意“一贴、二低、三靠”的原则,图中缺少玻璃棒引流,图中所示操作 错误。 【答案】A 4.下列物质的名称、化学式、俗称均一致的是( ) A.碳酸钙,CaCO3、石灰石 C.氢氧化钠、NaOH、纯碱 B.碳酸氢钠,NaHCO3、小苏打 D.氢氧化钙、CaO、熟石灰 【解析】A.石灰石的主要成分是碳酸钙,而不是其俗称; B.碳酸氢钠俗称小苏打,其化学式为NaHCO3; C.氢氧化钠俗称火碱、烧碱、苛性钠,其化学为NaOH,纯碱是碳酸钠的俗称; D.氢氧化钙俗称消石灰、熟石灰,其化学式为Ca(OH)2;CaO的氧化钙的化学式,俗称生 石灰。 2【答案】B 5.图例为镁原子的结构示意图,下列所示粒子化学性质与其相似的是( ) 【解析】决定元素化学性质的是最外层电子数,原子的最外层电子数相同,具有相似的化 学性质;由题干中提供的镁原子的结构示意图可知,该粒子的最外层电子数为2,则与其化 学性质相似的粒子结构示意图中最外层电子数也应为2。 A、该粒子的最外层电子数为8,不符合要求,故选项错误。 B、该粒子的最外层电子数为2,但其核外只有一个电子层,属于稀有气体元素的原子,化 学性质稳定,尽管最外层电子数相同,但它们化学性质不相似,不符合要求,故选项错误 。C、该粒子的最外层电子数为1,不符合要求,故选项错误。 D、该粒子的最外层电子数为2,在化学反应中易失去2个电子而形成阳离子,符合要求,故 选项正确。 【答案】D 6.下列有关实验现象描述正确的是( ) A.打开盛有浓盐酸试剂瓶的瓶塞,瓶口出现大量白烟 B.将一氧化碳通入装有灼热氧化铜的玻璃管,生成铜和二氧化碳 C.铁丝在空气中剧烈燃烧,火星四射,生成黑色固体 D.向蒸馏水中加入适量肥皂水搅拌,产生大量泡沫 【解析】A、打开盛浓盐酸试剂瓶的瓶塞,瓶口上方出现白雾,而不是白烟; 3B、生成铜和二氧化碳是实验结论不是现象; C、铁丝在空气中不燃烧; D、向蒸馏水中加入适量肥皂水搅拌,产生大量泡沫。 【答案】D 7.我国颁布的《饮用天然矿泉水标准》严格规定了饮用天然矿泉水中的溴酸盐指标限量, 过量添加溴酸钾(KBrO3)会致癌,其中溴元素(Br)的化合价为( )A.+1 B.+3 C.+5 D.+6 【解析】根据在化合物中正负化合价代数和为零,设溴的化合价是x,可得溴酸钾(KBrO3 )中溴元素的化合价为:(+1)+x+(﹣2)×3=0,则x=+5; 【答案】C 8.如图是汽车尾气中有毒气体转变为无毒气体的微观示意图,图中不同的圆球代表不同原 子。下列说法错误的是( ) A.反应前后原子的种类、数目均无变化 B.此反应不属于置换反应 C.反应中有单质生成 D.参加反应的两种分子的个数比为2:1 【解析】观察图示可知反应前后存在相同的分子情况,所以该图示可简化为: ;A、由反应图示可知反应前后原子种类不变、原子个数不变,所以可得到原子在化学变化中 不可分的结论; 4B、反应前的分子是由不同种原子构成的两种化合物的分子,故该反应一定不是置换反应; C、观察图是可知:反应后生成了一种由同种原子构成的单质分子,因此此反应有单质生成 ;D、反应前的两种分子各有2个分子参加反应,因此参加反应的两种分子的个数比为1:1。 【答案】D 9.小明发现自家农田里的作物叶色发黄,并且茎杆软弱容易倒伏,他应该施用下列化肥( )A.KNO3 B.CO(NH3)2 C.K2CO3 D.Ca3(PO4)3 【解析】植物出现了倒伏、叶色发黄的现象,这说明植物缺少氮元素和钾元素; A、KNO3中含有氮元素和钾元素,属于复合肥; B、CO(NH3)2中含有氮元素,属于氮肥; C、K2CO3中含有钾元素,属于钾肥; D、Ca3(PO4)3中含有磷元素,属于磷肥; 【答案】A 10.人体中的钙元素主要以羟基磷酸钙[Ca10(PO4)6(OH)2]的形式存在于骨骼和牙齿中,关 于羟基磷酸钙的说法正确的是( ) A.该物质由四种元素组成 B.该物质中钙元素与氢元素的质量比为5:1 C.它的相对分子质量为1004g D.它属于有机化合物 【解析】A.由化学式可知,羟基磷酸钙由钙、磷、氧、氢四种元素组成的; B.该物质中钙元素与氢元素的质量比为(40×10):(1×2)=200:1; C.相对分子质量的单位不是“g”而是“1”,通常省略不写; D.羟基磷酸钙中不含碳元素,所以不属于有机化合物。 5【答案】A 11.如图所示,将液体X加入到集气瓶中与固体Y作用,观察到气球逐渐变大,如表中液体X 和固体Y的组合,符合题意的是( ) ①②水③水④⑤水稀盐酸 铁粉 XY双氧水 二氧化锰 氢氧化钠 氯化钠 硝酸铵 A.①②⑤ B.①③④ C.①②④ D.②③⑤ 【解析】①稀盐酸和铁粉混合能生成大量的氢气,会使气球膨胀起来; ②氢氧化钠固体溶于水会放出大量的热,瓶中气温升高气体膨胀体积变大,瓶内压强增大 ,小气球鼓起来; ③氯化钠溶于水后,温度没有明显变化,气球没有明显变化; ④氧化锰和过氧化氢溶液混合能生成大量的氧气,会使气球膨胀起来; ⑤NH4NO3粉末溶于水,温度降低,瓶内压强减小,气球会变小。 【答案】C 12.下列说法正确的是( ) A.汽油清洗油污利用乳化原理 B.分子与原子的区别是分子大,原子小 C.鉴别羊毛与涤纶可采用点燃闻气味的方法 D.物质燃烧需要氧气是因为氧气具有可燃性 6【解析】A.用汽油清洗衣服上的油污是利用溶解原理; B.在化学变化中分子分成原子,原子再重新组合成新的分子,所以分子与原子的主要区别 是:在化学变化中是否可分; C.羊毛的成分是蛋白质,灼烧有烧焦羽毛的气味,而化纤制品灼烧没有烧焦羽毛的气味, 故鉴别羊毛和涤纶可采用点燃闻气味的方法; D.氧气具有助燃性没有可燃性。 【答案】C 13.为治理SO2污染,某市环保部门派出飞机喷微x粉末吸收SO2反应原理为:2X+2SO2+O2= ==2CaSO3+2CO2,X的化学式是( ) A.CaO B.Ca(OH)2 C.Na2CO3 D.CaCO3 【解析】由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式2X+2 SO2+O2===2CaSO3+2CO2,反应前钙、硫、氧、碳原子个数分别为0、2、6、0、,反应后的 生成物中钙、硫、氧、碳原子个数分别为2、2、10、2,根据反应前后原子种类、数目不变 ,则2X分子中含有2个钙原子、2个碳原子和6个氧原子,则每个X分子由1个钙原子、1个碳 原子和3个氧原子构成,则物质X的化学式为CaCO3。 【答案】D 14.下列操作能达到目的是( ) A.稀释浓硫酸时,将水沿容器壁慢慢注入浓硫酸中,并不断搅拌 B.溶解食盐时用玻璃棒搅拌以增大氯化钠的溶解度 C.用湿润的pH试纸测量酸雨的酸碱度 D.蒸发操作中,当蒸发中出现较多固体时,停止加热 【解析】A、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌, 以使热量及时地扩散;一定不能把水注入浓硫酸中; B、溶解食盐时用玻璃棒搅拌,目的是加快溶解速率,而不是增大氯化钠的溶解度; C、用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的 pH试纸上,与标准比色卡对比来确定pH。不能用水湿润pH试纸,否则稀释了待测溶液,使 7酸雨的酸性减弱,测定结果偏大; D、蒸发时,待蒸发皿中出现较多量的固体时,应停止加热,利用余热将剩余液体蒸干。 【答案】D 15.在密闭容器内,有甲、乙、丙、丁四种物质,在一定条件下充分混合反应,测得反应 前后各物质的质量分数如图所示,下列说法错误的是( ) A.丁一定是化合物 B.生成的甲,丙两物质的质量比为8:1 C.乙可能是该反应的催化剂 D.参加反应的丁的质量一定是生成甲和丙的质量之和 【解析】反应前后容器中物质的总质量不变,反应后质量分数减小的物质是反应物,质量 分数增大的物质是生成物,由图中物质的质量分数的变化可知,丁的质量分数减小,是反 应物;甲、丙物质的质量分数增大,是生成物,而乙物质的质量分数不变,可能是催化剂 ;A、该反应为:丁→甲+丙,丁一定是化合物; B、生成的甲,丙两物质的质量比为:2:16=1:8; C、乙物质的质量分数不变,可能是催化剂; D、参加反应的丁的质量一定是生成甲和丙的质量之和。 【答案】B 二、多选题(本题共5小题,每小题2分,共10分,每小题有1~2个正确选项,多选,错选 8、不选不得分,漏选得1分) 16.下列知识点归纳全部正确的是( ) A.性质与用途 C.组成与结构 ①N2化学性质稳定,可用作保护气 ①金刚石与石墨物理性质不同是因为碳原子 排列方式不同 ②浓硫酸具有吸水性,可用来在实验室中 ②CO2与CO化学性质不同是因为分子构成不同 ③钠元素与氯元素的元素种类不同是 因为核内质子数不同 于燥氨气 CO2不燃烧也不支持燃烧,可用来灭 火B.消防与安全 D.生活与健康 ①进入久未开启的地窖前,应先做灯火实 ①霉变的大米不能食用 验②多吃加碘盐以预防甲状腺肿大 ③重金属盐中毒可及时服用大量牛奶 解毒 ②存放易燃物时,不能堆放的过高过密 ③发现燃气泄漏,应及时打开排气扇 【解析】A、氮气化学性质稳定,可用作保护气;浓硫酸有吸水性,可作干燥剂,但是氨气 是碱性气体,会与浓硫酸发生中和反应;二氧化碳既不能燃烧也不支持燃烧且密度比空气 大,可以用于灭火; B、金刚石和石墨的物理性质相差较大,是因为构成它们的碳原子的排列方式不同;一氧化 碳是由一氧化碳分子构成,而二氧化碳是由二氧化碳分子构成,所以一氧化碳和二氧化碳 的化学性质不同是因为它们的分子构成不同,钠元素与氯元素最本质的区别是质子数(或 核电荷数)不同; C、久未开启的地窖中可能含有较多的二氧化碳,二氧化碳不支持呼吸和燃烧,含量过高对 人体有害,因此进入久未开启的地窖,应先做灯火实验;存放易燃、易爆物时,不能堆放 得过高过密,防止爆炸;然气泄漏时,打开排气扇有可能发生爆炸; D、霉变的大米中含有的黄曲霉菌毒素性质稳定,经洗净、高温蒸煮后也不能食用;缺碘或 碘摄入过量,都会引起人体患甲状腺肿大;重金属盐中毒是使人体内的蛋白质失去生理活 性,牛奶的主要成分是蛋白质,所以人误食重金属盐中毒后,可迅速服用大量牛奶进行解 毒。 【答案】B 917.推理是化学学习中常用的方法,下列推理正确的是( ) A.化合反应的生成物只有一种,所以生成一种物质的反应一定是化合反应 B.同种元素的粒子质子数相同,所以含有相同质子数的粒子一定属于同种元素 C.有机化合物都含有碳元素,所以含有碳元素的化合物一定是有机化合物 D.酸溶液能使紫色石蕊溶液变红,所以能使紫色石蕊变红的溶液一定显酸性 【解析】A.化合反应的生成物只有一种物质,生成物只有一种物质的反应不一定是化合反 应,例如3O2 2O3; B.质子数相同的粒子一定不一定属于同种元素,例如水分子与氨气分子质子数相同但不是 同种元素,要说明是同种元素须指明是原子作前提; C.二氧化碳含有碳元素,但不是有机化合物; D.酸溶液能使紫色石蕊溶液变红,所以能使紫色石蕊变红的一定显酸性。 【答案】D 18.下列实验所选试剂和操作方法均正确的是( ) 选项 实验目的 所选试剂及操作 鉴别别CaCO3、NaCl和NaOH固体 除去KCl溶液中少量K2SO4 除去CO2中的把HCl气体 分别加入适量水观察现象 ABCD加入适量的BaCl2溶液过滤 先通过NaOH溶液,再通过浓硫酸 加入足量的水溶解、过滤、洗涤干燥 除去铁粉中少量的硫酸铜粉末 【解析】A、碳酸钙难溶于水,氯化钠溶于水,但温度几乎无变化;NaOH固体溶于水放热, 使温度升高;可以鉴别; B、K2SO4能与适量的BaCl2溶液反应生成硫酸钡沉淀和氯化钾,能除去杂质且没有引入新的 杂质,符合除杂原则; C、CO2和HCl气体均能与NaOH溶液反应,不但能把杂质除去,也会把原物质除去,不符合除 杂原则; D、加入足量的水溶解,铁能与硫酸铜溶液反应生成硫酸亚铁溶液和铜,不但能把杂质除去 ,也会把原物质除去,不符合除杂原则。 10 【答案】AB 19.下列图象与实验表述不一致的是( ) A. B. 向饱和的石灰水中加入一定质量的生石灰 向等质量的锌粉和铁粉中分别滴加稀盐酸至过量 向MgC12和HC1的混合溶液中滴加NaOH溶液至过量 镁带在密闭容器中燃烧 C. D. 【解析】A、向饱和的石灰水中加入一定质量的生石灰,图象正确,因为生石灰溶于水放热 ,图象与实验表述一致; B、向等质量的锌粉和铁粉中分别滴加稀盐酸至过量,产生氢气的质量是铁大于锌正确,图 象与实验表述一致; C、向MgC12和HC1的混合溶液中滴加NaOH溶液至过量,氢氧化钠先与盐酸反应,再与氯化镁 反应,因此开始没有沉淀,所以图象错误,图象与实验表述不一致; D、镁带在密闭容器中燃烧,总质量不变,图象与实验表述一致。 【答案】C 20.有一包不纯的Na2CO3样品,可能混有MgCO3、KC1、K2CO3中的一种或几种,取样品10.6g 加入100g稀盐酸,恰好完全反应,生成气体4.4g。则下列列断正确的是( ) 11 A.样品中一定含有MgCO3 B.样品中一定不含KCl C.盐酸溶液的溶质质量分数为7.3% D.该样品组成有两种可能 【解析】假设该固体都是碳酸钠,设生成的二氧化碳的质量是x,需要HCl的质量为y。 Na2CO3+2HCl===2NaCl+H2O+CO2↑ 106 73 44 x10.6g y 106 10.6g x=4.4g 44 x106 10.6g y=7.3g 73 y由于杂质碳酸镁、碳酸钾也能生成二氧化碳,且碳酸镁的相对分子质量比碳酸钠小,碳酸 钾的相对分子质量比碳酸钠大。同质量的碳酸镁比碳酸钠生成的二氧化碳要多,同质量的 碳酸钾比碳酸钠生成的二氧化碳要少,故杂质中不能全部是碳酸镁或者碳酸钾,可能是两 者的混合物,也可能是碳酸镁与氯化钾的混合物;或者是三者的混合物。 A、根据上述分析,样品中一定含有MgCO3; B、根据上述分析,样品中可能含有氯化钾; C、碳酸镁与稀盐酸反应的化学方程式为MgCO3+2HCl===MgCl2+H2O+CO2↑,碳酸钾与稀盐 酸反应的化学方程式为K2CO3+2HCl===2KCl+H2O+CO2↑,2HCl~CO2,可以得出则稀盐酸中 7.3g 溶质的质量应为7.3g,则盐酸的溶质质量分数是 ×100%=7.3%; 100 g D、根据上述分析,该样品组成有三种可能。 【答案】AC 三、填空题 21.用化学用语表示 12 (1)铵根离子 ; (2)保持汞化学性质的最小粒子 ; (3)实验室中常用的燃料 ; 【解析】(1)由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正 负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。铵根离子可表示为NH4+。 (2)汞是汞原子直接构成的,保持汞化学性质的最小粒子是汞原子,其原子符号为:Hg。 (3)酒精是实验室中常用的燃料,其化学式为:C2H5OH。 【答案】(1)NH4+; (2)Hg; (3)C2H5OH。 22.端午节到了,学校组织学生到郊外踏青,请用化学知识回答下列问题: (1)同学们刚下车就闻到阵阵花香,这是因为 (从微观角度回答); (2)妈妈给小明带了用糯米和火腿瘦肉制作的肉粽,它能为人体提供的两种主要营养素是 。肉粽被保存在密封的型料包装袋中,该塑料制品应具有 (填“热塑性”或“热固性”)。 (3)同学们在树林里发现了马蜂窝,老师劝诫别干”插马蜂窝”的傻事,因为马蜂体内含有 一种碱性物质,蛰咬后疼痛难忍,若发生此事故,就医前可用厨房中的 (填调味品)先做简单处理,缓解疼痛; (4)返回时老师提醒同学们要把矿泉水瓶等垃圾随身带走,这个行为有利于缓解 (填一种环境问题);绿水青山是我们宝贵的资源,请针对防治水体污染给出一条合理化 建议 。 【解析】(1)分子是在不断运动的,所以同学们刚下车就闻到阵阵花香; (2)糯米富含糖类,火腿瘦肉富含蛋白质;用来包装食品的塑料具有热塑性; (3)马蜂体内含有一种碱性物质,蛰咬后疼痛难忍,可先涂上酸性物质来缓解症状,如厨 房中的食醋; (4)把矿泉水瓶等垃圾随身带走,这个行为有利于缓解白色污染;工业废水处理达标后再 13 排放、生活污水处理后再排放,农业上合理施用农药和化肥等都可以防止水体污染。 【答案】(1)分子是不断运动的;(2)糖类、蛋白质;热塑性;(3)食醋;(4)白色 污染 工业废水处理达标后排放(合理即可) 23.甲、乙、丙三种物质的溶解度曲线如图所示,回答下列问题: (1)三种物质中 的溶解度随温度变化趋势与气体溶解度的变化相似(填“甲”或“乙”或“丙”)。 (2)将t2℃时甲,乙两物质饱和溶液分别蒸发等质量的水,析出固体的质量甲 乙(填“>”或“<”或“=”)。 (3)当甲中混有少量乙时,可采用 的方法提纯甲。 (4)将t2℃时等质量的甲、乙、丙三种物质的饱和溶液同时降温至t1℃,所得溶液中溶剂 质量由大到小的顺序为 。 【解析】(1)三种物质中丙的溶解度随温度变化趋势与气体溶解度的变化相似,都是溶解 度随温度的升高而减少; (2)将t2℃时,甲、乙两物质饱和溶液分别蒸发等质量的水,析出固体的质量甲>乙,因 为在该温度下甲的溶解度大于乙; (3)当甲中混有少量乙时,可采用降温结晶(或冷却热饱和溶液)的方法提纯甲,因为甲 的溶解度受温度的影响变化比乙大; (4)将t2℃时等质量的甲、乙、丙三种物质的饱和溶液同时降温至t1℃,所得溶液中溶剂 质量由大到小的顺序为:丙>乙>甲,因为降温后,溶剂的质量不变。【答案】(1)丙; (2)>; (3)降温结晶(或冷却热饱和溶液); (4)丙>乙>甲(或丙、乙、甲) 14 24.将一定量的锌粉投入到硝酸银、硝酸铜和硝酸镁的混合溶液中,充分反应后过滤,得 到滤液和滤渣,写出一定发生的反应方程式 ;若所得滤液呈无色,则滤液中一定含有的金属阳离子为 (填离子符号)滤渣中可能含有的金属单质为 。 【解析】一定量的锌粉投入到硝酸银、硝酸铜和硝酸镁的混合溶液中时,锌不能和硝酸镁 反应,先和硝酸银反应生成硝酸锌和银,因此一定发生的反应方程式为锌和硝酸银的反应 ;若所得滤液呈无色,说明硝酸银、硝酸铜已经完全反应,则滤液中一定含有的金属阳离 子有没有反应的硝酸镁中的Mg2+、锌和硝酸银、硝酸铜反应生成的硝酸锌中的Zn2+,滤渣中 一定含有银和铜,可能含有的金属单质为Zn。 【答案】Zn+2AgNO3===Zn(NO3)2+2Ag Mg2+、Zn2+ Zn。 25.已知A~G均为初中化学常见的物质,其中A、C是组成元素相同的气体,且C能参与植物 光合作用;B为赤铁矿主要成分;F是紫红色金属,根据如图所示的转化关系(图中反应条 件均已略去),请回答: (1)写出E的化学式 ; (2)写出①对应的化学反应方程式 ,列举出与此反应中A的化学性质相似的一种物质 (填填化学式); (3)写出②对应的基本反应类型 。 【解析】(1)A~G均为初中化学常见的物质,其中A、C是组成元素相同的气体,且C能参 与植物光合作用,所以C是二氧化碳,A是一氧化碳,B为赤铁矿主要成分,所以B是氧化铁 ,氧化铁和一氧化碳在高温的条件下生成铁和二氧化碳,所以D是铁,F是紫红色金属,所 以F是铜,铁和硫酸铜反应生成硫酸亚铁和铜,所以E可以是硫酸铜,经过验证,推导正确 ,所以E的化学式是CuSO4; (2)反应①是一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,化学方程式为:3CO 高温 +Fe2O3 2Fe+3CO2,与此反应中A的化学性质相似的物质有H2或C; 15 (3)反应②可以是铁和硫酸铜反应生成硫酸亚铁和铜,所以基本反应类型是置换反应。 【答案】(1)CuSO4; 高温 (2)3CO+Fe2O3 2Fe+3CO2 H2或C; (3)置换反应 四、简答题(本题共3小题,26题4分,27,28每小题各3分,共10分) 26.近几年无人监察机广泛应用于大气质量监测,以预防雾霾的产生。 (1)请回答产生雾霾的原因并提出解决措施(各一点)。 (2)请列举出一种新能源。 (3)这种无人机主要采用一种有机高分子聚合物作为外壳材料,请回答该材料的一点性质 。【解析】(1)产生雾霾的原因有化石燃料的大量使用、工业废气的排放、汽车尾气的排放 、任意焚烧粘杆等;减少“雾霾”的措施有:减少化石燃料使用,开发清洁能源(或禁止焚 烧桔秆等; (2)人们正在利用和开发其他新能源,如太阳能、核能、风能、地热能和潮汐能等; (3)这种有机高分子聚合物作的性质有强度高、密度小、耐腐蚀。 【答案】(1)化石燃料的大量使用;减少化石燃料使用,开发清洁能源; (2)太阳能; (3)强度高、密度小、耐腐蚀 27.燃烧是人类最早利用的化学反应之一,如图是某化学活动小组围绕探究燃烧条件与灭 火原理而设计的实验装置,请回答下列问题: 16 (1)该装置的优点是什么?(答一点) (2)通过实验中的现象可得出燃烧的条件是什么? (3)请列举出通过破坏该条件达到灭火目的实例。(答一点) 【解析】(1)该实验是在密闭的容器内进行的,生成的五氧化二磷不会扩散到空气中造成 污染; (2)在实验中发现,烧杯的热水中的白磷没有燃烧,试管中的白磷发生了燃烧,证明了燃 烧需要氧气;而试管中的红磷没有发生燃烧,证明了燃烧需要温度达到可燃物的着火点; (3)隔绝氧气可以灭火,如油锅着火用锅盖盖灭;降温至着火点以下也可以灭火,如木材 着火用水浇灭;隔离可燃物也可以灭火,如做饭结束后,关闭燃气阀门等。 【答案】(1)减少生成五氧化二磷对空气的污染(合理即可); (2)燃烧需要氧气,且温度达到可燃物的着火点; (3)木材着火用水浇灭(合理即可) 28.根据有关报导,世界上每年因腐蚀而报废的金属设备和材料相当于年产量的20%~40% ,防止金属锈蚀已成为科学和技术领域的重大问题,为探究金属锈蚀的条件,进行如图实 验,一周后观察到①中铁钉生锈,请回答下列问题: (1)铁生锈的条件。 (2)防止金属锈蚀的措施(答一条)。 (3)回收废旧金属的意义(答一条)。 17 【解析】(1)Ⅰ中的铁钉与水和氧气充分接触,容易生锈;Ⅱ中的铁钉不能与氧气接触, 不容易生锈;Ⅲ中的铁钉不能与水接触,不容易生锈,由此对比可知铁生锈的条件是铁与 氧气和水共同接触; (2)根据已有的知识进行分析,铁在有水和氧气并存时易生锈,防锈就是使铁与水或氧气 隔绝,如在金属表面形成保护膜如喷漆等;保持金属表面洁净干燥; (3)回收废旧金属,可以节约金属资源、节约冶炼金属消耗的能源、降低生产成本、可以 减少对环境的污染。 【答案】(1)铁与氧气和水共同接触; (2)在金属表面形成保护膜如喷漆等(或保持金属表面洁净干燥)(合理即可);(3) 节约金属资源(或减少环境污染、节约能源、降低生产成本)(合理即可) 五、实验题 29.实验室中有下列仪器: (1)填写标号仪器名称:⑦ ; (2)实验室制取CO2并欲得到平稳的气流,应选择发生装置仪器的组合为 (选择一套,填序号),当用如图2装置收集CO2气体时,气体应从 (填“a”或“b”)端进入,写出检验CO2的化学反应方程式 ; (3)若用高锰酸钾制取氧气,还需要补充的实验仪器为 ,反应方程式为 ;用排水法收集O2,所得气体不纯的原因可能是 【解析】(1)图中标号⑦仪器是常用仪器锥形瓶; (答一条)。 (2)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互 相交换成分生成氯化钙和水和二氧化碳,不需要加热,要得到平稳的气流,则需控制反应 速率,可通过分液漏斗控制液体的滴加速度,故应选择发生装置仪器的组合为:②④⑦ ;检验二氧化碳用澄清石灰水,该反应的化学反应方程式为:Ca(OH)2+CO2===CaCO3↓+H2O ;二氧化碳密度比空气的密度大,因此用图2装置收集CO2气体时,气体应从a端进入; 18 (3)高锰酸钾制取氧气需要加热,属于固体加热型,故还需要补充的实验仪器为酒精灯; 高锰酸钾加热生成锰酸钾、二氧化锰和氧气,反应的化学方程式 △2KMnO4 K2MnO4+MnO2+O2↑。用排水法收集氧气不纯的原因可能是瓶内要留有少量的水 集气瓶没装满水或没等气泡连续而均匀冒出就开始收集。 【答案】(1)锥形瓶; (2)②④⑦ a Ca(OH)2+CO2===CaCO3↓+H2O; △(3)酒精灯 2KMnO4 K2MnO4+MnO2+O2↑ 没等气泡连续而均匀冒出就开始收集 30.根据如图所示实验回答下列问题: (1)如A图所示实验中,实验结束后进入集气瓶中水的体积大于瓶内原气体体积的五分之 一,造成该现象的原因是 (答一条); (2)通过B图实验中的现象所得到的结论是 ; (3)C图实验中,实验前预先向水中加入适量硫酸钠的作用是 ; (4)在配制一定质量分数氯化钠溶液时,量取水的操作如D图所示,其他操作均正确,所 配制溶液中氯化钠的质量分数 (填“偏大”“偏小”或“不变”); (5)E图实验中所体现的微观实质是 。 【解析】(1)选择装置A进行实验,实验结束后,若进入集气瓶中水的体积大于原 气体体积的1/5,导致这一结果的可能原因是:点燃红磷前弹簧夹没有夹紧胶皮管,点燃红 磷后伸入瓶中时太慢; 19 (2)碘在水中几乎不溶解;高锰酸钾可以溶于水,这说明溶解性与溶质的种类有关; (3)纯水的导电性较弱,为了增强水的导电性,可在水中加入硫酸钠; (4)量取水时仰视读数,会导致量取水的体积偏大,从而导致配制溶液的质量分数偏小; (5)由微观反应示意图可知,该反应的实质是氢离子与氢氧根离子结合成了水分子。 【答案】(1)点燃红磷前弹簧夹没有夹紧胶皮管,点燃红磷后伸入瓶中时太慢;(2)溶 解性与溶质的种类有关; (3)增强水的导电性; (4)偏小; (5)氢离子与氢氧根离子结合成了水分子 31.某化学活动小组在一次实验中进行如图所示实验: 此时观察到U型管左右两侧产生的现象分别是 ;实验后,小组同学充分振荡U型管,发现管内仍有白色固体残留,将混合物过滤后,同学 们对滤液成分产生了浓厚的兴趣,于是进行了进一步的探究活动。 【提出问题】滤液中可能含有哪些溶质? 【猜想与假设】猜想一:溶质为NaCl 猜想二:溶质为NaCl和BaCl2 猜想三:溶质为NaCl、BaCl2和HC1 【评价与交流】你认为以上猜想 不合理,理由是 ;则你的猜想为 ;【实验探究】小红为了验证滤液成分,取滤液于试管中,向其中滴加少量的硫酸钠溶液, 观察到无明显现象。由此得出结论:猜想一成立,小刚认为小红的结论不严密,因为 20 。为验证你的猜想请填写如表 实验过程 实验结论 实验现象 你的猜想成立 【归纳与总结】通过上述实验我们能够总结出:在确定化学反应后所得溶液中溶质成分时 ,除了考虑生成物外,还要考虑 。 【解析】氯化钡和碳酸钠反应生成碳酸钡沉淀和氯化钠,碳酸钠和盐酸反应生成氯化钠、 水和二氧化碳,所以观察到U型管左右两侧产生的现象分别是:左侧产生白色沉淀,右侧产 生气泡; 【评价与交流】碳酸钡和盐酸反应生成氯化钠、水和二氧化碳,实验后,小组同学充分振 荡U型管,发现管内仍有白色固体残留,以上猜想三不合理,理由是:当U型管内仍有白色 沉淀时,溶液中的HCl一定完全反应,碳酸钠可能是过量的,所以我的猜想为NaCl、Na2CO3 ;【实验探究】碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,所以小红的结论不严密,因 为该现象只能证明溶液中不含氯化钡,无法证明溶液中是否含有碳酸钠;碳酸钠和盐酸反 应生成氯化钠、水和二氧化碳,所以: 实验结论 实验过程 实验现象 取样品,加入稀盐酸 有气泡产生 你的猜想成立 【归纳与总结】在确定化学反应后所得溶液中溶质成分时,除了考虑生成物外,还要考虑 反应物是否有剩余。 【答案】左侧产生白色沉淀,右侧产生气泡; 【评价与交流】三 当U型管内仍有白色沉淀时,溶液中的HCl一定完全反应,碳酸钠可能是过量的 NaCl、Na2CO3; 【实验探究】该现象只能证明溶液中不含氯化钡,无法证明溶液中是否含有碳酸钠; 取样品,加入稀盐酸 有气泡产生 【归纳与总结】反应物是否有剩余 21 六、计算题(本题共2小题,32小题3分,33小题7分,共10分) 32.抗癌新药紫杉醇的化学式为C47H51NO4,回答下列问题: (1)紫杉醇的相对分子质量为 ; (2)紫杉醇中氮元素与氧元素的质量之比为 (写出最简整数比); (3)13.86g中紫杉醇中氢元素的质量为 g。 【解析】(1)紫杉醇的相对分子质量为12×47+1×51+14+16×4=693; (2)紫杉醇中氮、氧元素的质量比为14:(16×4)=7:32,故填: 151 (3)13.86g中紫杉醇中氢元素的质量为13.86g× 100% =1.02g。 693 【答案】(1)693;(2)7:32;(3)1.02 33.为测定某黄铜(铜锌合金)样品中铜的含量,某化学活动小组分三次进行实验,实验 数据如表,请回答下列问题: 所取药品 第一次 12 第二次 10 第三次 10 黄铜样品质量(g) 稀盐酸质量(g) 生成气体质量(g) 100 100 150 0.2 0.2 0.2 (1)第 次实验中,药品成分恰好完全反应。 (2)黄铜样品中铜的质量分数是多少?恰好完全反应时所得溶液的溶质质量分数是多少? (精确到0.1%) 【解析】(1)依据质量守恒定律可知:三次放出氢气的质量都是0.2g,第一次黄铜样品中 的质量多,第三次中稀盐酸质量多,所以第二次取用的稀盐酸和样品恰好完全反应;(2) 选择第二次实验的有关数据进行计算即可。 【答案】(1)二; (2)解:设参加反应的锌的质量为x,反应后得到溶液中溶质的质量为y 丙中盐酸的质量=129g-56g=73g Zn+2HCl===ZnCl2+H2↑ 22 65 x136 y20.2g 65 2xy解得:x=6.5g y=13.6g 0.2g 0.2g 10g 6.5g 黄铜样品中铜的质量分数是: 所得溶液的溶质质量分数是: 100% 35% 10g 13.6g 6.5g 100g – 0.2g 100% 12.8% 。答:(1)二;(2)黄铜样品中铜的质量分数是35%;恰好完全反应时所得溶液的溶质质量 分数是12.8%。 23
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





