



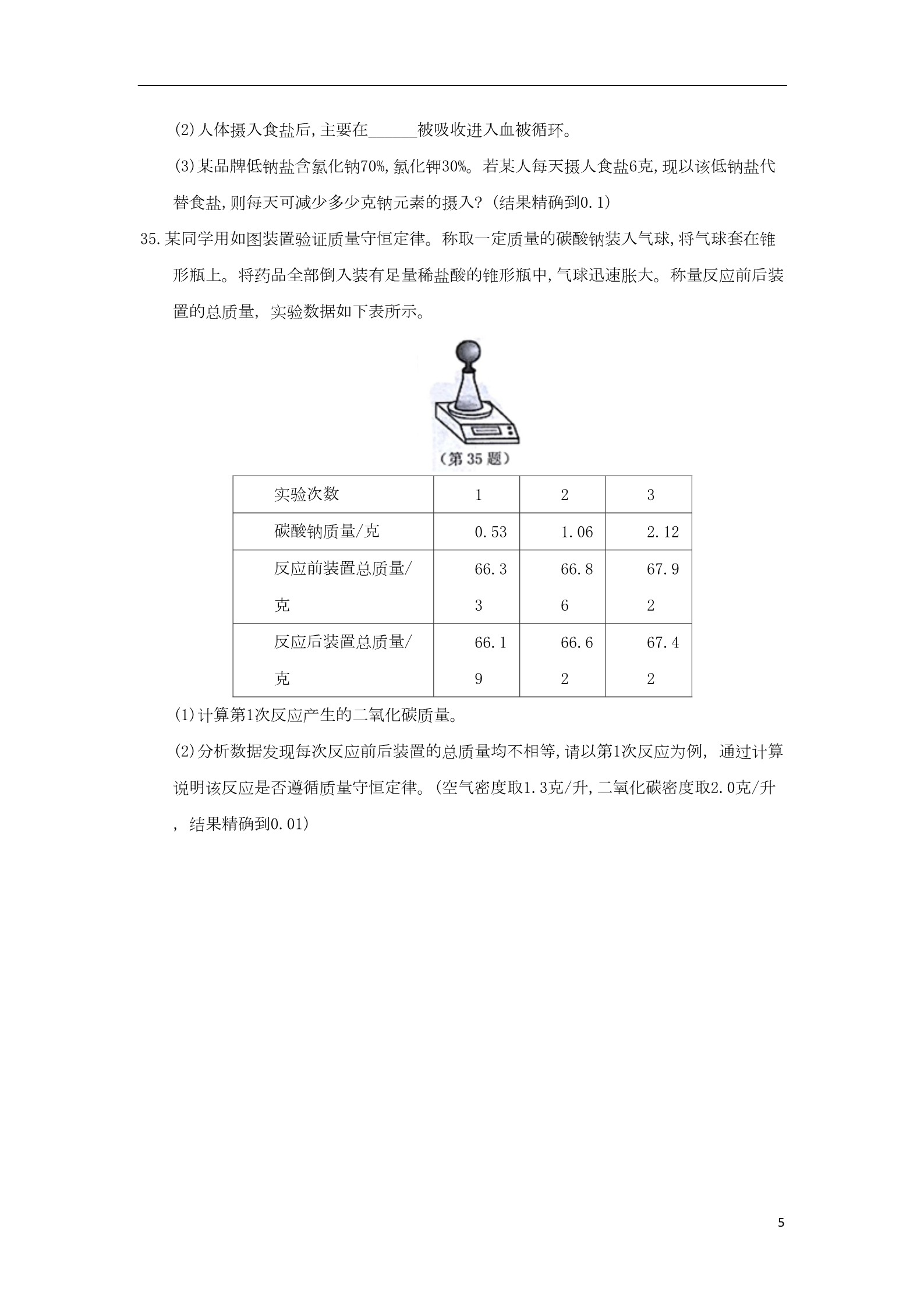
浙江省台州市2018年中考化学真题试题 4.下图为自米水生产过程示意图。下列说法正确的是 A.清水池中的水是溶液 C.消毒用的液氯是化合物 B.过滤池中主要发生化学变化 D.供水系统流出的水是纯净物 7.电脑芯片的制作要用到高纯度的硅。目前广泛采用石英砂(主娶成分是SiO2)为原料制取 高温 ,其中一步反应为:SiO2+2C A.该反应属于置换反应 Si+2CO↑。对该反应分析正确的是 B.碳发生了还原反应 C.碳元素化合价由0价变为+4价 D.该反应利用了CO的还原性 12.肝脏中含有过氧化氢酶。某同学利用动物肝脏研究酶的某些特点,实验记录如下表: 试管 实验材料及处理 产生气泡快慢 最慢 5毫升5%H2O2溶液+2滴蒸馏水,常温 1234较快 5毫升5%H2O2溶液+2滴3.5%FeCl3溶液,常温 5毫升5%H2O2溶液+2滴肝脏研磨液,常温 最快 5毫升5%H2O2溶液+2滴肝脏研磨液,70℃水浴加热 较慢 分析实验结果,无法得出过氧化氢酶 A.具有专一性 B.能加快过氧化氢分解 1C.具有高效性 D.活性受温度影响 13.下列选项所示的物质转化均能一步实现的是 A.Fe C.S Fe2O3 SO2 Fe(OH)3 B.CuO H2SO4 D.CO2 CuSO4 CuCl2 NaOH Na2CO3 15.某固体由Ba2+、Cu2+、Na+、Cl-、CO32-、SO42- 中的几种离子构成,取一定质量的该固体样品,进行如下实验: ①将固体溶于水得无色透明溶液,加入足量BaCl2溶液,过滤后得到5克白色沉淀。 ②在沉淀中加入过量稀硝酸,仍有3克白色沉淀。 ③在滤液中滴加AgNO3溶液,产生白色沉淀。则该固体中一定含有 A.Na+、CO32-、SO42- C.Cl-、CO32-、SO42- B.Cu2+、CO32-、SO42- D.Na+、Ba2+、Cl- 18.图甲是一个“火山爆发”模型。将碳酸氢钠干粉和柠檬酸(C6H8O7)干粉倒入火山模型内 ,火山模型内没有动静,慢慢注入水,两者就会剧烈反应(3NaHCO3+ C6H8O7=C6H5O7Na3+3H2O+3CO2↑),“火山”就会爆发出来。 (1)自然界中的火山是_______变动的表现。 (2)这个模拟实验为什么要加水呢?将碳酸氢钠干粉和柠檬酸干粉混合后,置于试管中( 如图乙),立即伸入燃着的木条,火焰没有熄灭。用棉花封住管口,静置约半小时后再伸 入燃着的木条,火焰熄灭。可见,水在本模拟实验中的作用是_____。 20.草酸固体熔点较低,受热熔化后,迅速分解生成水、一氧化碳和二氧化碳。 (1)草酸(H2C2O4)中,氢、碳、氧原子的个数比为______。 (2)写出草酸受热分解的化学方程式: ______。 (3)加热分解草酸固体,应选择图中的_______装置。 221.19世纪初,电灯尚未发明,煤矿工人在矿井中只能借助煤油灯照明。矿井中通常存在大量 的甲烷气体,遇火极易发生爆炸。1815年,化学家戴维设计出一种安全矿灯—— 戴维灯(如图)。采用一种网眼很小的普通金属网罩住火焰,火焰只会在网中燃烧而不 会引燃外界的甲烷气体。 (1)甲烷与空气混合,遇火易发生爆炸,是因为甲烷燃烧释放大量的_______。 (2)用戴维灯照明,不会引燃矿井中的甲烷,原因是_________。 23.活泼金属能将不活没金属从其盐的水溶液中置换出来。与此类似,碳在高温下,能将不 活泼金属从其氧化物中置换出来,但活泼金属形成的氧化物不与碳发生反应。如碳在高 温下,能置换出氧化铁中的铁,但与氧化铝不反应。 (1)判断C、Fe、Al的活动性顺序由强到弱为________。 (2)结合所学知识,下列各组物质能发生置换反应的是_______ A.碳与氧化铜 B.锌与稀硫酸 C.碳与氧化钙 D.银与硫酸铜 28.氨气的水溶液称为氨水,呈碱性,易挥发,有强烈的刺激性气味。某兴趣小组利用浓氨水 和浓盐酸探究分子运动速度与相对分子质量的关系。 方案I:在两玻璃片上同时分别滴加少量相同体积的浓氨水和浓盐酸,将2张湿润的pH试 纸分别置于距玻璃片上方15厘米处(如图甲),比较2张pH试纸变色的时间。 方案II :将一支约35厘米长的玻璃管水平放置,将一湿润的pH试纸置于玻璃管的中间。 在玻璃管两端同时分别滴加2滴浓氨水和浓盐酸后,迅速塞上橡皮塞(如图乙),观察pH试 纸的颜色变化。 3(1)方案I实验中,观察到两液滴间的上方出现白烟。针对此现象,你的合理猜想是____ ____。 (2)请指出方案I的两点不足之处________。 (3)多次进行方案II的实验,均观察到试纸先变蓝色,得出相对分子质量越小分子运动速 度越快的结论。为使该结论更具有普遍性,还应继续研究_________。 29.镉是重金属污染中最受关注的元素之一。已有研究表明,秋华柳对镉具有较强的耐受和 富集能力。为研究秋华柳受镉污染时,体内金属元素含量的变化。选取生长基本一致 的幼苗,在不同镉离子浓度的土壤中进行分组实验。18天后测量植株各部分金属元素的 含量,结果如图。 (1)由图可知,秋华柳叶片铁元素含量与镉离子浓度的关系是______。 (2)由实验结果可知,秋华柳______的变化可作为其受镉污染程度的指示。 (3)对镉污染土壤进行治理可采用化学沉淀法,即将土壤溶液中的镉离子形成沉淀物而 降低污染。已知氯化镉易溶于水,碳酸镉和氢氧化镉难溶于水。下列物质可用于处理土 壤镉污染的是______。 A.氢氧化钠 B.氢氧化钙 C.碳酸钙 D.氯化钠 30.《中国居民膳食指南》建议成人平均每天食盐摄入量应在6克以下。据调查,我国成人平 均每天食盐摄入量为10.5克。 (1)高盐饮食容易引发______。 A.传染病 B.遗传病 C.心血管疾病 4(2)人体摄入食盐后,主要在______被吸收进入血被循环。 (3)某品牌低钠盐含氯化钠70%,氯化钾30%。若某人每天摄人食盐6克,现以该低钠盐代 替食盐,则每天可减少多少克钠元素的摄入? (结果精确到0.1) 35.某同学用如图装置验证质量守恒定律。称取一定质量的碳酸钠装入气球,将气球套在锥 形瓶上。将药品全部倒入装有足量稀盐酸的锥形瓶中,气球迅速胀大。称量反应前后装 置的总质量,实验数据如下表所示。 实验次数 123碳酸钠质量/克 0.53 66.3 31.06 66.8 62.12 67.9 2反应前装置总质量/ 克反应后装置总质量/ 66.1 966.6 267.4 2克(1)计算第1次反应产生的二氧化碳质量。 (2)分析数据发现每次反应前后装置的总质量均不相等,请以第1次反应为例,通过计算 说明该反应是否遵循质量守恒定律。(空气密度取1.3克/升,二氧化碳密度取2.0克/升 ,结果精确到0.01) 5参考答案 4.A 7.A 12.A13.D 15.A 18.(1)地壳;(2)使反应在溶液中进行,加快反应速度 △20.(1)1:1:2;(2)H2C2O4 H2O+CO↑+CO2↑;(3)丙 21.(1)热量;(2)金属网可以把火焰的热量迅速传递出去,矿井中甲烷气体的温度达不 到着火点 23.(1)Al、C、Fe;(2)AB 28. (1)氨气与氯化氢气体发生反应生成固体 (2)使用的气体有强烈的刺激性气味,对人体有害或污染空气;在开放的空间进行实验, 实验结果易受环境影响,如空气流动等(或“两种气体互相干扰”等)(仅答一点给1分) (3)其它物质的分子运动速度与相对分子质量的关系 29. (1)镉离子浓度较低时,叶片中的铁元素含量影响不明显;达到一定浓度时,铁元素含 量明显下降;浓度继续升高,铁元素含量基本不变。(答出一点给1分,仅答“镉离子浓 度越高,秋华柳叶片铁元素含量越低”给1分) (2)根中铁、镁、锌金属元素的含量 (3)B 30.(1)C;(2)小肠;(3)0.7g 35.(1)0.22g;(2)符合。(计算略) 6
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





