
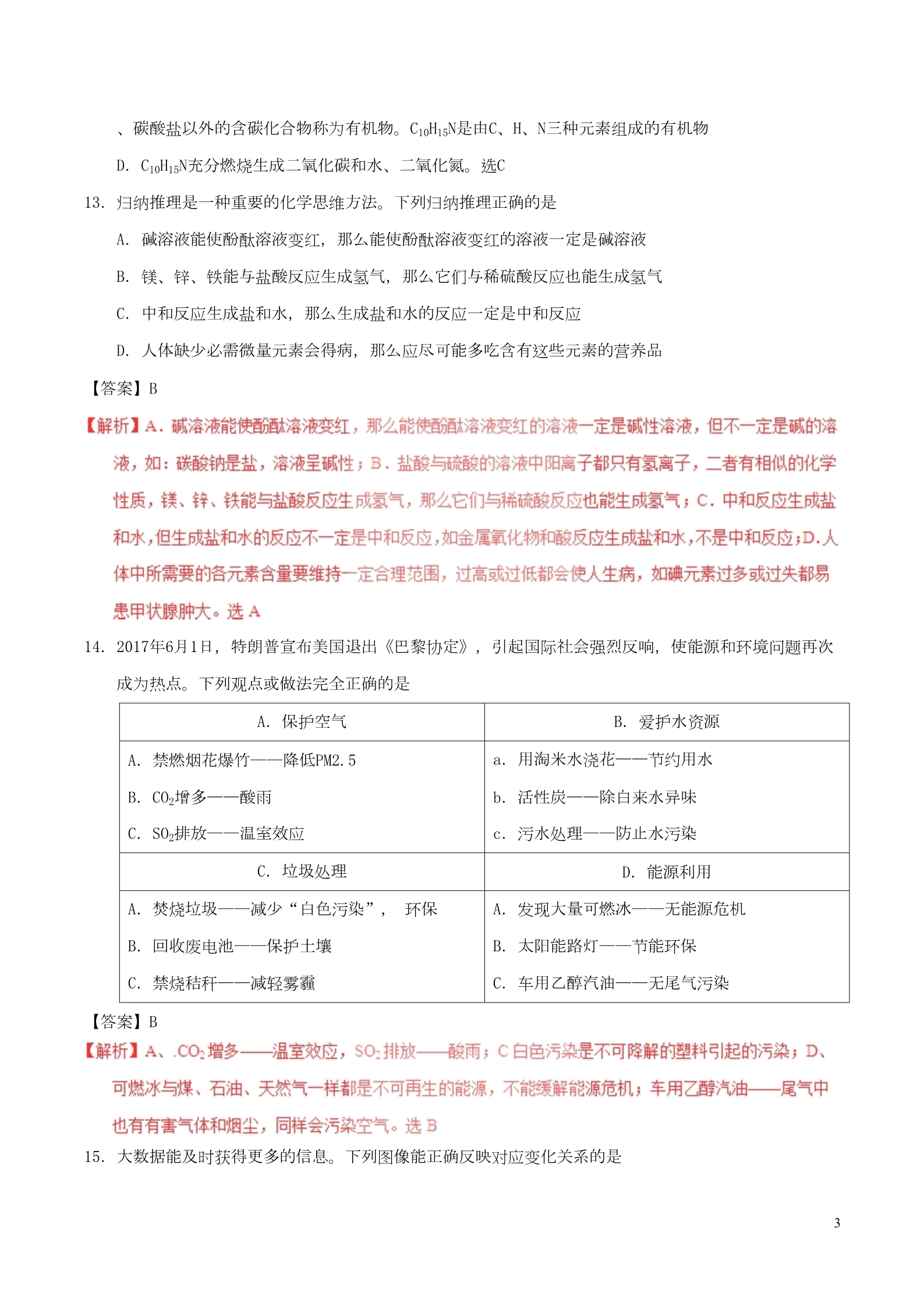


湖北省随州市2017年中考理综化学试题 8.成语是中华传统文化的瑰宝。下列成语中包含化学变化的是 A.刻舟求剑 B.滴水石穿 C.投鞭断流 【答案】D D.钻木取火 9.下列实验操作.正确的是 【答案】A 【解析】A、铁在氧气中燃烧,火星四射,生成黑色固体,为防止高温的生成物溅落,使集气瓶底炸裂, 在集气瓶内装少量的水或西沙;B、量筒只能用于量取一定量的液体,不能用作配置溶液或做反应容 器;C、称量一定质量的固体时,应遵循左物右码的原则;D、过滤时应用玻璃棒引流,防止浊液洒在 过滤器外边,且漏斗末端因紧靠烧杯内壁。选A 10.稀土是储量较少的一类金属的统称,有“工业维生素”的美誉,是不可再生的战略资源。铈是一种稀 土元素,它在元素周期表中的信息如右图所示,下列有关说法错误的是 A.铈原子的核内质子数是58 C.铈的相对原子质量是140.1g B.在化学反应中,铈原子一般失去电子 D.铈元素符号是Ce 【答案】C 【解析】在元素周期表中,元素名称的左上角数字为原子序数,右上角的为元素符号,下边的是相对原子 质量。同一原子中,质子数=核外电子数=核电荷数=原子序数;A.铈原子的核内质子数是58; 1B.铈是金属元素,铈原子在化学反应中,铈原子一般失去电子;C.铈的相对原子质量是140.1; D.铈元素符号是Ce;选C 11.如图,是甲、乙两种固体物质的溶解度曲线,下列说法正确的是 A.20℃时,甲、乙两种固体物质的溶解度都是30 B.40℃时,甲的饱和溶液中溶质质量分数为50% C.40℃时,将50g乙物质全部溶于水中,恰好能得到150g乙的饱和溶液 D.将130g 20℃甲的饱和溶液升温到40℃,最多还能溶解甲物质20g 【答案】D 12.“珍爱生命,远离毒品”。冰毒是一种毒品,能引发急性心脑疾病,并出现狂躁、暴力、自杀等倾向 ,其主要成分为甲基苯丙胺(化学式为C10H15N)。下列有关甲基苯丙胺的说法正确的是 A.相对分子质量是82 C.是由C、H、N三种元素组成的有机物 D.充分燃烧只生成二氧化碳和水 【答案】C B.碳、氢、氮三种元素的质量比为10:15:l 【解析】A.相对分子质量=(相对原子质量×原子个数)之和,相对分子质量是12×10+15+14=149; B.碳、氢、氮三种元素的质量比为12×10:15:14=120:15:14;C.除一氧化碳、二氧化碳、碳酸 2、碳酸盐以外的含碳化合物称为有机物。C10H15N是由C、H、N三种元素组成的有机物 D.C10H15N充分燃烧生成二氧化碳和水、二氧化氮。选C 13.归纳推理是一种重要的化学思维方法。下列归纳推理正确的是 A.碱溶液能使酚酞溶液变红,那么能使酚酞溶液变红的溶液一定是碱溶液 B.镁、锌、铁能与盐酸反应生成氢气,那么它们与稀硫酸反应也能生成氢气 C.中和反应生成盐和水,那么生成盐和水的反应一定是中和反应 D.人体缺少必需微量元素会得病,那么应尽可能多吃含有这些元素的营养品 【答案】B 14.2017年6月1日,特朗普宣布美国退出《巴黎协定》,引起国际社会强烈反响,使能源和环境问题再次 成为热点。下列观点或做法完全正确的是 A.保护空气 B.爱护水资源 a.用淘米水浇花——节约用水 b.活性炭——除白来水异味 c.污水处理——防止水污染 A.禁燃烟花爆竹——降低PM2.5 B.CO2增多——酸雨 C.SO2排放——温室效应 C.垃圾处理 D.能源利用 A.发现大量可燃冰——无能源危机 B.太阳能路灯——节能环保 A.焚烧垃圾——减少“白色污染”, 环保 B.回收废电池——保护土壤 C.禁烧秸秆——减轻雾霾 C.车用乙醇汽油——无尾气污染 【答案】B 15.大数据能及时获得更多的信息。下列图像能正确反映对应变化关系的是 3【答案】A 【解析】A铁与盐酸反应生成氯化亚铁和氢气,所以反应中随氯化亚铁的量的增加,溶液中铁元素的质量 增加,完全反应后氯化亚铁的质量不再改变,溶液中铁元素的质量也不再增加;B浓硫酸有吸水性, 敞口放置时,溶质不变,溶剂的量增加,所以溶质的质量分数减小;C氢氧化钠和盐酸反应生成氯化 钠,反应中氯化钠的质量分数增大,刚好完全反应时,氯化钠的质量分数达到最大;再加入盐酸时溶 液增加,氯化钠的量不变,;溶液中氯化钠的质量分数减小;D、氢氧化钠溶液呈碱性,溶液的pH大 于7,加水时,溶液的减小变弱,pH减小,但由于溶液始终呈碱性,PH不可能等于或小于7. 35.(6分)从H、C、N、O、Na、S、K七种元素中,选取有关的元素,用适当化学用语填空: (l)不含电子的离子_______; (3)含有10个电子的分子_______;(4)纯碱中金属元素的化合价_______; (5)可作复合肥的盐_______; (6)生成物都是单质的分解反应_______。 【答案】(1)H+;(2)N2;(3)CH4或NH3或H2O(任写一种即可) (4)+1;(5)KNO3;(6)2H2O 2H2↑+O2↑ (2)空气中含量最多的气体单质_______; 【解析】由两种或两种以上物质组成的物质叫混合物;由一种物质组成的物质叫纯净物;由一种元素组成 的纯净物叫单质;由不同元素组成的纯净物叫化合物;由两种元素组成,且其中一种是氧的化合物叫 氧化物。溶于水产生的阳离子只有氢离子的化合物是酸 。由金属或铵根和酸根组成的化合物叫盐,由金属或铵根和氢氧根组成的化合物叫碱。化合物的化学 式书写:显正价的元素其符号写在左边,显负价的写在右边,化合价的绝对值交叉约减,得化学式右 下角的数字,数字为1时不写;单质的化学式的书写:在元素符号右下角标上一个分子中原子的个数 。(l)氢原子中只有一个电子,其离子中没有电子,H+; 2)空气中含量最多的气体单质氮气,占空气的体积 的78% ,N2;;(3)一个水分子由一个氧原子和两个氢原子构成,一个氧原子中有8个电子,一个氢原子中有 4一个电子,一个水分子含有10个电子,H2O(CH4或NH3);(4)纯碱中金属元素钠元素的化合价为+1 ;(5)可作复合肥的盐KNO3;; (6)生成物都是单质的分解反应2H2O通电 2H2↑+O2↑ 36.(4分)留心观察,化学就在身边: (1)某班同学给学校食堂提出的下列建议中不合理的是_______(填字母,下同) A.多提供油炸食品 B.常提供水果 C.提供一次性餐具 D.常供应粗粮 (2)加油站、面粉加工厂应张贴下列标志中的_______; (3)测量体温时,体温计汞柱上升的微观原因是________; (4)小明同学刚做完CO2的性质实验后,用烧杯罩住两支点燃的、高矮不同的蜡烛(如图),竟看到 了高蜡烛先熄灭的现象,请你帮他解释_________。 【答案】(4分)(l)AC(只选对l个得0.5分,错选不得分)(2) C (3)温度过高,原子间隔增大;(4)燃烧放热使生成的CO2气体密度比空气小,浮在上面 37.(3分)将一定量的金属M(M是Mg、Al、Zn、Fe中的一种)粉末放入AgNO3和Cu(NO3)2的混合溶液中, 充分反应后过滤,得到滤渣和无色滤液。向滤渣和滤液中分别滴加稀盐酸均无明显现象产生。 (1)金属M不可能是_______(填名称)。 (2)滤渣中一定含有的金属是_______;无色滤液中含有的阴离子是_______(填符号)。 【答案】(1)铁(2)Cu、Ag(只填一种不得分); NO3- 538.(4分)小李用盐酸与碳酸钙粉末反应验证质量守恒定律,实验装置如图 (1)根据实验目的,小李必须测量的数据是______。 A.锥形瓶质量 B.气球质量 C.反应前整个反应装置(包括里边的物质)质量 D.反应后整个反应装置(包括里边的物质)质量 (2)将反应装置放在天平左盘,使天平平衡后,再将碳酸钙粉末倒入锥形瓶中。反应结束后,气球 鼓起,天平向右倾斜。小李按规范操作重新实验,得到相同结果。请你帮他分析原因_。 (3)反应结束后,锥形瓶中无固体剩余,则生成气体质量____g,所得溶液中生成物的溶质质量分数 (只需写出最终的计算表达式)_____。 【答案】(l) CD (只填1个不得分); (2)气球膨胀受到浮力增大(或装置漏气); (3)0.88g; 【解析】(l) 。质量守恒定律是参加反应的各物质的质量总和等于反应后生成的各物质的质量总和,所以要验证质量 守恒定律需要测定数据有:反应前整个反应装置(包括里边的物质)质量及反应后整个反应装置(包 括里边的物质)质量;(2)碳酸钙和盐酸反应生成二氧化碳气体,使装置在空气中受到的浮力增大 ,所以气球膨胀受到浮力增大(或装置漏气使反应后总质量减少)反应结束后,气球鼓起,天平向右 倾斜。(3)设2g碳酸钙完全反应生成二氧化碳的质量为x,所得溶液中溶质的质量为y 6CaCO3 +2HCl ==CaCl2+ CO2↑ + H2O 100 2g 111 y44 x100/2g=44/x x=0.88g; 100/2g=111/y y=2.22g; 2.22g 所得溶液中生成物的溶质质量分数= 100% 50g 2g 0.88g 39.(4分)一定条件下,甲、乙、丙、丁四种常见物质有如下关系:甲+乙→丙+丁。 (1)若甲、丙是单质,乙、丁是化合物,且甲乙均为黑色粉末,该反应的基本类型是____,反应结 束后,固体质量______(填“增加”“减少”“不变”或“无法确定”)。 (2)若甲、乙、丙、丁都是化合物,且丙是蓝色沉淀,则丁属于_____(填“酸”、“碱”、“盐” 或“氧化物”),写出一个符合这一条件的化学反应方程式_________。 【答案】(1)置换反应:减少; (2)盐:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 40.(4分)根据图中装置回答问题: (l)实验室选用A装置制取氧气的化学方程式__________。 (2)硫化氢(H2S)气体是一种密度比空气大,能溶于水的有毒物质,其水溶液叫氢硫酸。实验室常 用硫化亚铁(FeS)固体和稀硫酸在常温下发生反应制取硫化氢气体,应选择的发生装置是_____ __。小虹同学认为收集硫化氢气体可用D或F装置,但小娟提出了质疑,小娟的理由是__________ 。写出你改进后收集方法:_______________。 △【答案】(1)2KMnO4 K2MnO4+MnO2+O2↑ 7(2)B;H2S气体有毒会污染空气;用F装置收集,排出的气体用塑料袋收集(或通入碱溶液或水中) 。【解析】(1)选择发生装置需考虑是因素是,反应物的状态和反应条件。装置A是加热固体制取气体,且 试管口有棉花,说明是高锰酸钾法制氧气,反应方程式为:2KMnO4 K2MnO4+MnO2+O2↑;(2)硫化亚铁(FeS)固体和稀硫酸在常温下发生反应制取硫化氢气体,应选择的 固液常温型发生装置是B;H2S气体有毒会污染空气,用D收集会导致污染空气;为防止气体排放到空气 中,用F装置收集,排出的气体用塑料袋收集(或通入碱溶液或水中吸收过量的硫化氢)。 41.(9分)实验探究一:课本第二单元课后作业中有“寻找新的催化剂” 的探究内容,实验中学探究小组据此设计了如下探究方案。 【提出问题】红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何? 【实验探究】 实验步骤 实验现象 实验结论及解释 A中无明显现象, B中产生大量能使带火星木条复 燃的气体 ① 产生的气体是______ ②红砖粉末能改变过氧化氢分解 速率 Ⅰ. Ⅱ.向B试管中重新加入5%的过 红砖粉末的_____在反应前后均 没有发生变化,能作过氧化氢 分解的催化剂 ①氧化氢溶液,反应停止后过滤、 又产生大量能使带火星木条复 洗涤、干燥、称量滤渣 燃的气体 ② 滤渣质量等于ag 两试管中均产生气泡且______ 红砖粉末的催化效果没有二氧 化锰粉末好 Ⅲ. 【拓展应用】 己知CuSO4也可作为过氧化氢分解的催化剂。向101.2g一定溶质质量分数的过氧化氢溶液中加入2g CuSO4粉末,充分反应后得到溶质质量分数为2%的溶液,则生成氧气_____g。 8实验探究二:实验室中的试剂一般要密封保存,否则可能会与空气接触而变质。淅河中学化学学习小 组发现一瓶未密封的氢氧化钾固体,对其是否变质进行探究。 【提出猜想】1.未变质 2.部分变质 3.完全变质 【查阅资料】KOH与NaOH性质类似,也能与CO2反应而变质。写出KOH变质的化学方程式为_____。 【设计实验】 (l)取少量样品于试管中配成溶液,滴加足量稀盐酸有气泡产生,则猜想_____不成立。 (2)准确称取一定质量的固体样品,放在右图所示装置中进行实验,根据CO2的体积和密度计算变质 产物的质量,从而确定变质情况,你认为这个方案是否可行,并说明理由_________。 (3)请你另外设计一个方案,进一步探究变质情况 实验结论 实验步骤 实验现象 猜想2成立 【答案】探究一(4分): 实验步骤 实验现象 实验结论及解释 ①氧气 化学性质和质量 C中产生气泡较慢 【拓展应用】3.2g 探究二(5分): 【查阅资料】2KOH+CO2=K2CO3+H2O 【设计实验】(l)l (2)不可行,因为CO2能溶余水(或与水反应),导致测量结果误差较大。 (3) 实验结论 实验步骤 实验现象 另取少量样品,配成溶液滴加 足量CuCl2溶液,静置后滴加酚 产生白色沉淀 溶液变红色 猜想2成立 9酞溶液 (说明:设计思路为先除尽CO32-,然后证明OH-存在。合理即可) 【解析】探究一过氧化氢在一定条件下分解生成氧气;催化剂在能改变其他物质的反应速率,而本身的质 量和化学性质在反应前后不变。红砖粉末的催化效果没有二氧化锰粉末好,所以用红砖作催化剂的试 量稀盐酸有气泡产生,说明有碳酸钾,说明氢氧化钾变质;(2)因为CO2能溶于水(或与水反应), 该方法测定的二氧化碳偏少,导致测量结果误差较大。(3)可利用碳酸钾转化成沉淀的方法测定碳 酸钾,用氢氧化钾溶液呈碱性,能使酚酞试液变红。具体操作现象、结论是:另取少量样品,配成溶 液滴加足量CaCl2溶液,静置后滴加酚酞溶液;产生白色沉淀 ,溶液变红色;(说明:设计思路为先除尽CO32-,然后证明OH-存在。合理即可) 10
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





