


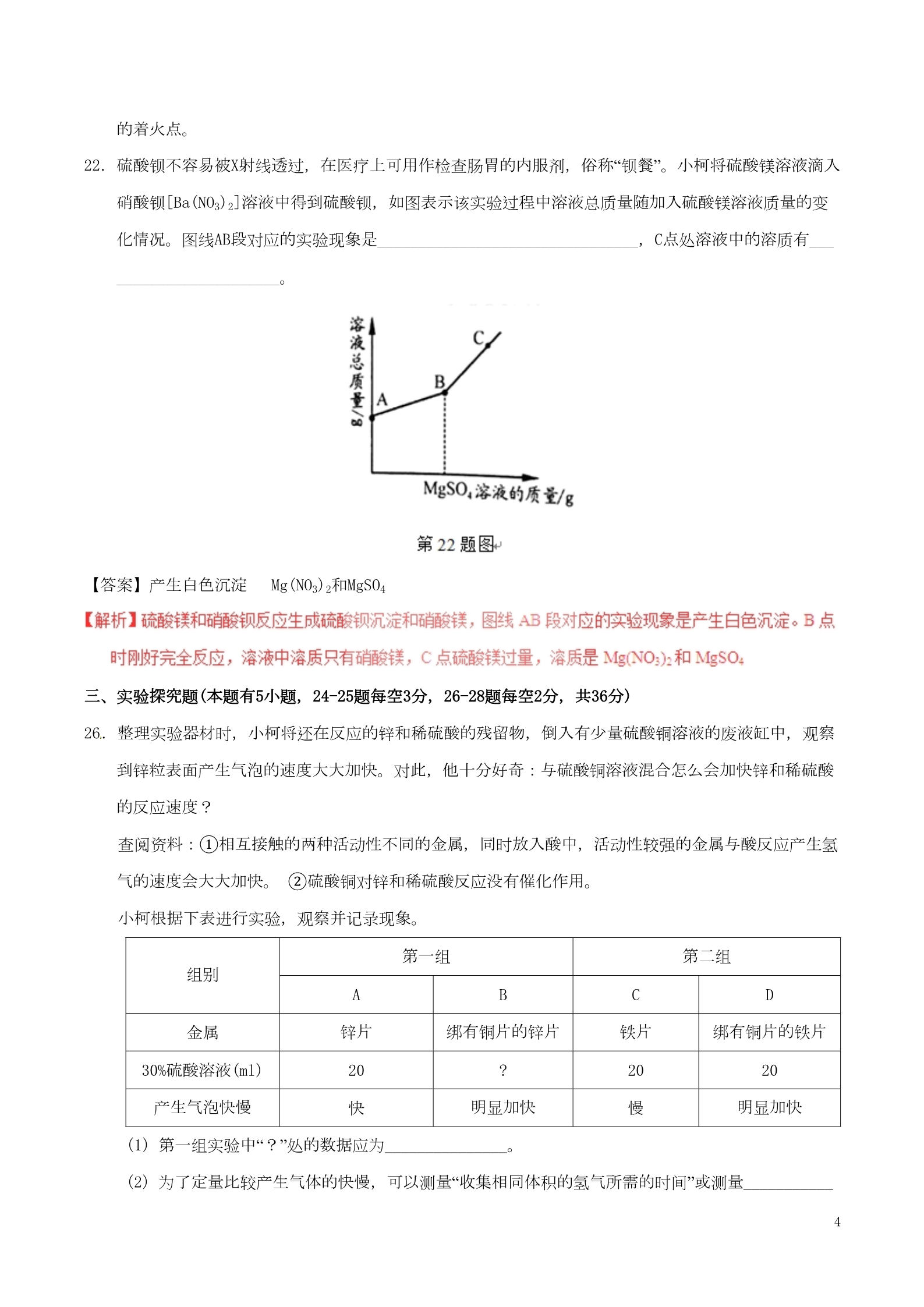
浙江省2017年初中毕业生学业考试(衢州卷) 化学部分 本卷可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32 Ba-137 卷Ⅰ 说明:本卷共有一大题,15小题,共40分。 一、选择题(本题有15小题,1-10题每小题3分,11- 15小题每小题2分,共40分。请选出各题中一个符合题意的选项,不选、多选、错选均不给分) 6.物质分类是重要的学习内容,下列物质属于氧化物的是( )A.O2 B.NaCl C.Fe2O3 D.C2H5OH 【答案】C 8.实验时要严格遵守实验室安全守则,重视规范操作。下列操作正确的是( )【答案】B 【解析】A、加热试管中的液体时,应将试管用试管夹加持试管,液体的量不能超过试管容积的三分之一 ,且要用外焰加热,先均匀加热,后对准药品固定加热。试管口向上倾斜,与桌面呈45°角。 B、闻气体气味时,应该用手在瓶口轻轻扇动,使少量气体进入鼻孔闻气味; C、稀释浓硫酸,应将浓硫 酸沿器壁慢慢注入水中,并不断用玻璃棒搅拌,使热量及时扩散;D、熄灭酒精灯应该用灯帽盖灭, 吹灭酒精灯易导致灯内酒精着火,甚至引起酒精灯爆炸;选B 111.1897年,英国科学家汤姆生发现了原子内有带负电的电子,而原子 是电中性的,由此推测,原子内还有带正电的物质。在此基础上,经过卢瑟福、玻尔等科学家的不断 完善和修正,建立了现代原子结构模型。如图是小柯整理的物质微观构成网络图,则汤姆生当年推测 的“带正电的物质”相当于图中的( )A.甲 B.乙 C.丙 D.丁 【答案】B 13.质量守恒定律是自然界基本的规律之一。下列装置及实验(天平未画出)能用来验证质量守恒定律的 是( )【答案】A 【解析】质量守恒定律是指参加反应的各物质的质量总和等于反应后生成的各物质的质量总和;所以质量 守恒定律只研究化学变化质量问题。硝酸银和盐酸反应生成氯化银沉淀和硝酸;可以用来验证质量守 恒定律;B实验中没有发生化学变化;C镁的燃烧实验,涉及到气体,但是没有在密闭容器内进行,不 能称量参加反应的氧气的质量;D实验生成氧气,逸出,不能称量生成氧气的质量。 二、填空题(本题有8小题20空,每空2分,共40分) 16.随着科技的进步,农场也向智能化方向发展。某智慧农场中种植了大量的果树和蔬菜,其中的施肥、 灌溉等都可以实现远程控制和自动控制。 (1)经农场智能系统检测后,自动为农场中的大白菜施加一定量的化肥—— 尿素[CO(NH2)2],即为大白菜施加了_______肥。 2【答案】.(1)N 或氮 17.海水晒盐是海水在常 温下蒸发得到氯化钠的过程。小柯用氯化钠溶液模拟该过程,如图: (1)乙烧杯中的溶液__________(选填“是”、“不是”或“可能是”) 氯化钠饱和溶液 (2)要加快氯化钠晶体析出,可以采用的方法是________________。 【答案】(1) 可能是 (2)加快液面空气流速 20.小柯用高锰酸钾制取氧气,并用制得的氧气来探究白磷燃烧的条件。 (1)指出图甲装置中存在的错误是 _____________________________。 (2)乙中的白磷不燃烧,丙中的白磷燃烧,可以 得出的结论是__________________________________________。 【答案】(1)导管伸入试管中过长 (2) 白磷燃烧的条件是温度要达到白磷的着火点 【解析】(1)指出图甲装置中存在的错误是导管伸入试管中过长,不利于导出气体,因略露出单孔塞即 可;燃烧需要同时具备的三个条件:物质有可燃性、温度达可燃物的着火点、与氧气充分接触;乙中 温度低的白磷不燃烧,丙中温度高的白磷燃烧,可以得出的结论是白磷燃烧的条件是温度要达到白磷 3的着火点。 22.硫酸钡不容易被X射线透过,在医疗上可用作检查肠胃的内服剂,俗称“钡餐”。小柯将硫酸镁溶液滴入 硝酸钡[Ba(NO3)2]溶液中得到硫酸钡,如图表示该实验过程中溶液总质量随加入硫酸镁溶液质量的变 化情况。图线AB段对应的实验现象是________________________________,C点处溶液中的溶质有___ ____________________。 【答案】产生白色沉淀 Mg(NO3)2和MgSO4 三、实验探究题(本题有5小题,24-25题每空3分,26-28题每空2分,共36分) 26.整理实验器材时,小柯将还在反应的锌和稀硫酸的残留物,倒入有少量硫酸铜溶液的废液缸中,观察 到锌粒表面产生气泡的速度大大加快。对此,他十分好奇:与硫酸铜溶液混合怎么会加快锌和稀硫酸 的反应速度? 查阅资料:①相互接触的两种活动性不同的金属,同时放入酸中,活动性较强的金属与酸反应产生氢 气的速度会大大加快。 ②硫酸铜对锌和稀硫酸反应没有催化作用。 小柯根据下表进行实验,观察并记录现象。 第一组 第二组 组别 A锌片 20 BC铁片 20 D绑有铜片的锌片 绑有铜片的铁片 20 金属 30%硫酸溶液(ml) 产生气泡快慢 ?明显加快 明显加快 快慢(1)第一组实验中“?”处的数据应为_______________。 (2)为了定量比较产生气体的快慢,可以测量“收集相同体积的氢气所需的时间”或测量___________ 4_____________________,然后进行比较。 (3)请推测与废液缸中少量硫酸铜溶液混合后,锌料与稀硫酸反应速度加快的原因_______________ __ ____________________________________________________________。 【答案】(1)20 (2)相同时间收集到氢气(气体)的体积 (3) 硫酸铜与锌发生置换反应产生的铜附着在锌粒表面,加快了锌与稀硫酸的反应速度 27.小柯探究pH对唾液淀粉酶活性的影响,其实验过程及结果如下: 组别 ABC1ml唾液 1ml唾液 1ml蒸馏水 2ml淀粉溶液 37℃ 1ml唾液 试管中依次 加入物质 1ml盐酸溶液 2ml淀粉溶液 37℃ 1ml氢氧化钠溶液 2ml淀粉溶液 37℃ 水浴10分钟 各滴入2滴 变蓝 不变蓝 不变蓝 碘液后的现象 (1) B组实验不变蓝的原因是______________________________________________________。小柯观察到C 组也不变蓝,认为氢氧化钠对酶的活性没有影响。老师提示他:“氢氧化钠会影响酶的活性。”那么, 是什么原因导致C组没变蓝?小柯进一步分析并做出猜想。 5猜想一:氢氧化钠变质。 猜想二:氢氧化钠与碘发生了化学反应。 …… (2)小柯按图甲实验,看到溶液变红,认为氢氧化钠没有变质。小常认为他的结论是 错误的,理由是_________________________________________________________。 在小常的建议下,小柯按乙实验,溶液中没有沉淀产生,从而排除了猜想一。 (3)在原来C组实验基础上,只要继续___________________________________(写出操作和现象), 就可以证明猜想二正确。 【答案】(1)淀粉被唾液淀粉酶完全分解 (3)滴加碘液直到出现蓝色 (2)变质产生的碳酸钠也能使酚酞变红 四、解答题(本题有7小题,29题4分,30题5分,31题4分,32题9分,33题6分,34题7分,35题9分,共44 分) 33.2017年5月,我国在南海首次试采可燃冰成功。 材料一:可燃冰的化学式为CH4·8H2O,相对分子质量为160,它是由甲烷气体与不在高压低温 条件下形成的类冰状水合物。可燃冰热值高、储藏量大。燃烧不产生污染物。 材料二:将CO2注入海底的可燃冰储层,能将可燃冰中的CH4“挤走”,而形成二氧化碳水合物。 回答下列问题: (1)写出甲烷(CH4) 燃烧的化学方程式__________________________________。 (2) CH4·8H2O碳元素的质量分数为_______________。 (3)下列关于可燃冰的说法正确的是________。 A.可燃冰是一种清洁能源 B.甲烷和水形成可燃冰的过程是化学变化 C.用CO2 “挤走”可燃冰中的CH4过程属于置换反应 点燃 【答案】(1) CH4+2O2 CO +2H O 2(2)7.5%或0.075 (3)AB ==== 26【解析】(1) 甲烷(CH4) 和氧气在点燃条件下反应生成水的和二氧化碳,化学方程式CH4+2O2点燃 16 CO2+2H2O (2) CH4•8H2O碳元素的质量分数为 100% =7.5%或0.075 (3) 16+818 可燃冰是一种清洁能源,燃烧时几乎不产生残渣或废弃物;可燃冰是甲烷和水在低温高压条件形成的 形成甲烷的结晶水合物,有新的物质生成,可燃冰的过程是化学变化。 34.有一种管道疏通剂,主要成分为铝粉和氢氧化钠混合粉末。工作原理是:利用铝和氢氧化钠遇水反应 放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通。 小柯利用如图装置测定疏通剂中铝的质量分数。 Ⅰ.取样品20g,倒入容积为200ml的锥形瓶中,然后在分流漏斗中加入水,置于电 子天平上测出总质量m1。 Ⅱ.打开活塞,加入足量的水充分反应,直到没有固体剩余,静置一段时间,测出总 质量m2。 Ⅲ.实验数据如下表: 反应前总质量m1 反应后总质量m2 371.84g 371.24g 回答下列问题: 加热 (1)配平化学方程式:2Al+2NaOH+2H2O ==== _______NaAlO2+3H2↑ (2)根据化学方程式计算样品中铝的质量分数。 (3)以下情形会导致样品中铝的质量分数测量结果偏高的原因可能有__________。 A.向锥形瓶中倒入样品时,撒出了部分粉末 C.没有等装置中氢气全部排尽就称量 B.在反应过程中有水蒸气逸出 【答案】(1)2 (2) 27%。(3)BC 7设参加反应的铝质量为x 2Al+2NaOH+H2O===2NaAlO2+3H2↑ 54 6X0.6g 54/x=6/0.6g 解得x=5.4g Al%=m铝/m样品×100%=5.4g/20g×100%=27% 答:该样品中铝的质量分数为27%。 (3) A.向锥形瓶中倒入样品时,撒出了部分粉末,不影响测定结果; B.在反应过程中有水蒸气逸出,导致氢气的质量偏多,计算的铝的质量偏大;样品中铝的含量偏高 ;C.没有等装置中氢气全部排尽就称量,导致氢气的质量偏少,计算得出铝的质量比实际偏低,样 品中铝的含量偏低。 8
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





