
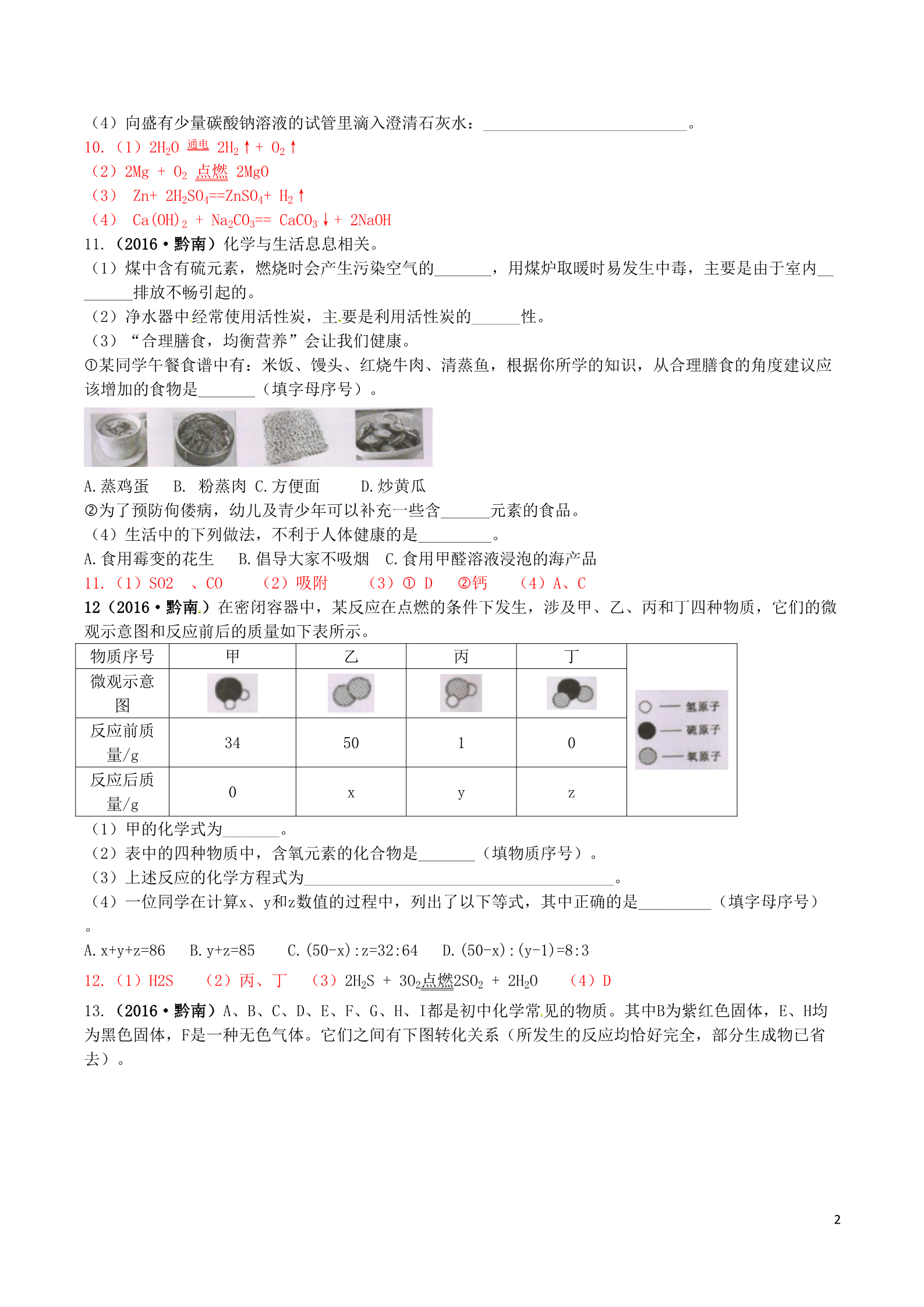



贵州省黔南州2016年中考理综(化学部分)真题试题 一、选择题(每小题只有一个选项符合题意,每题2分,共16分。) 1.(2016·黔南)下列变化属于化学变化的是 A.蔗糖溶于水 B.食物发霉 C.酒精挥发 D.西瓜榨汁 2.(2016·黔南)下列常见的饮料中,不含有机物的可能是 A.牛奶 B.果汁 C.啤酒 D.矿泉水 3.(2016·黔南)已知碳14原子中,原子核内含有6个质子和8个中子,则碳14原子核外电子数为 A.6 B.8 C.12 D.14 4.(2016·黔南)人体内的一些液体的正常pH范围如下: 液体 血浆 胆汁 胰液 胃液 pH 7.35~7.45 7.1~7.3 7.5~8.0 0.9~1.5 其中显酸性的是 A.胃液 B.胆汁 C.胰液 D.血浆 5.(2016·黔南)下列实验操作不正确的是 A.取用液体 B.加热液体 C.稀释浓硫酸 D.蒸发食盐水 6.(2016·黔南)现有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应; 如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化。根据以上实验事实,可 以判断三种金属的活动性顺序是 A.Z>X>Y B.Z>Y>X C.X>Y>Z D.Y>Z>X 7.(2016·黔南)下图是甲、乙两种固体物质在水中的溶解度曲线,下列说法不正确的是 A.10℃时,甲、乙两种物质的饱和溶液浓度相同 B.将10℃时的甲、乙两种饱和溶液分别升温至30℃,溶液中 溶质的质量分数都增大 C.30℃时,将40g甲物质加入50g水中,充分溶解后溶液的 质量为80g D.保持20℃,蒸发溶剂可使接近饱和的乙溶液变成饱和溶液 8.(2016·黔南)高铁酸钾(K2FeO4)是一种集吸附、凝聚、杀菌等功能为一体的新型高效水处理器,可 将水中的三氯乙烷(C2HCl3)除去85.6%,下列说法正确的是 A. K2FeO4是氧化物 B. C2HCl3中三种元素的质量比是2:1:3 C. K2FeO4 中Fe元素的化合价为+3价 D. 三氯乙烯中碳元素的质量分数约为18.25% 二、填空及简答题 9.(2016·黔南)用元素符号或化学式填空。 (1)氯化铝:______________________ ; (2)溴化钠:_____ _________________; (3)8个二氧化氮分子:____________ ; (4)6个氢氧根离子:_____________。 9.(1)Al2O3(2)NaBr (3)8NO2 (4)6OH- 10.(2016·黔南)写出下列反应的化学方程式。 (1)水通直流电生成氢气和氧气:___________________________________________; (2)镁带在氧气中燃烧:___________________________________________________; (3)实验室常用锌与稀硫酸反应来制取氢气:_________________________________; 1(4)向盛有少量碳酸钠溶液的试管里滴入澄清石灰水:_________________________。 通电 10.(1)2H2O 2H2↑+ O2↑ (2)2Mg + O2 点燃 2MgO (3) Zn+ 2H2SO4==ZnSO4+ H2↑ (4) Ca(OH)2 + Na2CO3== CaCO3↓+ 2NaOH 11.(2016·黔南)化学与生活息息相关。 (1)煤中含有硫元素,燃烧时会产生污染空气的_______,用煤炉取暖时易发生中毒,主要是由于室内__ ______排放不畅引起的。 (2)净水器中经常使用活性炭,主 要是利用活性炭的______性。 (3)“合理膳食,均衡营养”会让我们健康。 某同学午餐食谱中有:米饭、馒头、红烧牛肉、清蒸鱼,根据你所学的知识,从合理膳食的角度建议应 该增加的食物是_______(填字母序号)。 A.蒸鸡蛋 B. 粉蒸肉 C.方便面 D.炒黄瓜 为了预防佝偻病,幼儿及青少年可以补充一些含______元素的食品。 (4)生活中的下列做法,不利于人体健康的是_________。 A.食用霉变的花生 B.倡导大家不吸烟 C.食用甲醛溶液浸泡的海产品 11.(1)SO2 、CO (2)吸附 (3) D 钙 (4)A、C 12(2016·黔南)在密闭容器中,某反应在点燃的条件下发生,涉及甲、乙、丙和丁四种物质,它们的微 观示意图和反应前后的质量如下表所示。 物质序号 微观示意 图甲乙丙丁反应前质 量/g 34 050 x1y0z反应后质 量/g (1)甲的化学式为_______。 (2)表中的四种物质中,含氧元素的化合物是_______(填物质序号)。 (3)上述反应的化学方程式为______________________________________。 (4)一位同学在计算x、y和z数值的过程中,列出了以下等式,其中正确的是_________(填字母序号) 。A.x+y+z=86 B.y+z=85 C.(50-x):z=32:64 D.(50-x):(y-1)=8:3 (4)D 12.(1)H2S (2)丙、丁 (3)2H2S + 3O2点燃2SO2 + 2H2O 13.(2016·黔南)A、B、C、D、E、F、G、H、I都是初中化学常见的物质。其中B为紫红色固体,E、H均 为黑色固体,F是一种无色气体。它们之间有下图转化关系(所发生的反应均恰好完全,部分生成物已省 去)。 2根据转化关系图回答问题: (1)写出A的化学式________________________。 (2)写出A→B的化学方程式_____________________________。 写出C→D的化学方 程式_________________________________,反应类型属于_________________。 ③写出F→E的化学方程式______________________,在该反应中,F具有________性。13.(1)H2 (2)H2 + CuO △Cu + H2O 2NaOH + CuSO4 == Cu (OH)2↓ + Na2 SO4 复分解反应 3CO+ Fe2O3高温2Fe + 3CO2 还原 三、实验与探究题 14.(2016·黔南)根据下图回答问题。 (1)实验室用高锰酸钾制取氧气的化学方程式为_____________。实验室用过氧化氢溶液制取氧气,选用 的发生装置是______(填字母序号)。用C装置收集氧气时,检验O2的方法是__________________________ ________________________。 实验室可以用装置D制取并收集二氧化碳气体。收集时,检验CO2已经收集满的方法是______________,检 验CO2的方法是________________________(用化学方程式表示)。 (3)检查装置E的气密性:可以看到_____________________,说明气密性良好。 (4)实验F中观察到的实验现象是___________,反应的化学方程式为_________。 14.(1)2KMnO4 △K2MnO4 +MnO2 +O2↑; A;用带火星的木条伸入集气瓶中,若木条复燃,说明瓶中是氧气。 (2)用燃着的木条靠近集气瓶口,若木条熄灭,说明已集满二氧化碳气体。 Ca(OH)2 + CO2== CaCO3↓+ H2O (3)导管口有气泡冒出 (4)铁丝剧烈燃烧,火星四射,生成黑色固体;3Fe + 2O2点燃 Fe3O4 15.(2016·黔南)小明同学设计以下实验来探究可燃物燃烧的条件和测定空气中氧气的含量。(已知: 白磷的着火点是40℃,红磷的着火点是240℃。) 3(1)实验过程是___________,烧杯中发生反应的化学方程式为_________________。 (2)白磷燃烧反应的化学方程式为_________________________________。 (3)根据实验2的结果,计算空气中氧气的体积分数约为__________(写出计算式和结果)。 (4)在整个实验2的过程中,集气瓶内的压强变化是______________。集气瓶中预先装入50mL水,水起的 作用是___________________________________。 15.(1)向烧杯中加入适量的冷水(填“加热水”者不给分);CaO + H2O== Ca(OH)2 (2)4P + 5O2点燃 2P2O5 60 15(3) 350-50 (4)先变大后变小到与大气压相等。防止集气瓶内的空气因瓶内温度升高、压强增大而泄出瓶外 16.(2016·黔南)小芳同学采用如下方法测定石灰石中碳酸钙的质量分数:取该石灰石样品10g,把40g 稀盐酸分四次加入,实验过程所得数据如下表(石灰石样品中含有的二氧化硅等杂质不溶于水也不与稀盐 酸反应)。 实验次数 加入稀盐酸的质量/g 剩余固体的质量/g 123410 10 10 10 7.5 5.0 3.2 a根据实验数据计算: (1)表中a的数值为__________。 (2)样品中碳酸钙的质量分数是________________。 (3)求盐酸中溶质的质量分数。 16.解:(1)3.2克 (2)(10-3.2)÷10×100%=68% (3)设第一次加入的10g盐酸中溶质的质量为x,则有: CaCO3 + 2HCl==CaCl2 + H2O + CO2↑ 100 73 10g-7.5g x 100/73=(10g-7.5g)/x X=1.825g 1.825g/10g×100%=18.25% 答:盐酸中溶质的质量分数是18.25%。 4
声明:如果本站提供的资源有问题或者不能下载,请点击页面底部的"联系我们";
本站提供的资源大部分来自网络收集整理,如果侵犯了您的版权,请联系我们删除。





